Con voi ma mút lông xù cuối cùng đã lang thang trên vùng lãnh nguyên Bắc Cực rộng lớn cách đây 4,000 năm. Gen của chúng vẫn còn tồn tại trong loài động vật to lớn ngày nay – loài voi châu Á.
Với sự giống nhau đến 99.6% trong cấu trúc di truyền, voi châu Á là điểm khởi đầu hoàn hảo cho một kế hoạch táo bạo nhằm đưa loài voi ma mút—hoặc loài nào đó gần giống nó—khỏi nguy cơ tuyệt chủng. dự án, do công ty công nghệ sinh học đưa ra Đại qui mô vào năm 2021, chúng tôi nhướn mày vì mục tiêu vượt mặt trăng của mình.
Playbook tổng thể nghe có vẻ đơn giản.
Bước đầu tiên là sắp xếp và so sánh bộ gen của voi ma mút và voi. Tiếp theo, các nhà khoa học sẽ xác định các gen đằng sau các đặc điểm thể chất—lông dài, chất béo tích tụ—cho phép voi ma mút phát triển ở nhiệt độ đóng băng và sau đó đưa chúng vào tế bào voi bằng cách chỉnh sửa gen. Cuối cùng, nhóm nghiên cứu sẽ chuyển nhân – nơi chứa DNA – từ các tế bào đã được chỉnh sửa vào trứng voi và cấy phôi vào vật thay thế.
Vấn đề? Voi châu Á đang bị đe dọa và rất khó để có được tế bào của chúng, đặc biệt là trứng.
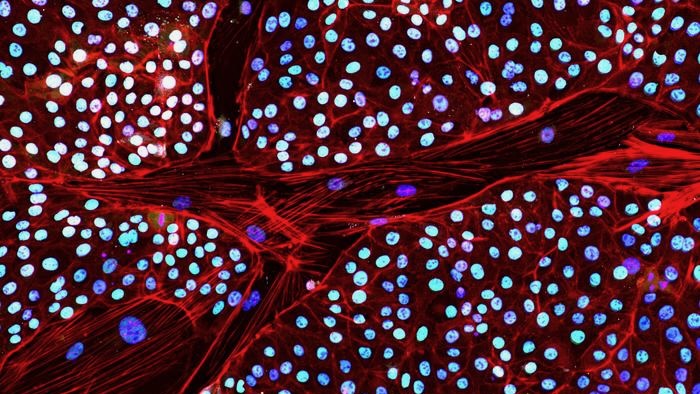
Tuần trước, công ty đã báo cáo một cách giải quyết chính. Lần đầu tiên, họ biến tế bào da voi thành tế bào gốc, mỗi tế bào có khả năng trở thành bất kỳ tế bào hoặc mô nào trong cơ thể.
Sự tiến bộ này giúp việc xác nhận kết quả chỉnh sửa gen trong phòng thí nghiệm dễ dàng hơn trước khi quyết định có khả năng mang thai - kéo dài tới 22 tháng đối với voi. Ví dụ, các nhà khoa học có thể kích thích các tế bào gốc của voi được biến đổi gen để trở thành tế bào lông và kiểm tra các chỉnh sửa gen mang lại cho voi ma mút bộ lông dày và ấm áp mang tính biểu tượng.
Những tế bào gốc đa năng cảm ứng này, hay iPSC, đặc biệt khó tạo ra từ tế bào voi. Các loài động vật này “là một loài rất đặc biệt và chúng ta mới chỉ bắt đầu khám phá bề mặt sinh học cơ bản của chúng”, nói Tiến sĩ Eriona Hysolli, người đứng đầu bộ phận khoa học sinh học tại Colossal, trong một nhấn phát hành.
Bởi vì phương pháp này chỉ cần một mẫu da của một con voi châu Á nên sẽ mất một chặng đường dài để bảo vệ các loài có nguy cơ tuyệt chủng. Công nghệ này cũng có thể hỗ trợ bảo tồn voi còn sống bằng cách cung cấp các chương trình nhân giống trứng nhân tạo làm từ tế bào da.
“Voi có thể nhận được giải thưởng 'khó lập trình lại nhất'," nói Tiến sĩ George Church, nhà di truyền học Harvard và là người đồng sáng lập Colossal, “nhưng việc học cách thực hiện điều đó sẽ giúp ích cho nhiều nghiên cứu khác, đặc biệt là về các loài có nguy cơ tuyệt chủng”.
Quay ngược đồng hồ
Gần hai thập kỷ trước, nhà sinh vật học Nhật Bản, Tiến sĩ Shinya Yamanaka đã cách mạng hóa sinh học bằng cách khôi phục các tế bào trưởng thành về trạng thái giống tế bào gốc.
Lần đầu tiên được chứng minh ở chuột, kỹ thuật đoạt giải Nobel chỉ cần bốn loại protein, gọi chung là yếu tố Yamanaka. Các tế bào được lập trình lại, thường có nguồn gốc từ tế bào da, có thể phát triển thành nhiều loại mô với sự hướng dẫn hóa học sâu hơn.
Tế bào gốc đa năng cảm ứng (iPSC), như chúng được gọi, đã biến đổi sinh học. Chúng rất quan trọng đối với quá trình hình thành các cơ quan não—những quả bóng thần kinh thu nhỏ phát ra tia sáng khi hoạt động—và có thể được đưa vào tế bào trứng hoặc các mô hình sớm. phôi người.
Công nghệ này đã được thiết lập tốt cho chuột và con người. Đối với voi thì không như vậy. Hysolli cho biết: “Trước đây, vô số nỗ lực tạo ra iPSC cho voi đều không thành công.
Hầu hết các tế bào voi đều chết khi được điều trị theo công thức chuẩn. Những người khác biến thành tế bào lão hóa “thây ma”—sống nhưng không thể thực hiện các chức năng sinh học thông thường của chúng—hoặc có rất ít thay đổi so với danh tính ban đầu của chúng.
Điều tra sâu hơn đã tìm ra thủ phạm: Một loại protein có tên TP53. Được biết đến với khả năng chống lại ung thư, protein này thường được mệnh danh là người gác cổng di truyền. Khi gen TP53 được bật, protein sẽ thúc đẩy các tế bào tiền ung thư tự hủy mà không gây hại cho các tế bào lân cận.
Thật không may, TP53 cũng cản trở việc lập trình lại iPSC. Một số yếu tố Yamanaka bắt chước các giai đoạn đầu tiên của quá trình phát triển ung thư, có thể khiến các tế bào đã được chỉnh sửa tự hủy diệt. Voi có tới 29 bản sao của gen “bảo vệ”. Cùng với nhau, chúng có thể dễ dàng tiêu diệt các tế bào có DNA đột biến, bao gồm cả những tế bào đã được chỉnh sửa gen.
“Chúng tôi biết p53 sẽ là một vấn đề lớn,” Church nói với các Bán Chạy Nhất của Báo New York Times.
Để vượt qua người gác cổng, nhóm nghiên cứu đã nghĩ ra một loại cocktail hóa học có tác dụng ức chế sản xuất TP53. Với liều tiếp theo của các yếu tố tái lập trình, họ đã có thể tạo ra iPSC voi đầu tiên từ tế bào da.
Một loạt thử nghiệm cho thấy các tế bào biến đổi có hình dáng và hoạt động như mong đợi. Họ có gen và dấu hiệu protein thường thấy trong tế bào gốc. Khi được phép phát triển hơn nữa thành một cụm tế bào, chúng tạo thành cấu trúc ba lớp rất quan trọng cho sự phát triển phôi sớm.
“Chúng tôi thực sự đã chờ đợi những điều này một cách tuyệt vọng,” Church nói với Thiên nhiên. Nhóm đã công bố kết quả của mình, chưa được bình duyệt, trên máy chủ in sẵn bioRxiv.
Đường dài phía trước
Chiến lược hiện tại của công ty nhằm đưa voi ma mút trở lại dựa vào công nghệ nhân bản chứ không phải iPSC.
Nhưng các tế bào này có giá trị như các đại diện cho tế bào trứng voi hoặc thậm chí là phôi, cho phép các nhà khoa học tiếp tục công việc của mình mà không gây hại cho các loài động vật có nguy cơ tuyệt chủng.
Ví dụ, họ có thể biến đổi tế bào gốc mới thành tế bào trứng hoặc tinh trùng – một kỳ tích cho đến nay chỉ đạt được ở chuột—để chỉnh sửa gen thêm. Một ý tưởng khác là biến đổi trực tiếp chúng thành các cấu trúc giống phôi thai được trang bị gen voi ma mút.
Công ty cũng đang nghiên cứu phát triển tử cung nhân tạo để giúp nuôi dưỡng bất kỳ phôi đã được chỉnh sửa nào và có khả năng đưa chúng đến giai đoạn trưởng thành. Năm 2017, tử cung nhân tạo đã sinh ra một con cừu khỏe mạnh, tử cung nhân tạo hiện nay tiến tới thử nghiệm trên người. Những hệ thống này sẽ làm giảm nhu cầu về người đại diện cho voi và tránh gây nguy hiểm cho chu kỳ sinh sản tự nhiên của chúng.
Vì nghiên cứu này là bản in trước nên kết quả của nó vẫn chưa được các chuyên gia khác trong lĩnh vực này xem xét kỹ lưỡng. Vẫn còn nhiều câu hỏi. Ví dụ, các tế bào được lập trình lại có duy trì trạng thái tế bào gốc của chúng không? Chúng có thể biến đổi thành nhiều loại mô theo yêu cầu không?
Hồi sinh voi ma mút là mục tiêu cuối cùng của Colossal. Nhưng Tiến sĩ Vincent Lynch tại Đại học Buffalo, người từ lâu đã cố gắng tạo ra iPSC từ voi, cho rằng kết quả có thể có phạm vi tiếp cận rộng hơn.
Voi có khả năng chống ung thư đáng kể. Không ai biết tại sao. Do iPSC của nghiên cứu bị loại bỏ TP53, một gen bảo vệ ung thư, nên chúng có thể giúp các nhà khoa học xác định mã di truyền cho phép voi chiến đấu với các khối u và có khả năng truyền cảm hứng cho các phương pháp điều trị mới cho chúng ta.
Tiếp theo, nhóm nghiên cứu hy vọng có thể tái tạo các đặc điểm của voi ma mút – chẳng hạn như lông dài và chất béo tích tụ – trong các mô hình tế bào và động vật được tạo ra từ tế bào voi đã được chỉnh sửa gen. Nếu mọi việc suôn sẻ, họ sẽ sử dụng một kỹ thuật giống như kỹ thuật được sử dụng để nhân bản cừu Dolly để sinh ra những chú bê con đầu tiên.
Liệu những động vật này có thể được gọi là voi ma mút hay không vẫn còn đang tranh luận. Bộ gen của chúng sẽ không khớp chính xác với các loài đã tuyệt chủng. Hơn nữa, sinh học và hành vi của động vật phụ thuộc rất nhiều vào sự tương tác với môi trường. Khí hậu của chúng ta đã thay đổi đáng kể kể từ khi voi ma mút tuyệt chủng cách đây 4,000 năm. Vùng lãnh nguyên Bắc Cực—ngôi nhà cũ của họ—đang tan chảy nhanh chóng. Liệu những động vật được hồi sinh có thể thích nghi với môi trường mà chúng không thích nghi để đi lang thang không?
Động vật cũng học hỏi lẫn nhau. Nếu không có voi ma mút còn sống để chỉ cho con bê cách trở thành voi ma mút trong môi trường sống tự nhiên của nó, nó có thể áp dụng một loạt hành vi hoàn toàn khác.
Colossal có một kế hoạch chung để giải quyết những câu hỏi khó này. Đồng thời, công việc này sẽ giúp dự án tiến triển mà không gây nguy hiểm cho voi, theo Nhà thờ.
“Đây là một bước tiến quan trọng” nói Ben Lamm, đồng sáng lập và CEO của Colossal. “Mỗi bước đều đưa chúng tôi đến gần hơn với mục tiêu dài hạn là đưa loài vật mang tính biểu tượng này trở lại.”
Ảnh: Khoa học sinh học Colossal
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- PlatoSức khỏe. Tình báo thử nghiệm lâm sàng và công nghệ sinh học. Truy cập Tại đây.
- nguồn: https://singularityhub.com/2024/03/12/colossal-creates-elephant-stem-cells-for-the-first-time-in-quest-to-revive-the-woolly-mammoth/



