Một xét nghiệm đơn giản để sàng lọc các protein phân loại EV
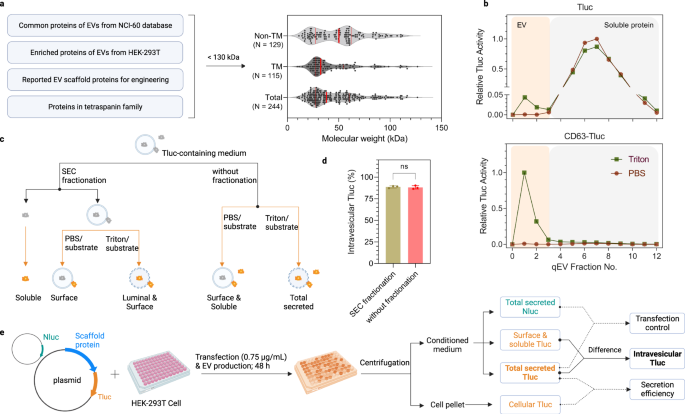
Để tìm kiếm các protein phân loại EV hiệu quả, một danh sách các ứng cử viên đã được tổng hợp dựa trên cơ sở dữ liệu xem xét tài liệu và proteomics. Các ứng cử viên tiềm năng được lấy từ (1) protein được làm giàu trong EV trên các tế bào NCI-6029, (2) protein có nhiều trong EV được sản xuất bởi tế bào biểu mô thận phôi người (HEK) -293T34, (3) đã báo cáo các protein phân loại EV làm tài liệu tham khảo cho các nghiên cứu trước đây32,33và (4) tất cả các protein trong siêu họ tetraspanin. Các protein lớn hơn 130 kDa đã bị loại trừ để tạo điều kiện cho kỹ thuật/biểu hiện quá mức. Tổng cộng có 244 ứng cử viên với kích thước trung bình là 38 kDa được đưa vào, trong đó có 129 protein không phải và 115 là protein xuyên màng (Hình. 1a; xem tệp Nguồn dữ liệu để biết danh sách đầy đủ).
a Tiêu chí lựa chọn và tổng quan về các ứng cử viên protein phân loại EV. Các đường liền màu đỏ biểu thị các giá trị phần trăm 25%, 50% và 75%. b Cấu hình rửa giải SEC của phương tiện được điều hòa từ các tế bào HEK-293T thể hiện Tluc hoặc CD63-Tluc. Hoạt tính Tluc trong mỗi phân đoạn được định lượng trực tiếp (nhóm PBS) hoặc sau quá trình ly giải màng (nhóm Triton) và được chuẩn hóa thành phân số có tín hiệu cao nhất. EV và protein hòa tan được phục hồi lần lượt theo các phân số 0-3 và 4–12. c Sơ đồ phân biệt các dạng Tluc trong môi trường điều hòa. d Tỷ lệ Tluc trong tĩnh mạch đối với CD63-Tluc sử dụng môi trường phân đoạn và không phân đoạn. Kết quả được hiển thị dưới dạng độ lệch chuẩn trung bình ± của ba lần sao chép sinh học. Học sinh hai mặt t kiểm tra (P > 0.9999). ns: không đáng kể. e Phác thảo quy trình sàng lọc và phân tích dữ liệu. Các tế bào HEK-293T được nuôi cấy trong các tấm vi mạch 96 giếng và được thay thế đồng thời bằng plasmid dung hợp Tluc và plasmid Nluc. Nuôi cấy tế bào được ly tâm và hoạt động Tluc được đo trong viên tế bào và môi trường điều hòa. Hoạt động Nluc chỉ được định lượng trong môi trường có điều kiện. c, e Được tạo bằng BioRender.com. Dữ liệu nguồn được cung cấp dưới dạng tệp Dữ liệu nguồn. Sắc ký loại trừ kích thước SEC.
Để đánh giá khả năng tải quang của các ứng cử viên vào EV, chúng tôi đã phát triển một thử nghiệm dựa trên trình báo cáo luciferase ThermoLuc (Tluc; 60.5 kDa)18. Tóm lại, Tluc đã được hợp nhất với đầu cuối C của tất cả các ứng cử viên, lưu ý rằng đầu cuối N thường là vị trí cho các peptide tín hiệu và sửa đổi sau dịch mã. Các plasmid mã hóa các protein dung hợp đã được chuyển vào các tế bào HEK-293T. Sau 48 giờ, môi trường đã điều hòa được thu thập và xử lý thêm trước khi đo phát quang sinh học. Ban đầu, để đánh giá tính khả thi của xét nghiệm này, phương tiện được điều hòa của các tế bào chỉ biểu hiện Tluc và CD63-Tluc đã được phân tích. Cả hai đều được phân đoạn bằng các cột sắc ký loại trừ kích thước (SEC) để tách các túi ra khỏi protein tự do (Hình XNUMX). 1b)35. Các phân số được xử lý bằng PBS để xác định Tluc hòa tan/liên quan đến bề mặt hoặc chất tẩy rửa Triton X-100 để phát hiện Tluc tổng số được tiết ra (Hình XNUMX). 1c). So với Tluc một mình, phản ứng tổng hợp với CD63 dẫn đến sự thay đổi nổi bật của Tluc đối với phần EV (Hình. 1b). Đáng chú ý, hoạt động của Tluc trong phân số EV chỉ được phát hiện khi ly giải màng, cho thấy chất nền Tluc không thể xuyên qua màng EV và phản ứng với luciferase luminal. Điều này ngụ ý rằng phân đoạn SEC có thể được phân phối để định lượng protein ở vùng thắt lưng. Điều này được hỗ trợ thêm bằng cách so sánh môi trường không phân đoạn và phân đoạn của các tế bào biểu hiện CD63-Tluc, cho thấy không có sự khác biệt đáng kể về tỷ lệ phần trăm Tluc trong tĩnh mạch (Hình. 1d). Kết hợp lại với nhau, những dữ liệu này cho thấy rằng thử nghiệm này có thể được sử dụng ở định dạng thông lượng cao để xác định các giàn giáo tải EV tiềm năng.
Về sau, nguyên tắc sàng lọc cả 244 ứng viên vẫn như trên. Đối với các phân tích xuôi dòng, các protein chủ yếu được đánh giá dựa trên lượng Tluc trong tĩnh mạch tuyệt đối, xuất phát từ sự khác biệt về tín hiệu Tluc được phát hiện khi có và không có quá trình ly giải màng, hoặc tỷ lệ phần trăm tương đối của chúng (Hình XNUMX). 1e). Thông tin về biểu hiện protein tổng hợp thu được bằng cách đo Tluc trong các tế bào sản xuất EV. Ngoài ra, khi được chỉ định, dữ liệu đã được chuẩn hóa thành một biện pháp kiểm soát chuyển đổi ở dạng luciferase NanoLuc (Nluc) mã hóa plasmid được thêm vào hỗn hợp chuyển đổi để giải thích cho các biến thể chuyển đổi có thể xảy ra.
Sàng lọc xác định hàng chục protein phân loại EV
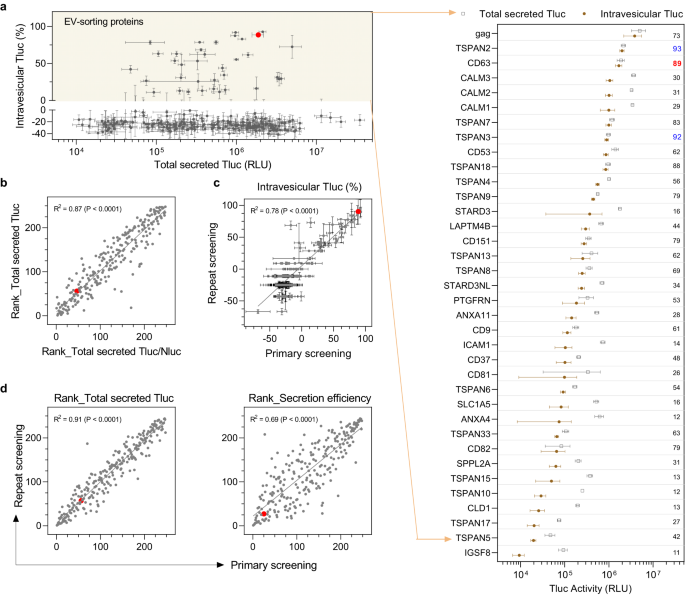
Sàng lọc 244 ứng cử viên trong các tế bào HEK-293T cho thấy không có mối tương quan rõ ràng nào giữa Tluc trong tĩnh mạch và Tluc được tiết ra trong tế bào hoặc toàn bộ (Hình bổ sung. 1a, b), chỉ ra rằng cả biểu hiện tế bào và bài tiết tổng thể đều không dự đoán đầy đủ khả năng sắp xếp EV. Đối với hầu hết các ứng cử viên, tỷ lệ phần trăm Tluc trong tĩnh mạch là dưới 36, điều này là bất ngờ nhưng có thể là do hoạt động của enzyme bị suy giảm và/hoặc thời gian tồn tại của photon khi có chất tẩy rửa Triton. Tuy nhiên, nó cung cấp một giới hạn hợp lý và thiết thực cho các protein có khả năng phân loại EV. Theo định nghĩa này, tổng cộng 293 protein đã được tìm thấy để thể hiện khả năng sắp xếp EV trong các tế bào HEK-XNUMXT (Hình XNUMX). 2a). Trong số này có năm protein phân loại EV đã biết bao gồm ba dấu hiệu EV (CD9, CD63, CD81), một protein được xác định gần đây (PTGFRN)32và gag glycoprotein của virus, do đó chứng minh tính hợp lệ của giao thức sàng lọc của chúng tôi. Theo hiểu biết tốt nhất của chúng tôi, đây là lần đầu tiên 31 protein còn lại được báo cáo là có khả năng tải hàng hóa tối đa vào xe điện.
a Tổng quan về tất cả 244 ứng cử viên vẽ biểu đồ tổng Tluc được tiết ra so với tỷ lệ Tluc trong tĩnh mạch. Các protein phân loại EV được xác định là có tỷ lệ phần trăm Tluc trong tĩnh mạch trên XNUMX (vùng màu vàng) và được hiển thị trong biểu đồ chấm được nhóm. Giá trị đề cập đến tỷ lệ phần trăm của Tluc trong tĩnh mạch. Protein được đánh dấu bằng tên gen. b Mối tương quan giữa thứ hạng liên quan đến tổng Tluc được tiết ra và thứ hạng liên quan đến tỷ lệ Tluc/Nluc được tiết ra. c Mối tương quan giữa tỷ lệ phần trăm Tluc trong tĩnh mạch thu được từ sàng lọc chính và lặp lại. d Mối tương quan về thứ hạng liên quan đến Tluc được tiết ra hoặc hiệu quả bài tiết giữa sàng lọc chính và sàng lọc lặp lại. Kết quả trong (a, b) là từ sàng lọc chính và được hiển thị dưới dạng trung bình ± độ lệch chuẩn của năm lần sao chép sinh học. Dữ liệu từ sàng lọc lặp lại được hiển thị dưới dạng trung bình ± độ lệch chuẩn của ba lần sao chép sinh học. Trong các biểu đồ phân tán, mỗi dấu chấm biểu thị một ứng cử viên và dấu chấm màu đỏ biểu thị điểm chuẩn CD63. Mức độ tương quan được phân tích với hồi quy tuyến tính và được thể hiện dưới dạng mức độ phù hợp (R2) và ý nghĩa của độ dốc khác không (P). Dữ liệu nguồn được cung cấp dưới dạng tệp Dữ liệu nguồn.
Trong số bốn loại protein phân loại EV không phải virut đã biết, CD63 cho thấy tỷ lệ Tluc trong tĩnh mạch cao nhất, với 89% tổng số Tluc được tiết ra bên trong EV. Đáng chú ý, TSPAN2 vượt trội so với CD63 không chỉ về Tluc trong tĩnh mạch tương đối (93% so với 89%) mà còn về số lượng tuyệt đối (2.0e6 so với 1.7e6; xem tệp Dữ liệu nguồn để biết thông tin chi tiết). Ngoài ra, ba protein calmodulin (CALM1, CALM2, CALM3) đã sắp xếp một lượng đáng kể Tluc thành EV nhưng với tỷ lệ Tluc trong tĩnh mạch vừa phải (29–31%).
Để loại trừ bất kỳ yếu tố không mong muốn nào cản trở quá trình tiết Tluc, các biện pháp kiểm soát chất lượng phù hợp đã được áp dụng. Đầu tiên, tất cả các ứng cử viên được xếp hạng theo tổng số Tluc được tiết ra và tỷ lệ của tổng số Tluc được tiết ra trên Nluc. Bình thường hóa chống lại tín hiệu Nluc không ảnh hưởng đến bài tiết Tluc (Hình. 2b), do đó loại bỏ vai trò gây nhiễu của quy trình truyền máu. Thứ hai, việc lặp lại sàng lọc cho thấy kết quả nhất quán về tỷ lệ Tluc trong tĩnh mạch (Hình. 2c) cũng như thứ hạng của tổng số Tluc được tiết ra và hiệu quả bài tiết (Hình. 2d). Cuối cùng, thứ hạng của tổng Tluc được tiết ra và hiệu quả bài tiết cho thấy mức độ tương quan tuyến tính cao giữa hai liều plasmid khác nhau (0.75 µg/mL so với 1 µg/mL; Hình bổ sung. 1c). Kết hợp lại với nhau, những kết quả này chứng minh độ tin cậy của những phát hiện thu được bằng phương pháp sàng lọc của chúng tôi.
Các protein phân loại EV phần lớn được bảo tồn trên các loại tế bào khác nhau
Bên cạnh HEK-293T, các loại tế bào khác thường được sử dụng làm nguồn EV, điều này nhắc chúng tôi sàng lọc khả năng phân loại EV của các ứng cử viên trong (1) tế bào HEK thích ứng với hệ thống treo (Freestyle 293-F), (2) tế bào có nguồn gốc từ máu dây rốn người. tế bào gốc trung mô (MSC), (3) tế bào ung thư biểu mô có nguồn gốc từ tế bào gan người (Huh-7) và (4) tế bào biểu mô thận chuột (TCMK-1). Với mục đích này, 95 ứng cử viên đã thể hiện hứa hẹn trong lần sàng lọc ban đầu, ở một trong hai loại sau: tỷ lệ Tluc trong tĩnh mạch, tổng số Tluc được tiết ra và hiệu quả bài tiết (xem tệp Dữ liệu Nguồn để biết thông tin chi tiết), đã được sàng lọc như trên.
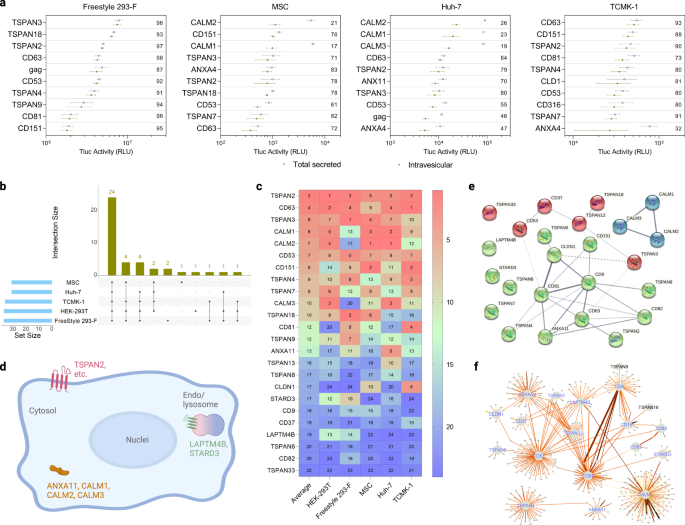
Trong Freestyle 293-F, protein có khả năng phân loại EV cao nhất tính theo tỷ lệ phần trăm của Tluc trong tĩnh mạch là TSPAN3. Trong MSC và Huh-7, CALM2 chiếm thứ hạng cao nhất và trong TCMK-1 là CD63 (Hình. 3a). Mặc dù quy trình truyền máu không ảnh hưởng đáng kể đến sự bài tiết Tluc trong tất cả các tế bào kết dính được thử nghiệm, nhưng Freestyle 293-F dường như dễ bị biến đổi hơn (Hình bổ sung. 2). Từ 30 đến 37 protein có khả năng sắp xếp EV (tỷ lệ phần trăm Tluc trong tĩnh mạch trên XNUMX) đã được xác định cho từng loại tế bào (Hình. 3b). Trong số này, 24 protein được bảo tồn trên tất cả năm loại tế bào cho thấy khả năng sắp xếp mạnh mẽ của chúng trong các bối cảnh tế bào khác nhau (xem tệp Dữ liệu nguồn để biết danh sách đầy đủ). Các protein trong tập hợp con được bảo tồn đã được xếp hạng theo hoạt động Tluc trong tĩnh mạch tuyệt đối của chúng (Hình XNUMX). 3c). Trung bình, TSPAN2, CD63 và TSPAN3 đã thể hiện khả năng sắp xếp tốt nhất trên các loại tế bào khác nhau.
a Mười protein giàn giáo hàng đầu liên quan đến Tluc trong các loại tế bào sản xuất khác nhau. Giá trị bên trong biểu đồ đề cập đến tỷ lệ phần trăm của Tluc trong tĩnh mạch. Kết quả được hiển thị dưới dạng trung bình ± độ lệch chuẩn của ba lần sao chép sinh học. b Số lượng protein phân loại EV được xác định cho từng loại tế bào sản xuất và sự chồng chéo giữa các loại tế bào. c Xếp hạng của 24 protein phân loại EV được bảo tồn liên quan đến Tluc nội mạch trong từng loại tế bào. Giá trị cho biết thứ hạng trong mỗi loại ô cũng như giá trị trung bình của chúng. d Cấu trúc liên kết và vị trí dưới tế bào của 24 protein phân loại EV được bảo tồn. Được tạo bằng BioRender.com. (ef) Mạng tương tác của 24 protein sắp xếp EV được bảo tồn được lấy từ CHUỖI (e) và IntAct (f) cơ sở dữ liệu. Độ dày đường trong bảng (e, f) cho thấy sức mạnh của hỗ trợ dữ liệu, với đường kẻ dày hơn thể hiện bằng chứng mạnh mẽ hơn. Protein được đánh dấu bằng tên gen. Dữ liệu nguồn được cung cấp dưới dạng tệp Dữ liệu nguồn.
Để hiểu sâu hơn về các cơ chế tiềm năng chi phối khả năng sắp xếp EV của tập hợp con được bảo tồn, các nghiên cứu tin sinh học đã được tiến hành. Theo chú thích có sẵn trên UniProtKB, chỉ có ba protein calmodulin và ANXA11 là tế bào học, trong khi các protein còn lại đều là thành viên của siêu họ tetraspanin và nằm trên màng huyết tương hoặc màng nội nhũ/lysosome (Hình XNUMX). 3d). Tiếp theo, chúng tôi đã đánh giá các tương tác có thể có giữa 24 protein phân loại EV. Hệ tương tác thử nghiệm và dự đoán có sẵn từ cơ sở dữ liệu STRING cho thấy bằng chứng yếu về sự tương tác của TSPAN2/TSPAN3 với CD63 và các protein calmodulin dường như hoạt động bất kể phần còn lại (Hình XNUMX). 3e). Tương tự như vậy, các kết quả từ cơ sở dữ liệu IntAct, bao gồm cả tương tác trực tiếp và gián tiếp, gợi ý rằng hệ tương tác của TSPAN2 trùng lặp kém với hệ tương tác của ba tetraspanin đặc trưng CD9/CD63/CD81 (Hình XNUMX). 3f). Những dự đoán này chỉ ra rằng TSPAN2 và TSPAN3 hoạt động phần lớn độc lập với nhau và các tetraspanin khác.
Các ứng cử viên phân loại EV tỏ ra mạnh mẽ trong quá trình sản xuất EV được tiêu chuẩn hóa
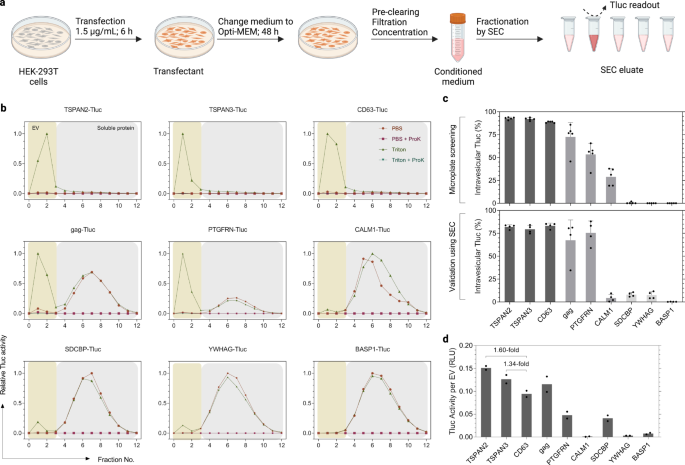
Trong quá trình sàng lọc, các tế bào HEK-293T đã được nuôi cấy và truyền trong các tấm vi mạch 96 giếng nhằm mục đích đạt được thông lượng cao hơn. Tuy nhiên, quy mô như vậy là không khả thi đối với các ứng dụng trong tương lai đang tìm cách sản xuất số lượng lớn hơn EV được thiết kế. Ngoài ra, môi trường đã điều hòa trong quá trình sàng lọc được phân tích trực tiếp sau khi ly tâm mà không có bất kỳ kỹ thuật phân tách xác định nào. Ở đây, chúng tôi đặc biệt quan tâm đến các EV nhỏ (sEV, ≤ 200 nm) vì tiềm năng điều trị của chúng đối với nhiều bệnh36,37. Với ý nghĩ đó, chúng tôi đã sản xuất xe điện theo một giao thức được tiêu chuẩn hóa do nhóm của chúng tôi thiết lập gần đây38. Sự khác biệt chính đối với giao thức sàng lọc ban đầu là (1) liều plasmid cao hơn và thời gian truyền máu ngắn hơn, (2) bảo trì sau đó trong Opti-MEM và (3) lọc môi trường đã điều hòa qua màng 200nm sau đó là nồng độ bước (Hình. 4a). Ngoài ra, các sEV được SEC tách ra khỏi các protein hòa tan trước khi đo hoạt động Tluc và số lượng túi (Hình. 4b). Đáng chú ý, Tluc trong dịch rửa giải đã bị vô hiệu hóa hoàn toàn bởi Proteinase K cho thấy rằng các tập hợp protein kháng thuốc không phải là vấn đề đáng lo ngại (Hình XNUMX). 4b).
a Quy trình sản xuất EV và giao thức phân đoạn SEC. Được tạo bằng BioRender.com. b Cấu hình rửa giải SEC của phương tiện được điều hòa từ các tế bào HEK-293T đã được truyền. EV và protein hòa tan được phục hồi lần lượt theo các phân số 0–3 và 4–12. Hoạt động Tluc trong từng phân số được đo khi có và không có Triton và ProK, đồng thời được chuẩn hóa thành phân số có tín hiệu cao nhất. c Tỷ lệ phần trăm Tluc trong tĩnh mạch sử dụng quy trình sàng lọc (bảng trên; năm lần lặp lại sinh học) và tiêu chuẩn hóa (bảng dưới; bốn lần lặp lại sinh học). Giá trị trung bình ± độ lệch chuẩn. d Hoạt tính Tluc được tính toán trên mỗi túi đối với các chế phẩm EV tinh khiết. Kết quả được hiển thị dưới dạng trung bình của hai lần sao chép sinh học. Protein được đánh dấu bằng tên gen. Dữ liệu nguồn được cung cấp dưới dạng tệp Dữ liệu nguồn. Sắc ký loại trừ kích thước SEC.
Để hiểu rõ hơn về khả năng sắp xếp sEV, chín ứng cử viên đại diện đã được chọn dựa trên hiệu suất của họ trong quá trình sàng lọc (Hình. 4c). Tỷ lệ phần trăm Tluc trong tĩnh mạch thường trùng khớp với sàng lọc, cho thấy khả năng phân loại sEV cao (>80%; TSPAN2, TSPAN3 và CD63) và thấp (<15%; SDCBP, YWHAG, BASP1) (Hình. 4c). Thật thú vị, CALM1 chỉ sắp xếp 3.7% Tluc thành sEV so với 28.9% trong quá trình sàng lọc (P < 0.01, Sinh viên hai mặt t Bài kiểm tra). Khi tính đến số lượng túi, chúng tôi đã quan sát thấy rằng TSPAN2 và TSPAN3 vượt trội so với CD63 về hoạt động Tluc trên mỗi EV (lần lượt là 1.60 lần và 1.34 lần; Hình. 4d). Nhìn chung, những kết quả này chứng minh rằng khả năng sắp xếp của chín ứng cử viên này hầu như không thay đổi khi tuân theo giao thức sản xuất sEV được tiêu chuẩn hóa.
Các ứng cử viên phân loại EV tỏ ra linh hoạt đối với các loại hàng hóa khác nhau
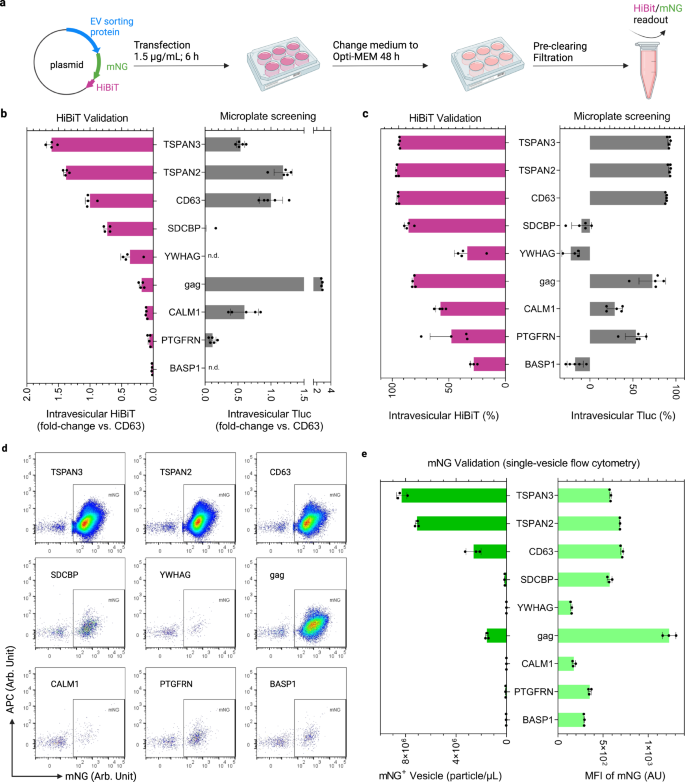
Luciferase là một phóng viên dễ dàng để định lượng số lượng lớn EV được thiết kế. Tuy nhiên, để có thêm thông tin về số lượng EV được thiết kế và sự phong phú của protein hàng hóa trên mỗi EV, phương pháp tế bào học dòng hình ảnh túi đơn là phương pháp được lựa chọn39,40. Do đó, đối với chín protein ứng cử viên đã khám phá ở trên, Tluc đã được thay thế bằng một trình báo lai bao gồm protein huỳnh quang mNeonGreen (mNG; 26.6 kDa) được hợp nhất với HiBiT41, một peptide 11-mer từ Nluc luciferase đã phân tách (Hình. 5a).
a Quy trình sản xuất và phân tích EV. Được tạo bằng BioRender.com. b HiBiT trong tĩnh mạch so với CD63 chuẩn. và không được phát hiện. c Tỷ lệ phần trăm của HiBiT trong tĩnh mạch. TRONG b, c, kết quả được hiển thị dưới dạng trung bình ± độ lệch chuẩn của bốn lần sao chép sinh học. Kết quả sàng lọc từ các tế bào HEK-293T được vẽ lại để tham khảo. d Các sơ đồ tế bào học dòng chảy một túi của các EV có nhãn mNG-HiBiT. e Nồng độ và cường độ huỳnh quang trung bình (MFI) của EV dương tính với mNG. Kết quả được hiển thị dưới dạng trung bình ± độ lệch chuẩn của ba lần sao chép sinh học. Protein được đánh dấu bằng tên gen. Dữ liệu nguồn được cung cấp dưới dạng tệp Dữ liệu nguồn.
So sánh các hoạt động luciferase trong tĩnh mạch của HiBiT và Tluc cho thấy hiệu quả kỹ thuật có thể so sánh được đối với TSPAN3, TSPAN2 và CD63 về số lượng (Hình. 5b) và tỷ lệ phần trăm (Hình. 5c). Sử dụng mNG để xem xét cấp độ túi đơn, TSPAN3 và TSPAN2 đã tạo ra số lượng EV được thiết kế cao nhất, vượt trội so với CD63 gần gấp ba lần trong khi đạt mức mNG tương tự trên mỗi EV được thiết kế (Hình XNUMX). 5d, e). Ngoài ra, chúng tôi đã chỉ ra rằng mNG được đồng bộ hóa với các protein sắp xếp tương ứng trên EV sau khi nhuộm kháng thể, đây là dấu hiệu cho thấy các protein tổng hợp còn nguyên vẹn (Hình bổ sung. 3). Đáng ngạc nhiên, các phép đo dựa trên HiBiT- và Tluc khác nhau rất nhiều đối với gag (Hình. 5b, c); tuy nhiên, các mức mNG của nó không cho thấy sự khác biệt như vậy (Hình XNUMX). 5d, e). Điều này khiến chúng tôi đưa ra giả thuyết rằng cấu hình không gian của gag-mNG-HiBiT cấm HiBiT kết hợp với tiểu đơn vị đối tác của nó để tạo thành luciferase chức năng. Ngoài ra, CALM1 cho thấy mức độ thấp của HiBiT và mNG dạng mụn nước, phù hợp với xu hướng được quan sát thấy đối với CALM1-Tluc trong các thử nghiệm xác thực SEC (Hình XNUMX). 4c). Những kết quả này cho thấy rằng CALM1 ưu tiên sắp xếp thành các túi lớn hơn (> 200nm) được loại bỏ trong bước lọc (Hình bổ sung. 4).
Chúng tôi cũng đã đánh giá hiệu suất của các protein được chọn này trong các tế bào Freestyle 293-F, đây là nguồn nổi bật để sản xuất EV do quy trình nhân giống ít tẻ nhạt hơn. Một lần nữa, TSPAN3 và TSPAN2 vượt trội so với CD63 lần lượt là 82% và 50% về HiBiT trong tĩnh mạch (Hình bổ sung. 5a). Ở cấp độ một túi, nồng độ cao nhất của các túi dương tính với mNG được tạo ra bởi TSPAN3 và TSPAN2 đã thiết kế các tế bào Freestyle 293-F (Hình bổ sung. 5b). Nói chung, các kết quả đối chiếu dựa trên các phóng viên mNG-HiBiT và Tluc củng cố độ tin cậy của giao thức sàng lọc và làm nổi bật khả năng phân loại EV mạnh mẽ của các protein ứng cử viên cho các loại hàng hóa khác nhau.
Chữ ký phân tử khác biệt giữa các EV được thiết kế bằng tetraspanin
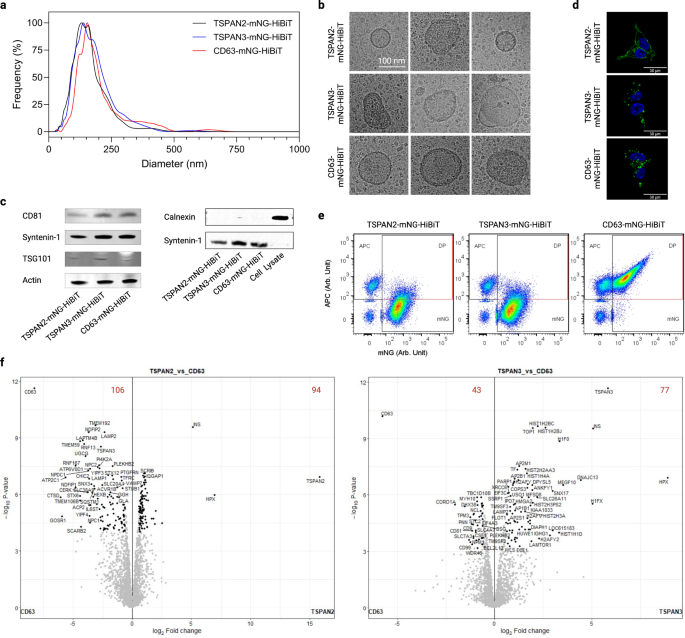
Xuyên suốt tất cả các thí nghiệm, TSPAN2 và TSPAN3 xuất hiện trong số các protein phân loại EV tốt nhất, dường như hoạt động tốt hơn so với tetraspanin CD63 đặc trưng. Đáng chú ý, các dạng đồng phân mối nối khác nhau của TSPAN2 và TSPAN3 không thể duy trì khả năng sắp xếp EV trong các tế bào HEK293-T (Hình bổ sung. 6). Vì, theo những gì chúng tôi biết, đây là báo cáo đầu tiên về các protein này cho kỹ thuật nội sinh của EV, chúng tôi đã mô tả các đặc tính hóa lý của EV được thiết kế TSPAN2- và TSPAN3 liên quan đến EV được thiết kế bằng CD63 một cách chi tiết hơn.
Phân tích theo dõi hạt nano của các chế phẩm EV từ các tế bào HEK-293T đã được truyền cho thấy sự phân bố kích thước hẹp với đường kính thủy động lực học trung bình khoảng 120nm (Hình XNUMX). 6a). Ngoài ra, sự xuất hiện hình thái của chúng là điển hình của EVs như được minh họa bằng cấu trúc và kích thước màng (Hình XNUMX). 6b). Ngoài ra, các dấu hiệu EV phổ biến như CD81, syenin-1 và TSG101, nhưng không phải là dấu hiệu âm tính Calnexin, đã được phát hiện trong EV (Hình XNUMX). 6c). Ngoài ra, chúng tôi đã kiểm tra vị trí của ba protein tetraspanin trong các tế bào được chuyển gen để hiểu rõ hơn về quá trình sinh học EV. Trong khi TSPAN2 được định vị trong cả màng sinh chất và tế bào chất của tế bào sản xuất, TSPAN3 và CD63 chủ yếu được phát hiện dưới dạng tín hiệu dấu chấm câu bên trong tế bào (Hình. 6d). Hơn nữa, việc sản xuất tất cả các loại EV được thiết kế có khả năng chống lại sự ức chế của ceramide (Hình bổ sung. 7a), đây là yếu tố thúc đẩy con đường sản xuất exosome được công nhận1,42.
a Phân bố kích thước của EV từ các tế bào HEK-293T được truyền. b Hình ảnh kính hiển vi điện tử lạnh đại diện của EVs. c Western blots của các dấu hiệu tích cực và tiêu cực của EVs. d Vị trí tế bào của tetraspanin trong các tế bào HEK-293T được truyền. e Tế bào học dòng chảy một túi chấm các lô EV sau khi nhuộm bằng kháng thể tetraspanin CD9 / CD63 / CD81 liên hợp APC. f Biểu đồ núi lửa hiển thị các protein được làm giàu khác nhau trong EVs. Các chữ số màu đỏ biểu thị số lượng protein được làm giàu khác nhau. Kết quả là từ ba bản sao sinh học. Dữ liệu nguồn được cung cấp dưới dạng tệp Dữ liệu nguồn. Dữ liệu proteomics khối phổ đã được gửi đến ProteomeXchange Consortium thông qua kho lưu trữ của đối tác PRIDE với mã định danh tập dữ liệu PXD043840.
Để hiểu được các dấu hiệu protein của chúng, EV được nhuộm bằng các chất đánh dấu bề mặt chảo cổ điển CD9/CD63/CD81 và được phân tích ở cấp độ một túi. Sự biểu hiện quá mức của các tetraspanin đã ảnh hưởng khác nhau đến năng suất của tổng số EV (được định nghĩa là tất cả các sự kiện huỳnh quang, Hình bổ sung. 7b) và EV được thiết kế (được định nghĩa là mNG+ sự kiện, Hình bổ sung. 7c). Thú vị hơn, chỉ một phần nhỏ EV được thiết kế TSPAN2- và TSPAN3 hiển thị ba điểm đánh dấu EV cổ điển trên bề mặt (Hình. 6e). Ngoài ra, phân tích biểu hiện bề mặt EV của 39 protein bằng phương pháp tế bào học dòng chảy dựa trên hạt ghép kênh43 tiết lộ rằng thành phần văn bia bề mặt của EV dương tính với TSPAN2 khác với thành phần của EV dương tính với CD9/CD63/CD81 (Hình bổ sung. 7d). Bên cạnh protein bề mặt, các phân tích proteomic chuyên sâu về EV cho thấy rất nhiều protein được làm giàu khác nhau cho TSPAN2 (106 loại được làm giàu và 94 được làm giàu) và TSPAN3 (43 loại được làm giàu và 77 được làm giàu) so với EV được thiết kế bằng CD63. CD9/CD63/CD81 nằm trong số các protein được điều hòa giảm đáng kể trong các EV được thiết kế bởi TSPAN2/TSPAN3, phù hợp với kết quả thu được từ phương pháp tế bào học dòng chảy dựa trên hạt và túi đơn. Dựa trên phân tích Gene Onology, khi so sánh với EV loại hoang dã từ các tế bào HEK293T, cả ba loại EV được xử lý công nghệ (CD63, TSPAN2 và TSPAN3) đều được làm giàu (>10%) với các enzym xen kẽ chất chuyển hóa, enzym biến đổi protein và protein chuyển hóa RNA , nhưng đã cạn kiệt (> 10%) protein ma trận ngoại bào (Hình bổ sung. 8). Tiếp theo, chúng tôi đã so sánh thành phần protein tổng thể với công cụ Phân tích phân cụm chính và quan sát thấy rằng EV được thiết kế khác với EV loại hoang dã và ở mức độ thấp hơn so với nhau (Hình bổ sung. 7e). Thật thú vị, so với WT EV, sự biểu hiện quá mức của TSPAN2 đã tác động tiêu cực đến mức CD63 và TSPAN3, điều này có thể cho thấy mối quan hệ cạnh tranh. Mặt khác, sự biểu hiện quá mức TSPAN3 đã dẫn đến sự gia tăng nhẹ về mức độ CD63 cho thấy một quy định tích cực (Hình bổ sung. 7f). Nhìn chung, những phát hiện này minh họa rằng kỹ thuật dựa trên TSPAN2/TSPAN3 tạo ra các quần thể EV khác biệt với CD63.
Xe điện do TSPAN2- và TSPAN3 thiết kế làm phương thức phân phối
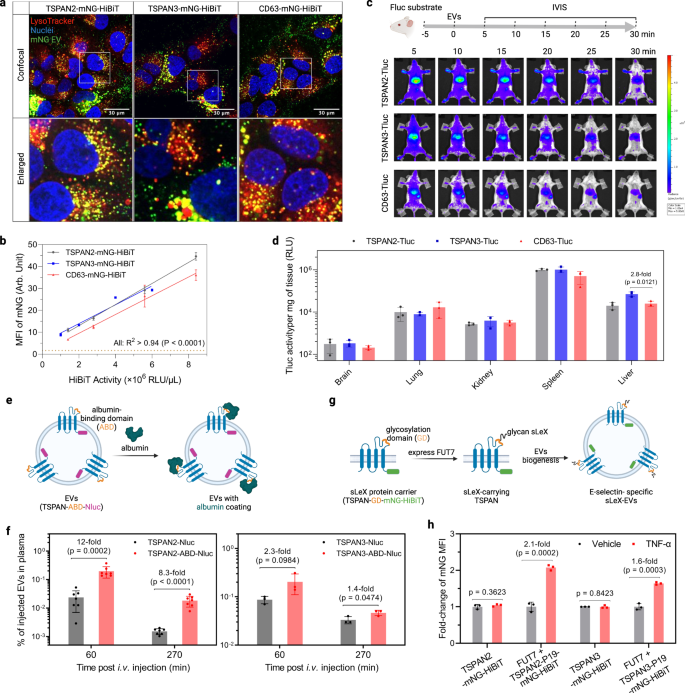
Để tìm hiểu xem xe điện do TSPAN2/TSPAN3 thiết kế có phù hợp để phân phối di động hay không, chúng tôi đã nghiên cứu tiềm năng phân phối in vitro và in vivo của chúng. Đầu tiên, các tế bào Huh-7 được xử lý bằng EV có nhãn mNG để kiểm tra vị trí dưới tế bào của chúng trong các tế bào nhận. Tín hiệu màu vàng có dấu chấm câu rõ ràng cho thấy rõ ràng quá trình nội địa hóa và buôn bán hiệu quả đối với lysosome (Hình. 7a). Định lượng MFI di động bằng phương pháp tế bào học dòng chảy cho thấy hiệu quả hấp thụ tốt hơn một chút đối với EV do TSPAN2/TSPAN3 thiết kế so với EV do CD63 thiết kế (Hình XNUMX). 7b). Đối với các nghiên cứu phân phối EV ở chuột, lượng EV được thiết kế bằng nhau (dựa trên hoạt động Tluc) được tiêm tĩnh mạch và theo dõi trong thời gian thực với hệ thống hình ảnh in vivo (Hình bổ sung. 9a và Hình. 7c). Đối với cả ba loại EV được thiết kế, chúng tôi đã quan sát thấy sự phân phối nhanh chóng đến gan và lá lách trong vòng 5 phút (Hình. 7c) và sự suy giảm đáng kể trong hoạt động của toàn bộ cơ thể trong hơn 30 phút (Hình bổ sung. 9c, P = 0.0006, kiểm định Kruskal–Wallis). Xe điện do TSPAN2- và TSPAN3 thiết kế dường như mang lại khả năng giữ chân toàn thân cao hơn một chút so với xe điện do CD63 thiết kế (Hình bổ sung. 9b). Kết quả từ các phép đo ex vivo tiếp theo đã hỗ trợ sự tích lũy chiếm ưu thế ở gan và lách của EVs được thiết kế (Hình. 7d). Khi được kết hợp với nhau, giống như EV được thiết kế bằng CD63, EV được thiết kế bằng TSPAN2 và TSPAN3 được các tế bào in vitro và in vivo tiếp nhận một cách hiệu quả.
a Các tế bào Huh-7 được xử lý bằng EV trong 4 giờ và được nhuộm bằng LysoTracker để hình dung lysosome. Hình ảnh kính hiển vi đồng tiêu từ các vùng đại diện từ toàn bộ giếng được hiển thị. Thí nghiệm được thực hiện một lần. b Các tế bào Huh-7 được xử lý bằng EV trong 8 giờ. MNG MFI di động được định lượng bằng phương pháp tế bào học dòng chảy. Dữ liệu được hiển thị dưới dạng trung bình ± độ lệch chuẩn của ba lần sao chép sinh học. Mức độ tương quan được phân tích với hồi quy tuyến tính và được thể hiện dưới dạng mức độ phù hợp (R2) và ý nghĩa của độ dốc khác không (P). c Phân phối sinh học của EVs ở chuột. Chuột NMRI được tiêm trong màng bụng d-chất nền luciferin. Năm phút sau, những con chuột được tiêm vào tĩnh mạch cùng một lượng EV đã được thiết kế (dựa trên hoạt động của Tluc) và được chụp ảnh bằng IVIS. Sau đó, các cơ quan chính được thu thập để đo phát quang sinh học ex vivo. Hình ảnh IVIS đại diện được hiển thị. N = 3. d Hoạt động của Tluc trong các cơ quan ex vivo sau IVIS. Kết quả được hiển thị dưới dạng trung bình ± độ lệch chuẩn của ba con chuột. e Đề án tạo EVs liên kết với albumin. EV được thu thập từ các tế bào HEK-293T biểu hiện ổn định các protein tổng hợp. f EVs liên kết với albumin được tiêm tĩnh mạch và nồng độ của chúng trong huyết tương đã được xác định. Dữ liệu được hiển thị dưới dạng trung bình ± độ lệch chuẩn. N = 7 (đối với TSPAN2 liên quan) hoặc 3 (đối với TSPAN3 liên quan). g Sơ đồ hiển thị sLeX trên xe điện. EV được thu thập từ các tế bào HEK-293T thể hiện ổn định các thành phần. h Các tế bào HUVEC đã được kích hoạt bởi TNF-α trong 2 giờ và được xử lý bằng EV trong 6 giờ. MNG MFI của tế bào đã được định lượng bằng phương pháp tế bào học dòng chảy và được hiển thị dưới dạng thay đổi lần so với các ô chưa được kích hoạt. c, e, g Được tạo bằng BioRender.com. Dữ liệu được hiển thị dưới dạng trung bình ± độ lệch chuẩn của ba lần sao chép sinh học. Học sinh hai mặt t Bài kiểm tra. Dữ liệu nguồn được cung cấp dưới dạng tệp Dữ liệu nguồn.
Sau khi giới thiệu rộng rãi khả năng tải và phân phối của TSPAN2 và TSPAN3 đối với hàng hóa nặng, tiếp theo chúng tôi đã nghiên cứu tiềm năng của chúng đối với các ứng dụng hiển thị bề mặt EV. Các vòng ngoại bào lớn (LEL) của một số tetraspanin đã được khai thác cho các ứng dụng như vậy và đưa ra sự tương đồng về cấu trúc liên kết của protein tetraspanin, chúng tôi đã tìm cách chế tạo LEL của TSPAN2 và TSPAN3. Việc chèn miền liên kết với albumin (ABD) vào LEL của CD63, CD9 và CD81 đã được chứng minh là kéo dài đáng kể thời gian lưu thông huyết tương của EVs44. Sử dụng cùng một chiến lược, một ABD đã được sao chép vào LEL của TSPAN2 và TSPAN3 với Nluc tại điểm cuối C để định lượng (Hình. 7e). EV được thu thập từ các tế bào HEK-293T biểu hiện ổn định protein tổng hợp TSPAN-ABD-Nluc (Hình bổ sung. 9c) và được đánh giá về khả năng liên kết với albumin của chúng. Đúng như dự đoán, chỉ các EV hiển thị ABD được liên kết với albumin (Hình bổ sung. 9d). Tiếp theo, những EV này được tiêm tĩnh mạch vào chuột và nồng độ EV trong huyết tương được đo trên cơ sở Nluc ở các mốc thời gian khác nhau. So với các EV được chế tạo bằng tetraspanin kiểu hoang dã, các EV hiển thị ABD có nồng độ trong huyết tương cao hơn đáng kể, đặc biệt khi sử dụng TSPAN2 làm protein giàn giáo (Hình XNUMX). 7f).
Trong một ví dụ khác, chúng tôi nhằm mục đích đạt được mục tiêu cụ thể của tế bào nội mô được kích hoạt thông qua hiển thị bề mặt của phối tử glycan sialyl Lewis X (sLeX)45. Do đó, chất mang peptit 19-mer sLeX (P19) đã được đưa vào LEL của từng protein tetraspanin với mNG-HiBiT tại đầu C. Với sự có mặt của fucosyltransferase VII (FUT7), P19 được glycosyl hóa để hiển thị sLeX (Hình XNUMX). 7g). Dựa trên cơ sở lý luận này, các sLeX-EV được tạo ra từ các tế bào HEK-293T thể hiện ổn định FUT7 và TSPAN-P19-mNG-HiBiT (Hình bổ sung. 9c). Sự hấp thu của chúng được đánh giá trong các tế bào nội mô được kích hoạt bằng TNF-α, biểu hiện E-selectin, thụ thể chính của sLeX. Các EV được thiết kế bằng tetraspanin kiểu hoang dã được sử dụng tương tự trong các tế bào nội mô chưa được kích hoạt và được kích hoạt trong khi sLeX-EV, sử dụng TSPAN2 hoặc TSPAN3 làm giàn giáo, đã thể hiện sự hấp thu thích hợp hơn bởi các tế bào nội mô được kích hoạt (Hình XNUMX). 7h). Nhìn chung, điều này chứng tỏ tính khả thi của TSPAN2 và TSPAN3 về mặt kỹ thuật đồng thời của LEL để hiển thị bề mặt và đầu C để tải hàng hóa trong lòng, do đó làm nổi bật tiềm năng của chúng đối với các ứng dụng trị liệu.
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Ô tô / Xe điện, Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- BlockOffsets. Hiện đại hóa quyền sở hữu bù đắp môi trường. Truy cập Tại đây.
- nguồn: https://www.nature.com/articles/s41467-023-40453-0