CITE-seq cung cấp sự trình bày toàn diện về EHT
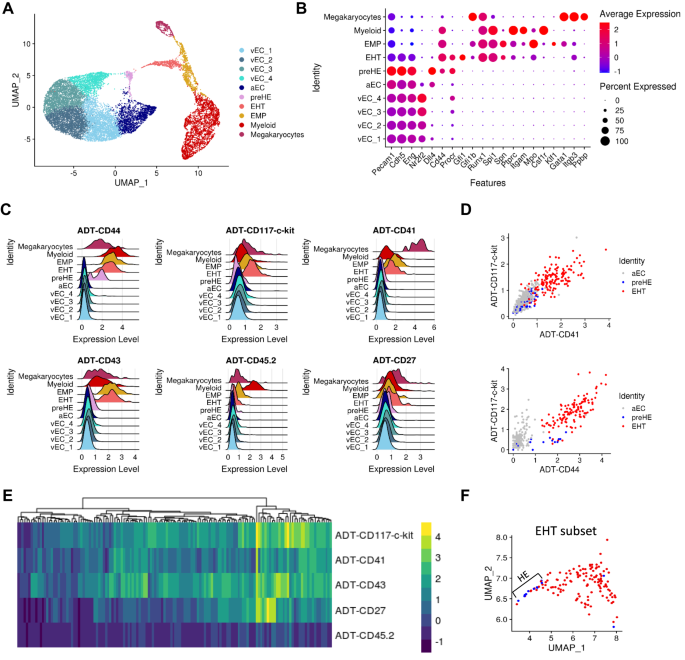
Để xác định các yếu tố trong nội mô giúp tế bào hướng tới kiểu hình tạo máu, chúng tôi đã thực hiện CITE-seq trên CD31+ Các tế bào được phân lập FACS từ AGM của phôi hoang dã E10.5 (WT) để phân lập tất cả các tế bào EC và IAHC, thay vì có nguy cơ mất mát với các điểm đánh dấu bổ sung được chọn trước. Các kháng thể chống lại CD44, CD117, CD41, CD43, CD27 và CD45 đã được sử dụng để xác định các quần thể EC, HE và tiền HSPC ở các giai đoạn khác nhau của quy trình EHT1,3,4,5,6,16. Việc phân cụm các bản phiên mã đơn bào không được giám sát cho thấy các quần thể EC khác nhau (biểu hiện Cdh5 (VE-Cadherin) và Anh (CD105, Endoglin)), các tế bào trải qua EHT biểu hiện cả gen nội mô và gen tạo máu (tức là: Runx1, gfi1, Spi1) và các tế bào tạo máu trưởng thành (biểu hiện ptprc (CD45) và các dấu hiệu dòng dõi khác) (Hình XNUMX). 1A, B). Các tế bào tạo máu trưởng thành này, bao gồm các tế bào tiền thân hồng cầu-myeloid (EMP), có khả năng bắt nguồn từ quá trình tạo máu sớm trong túi noãn hoàng nhưng cũng có thể đại diện cho một số tế bào trưởng thành được tạo ra ở giai đoạn này từ quá trình EHT. Nhiều quần thể EC đã có mặt trong tập dữ liệu và chúng được phân loại sâu hơn dựa trên biểu hiện của các dấu hiệu tĩnh mạch (vEC) và động mạch (aEC) (Hình bổ sung. 1A, B).
A Biểu diễn UMAP của phân cụm không giám sát một ô dựa trên dữ liệu bảng điểm. B Các gen liên kết với mỗi cụm trong (A) xác định loại tế bào. C, D Biểu hiện thẻ có nguồn gốc từ kháng thể (ADT) cho (C) mỗi cụm được xác định trước đó được biểu thị bằng các ô sườn và D lô phân tán của các quần thể có liên quan. E Sơ đồ nhiệt biểu hiện bề mặt, dựa trên ADT, của các điểm đánh dấu được chọn trên các ô tạo thành cụm EHT. F Xác định kiểu hình HE trong phân nhóm “EHT' trên phép chiếu UMAP. Các ô được dán nhãn màu xanh lam là âm tính với CD117, CD41, CD43 và CD45 dựa trên biểu hiện ADT và các ô màu đỏ biểu thị ít nhất một trong các dấu EHT.
Ngoài các cụm EC và EHT, dữ liệu CITE-seq cho thấy một quần thể nhỏ EC tiền tạo máu (tiền HE) tương tự như các mô tả gần đây của Zhu et al.18. (Hình bổ sung. 1C, D). Các tế bào này đi theo quỹ đạo giả thời gian hướng tới EHT (Hình bổ sung. 1E) và có biểu hiện cao của các dấu hiệu nội mô nhưng cũng được biểu hiện thêm Cd44, một dấu hiệu gần đây có liên quan đến khả năng tạo máu16, cùng với mức độ cao hơn của Procr (CĐ201)17 so với các tập hợp con EC khác (Hình XNUMX). 1B và Hình bổ sung. 1F). Các tế bào tiền HE thiếu các dấu hiệu HE nguyên mẫu Runx1 và gfi1, do đó phân biệt hai quần thể này (Hình XNUMX). 1B và Hình bổ sung. 1G).
Thông tin về kiểu hình miễn dịch bổ sung do CITE-seq cung cấp đã xác nhận các quần thể phụ dự kiến của EC, biểu thị mức độ không đáng kể của các dấu hiệu bề mặt được chọn, cũng như các tế bào trải qua EHT, cho thấy biểu hiện thay đổi của CD117 và CD41 trong khi điều chỉnh lại CD43 và CD45 (Hình XNUMX). 1C–E và Hình bổ sung. 1H). Tế bào HE kiểu hình biểu hiện CD31+CD117-CD41-CD43-CD45- và cả hai Runx1 và gfi1 được đặt ở phần cực của cụm EHT gần nhất với các ô tiền HE trong không gian UMAP (Hình XNUMX). 1F và Hình bổ sung. 1I). Đáng chú ý, sự hiện diện của các tế bào HE này đại diện cho một phần nhỏ của cụm EHT (13 trong số 140 tế bào EHT), phù hợp với khả năng chuyển đổi nhanh chóng sang kiểu hình pro-/pre-HSPC18. Do đó, hầu hết các tế bào hình thành cụm EHT đều là IAHC, biểu thị cả hai Runx1 và gfi1 ở cấp độ phiên mã và ít nhất một điểm đánh dấu bề mặt kiểu hình, CD117 hoặc CD41 (Hình XNUMX). 1E). Ngoài ra, chúng tôi quan sát thấy rằng các tế bào tiền HE quan tâm không thể phân biệt được với lớp nội mạc còn lại bằng biểu hiện protein bề mặt của các dấu hiệu kiểu hình điển hình CD117 và CD41 (Hình XNUMX). 1C, D). Tuy nhiên, việc bổ sung kháng thể CD44 cho thấy sự làm giàu có chọn lọc đối với tập hợp nhỏ các tế bào tiền HE mà hiện nay chúng ta có thể định nghĩa là CD31+CD44+CD117-CD41-CD43-CD45- (Sung. 1C, D) và đại diện cho giai đoạn trung gian giữa quần thể aEC và các tế bào trải qua EHT, như được hỗ trợ bởi phân tích quỹ đạo silico (Hình bổ sung. 1E). Do đó, CITE-seq đã xác định các tập hợp con riêng biệt của quần thể nội mô và tạo máu có liên quan đến EHT cùng với dữ liệu biểu hiện gen đơn bào.
Meis1 được điều chỉnh lại trong các tế bào tiền HE sớm trước EHT
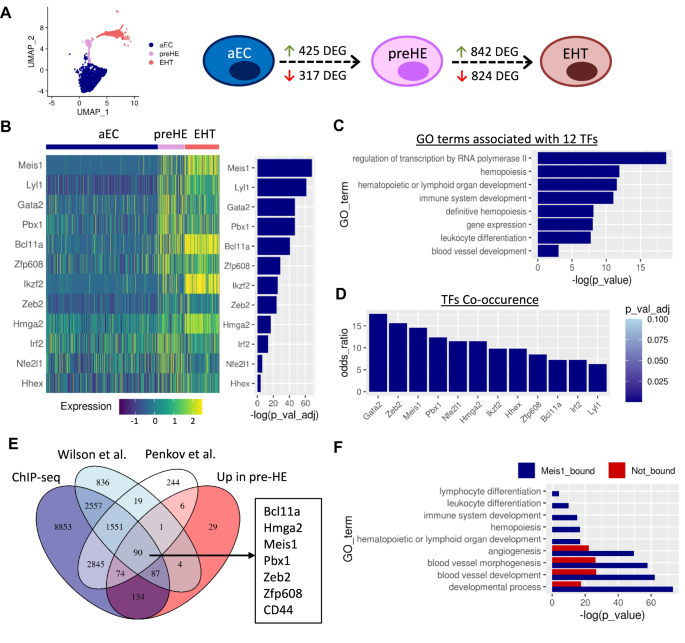
So với aEC, 425 và 317 gen đã được điều hòa tăng và giảm tương ứng trong giai đoạn tiền HE (được điều chỉnh p-giá trị < 0.1; Quả sung. 2A). Dấu hiệu của các gen được điều hòa đã được làm phong phú cho một số con đường được báo cáo trước đây là quan trọng đối với EHT như con đường TGF-β và Notch cũng như tín hiệu viêm (Hình bổ sung. 2A). Ngoài ra, phân tích bản thể gen (GO) đã xác định sự phong phú của các gen liên quan đến tạo máu, điều này làm nổi bật hơn nữa khả năng tạo máu của các tế bào này so với cụm aEC (Hình bổ sung. 2A). Phù hợp với tính chất tiền tạo máu của các tế bào này, tiền HE duy trì điểm biểu hiện cao của các gen liên quan đến sự hình thành mạch, so với các tế bào EHT và cũng cho thấy sự điều hòa tăng dần của dấu hiệu gen tạo máu xác định (Hình bổ sung. 2B).
A Biểu diễn UMAP chỉ của các cụm aEC, preHE và EHT và sơ đồ hiển thị số lượng DEG giữa mỗi quần thể tế bào trong quá trình chuyển đổi. B Bản đồ nhiệt hiển thị biểu hiện của 12 TF được làm giàu trong các ô trước HE so với aEC, được xếp hạng theo mức độ quan trọng (kiểm tra tổng xếp hạng Wilcoxon (hai mặt) với hiệu chỉnh Bonferroni để điều chỉnh p-giá trị). C Các thuật ngữ GO được chọn liên quan đến 12 TF được xác định trong B (giá trị p siêu hình với hiệu chỉnh g:SCS bằng cách sử dụng cài đặt mặc định trong gprofiler2). D Sự xuất hiện đồng thời của 12 TF trong B với 425 gen được làm giàu trước HE, dựa trên phân tích EnrichR (p-giá trị dựa trên thử nghiệm chính xác của Fisher một phía với hiệu chỉnh Stewamini-Hochberg). E Các gen chồng chéo giữa tập dữ liệu Meis1 ChIP-seq của chúng tôi, bộ dữ liệu ChIP-seq đã xuất bản và các gen được làm giàu ở giai đoạn tiền HE so với aEC trong dữ liệu CITE-seq. F Các thuật ngữ GO được chọn liên quan đến các gen được làm giàu trước HE được phân loại dựa trên sự hiện diện của các vị trí liên kết Meis1 trong dữ liệu ChIP-seq (giá trị p siêu bội với hiệu chỉnh g:SCS bằng cách sử dụng cài đặt mặc định trong gprofiler2).
Để tìm kiếm các yếu tố thúc đẩy số phận tế bào, chúng tôi tập trung vào các yếu tố phiên mã (TF). Trong số 425 gen được điều hòa, 12 TF được xác định là được làm giàu đáng kể ở giai đoạn tiền HE so với aEC và tồn tại qua EHT (Hình XNUMX). 2B). Phân tích thuật ngữ GO cho thấy sự phong phú của 12 TF này cho các quá trình sinh học liên quan đến phiên mã và tạo máu (Hình XNUMX). 2C). Do đó, chúng tôi đã đưa ra giả thuyết rằng sự biểu hiện sớm của các TF này có thể chi phối sự chuyển đổi nội mô liên quan đến khả năng tạo máu. Trong số 12 TF, Meis1 được xếp hạng là có mức độ giàu có đáng kể nhất, với đối tác ràng buộc của nó tổng đài1 xếp thứ tư (Hình XNUMX). 2B).
Một cách riêng biệt, chúng tôi đã thực hiện RNA-seq số lượng lớn để xác định các TF ngược dòng có trong HE dựa trên lý do căn bản rằng các TF này có thể quan trọng để đưa các tế bào tiền HE vào trạng thái HE. Để đạt được mục đích này, chúng tôi đã sử dụng Runx1+23Chuột phóng viên GFP là công cụ hữu hiệu để làm giàu cho các tế bào HE trong ĐHCĐ9. Tổng cộng có 228 yếu tố phiên mã (TF) đã được làm giàu đặc biệt trong CD31+CD117-CD45-Runx1+23GFP+ Các tế bào HE so với EC mạch máu trong AGM của chuột ở E10.5. Để tìm các bộ điều chỉnh ngược dòng ứng viên có khả năng điều khiển mẫu biểu thức được quan sát trong các ô HE, Phần tử điều tiết xa (DiRE)28 phân tích được thực hiện trên các TF được làm giàu HE, dẫn đến danh sách 9 TF được làm giàu có khả năng liên kết các yếu tố điều hòa liên quan đến các gen HE đồng biểu hiện. Bao gồm 9 TF này Meis1 và các đối tác ràng buộc của nó tổng đài1 và hoxa9 (Hình bổ sung. 3). Vì vậy, hai cách tiếp cận khác nhau được xác định Meis1 được làm phong phú trong giai đoạn đầu của đặc điểm kỹ thuật tiền HE/HE.
Meis1 liên kết các gen liên quan đến đặc điểm tạo máu
Với dự đoán rằng Meis1 có thể điều chỉnh biểu hiện của các TF được làm giàu HE khác trong tập dữ liệu của chúng tôi, chúng tôi đã đưa ra giả thuyết rằng Meis1 có thể được yêu cầu để thúc đẩy đặc điểm kỹ thuật tạo máu sớm. Dữ liệu đồng biểu thức từ máy chủ web EnrichR29 tiết lộ rằng cả hai Meis1 và tổng đài1 nằm trong số các TF hàng đầu cùng xuất hiện với 425 gen được làm giàu trước HE (Hình XNUMX). 2D), chồng chéo lần lượt với 64 và 57 gen.
Tiếp theo chúng tôi thực hiện ChIP-seq trong EPCR nguyên thủy+CD150+CD48-lin- Các tế bào tạo máu trưởng thành được tải nạp vectơ Meis1-YFP để xác định các mục tiêu Meis1 trực tiếp, dẫn đến ánh xạ các đỉnh liên kết tới 16,198 gen lân cận dựa trên khoảng cách trình tự. Chúng tôi đã so sánh danh sách các gen liên quan đến vị trí gắn Meis1 với hai bộ dữ liệu ChIP-seq có sẵn công khai dựa trên biểu hiện Meis1 nội sinh: một bộ được thực hiện trong các tế bào tiền thân tạo máu của chuột HPC730 và cái còn lại ở phôi chuột E11.531. Các gen được coi là bị ràng buộc bởi Meis1 nếu chúng được tìm thấy có điểm chung giữa ít nhất hai trong số ba bộ dữ liệu. Hơn 59% (252/425) gen được điều hòa trong các tế bào tiền HE so với aEC được liên kết với các vị trí gắn Meis1 (Hình XNUMX). 2E). Những gen này bao gồm 11 trong số 12 TF tạo máu mà trước đây chúng tôi đã xác định ở giai đoạn tiền HE so với aEC, đặt Meis1 với tư cách là một ứng cử viên chính điều tiết thượng nguồn. Các yếu tố thúc đẩy của 52 trong số 64 gen thường xuyên biểu hiện cùng với Meis1 dựa trên phân tích EnrichR bị ràng buộc bởi Meis1 dựa trên ChIP-seq, hỗ trợ vai trò của Meis1 trong việc thúc đẩy aEC hướng tới số phận tạo máu.
So với aEC, chữ ký gen tiền HE đã được làm phong phú hơn cho các thuật ngữ GO liên quan đến tạo máu (Hình bổ sung. 2A). Điều thú vị là, phân tích thuật ngữ GO cho thấy mối liên quan của các quá trình sinh học liên quan đến sự phát triển của hệ thống tạo máu chỉ trong một phần gen tiền HE được dự đoán sẽ bị ràng buộc bởi Meis1 (Hình XNUMX). 2F). Mặt khác, các gen liên quan đến quá trình hình thành mạch và quá trình phát triển được phân bố rộng rãi hơn giữa các phân số gắn kết Meis1 và không liên kết (Hình XNUMX). 2F). Do đó, các gen liên quan đến sự phát triển của hệ thống tạo máu được biểu hiện trong các tế bào tiền HE cũng là mục tiêu trực tiếp của Meis1, cho thấy rằng Meis1 ưu tiên aEC cho cam kết tạo máu bằng cách đóng vai trò là bộ điều chỉnh ngược dòng biểu hiện gen tạo máu. Một số gen được điều hòa trong quá trình chuyển sang tiền HE cũng được tìm thấy gần với các vị trí gắn kết Meis1 (Hình bổ sung. 4). Mặc dù các gen này được làm phong phú thêm cho các thuật ngữ GO sinh học tổng quát hơn, nhưng danh sách này bao gồm các gen liên quan đến mạch máu và Wnt cần được điều hòa để EHT tiếp tục (Hình bổ sung. 4). Meis1 cũng có thể có vai trò ức chế tiềm tàng đối với số phận nội mô thông qua một số gen quan trọng.
Meis1 được biểu hiện cao ở IAHC và nội mô xung quanh in vivo
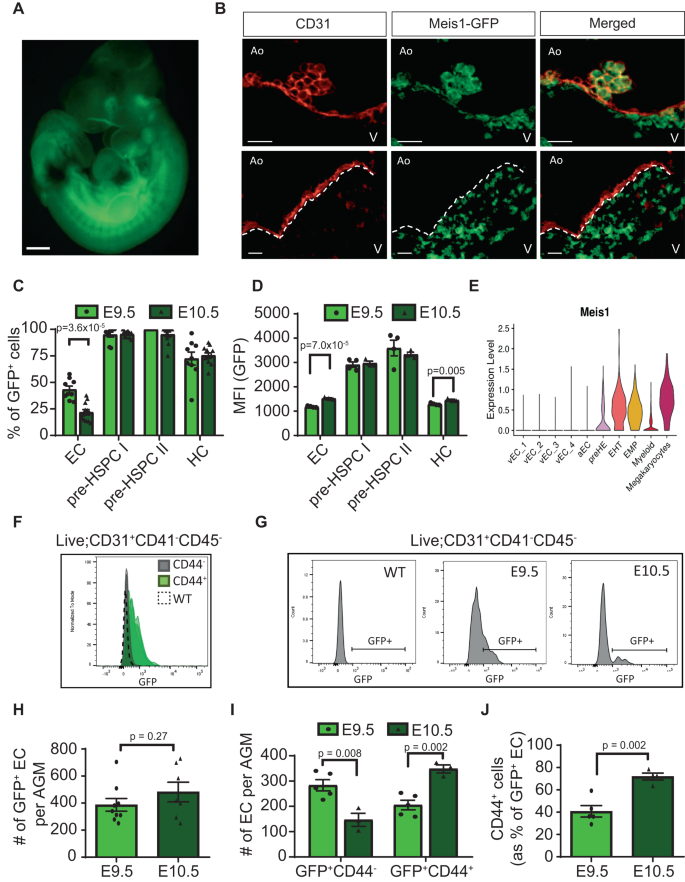
Để xác nhận vai trò của Meis1 trong đặc điểm kỹ thuật EC tạo máu, chúng tôi đã sử dụng một Meis1 Mô hình chuột phóng viên GFP (Hình XNUMX). 3A) trong đó thẻ GFP-P2A-HA được chèn ngược dòng của Meis1 vị trí bắt đầu phiên mã32. GFP tóm tắt lại một cách trung thực biểu thức Meis1 mà không làm thay đổi chức năng của nó do phản ứng tự phân tách 2A trong quá trình dịch mã (Hình bổ sung. 5A, giới thiệu. 32). Trong E10.5 AGM, GFP được biểu hiện cao ở tất cả IAHC và trong một tập hợp con EC của động mạch chủ lưng, cũng như trong trung mô dưới động mạch chủ (Hình XNUMX). 3B). Phù hợp với vai trò trong sự xuất hiện của IAHC, GFP+ EC đã được làm giàu ở các phần của động mạch chủ lưng nằm dưới IAHC trái ngược với GFP- EC có thể được nhìn thấy trên các phần dài không có IAHC (Hình XNUMX). 3B). Tương tự, phân tích bằng phương pháp tế bào học dòng chảy đã xác nhận biểu hiện cao ở khắp nơi của Meis1 về kiểu hình tiền HSPC (CD31+CD41thấpCD45- / +) (Hình. 3C, D), như được quan sát trong dữ liệu CITE-seq (Hình XNUMX). 3E). Phù hợp với việc duy trì miễn dịch, hầu hết EC (CD31+CD41-CD45-) là GFP- bằng phương pháp tế bào học dòng chảy với tập hợp con GFP nhỏ hơn rõ rệt+ EC (Hình. 3C). Trong ngăn EC số lượng lớn, GFP hầu như chỉ được thể hiện trong CD44+ EC xác nhận rằng Meis1 dán nhãn CD44+ phần tiền HE của nội mô ở E10.5 (Hình XNUMX). 3F), do đó xác nhận ở mức protein in vivo Meis1 mẫu biểu thức được quan sát ở cấp độ bảng điểm trong dữ liệu CITE-seq ở E10.5 (Hình XNUMX). 3E).
A Hình ảnh đại diện của hơn 50 Meis1-Phôi GFP được mổ xẻ ở E10.5 (thanh tỷ lệ = 500 µm). B Miễn dịch các mặt cắt ngang của động mạch chủ lưng ở E10.5 cho thấy biểu hiện của CD31 (màu đỏ) và Meis1-GFP (màu xanh lá cây). Đường chấm ở các tấm phía dưới phân định lớp nội mô với trung mô dưới động mạch chủ. (Ao: Động mạch chủ, V: Bụng, thanh tỷ lệ = 20 µm). N = 7 phôi trên 4 thí nghiệm độc lập. C Tỷ lệ tế bào biểu hiện Meis1 trong quần thể tế bào được xác định dựa trên huỳnh quang GFP bằng phương pháp tế bào học dòng chảy (n = 9 tại E9.5 và n = 12 tại E10.5) và (D) các giá trị GFP MFI liên quan (n = 4 tại E9.5 và n = 3 tại E10.5 từ cùng một thí nghiệm). Các ô khả thi được kiểm soát như sau: EC: CD31+CD41-CD45-, trước HSPC I: CD31+CD41thấpCD45-, tiền HSPC II: CD31+CD41thấpCD45+, tế bào tạo máu (HC): CD31-CD45+. Dữ liệu được trình bày dưới dạng trung bình ± SEM và mỗi điểm dữ liệu đại diện cho một phôi khác nhau. E Cốt truyện miêu tả đàn violin Meis1 biểu hiện mRNA trong các quần thể CITE-seq khác nhau. Meis1 biểu hiện được phát hiện ở mức độ thấp trong 9.9% tổng số EC. F Biểu đồ hiển thị Meis1-Biểu hiện GFP bằng phương pháp tế bào học dòng chảy trong CD44- và CD44+ EC (n = 4 cho mỗi nhóm). WT đại diện cho một kiểu hoang dã (GFP-) phôi thai. G Biểu đồ đại diện cho huỳnh quang GFP bằng phương pháp tế bào học dòng chảy trong AGM EC tại các thời điểm khác nhau. H Tổng số GFP+ EC mỗi ĐHCĐ ở mức E9.5 (n = 9) và E10.5 (n = 7) và (I) Số EC được chia theo đồng biểu thức CD44 (n = 5 tại E9.5, n = 3 ở E10.5) dựa trên việc đếm hạt bằng phương pháp tế bào học dòng chảy. Đối với số ô tuyệt đối, một điểm dữ liệu E10.5 đã bị xóa dựa trên thử nghiệm Grubb để xác định các giá trị ngoại lệ. J Tỷ lệ GFP+ EC đồng biểu hiện CD44 ở E9.5 (n = 5) và E10.5 (n = 4). Dữ liệu được trình bày dưới dạng trung bình ± SEM và mỗi điểm dữ liệu đại diện cho một phôi khác nhau. Tất cả các giá trị p được chỉ định đã được tính toán bằng phép thử t hai mặt so sánh hai nhóm. Dữ liệu nguồn được cung cấp dưới dạng tệp Dữ liệu nguồn.
Trong khi IAHC nổi bật ở động mạch chủ lưng E10.5, đặc điểm kỹ thuật của HE có trước sự hình thành cụm. Theo dõi biểu hiện Meis1 tại thời điểm sớm hơn cho thấy tỷ lệ GFP tương đối cao hơn+ các ô ở E9.5 so với E10.5 cụ thể trong ngăn EC (Hình XNUMX). 3C, G). Mặc dù không có sự khác biệt nào được quan sát thấy trong GFP tuyệt đối+ Số EC giữa hai thời điểm (Hình XNUMX). 3H), E10.5 GFP+ EC cho thấy biểu hiện Meis1 tăng lên khi bắt đầu EHT (Hình XNUMX). 3D, G). Biểu thức CD44 theo thời gian theo biểu thức Meis1 trong GFP+ EC theo đề xuất của số lượng CD44 tăng lên+ các tế bào trong GFP+ EC từ E9.5 đến E10.5 (40% so với 72%, Hình XNUMX). 3I, J). Sự gia tăng tần số CD44 theo thời gian này+ các tế bào cho thấy sự tiến triển từ GFP sớm+CD44- tiền thân tại E9.5 tới GFP+CD44+ các tế bào tiền HE ở E10.5, với điều kiện là số lượng GFP tuyệt đối+ EC giữa hai thời điểm là tương tự nhau. Ủng hộ quan điểm này, E9.5 GFP+CD44- các tế bào đã điều hòa lại các gen tiền HE, đó cũng là mục tiêu Meis1, so với GFP-CD44- EC nhưng chưa biểu hiện gen HE (Hình bổ sung. 5B,C). Những phát hiện này cho thấy rằng Meis1 là động lực ban đầu của đặc điểm tạo máu.
Runx1 + Tế bào HE xuất hiện từ Meis1 + nội mô trong cơ thể
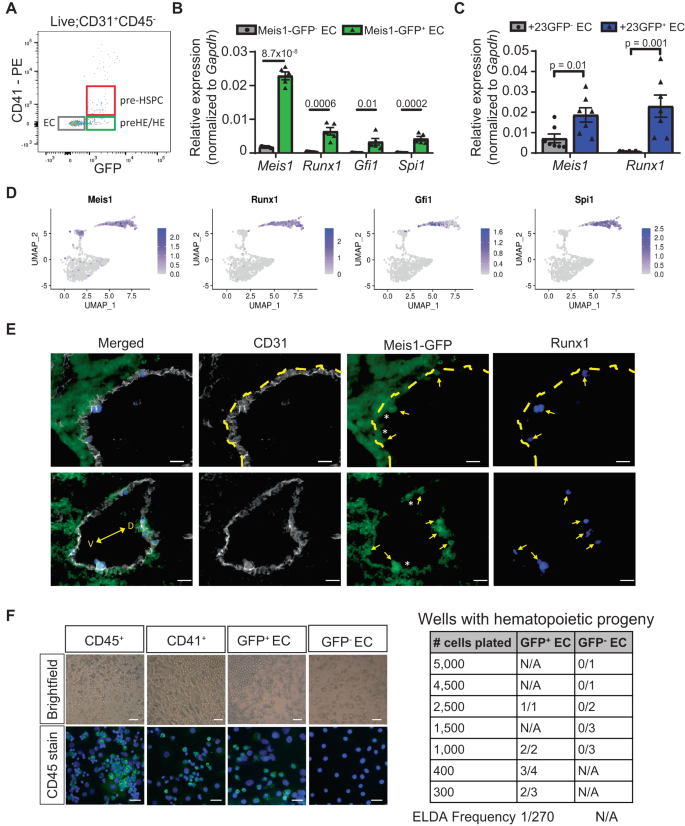
Mẫu biểu thức được quan sát lập luận rằng chỉ có Meis1-GFP+ EC có khả năng tạo máu và điều đó Meis1 có thể quan trọng trong đặc điểm kỹ thuật ban đầu của CD44+ tế bào tiền HE. Để điều tra điều này, GFP- EC và GFP+ EC được phân lập FACS khỏi AGM E10.5 phân tách để mô tả thêm đặc điểm của hai quần thể này (Hình XNUMX). 4A và Hình bổ sung. 8A). Phù hợp với giả thuyết của chúng tôi, sự biểu hiện của các gen liên quan đến EHT Runx1, gfi1và Spi1 được phát hiện độc quyền trong GFP+ EC (Hình. 4B), cho thấy sự hiện diện của các tế bào HE chỉ trong Meis1- thể hiện dân số. Trong khi Runx1 biểu hiện hoàn toàn được chứa trong Meis1-GFP+ EC (Hình. 4B), Meis1 được thể hiện rộng rãi hơn và được phát hiện ở mức độ thấp hơn trong Runx1+23GFP- EC từ ĐHCĐ tại E10.5 (Hình XNUMX). 4C). Quan sát này phù hợp với dữ liệu CITE-seq (Hình XNUMX). 4D) và củng cố thực tế rằng Meis1-biểu hiện EC bao gồm cả tế bào tiền HE và HE, và đứng trước Runx1 biểu thức (Hình. 4D). Hình ảnh huỳnh quang xác nhận rằng biểu hiện Meis1 đã được phát hiện trong tất cả Runx1 mới nổi+ HE in vivo, nhưng cũng có trong Runx1- EC trong một khu vực mở rộng bên cạnh Runx1+ HE (Hình. 4E và Hình bổ sung. 6), phù hợp với ý tưởng rằng các tế bào HE phát sinh từ một Meis1-biểu hiện tiền chất EC in vivo.
A Biểu đồ phân tán tế bào học dòng chảy đại diện được kiểm soát cho các tập hợp con có liên quan trong CD31 khả thi+CD45- dân số. B, C Biểu hiện mRNA của các gen liên quan đến EHT được chọn trong GFP phân lập FACS- và GFP+ EC từ E10.5 ĐHCĐ của (B) Meis1-Phôi GFP (n = 5 nhóm gồm 4 phôi từ cùng một lứa) và (C) Runx1+23 phôi GFP (n = 7 nhóm 3 phôi mỗi nhóm). Việc định lượng được thực hiện bởi ddPCR và được chuẩn hóa thành Gapdh. Các ô dạng vạch đang hiển thị giá trị trung bình ± SEM. Chỉ ra p-giá trị được tính toán bằng cách sử dụng t-test hai mặt so sánh hai nhóm. D Các phép chiếu UMAP của cụm aEC, tiền HE và EHT hiển thị biểu hiện của các gen được chọn trong dữ liệu CITE-seq. E Miễn dịch động mạch chủ lưng từ E10.5 Meis1-Phôi GFP (xám: CD31, xanh lục: GFP, xanh lam: Runx1, V: bụng, D: lưng). Mũi tên chỉ vào các ô Runx1+ và dấu hoa thị (*) biểu thị Meis1-GFP liền kề+Runx1- EC. Đường chấm chấm phân định lớp nội mô từ trung mô dưới động mạch chủ ở các tấm phía trên. Thanh tỷ lệ = 20 µm. Nhuộm được sao chép trong 2 thí nghiệm độc lập. F Xét nghiệm phân biệt ex vivo trên lớp mô đệm OP9 để đánh giá sự hình thành khuẩn lạc tạo máu từ GFP phân lập FACS+ và GFP- EC. Hình ảnh trường sáng đại diện (ở trên, thanh tỷ lệ = 50 µm) của các khuẩn lạc tạo máu được hình thành và xác nhận biểu hiện CD45 bằng phương pháp nhuộm miễn dịch huỳnh quang (bên dưới, thanh tỷ lệ = 25 Pha). Bảng bên phải hiển thị số lần sao chép khuẩn lạc dương tính ở điểm cuối đối với các đầu vào ô ban đầu khác nhau được thử nghiệm. Tần số của các tế bào HE được đánh giá bằng cách sử dụng phép tính xét nghiệm pha loãng giới hạn cực độ (ELDA). Dữ liệu nguồn được cung cấp dưới dạng tệp Dữ liệu nguồn.
Cũng không Meis1-GFP và CD44 riêng lẻ đều có thể tách các tế bào tiền HE khỏi các tế bào HE. Lý tưởng nhất là sự kết hợp của các điểm đánh dấu bề mặt sẽ phân biệt và tạo điều kiện thuận lợi cho việc cách ly tiền HE khỏi HE. Dựa trên dữ liệu CITE-seq của chúng tôi và tập dữ liệu đã xuất bản18, chúng tôi đã xác định được hai phân tử bề mặt ứng cử viên tiềm năng là CD200 và Notch4, được biểu thị bằng EC và tiền HE nhưng không có trong các tế bào HE và EHT (Hình bổ sung. 7A). So với E10.5 CD44- EC, các tế bào cùng biểu hiện CD44 và CD200 hoặc Notch4 cho thấy mức độ gen được điều hòa cao hơn trong quần thể tiền HE CITE-seq (Hình bổ sung. 7BNET E và hình bổ sung 5C). Mặt khác, gen HE được điều hòa lại trong CD44+CD200- và CD44+Notch4- các tế bào và được biểu hiện mạnh mẽ hơn ở giai đoạn tiền HSPC (Hình bổ sung. 7F, G). không giống Runx1, Meis1 được thể hiện mạnh mẽ ở cả CD44+CD200- hoặc CD44+Notch4- và CD44+CD200+ hoặc CD44+Notch4+ phân số tế bào, phù hợp với yêu cầu về Meis1 ở giai đoạn tiền HE trước Runx1 điều chỉnh lại trong thời gian đầu của EHT.
Để chứng minh một cách chức năng rằng chỉ Meis1-GFP+ các tế bào có khả năng trải qua EHT, E10.5 GFP+ và GFP- EC được nuôi cấy ex vivo trên các tế bào trung chuyển OP9 trong môi trường có các cytokine hỗ trợ tạo máu (Hình XNUMX). 4F và Hình bổ sung. 8B). CD41+ tiền HSPC và CD45+ các tế bào tạo máu được đưa vào làm đối chứng (Hình bổ sung. 8A, B) để xác nhận rằng hệ thống nuôi cấy này có thể thúc đẩy sự biệt hóa CD31+CD41thấpCD45- tế bào vào CD45+ tế bào và duy trì chúng trong môi trường nuôi cấy. Các khuẩn lạc tròn CD45+ tế bào tạo máu xuất hiện từ CD31+CD41-CD45-CFP+ EC sau 5 ngày nhưng hoàn toàn không có ở các giếng chứa GFP- EC (Hình. 4F) bất kể số lượng ô được mạ ban đầu, ngụ ý rằng biểu thức của Meis1 là cần thiết để tạo ra các tế bào HE chức năng. Điều quan trọng là, Meis1 locus gen không bị thay đổi về mặt di truyền trong mô hình này, do đó GFP- tế bào vẫn có khả năng tự điều chỉnh Meis1 biểu hiện nếu được yêu cầu ở giai đoạn sau trong quá trình nuôi cấy. Thực tế là không có GFP nào- EC sau đó đã hình thành các khuẩn lạc tạo máu ex vivo trong môi trường cho phép biệt hóa ủng hộ lập luận rằng Meis1 cần phải kích hoạt ở giai đoạn đầu của EHT, trước khi hình thành các tiền HSPC.
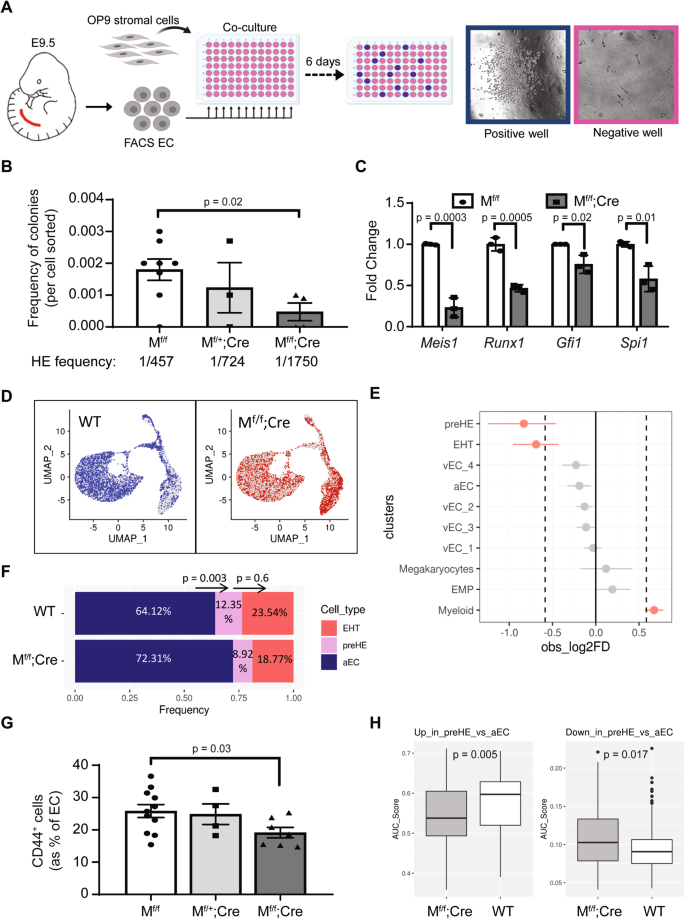
Meis1 biểu thức là cần thiết cho sự hình thành pre-HE/HE
Để điều tra một yêu cầu chức năng cho Meis1 trong EC, chúng tôi đã xóa có điều kiện Meis1 sử dụng Cre recombinase được điều khiển bởi bộ khởi động VE-Cadherin (VEC)33 để tạo ra Meis1phao / phao;Cre (Mf/f;Cre) phôi (Hình bổ sung. 9) và các bạn cùng lứa thiếu biểu hiện Cre sau đây được gọi là “WT”. Để định lượng tần số của các tế bào HE, chúng tôi đã nuôi cấy EC phân lập OP9 FACS từ các phôi đơn lẻ vào nhiều giếng của đĩa 96 giếng, với độ pha loãng giới hạn 100 tế bào mỗi giếng (Hình XNUMX). 5A). Ít tế bào hơn đáng kể từ E9.5 Mf/f;Phôi Cre tạo ra các khuẩn lạc tạo máu so với các bạn cùng lứa WT (Hình XNUMX). 5B), hỗ trợ yêu cầu về Meis1 trong sự xuất hiện của HE chức năng. Khẳng định rằng khiếm khuyết trong Meis1-null EC hiện diện ở cấp độ HE, phân tích biểu hiện gen được thực hiện trên EC phân lập FACS cho thấy sự giảm đáng kể các dấu hiệu chính của tế bào HE (Runx1, gfi1và Spi1) (Hình. 5C), được thể hiện riêng ở Meis1-GFP+ EC (Hình. 4B).
A Sơ đồ trình bày của xét nghiệm đồng nuôi cấy ex vivo được sử dụng để định lượng tần số của tế bào HE (được tạo bằng BioRender.com) và B tần số của các tế bào HE chức năng trong E9.5 AGM (n = 8 triệuf/f, 3 triệuf/+;Cre, 4 Mf/f;Cre). Mỗi dấu chấm trong B biểu thị kết quả của 1 phôi và tần số trung bình của tế bào HE được tính gần đúng bằng phần mềm Xét nghiệm pha loãng giới hạn cực độ (ELDA)48. C Biểu hiện mRNA của các gen liên quan đến EHT được chọn trong EC khả thi phân lập FACS (CD31+CD41-CD45-) từ ĐHCĐ E10.5. Việc định lượng được thực hiện bởi ddPCR và được chuẩn hóa thành Gapdh (n = 3 lần sao chép độc lập cho mỗi kiểu gen). TRONG B và C, dữ liệu được trình bày dưới dạng trung bình ± SEM và p-giá trị được tính toán bằng cách sử dụng hai mặt t-kiểm tra so sánh hai nhóm. D Đại diện của WT (màu xanh) và Mf/f;Các ô Cre (màu đỏ) trong không gian UMAP dựa trên phân cụm không giám sát. Các tế bào có kiểu gen đối diện được thể hiện bằng màu xám. E Phân tích sự khác biệt giữa tỷ lệ WT và Mf/f;Các ô Cre được tìm thấy trong mỗi cụm dữ liệu CITE-seq, sử dụng gói scProportionTest (kiểm tra hoán vị; n = 1000). Các quần thể được coi là có mức độ đại diện trên/dưới mức chênh lệch giới hạn > |1.5| (log2FD > |0.58|; đường chấm) và có ý nghĩa dựa trên FDR < 0.05 (chấm đỏ). Dữ liệu được trình bày dưới dạng khoảng tin cậy trung bình ± 95% (n = 8423 tế bào WT từ năm mẫu độc lập và n = 6745 triệuf/f; Tế bào Cre từ ba mẫu độc lập). F Tỷ lệ tương đối của các tế bào aEC, tiền HE và EHT trong WT và Mf/f;Cre mẫu. Một thử nghiệm Z hai tỷ lệ (hai mặt) đã được thực hiện để so sánh tỷ lệ tế bào trong các cụm liền kề để đánh giá sự khác biệt giữa các kiểu gen trong các tế bào chuyển từ aEC sang tiền HE và tiền HE sang EHT (p-giá trị được hiển thị phía trên các thanh). G Định lượng CD44+ các tế bào tiền HE trong E9.5 AGM bằng phương pháp tế bào học dòng chảy (n = 11 WT, 4 Mf/+;Cre, và 7 Mf/f;Cre). Dữ liệu được trình bày dưới dạng trung bình ± SEM và mỗi điểm dữ liệu đại diện cho một phôi khác nhau (p-giá trị dựa trên hai mặt t-kiểm tra). H Điểm biểu hiện gen cho chữ ký gen tiền HE (lên (bảng bên trái) hoặc xuống (bảng bên phải)) trong các tế bào tiền HE riêng lẻ từ WT và Mf/f;Cre mẫu, được tính toán bằng AUCell. Các ô hình hộp hiển thị dải phân cách giữa (đường giữa), phân vị thứ 25 và 75 (giới hạn hộp) và phạm vi liên tứ phân vị ±1.5*(râu). n = 171 tế bào WT từ năm mẫu độc lập và n = 77 triệuf/f; Tế bào Cre từ ba mẫu độc lập. P-giá trị được tính toán bằng cách sử dụng t-test hai phía. Dữ liệu nguồn được cung cấp dưới dạng tệp Dữ liệu nguồn.
Để mô tả rõ hơn nguồn gốc của khiếm khuyết ở cấp độ ô đơn, CITE-seq đã được thực hiện trên E10.5 Mf/f;Cre phôi để so sánh các quần thể khác nhau với đối tác WT của chúng. Tổng cộng 6745 triệuf/f; Tế bào Cre và 8423 tế bào WT (Bảng bổ trợ 2) đã được tích hợp và hiển thị bằng cách giảm kích thước của các bản phiên mã trên các ô UMAP (Hình XNUMX). 5D). Sự khác biệt đáng kể trong phân bố mẫu được quan sát thấy với Mf/f; Các tế bào Cre được thể hiện dưới mức đáng kể trong cả tập hợp con trước HE và EHT (Hình XNUMX). 5E và bảng bổ trợ 2). Tập trung vào các quần thể quan tâm đã xác nhận rằng tỷ lệ tế bào tiền HE và EHT đã giảm đáng kể so với aEC ở Mf/f;Các mẫu Cre (Hình. 5F). Điều thú vị là, tỷ lệ tương đối của các tế bào tiền HE tiến triển thành các tế bào EHT không khác biệt đáng kể so với những gì được quan sát thấy trong các mẫu WT (Hình XNUMX). 5F). Do đó, việc giảm số lượng tế bào trải qua EHT được quan sát thấy là do sự giảm ban đầu của quần thể trước HE, với sự gia tăng đồng thời về aEC và không phải là sự phong tỏa trong quá trình chuyển đổi từ trước HE sang EHT. Phù hợp với quan sát về khiếm khuyết trong thế hệ tiền HE, Mf/f;Phôi Cre cho thấy sự giảm tỷ lệ EC biểu hiện CD44 ở E9.5 (Hình XNUMX). 5G), chứng thực những phát hiện rằng Meis1 góp phần vào đặc điểm kỹ thuật của các tế bào tiền HE sớm.
Điều thú vị là trong khi một số tế bào tiền HE được hình thành trong trường hợp không có Meis1, chúng dường như ít được chuyển hóa hơn. Chúng tôi đã sử dụng chữ ký gen của quần thể aEC và tiền HE, dựa trên phân tích khác biệt giữa hai cụm này trong các tế bào WT (Hình XNUMX). 2A), để tính điểm biểu thức cho mỗi WT và Mf/f;Cre ô chứa trong cụm tiền HE. Nhìn chung, các tế bào tiền HE WT có biểu hiện gen được điều hòa cao hơn ở tiền HE so với aEC trong khi Mf/f;Các tế bào Cre đạt điểm cao hơn đối với các gen được cho là sẽ bị điều hòa quá mức trong cụm đó (Hình XNUMX). 5H). Vì thế, Meis1 đóng một vai trò quan trọng trong việc thu được chương trình phiên mã tiền HE trong các tế bào mà nếu không sẽ trở thành aEC.
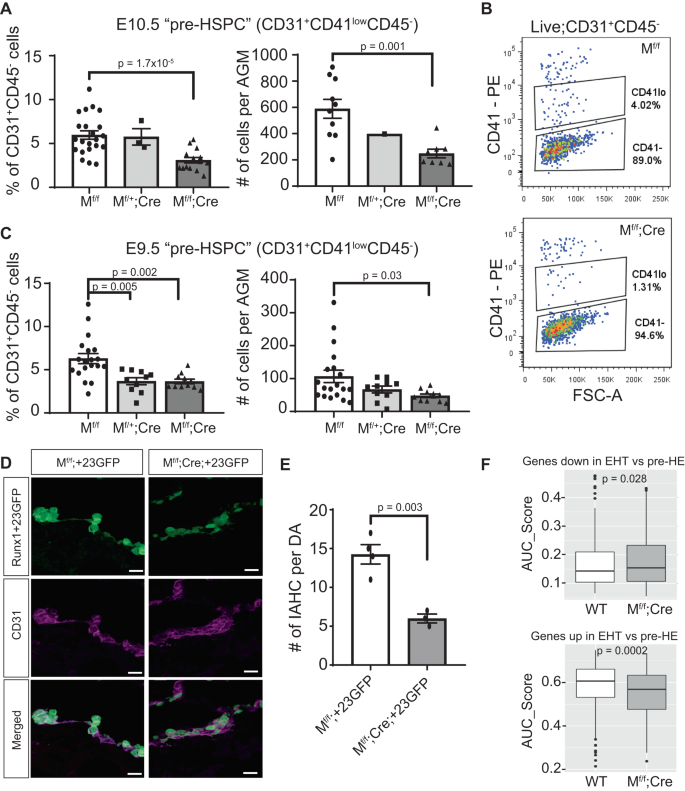
Sự hình thành tiền HE bất thường làm suy yếu sự xuất hiện của tiền HSPC
Hậu quả của việc mất Meis1 biểu hiện, khả năng tạo máu giảm của Mf/f;Cre EC từ động mạch chủ lưng làm suy yếu sự xuất hiện của tiền HSPC. Phương pháp tế bào học dòng chảy cho thấy số lượng CD31 kiểu hình miễn dịch thấp hơn+CD41thấpCD45- trước HSPC tại ĐHCĐ của Mf/f;Cre phôi cả theo tỷ lệ EC và theo số lượng tế bào tuyệt đối ở E10.5 (Hình XNUMX). 6A, B). Tương tự, số tiền HSPC kiểu hình miễn dịch ít hơn được phát hiện ở E9.5 Mf/f;Cre AGM so với các bạn cùng lứa WT (Hình XNUMX). 6C). Trong khi số lượng WT trước HSPC tăng mạnh giữa E9.5 và E10.5, thì mức giảm nếp gấp được quan sát thấy ở Mf/f;Phôi Cre so với WT được duy trì qua hai thời điểm (giảm 2.23 lần so với 2.37 lần ở E9.5 và E10.5 tương ứng). Do đó, khiếm khuyết EHT bắt nguồn từ rất sớm trong quá trình phát triển và được duy trì cũng như lan truyền trong suốt quá trình phát triển. Vì khiếm khuyết không được khuếch đại theo thời gian, điều này cho thấy Meis1 rất cần thiết cho đặc điểm kỹ thuật tiền HE sớm, nhưng không phải để thúc đẩy quá trình chuyển hóa tạo máu sang tiền HSPC sớm.
A, C Định lượng kiểu hình miễn dịch khả thi trước HSPC (CD31+CD41thấpCD45-) bằng phương pháp tế bào học dòng chảy trong (A) phôi E10.5 (n = 22 triệuf/f, 3 triệuf/+;Cre, và 15 Mf/f;Cre) và (C) E9.5 (n = 19 triệuf/f, 10 triệuf/+;Cre, và 11 Mf/f;Cre). TRONG A, hạt đếm chỉ được sử dụng trên một tập hợp con mẫu (bảng bên phải, n = 10 triệuf/f, 1 triệuf/+;Cre, và 8 Mf/f;Cre). Dữ liệu được trình bày dưới dạng trung bình ± SEM và mỗi điểm dữ liệu đại diện cho một phôi khác nhau. B Sơ đồ phân tán tế bào học dòng đại diện của biểu hiện CD41 trên CD31+CD45- các tế bào ở E10.5. D Miễn dịch E10.5 IAHC dựa trên biểu hiện GFP (màu xanh lá cây) và CD31 (màu tím) trong Runx1+23Phôi GFP biểu hiện Meis1 (Mf/f;+23GFP) và các bạn cùng lứa thiếu biểu hiện nội mô của Meis1 (Mf/f;Cre;+23GFP). Thanh tỷ lệ = 20 µm. E Định lượng IAHC lớn (>4 tế bào) trên mỗi động mạch chủ lưng (n = 4 triệuf/f;+23GFP và 3Mf/f;Cre;+23 phôi GFP). Dữ liệu được trình bày dưới dạng trung bình ± SEM. F Điểm biểu hiện gen cho chữ ký gen EHT (điều hòa giảm (bảng trên) hoặc điều hòa tăng (bảng dưới)) trong các ô EHT riêng lẻ từ WT và Mf/f;Cre mẫu trong tập dữ liệu CITE-seq, được tính toán bằng AUCell. Các ô hình hộp hiển thị dải phân cách giữa (đường giữa), phân vị thứ 25 và 75 (giới hạn hộp) và phạm vi liên tứ phân vị ±1.5*(râu). n = 326 tế bào WT từ năm mẫu độc lập và n = 162 triệuf/f; Tế bào Cre từ ba mẫu độc lập. Tất cả p-các giá trị trong hình này được tính bằng phép so sánh t-test hai phía giữa hai nhóm. Dữ liệu nguồn được cung cấp dưới dạng tệp Dữ liệu nguồn.
Để xác nhận thêm rằng việc thiếu các tế bào tiền HE khi không có Meis1 biểu hiện làm giảm EHT in vivo, chúng tôi đã lai ngược lại Meis1 chuột bị loại có điều kiện với Runx1+23 Chuột phóng viên GFP để tạo phôi chuyển gen biểu hiện GFP dưới sự kiểm soát không gian và thời gian của Runx1+23-chất tăng cường, do đó đánh dấu tất cả các chức năng tiền HSPC mới nổi9và thiếu biểu thức EC của Meis1 (Meis1phao / phao;VEC-cre;+23GFP, viết tắt Mf/f;Cre;+23GFP). Do đó, không phải lứa nào cũng tạo ra những phôi chuyển gen ba lần này, phôi được thu thập để kiểm tra IAHC bằng cách nhuộm miễn dịch các mặt cắt ngang của động mạch chủ lưng bằng cách sử dụng +23GFP làm điểm đánh dấu. Một số tế bào +23GFP đã được phát hiện trong cả WT (Mf/f;+23GFP hoặc Mf/+;+23GFP) và Mf/f;Cre;+23GFP động mạch lưng. Tuy nhiên, số lượng IAHC lớn (> 4 ô trên mỗi cụm) đã giảm đáng kể ở Mf/f;Cre;+23GFP động mạch lưng (Hình XNUMX). 6D, E). Hầu hết các tế bào +23GFP vẫn phẳng và bám vào thành mạch của động mạch chủ lưng thay vì phình ra vào lòng mạch như quan sát thấy ở các tế bào WT (Hình XNUMX). 6D). Thiếu Meis1 ngăn chặn đặc điểm kỹ thuật trước HE và Meis1- các tế bào null dường như không thể trải qua EHT mặc dù có biểu hiện của Runx1+23 gen chuyển GFP. Giống như các số tiền HSPC được định lượng bằng phương pháp tế bào học dòng chảy, sự hình thành IAHC trong Meis1-Phôi thiếu hụt đã giảm 2.38 lần thứ phát do khiếm khuyết về đặc điểm của EC mạch máu so với tiền HE. Mặc dù một số IAHC đã được hình thành, những M nàyf/f; Các tế bào Cre EHT chưa trưởng thành hơn so với đối tác WT của chúng dựa trên dấu hiệu biểu hiện gen đơn bào (Hình XNUMX). 6F).
Meis1 gây ra trạng thái phiên mã tiền HE ở EC trưởng thành
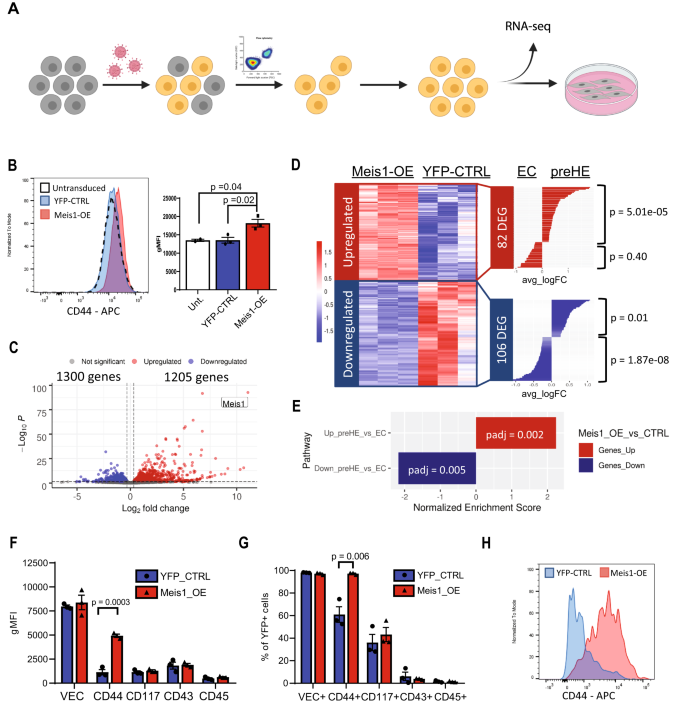
Khả năng của Meis1 để ưu tiên EC hướng tới chương trình sao chép tạo máu được đánh giá bằng cách giới thiệu Meis1 thông qua sự tải nạp lentivirus vào EC động mạch chủ từ chuột C57BL/6 trưởng thành, sau đó là phân lập các tế bào được tải nạp cùng biểu hiện CD31 và VEC để đảm bảo rằng các tế bào duy trì kiểu hình EC sau 72 giờ sau khi tải nạp (Hình XNUMX). 7A). Sự gia tăng biểu hiện bề mặt của CD44 được phát hiện ở Meis1-các tế bào biểu hiện quá mức (Meis1-OE) (Hình XNUMX). 7B), tương thích với sự điều hòa theo thời gian của CD44 được quan sát giữa E9.5 và E10.5 GFP+ EC in vivo (Hình XNUMX). 3I, J) và các địa điểm Meis1 như một bộ điều chỉnh ngược dòng CD44.
A Sơ đồ quy trình làm việc được sử dụng để nghiên cứu ảnh hưởng của sự biểu hiện quá mức Meis1 trong EC (được tạo bằng BioRender.com). B Cường độ huỳnh quang trung bình (MFI) của khả năng miễn dịch CD44 sau 72 giờ sau khi tải nạp. EC tải nạp đã được chọn (VEC+CD31+YFP+) cho các thí nghiệm (n = 2 CTRL chưa được truyền của cha mẹ, 3 YFP-CTRL và 3 Meis1-OE). Biểu đồ thanh bên phải hiển thị giá trị trung bình ± SEM (p-giá trị dựa trên hai phía t-kiểm tra). C Sơ đồ núi lửa hiển thị DEG trong Meis1-OE EC so với YFP-CTRL EC theo trình tự RNA (p-giá trị dựa trên phép thử Wald với hiệu chỉnh Stewamini–Hochberg). D Sơ đồ nhiệt mô tả tất cả các gen được điều chỉnh tăng/giảm trong Meis1-OE EC chung với DEG trong phân tích CITE-seq của aEC so với các tế bào tiền HE. Kiểm tra siêu hình học (một đầu) đã được thực hiện để xác định xem liệu sự trùng lặp có lớn hơn mong đợi từ việc lấy mẫu ngẫu nhiên hay không. E Phân tích GSEA định lượng mức độ phong phú của các bộ gen tiền HE tùy chỉnh (dựa trên biểu thức CITE-seq) trong Meis1-OE EC (giá trị p được điều chỉnh bằng hiệu chỉnh Stewamini-Hochberg). F–H Các tế bào được tải nạp với vectơ Meis1-OE hoặc YFP-CTRL được đồng nuôi cấy trên các tế bào OP9 trong 6 ngày sau đó là kiểu hình miễn dịch. F các giá trị gMFI để biểu thị các dấu hiệu bề mặt có liên quan đến các quần thể EHT và (G) tỷ lệ phần trăm các ô biểu thị từng điểm đánh dấu. Dữ liệu được trình bày dưới dạng trung bình ± SEM và mỗi điểm dữ liệu mô tả mức trung bình của các bản sao kỹ thuật (n = 3 mẫu sinh học độc lập cho mỗi nhóm). P-giá trị được tính toán bằng cách sử dụng hai mặt t-kiểm tra. H Biểu đồ biểu hiện biểu hiện CD44 bằng phương pháp tế bào học dòng chảy sau khi đồng nuôi cấy OP9. Dữ liệu nguồn được cung cấp dưới dạng tệp Dữ liệu nguồn.
RNA-seq của các tế bào Meis1-OE cho thấy 1205 gen được điều hòa và 1300 gen được điều hòa (Hình XNUMX). 7C). Đúng như dự đoán, các tế bào biểu hiện quá mức Meis1 trở nên giống với thời kỳ tiền HE hơn. Sự chồng chéo đáng kể đã được quan sát giữa các gen được điều hòa theo biểu hiện quá mức Meis1 và các gen được làm giàu trong các tế bào tiền HE so với aEC (Hình XNUMX). 7D). Cụ thể, 56 trong số 425 gen được làm giàu trước HE đã được tìm thấy được điều hòa trong Meis1-OE EC, nhiều hơn đáng kể so với dự kiến bằng cách lấy mẫu ngẫu nhiên (p = 5.01e-05, Hình. 7D). Phân tích làm giàu bộ gen được thực hiện bằng cách sử dụng các bộ gen tùy chỉnh bao gồm tất cả các DEG giữa aEC và trước HE đã xác nhận rằng Meis1-OE EC đã được làm giàu đáng kể trong các gen được điều hòa trong tiền HE so với aEC (Hình XNUMX). 7E). Ngoài ra, các gen được điều hòa theo Meis1-OE đã được làm giàu trong các gen được điều hòa ở giai đoạn tiền HE so với aEC (Hình XNUMX). 7E). Do đó, chỉ biểu hiện của Meis1 ở EC trưởng thành không tạo máu có thể kích hoạt những thay đổi phiên mã gợi nhớ đến kiểu biểu hiện mà chúng tôi quan sát thấy ở phôi thai trước HE, thể hiện vai trò rõ ràng đối với Meis1 trong việc tạo ra một chương trình tế bào là điều kiện tiên quyết để đạt được khả năng tạo máu.
Mặc dù một chương trình sao chép tiền HE rõ ràng đã được phát hiện trong Meis1-biểu hiện EC, EC trưởng thành biểu hiện quá mức Meis1 không thể hình thành các tế bào tạo máu trong ống nghiệm trong điều kiện đồng nuôi cấy OP9 cho phép. Sau 6 ngày nuôi cấy, hầu hết các tế bào đều giữ lại biểu hiện VEC và không có thay đổi nào về biểu hiện tương đối của các dấu hiệu bề mặt CD117, CD43 hoặc CD45 có thể được phát hiện khi so sánh với các tế bào YFP-CTRL (Hình XNUMX). 7F, G và Hình bổ sung. 10). Tuy nhiên, sự điều chỉnh lại của CD44 đã được quan sát trước đó sau 72 giờ (Hình XNUMX). 7B) thậm chí còn rõ rệt hơn sau 6 ngày đồng nuôi cấy với sự hiện diện của cytokine (Hình XNUMX). 7F–H và Hình bổ sung. 10), xác nhận thêm quy định tích cực về CD44 của Meis1. Mặc dù Meis1 đẩy EC về trạng thái tiền HE, nhưng dường như không đủ để điều khiển các tế bào thông qua EHT, ít nhất là trong các điều kiện nuôi cấy được sử dụng trong hệ thống này. Meis1 tạo ra một chương trình giống như HE trong EC, nhưng nó có thể yêu cầu hỗ trợ sao chép bổ sung để tạo điều kiện thuận lợi cho EHT. Thật vậy, phát hiện này cung cấp một hệ quả tất yếu cho kết quả trong Hình XNUMX. 5, điều này cho thấy rằng Meis1 không cần thiết cho việc bắt đầu EHT sau khi đạt được trạng thái tiền HE. Tổng hợp lại, những phát hiện của chúng tôi ngụ ý rằng chức năng chính của Meis1 trong quá trình phát triển máu sớm dường như thúc đẩy aEC chuyển sang trạng thái tiền HE và việc thúc đẩy hơn nữa EHT trong các tế bào HE đã cam kết là không cần thiết cũng như không đủ.
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Ô tô / Xe điện, Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- BlockOffsets. Hiện đại hóa quyền sở hữu bù đắp môi trường. Truy cập Tại đây.
- nguồn: https://www.nature.com/articles/s41467-023-40283-0