Blog này cung cấp thông tin chuyên sâu về phiên bản mới nhất của FDA eSTAR, phiên bản 5.0, được phát hành vào ngày 6 tháng 2023 năm XNUMX.
Tại sao FDA phát hành phiên bản eSTAR mới là v5.0 thay vì v4.4?
Bản cập nhật phiên bản chính bao gồm các thay đổi về chính sách, thay đổi về quy định hoặc các thay đổi lớn đối với mẫu và sẽ được biểu thị bằng số tăng số phiên bản chính (ví dụ: 4.3 đến 5.0). Bản cập nhật phiên bản nhỏ sẽ bao gồm các thay đổi khác và sẽ được biểu thị bằng số phiên bản tăng dần (ví dụ: 4.3 đến 4.4). Nếu có thay đổi về chính sách hoặc quy định, phiên bản chính mới của eSTAR sẽ được tạo trước ngày triển khai và phiên bản trước đó của eSTAR sẽ bị xóa. Trong trường hợp này, việc bật nội dung PMA, cập nhật chương trình thí điểm quốc tế của eSTAR với Bộ Y tế Canadavà việc triển khai các yêu cầu về tài liệu an ninh mạng được coi là những thay đổi lớn dẫn đến nhu cầu cập nhật phiên bản chính (tức là 5.0) thay vì cập nhật phiên bản nhỏ (tức là 4.4). Những thay đổi này áp dụng cho IVD eSTAR và eSTAR không phải IVD. Nếu bạn thường không quen thuộc với FDA eSTAR, vui lòng truy cập Trang khóa học 510k.
Hạn chót sử dụng v5.0 là khi nào?
Phiên bản 4.3 của FDA eSTAR, cả phiên bản nIVD và IVD, sẽ bị xóa khỏi trang web của FDA vào ngày 4 Tháng hai, 2024. Bất kỳ bài gửi nào được gửi với phiên bản eSTAR đã hết hạn sẽ bị từ chối. Nếu bạn đã tải thông tin lên phiên bản cũ hơn của mẫu, bạn sẽ cần cuộn xuống cuối eSTAR và xuất dữ liệu sang tệp HTML. Sau đó, bạn nhập tệp HTML vào phiên bản mới hơn của eSTAR. Mọi tệp đính kèm bạn đã tạo cho phiên bản cũ hơn của mẫu sẽ không được xuất và bạn sẽ phải đính kèm tất cả tệp đính kèm vào mẫu mới.
Nội dung PMA được kích hoạt trong FDA eSTAR mới
Các phiên bản trước của FDA eSTAR bao gồm chức năng đệ trình phê duyệt trước khi tiếp thị (PMA), nhưng ở phiên bản 5.0, FDA cuối cùng đã kích hoạt chức năng này. Bài gửi 510k có ba loại: 1) Truyền thống, 2) Viết tắt và 3) Đặc biệt. Đệ trình PMA cũng có nhiều loại khác nhau. Có hai loại gửi PMA cho một thiết bị mới: truyền thống và mô-đun. Thật không may, FDA eSTAR không dành cho PMA sử dụng phương pháp mô-đun. Đối với các thiết bị Loại 3, FDA có các biện pháp kiểm soát nghiêm ngặt hơn đối với những thay đổi so với các thiết bị Loại 1 và 2. Vì vậy, một bổ sung PMA là bắt buộc đối với các loại thay đổi sau đối với thiết bị được PMA phê duyệt:
- chỉ định sử dụng mới;
- thay đổi ghi nhãn;
- thay đổi cơ sở sản xuất hoặc đóng gói;
- thay đổi phương pháp sản xuất;
- những thay đổi trong quy trình kiểm soát chất lượng;
- thay đổi quy trình khử trùng;
- thay đổi về bao bì;
- những thay đổi về hiệu suất hoặc thông số kỹ thuật thiết kế, và
- gia hạn ngày hết hạn.
Có một số loại chất bổ sung PMA, nhưng chỉ có ba loại chất bổ sung có thể sử dụng FDA eSTAR: 1) Panel-Track, 2) 180-Day và 3) Real Time. Để xác định loại chất bổ sung PMA nào bạn nên sử dụng, FDA đã công bố hướng dẫn dành cho sửa đổi các thiết bị phải tuân theo quy trình phê duyệt trước khi đưa ra thị trường.
Nội dung PMA
Các phần sau trong FDA eSTAR dành riêng cho các yêu cầu về nội dung gửi PMA:
- Thông tin hệ thống quản lý chất lượng
- Thông tin cơ sở
- Kế hoạch nghiên cứu sau thị trường (PMS)
- Đính kèm tuyên bố loại trừ hoặc Báo cáo đánh giá môi trường theo quy định 21 CFR 814.20 (b) (11)
Bộ Y tế Canada đang tiến hành thí điểm với FDA eSTAR
Chương trình thí điểm eSTAR của Bộ Y tế Canada hiện đã đầy đủ với tổng số 10 người tham gia (ban đầu chỉ có 9 người được lên kế hoạch). Chương trình thí điểm sẽ thử nghiệm việc sử dụng eSTAR cho các đơn đăng ký nộp lên Bộ Y tế Canada. Kết quả của chương trình thí điểm sẽ sớm hoàn thành và sau đó chúng tôi dự kiến sẽ mở rộng chương trình thí điểm cho nhiều người đăng ký hơn. Chúng tôi nghe tin đồn rằng HC eSTAR quá phức tạp. Hy vọng rằng v5.0 được đơn giản hóa.
Có bất kỳ thay đổi nào đối với phần kiểm tra EMC không?
Các câu hỏi về Ghi nhãn EMC được hợp nhất thành một câu hỏi thay vì bốn câu hỏi vì phần này thường chỉ cung cấp một trích dẫn. Một bản sao của phiên bản cũ hơn được cung cấp dưới đây.
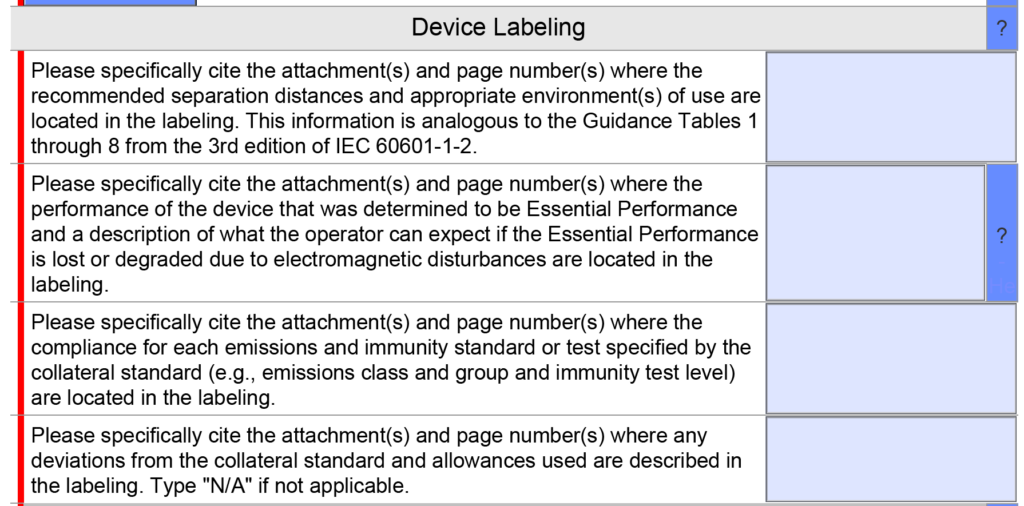
Phiên bản cập nhật 5.0 được hiển thị bên dưới và chỉ có một câu hỏi nhưng nội dung trợ giúp đã được thay đổi.

FDA eSTAR hiện có yêu cầu thêm tài liệu về an ninh mạng không?
Bhoomika Joyappa đã cập nhật của chúng tôi hướng dẫn công tác an ninh mạng (WI-007) để giải quyết hướng dẫn cập nhật của FDA về tài liệu an ninh mạng. Các bản sửa đổi đã được hoàn thành vào đầu tháng này và bạn có thể mua các mẫu cập nhật trên trang web của chúng tôi. Chúng tôi cũng đã thông báo với những người đăng ký của mình rằng hãy mong đợi một bản sửa đổi quan trọng đối với FDA eSTAR  mẫu khi điều này xảy ra. Việc phát hành phiên bản eSTAR cập nhật mất hơn hai tháng và sự thay đổi này dẫn đến một phần ba trang dành riêng cho tài liệu về an ninh mạng. Các phiên bản trước của mẫu bao gồm yêu cầu về tài liệu về quản lý rủi ro an ninh mạng và kế hoạch/kế hoạch quản lý an ninh mạng để tiếp tục hỗ trợ. Các tài liệu sau phải được đính kèm trong phần này nếu an ninh mạng áp dụng cho thiết bị của bạn:
mẫu khi điều này xảy ra. Việc phát hành phiên bản eSTAR cập nhật mất hơn hai tháng và sự thay đổi này dẫn đến một phần ba trang dành riêng cho tài liệu về an ninh mạng. Các phiên bản trước của mẫu bao gồm yêu cầu về tài liệu về quản lý rủi ro an ninh mạng và kế hoạch/kế hoạch quản lý an ninh mạng để tiếp tục hỗ trợ. Các tài liệu sau phải được đính kèm trong phần này nếu an ninh mạng áp dụng cho thiết bị của bạn:
- quản lý rủi ro – báo cáo (đính kèm)
- quản lý rủi ro – mô hình mối đe dọa (đính kèm)
- danh sách các phương pháp đe dọa (hộp văn bản)
- xác minh rằng tài liệu về mô hình mối đe dọa bao gồm (thả xuống có/không):
- Chế độ xem hệ thống toàn cầu
- Quan điểm tác hại của nhiều bệnh nhân
- Chế độ xem khả năng cập nhật/khả năng vá lỗi
- Chế độ xem trường hợp sử dụng bảo mật
- đánh giá rủi ro an ninh mạng (đính kèm)
- số trang nơi ghi lại phương pháp luận và tiêu chí chấp nhận (hộp văn bản)
- xác minh rằng đánh giá rủi ro tránh sử dụng xác suất để đánh giá khả năng và thay vào đó sử dụng khả năng khai thác (thả xuống có/không)
- hóa đơn phần mềm hoặc SBOM (đính kèm)
- mức hỗ trợ phần mềm và ngày kết thúc hỗ trợ cho từng thành phần phần mềm (đính kèm)
- hệ điều hành và phiên bản được sử dụng (hộp văn bản)
- đánh giá an toàn và bảo mật các lỗ hổng (đính kèm)
- đánh giá các bất thường chưa được giải quyết (đính kèm)
- dữ liệu từ việc giám sát số liệu an ninh mạng (đính kèm)
- thông tin về kiểm soát bảo mật (đính kèm)
- số trang nơi mỗi điều khiển bảo mật được giải quyết (hộp văn bản):
- Kiểm soát xác thực
- Kiểm soát ủy quyền
- Kiểm soát mật mã
- Kiểm soát tính toàn vẹn của mã, dữ liệu và thực thi
- Kiểm soát bảo mật
- Kiểm soát ghi nhật ký và phát hiện sự kiện
- Kiểm soát khả năng phục hồi và phục hồi
- Kiểm soát cập nhật chương trình cơ sở và phần mềm
- quan điểm kiến trúc (đính kèm)
- kiểm tra an ninh mạng (đính kèm)
- số trang nơi cung cấp nhãn an ninh mạng (hộp văn bản)
Những thay đổi trong phần vô trùng bao gồm câu hỏi cập nhật về dư lượng EO
Trong phần vô trùng của FDA eSTAR có câu hỏi về dư lượng chất khử trùng. Cụ thể, câu hỏi là “Mức dư lượng chất khử trùng tối đa còn lại trên thiết bị là bao nhiêu?” Không gian dành cho việc nhập thông tin cũng nhỏ.
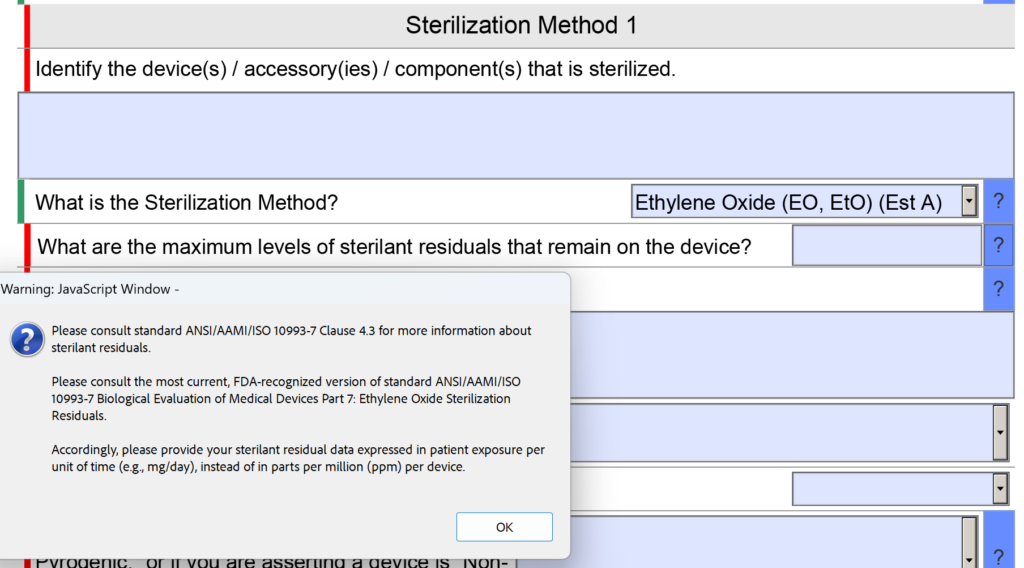
Bây giờ câu hỏi được đặt lại thành: “Mức dư lượng chất khử trùng tối đa còn lại trên thiết bị là bao nhiêu và bạn giải thích lý do tại sao những mức đó được chấp nhận đối với loại thiết bị và thời gian tiếp xúc dự kiến với bệnh nhân?” Không có thay đổi nào được thực hiện đối với văn bản trợ giúp cho câu hỏi này.
Ngoài những thay đổi trong phần vô trùng liên quan đến dư lượng EO, FDA cũng sửa đổi menu thả xuống và văn bản trợ giúp để kiểm tra khả năng gây sốt. Có các tùy chọn riêng cho “LAL” và “Thử nghiệm thỏ”, nhưng giờ đây chúng được kết hợp thành “Thử nghiệm LAL và Rabbit Pyrogen”. Ngoài ra, văn bản trợ giúp sau đã được thêm vào: “Nếu trước đây bạn đã tiến hành thử nghiệm thỏ trên các tài liệu này, vui lòng: 1) tham chiếu thử nghiệm này theo số gửi trong tài liệu về Khả năng gây sốt đính kèm của bạn và trích dẫn cụ thể (các) tài liệu đính kèm và số trang (s) nơi tìm thấy kết quả kiểm tra trong lần gửi đó hoặc 2) đính kèm báo cáo kiểm tra trước đó của bạn.”
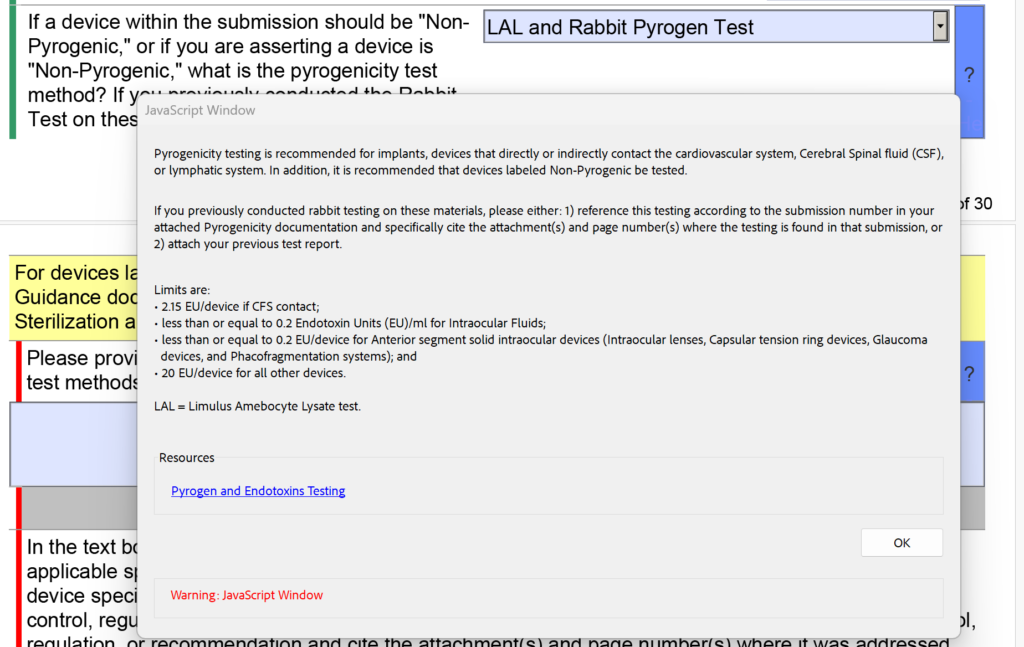
Hạn chót sử dụng v5.0 là khi nào?
Nhiều khách hàng cho biết họ nhận được thông báo lỗi khi cố mở mẫu FDA eSTAR. Điều này là do họ đang mở eSTAR từ trình xem PDF thay vì Adobe Acrobat Pro.

Một số người muốn tiết kiệm tiền bằng cách sử dụng phần mềm Adobe Acrobat Reader miễn phí, nhưng điều này sẽ không cho phép bạn hoàn thành eSTAR đúng cách. Do đó, FDA đã thêm thông báo Popup nếu sử dụng Adobe Acrobat Reader.
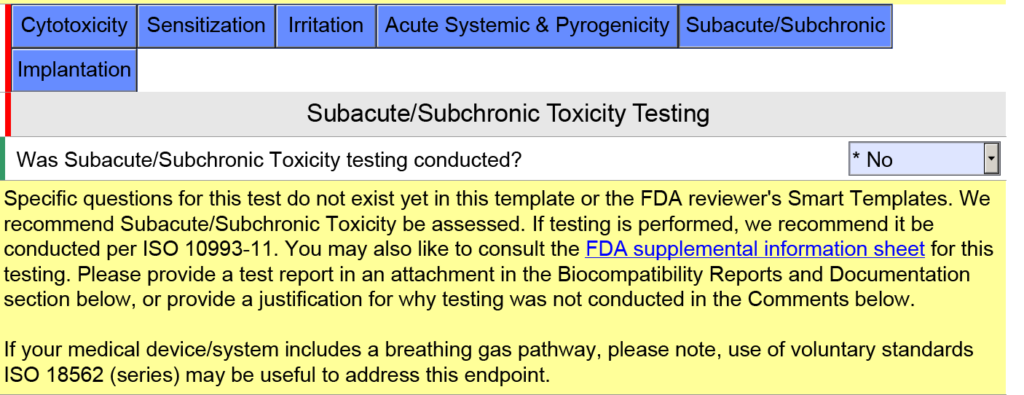
Các thiết bị có đường dẫn khí thở được đánh giá về khả năng tương thích sinh học như thế nào?
Trong ảnh chụp màn hình bên dưới, tôi đã cố ý chọn “Thiết bị bề mặt: Màng niêm mạc” làm loại tiếp xúc mô cho thiết bị đường dẫn khí thở vì thiết bị sẽ có ống ngậm được đặt trong miệng của bạn (tức là màng niêm mạc). Đây là một sai lầm phổ biến. Trong phiên bản 5.0 của FDA eSTAR, FDA nêu rõ rằng các thiết bị này phải được đánh giá là “giao tiếp bên ngoài” và phần tiếp xúc với mô là “mô/xương/ngà răng”. Cụ thể, nơi tiếp xúc với mô là phổi. Vì lý do này, FDA đã thêm văn bản trợ giúp hiển thị bên dưới trong Cửa sổ JavaScript về khả năng áp dụng ISO 18562-1, -2, -3 và -4.
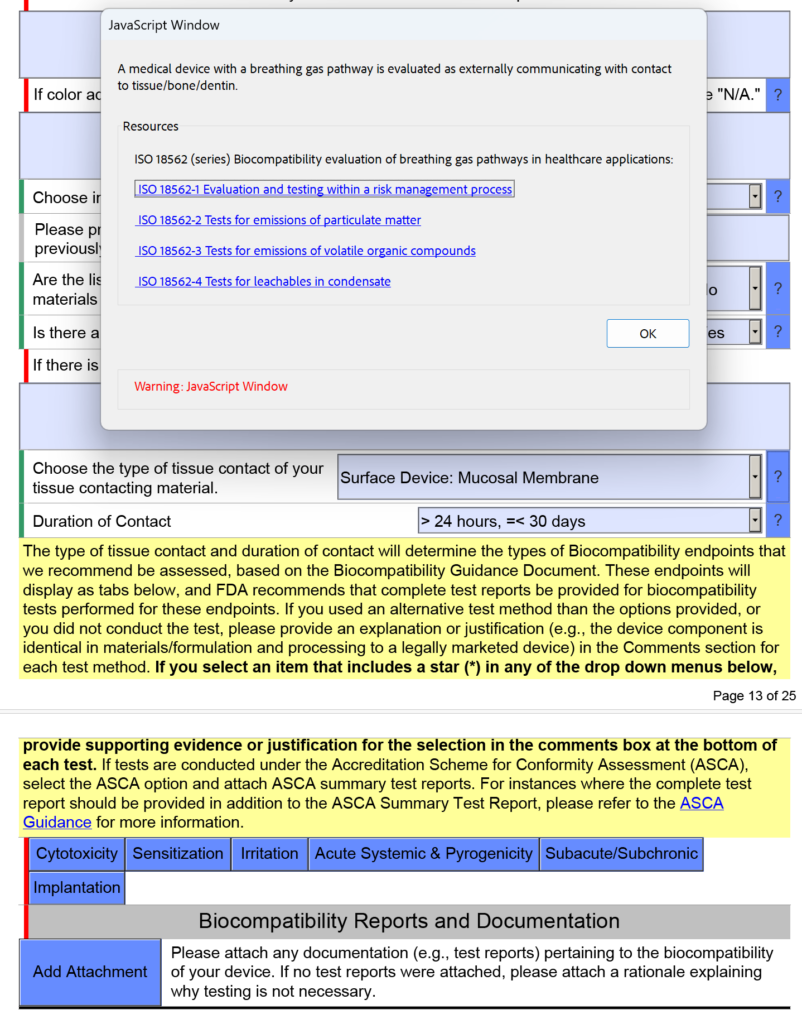
Các câu hỏi và hướng dẫn bổ sung sẽ xuất hiện khi bạn nhấp vào từng ô màu xanh lam được hiển thị ở trên. Đối với hộp màu xanh có nhãn “Bán cấp tính/Cận mãn tính”, bạn sẽ tìm thấy văn bản trợ giúp bổ sung về tiêu chuẩn ISO 18562. Bạn có thể tìm thấy văn bản trợ giúp tương tự khi bạn nhấp vào hộp màu xanh lam có nhãn “Hệ thống cấp tính & gây sốt”.

Lời nhắc thay đổi mặt cắt ngang là gì?
Một trong những thay đổi nhỏ được thực hiện trong phiên bản FDA eSTAR này là việc bổ sung “lời nhắc thay đổi mặt cắt ngang” vào văn bản trợ giúp trong phần mô tả thiết bị. Điều này không nhằm giúp bạn tránh trả lời các câu hỏi trong bài gửi của mình, vì nếu bạn thiếu một phần trong bài gửi vì bạn trả lời “Không” thay vì “Có”, người đánh giá của FDA sẽ xác định lỗi này trong quá trình Đánh giá Kỹ thuật. Điều này sẽ dẫn đến việc nội dung gửi của bạn bị tạm dừng và đồng hồ thời gian xem xét sẽ được đặt lại về XNUMX ngày khi bạn gửi lại với các chỉnh sửa đã được thực hiện. Ảnh chụp màn hình bên dưới hiển thị ví dụ về một trong những lời nhắc thay đổi mặt cắt ngang này.
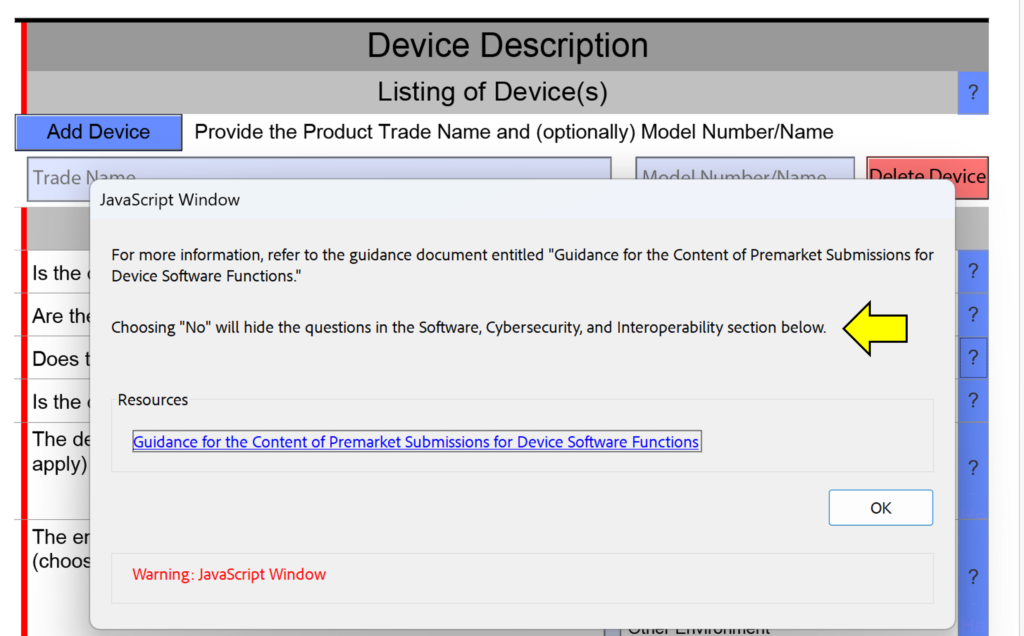
Những thay đổi nào đã được thực hiện đối với phần thử nghiệm lâm sàng của FDA eSTAR?
Phần thử nghiệm lâm sàng lúc này sẽ hiển thị khi sử dụng Trình chỉnh sửa PDF-XChange, nhưng chúng tôi khuyên bạn chỉ nên sử dụng Adobe Acrobat Pro để chỉnh sửa FDA eSTAR. Thay đổi này là một bản sửa lỗi và dành riêng cho nIVD eSTAR. IVD eSTAR và nIVD eSTAR đều bao gồm phần thử nghiệm lâm sàng trong phần thử nghiệm hiệu suất, nhưng phần thử nghiệm hiệu suất lại có trong FDA eSTAR trước phần kiểm tra an toàn điện và EMC, trong khi phần kiểm tra hiệu suất được tìm thấy sau khi phần kiểm tra an toàn điện và EMC. Nếu công ty của bạn dự định gửi dữ liệu lâm sàng trong hồ sơ gửi FDA trong tương lai, chúng tôi có các khuyến nghị sau:
- xem CDRH Tìm hiểu hội thảo trực tuyến về chủ đề 21 CFR 812
- tiến hành một cuộc họp từ xa trước khi gửi để đặt câu hỏi về quy trình nghiên cứu lâm sàng của bạn trước khi gửi IRB hoặc gửi hội đồng đánh giá đạo đức
- trước khi bạn gửi yêu cầu cuộc họp trước khi đăng ký, hãy xem thông tin lâm sàng chung nào mà FDA muốn đối với việc gửi De Novo hoặc PMA trong FDA eSTAR

Lưu ý: Phần lâm sàng hiển thị ở trên chỉ có trong FDA eSTAR nếu bạn chọn gửi De Novo hoặc PMA. Nếu bạn nộp hồ sơ 510k kèm theo dữ liệu lâm sàng thì phần lâm sàng sẽ được viết tắt như hình bên dưới.

- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- PlatoSức khỏe. Tình báo thử nghiệm lâm sàng và công nghệ sinh học. Truy cập Tại đây.
- nguồn: https://medicaldeviceacademy.com/fda-estar/



