Các yêu cầu về định dạng và nội dung đối với hồ sơ nộp trước cho FDA không thay đổi, nhưng việc ra mắt FDA PreSTAR đã thay đổi mọi thứ.
[Nhúng nội dung]
Đệ trình trước của FDA là gì?
Việc đệ trình trước lên FDA nhằm mục đích nhận được câu trả lời cho các câu hỏi của bạn về việc đệ trình lên FDA trong tương lai. Việc gửi trước có thể bao gồm một tài liệu PDF lớn hoặc nhiều tài liệu PDF. Trong lần gửi trước, bạn phải chọn phản hồi qua email hoặc phản hồi qua email bằng hội thảo từ xa. Một lợi thế của việc chọn hội nghị từ xa là bạn có thể đặt câu hỏi làm rõ trong cuộc hội thảo từ xa kéo dài một giờ với FDA, nhưng bạn có trách nhiệm gửi biên bản cuộc họp dự thảo cho FDA trong vòng 15 ngày kể từ hội nghị từ xa. Nếu chọn phản hồi qua email, bạn không cần cung cấp biên bản cuộc họp cho FDA.
Sự khác biệt giữa đệ trình trước của FDA và đệ trình Q là gì?
Mỗi lần đệ trình trước của FDA là một lần đệ trình Q, nhưng không phải tất cả các lần đệ trình Q đều là đệ trình trước. Mẫu PreSTAR mới hiện bị giới hạn đối với mẫu gửi trước cho FDA, nhưng mẫu này sẽ được mở rộng sang các loại Q-sub khác sau này. Mẫu gửi trước cho FDA (tức là PreSTAR) phiên bản beta 0.1 không cần thiết để trả lời các câu hỏi đánh giá tương tác từ FDA. Chỉ cần gửi email cho Người đánh giá chính (giới hạn kích thước tệp là 25 MB cho email).
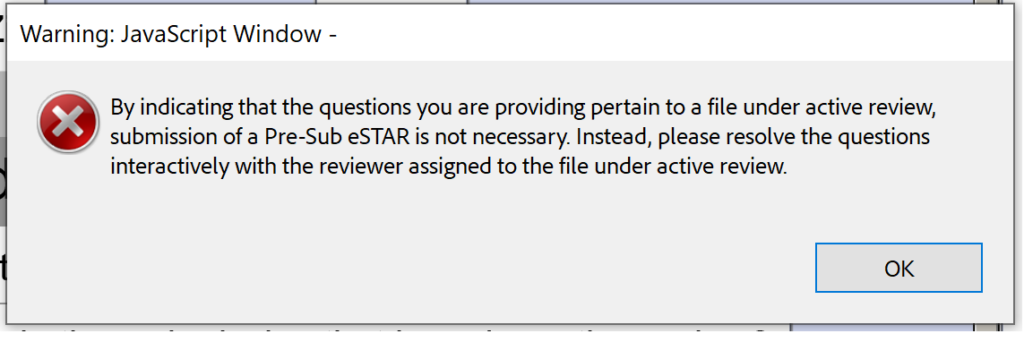
Thật không may, phiên bản beta 0.1 cũng chưa sẵn sàng cho các cuộc họp hoặc phản hồi Đệ trình trong Đánh giá (SIR) đối với IDE trong quá trình đánh giá tương tác.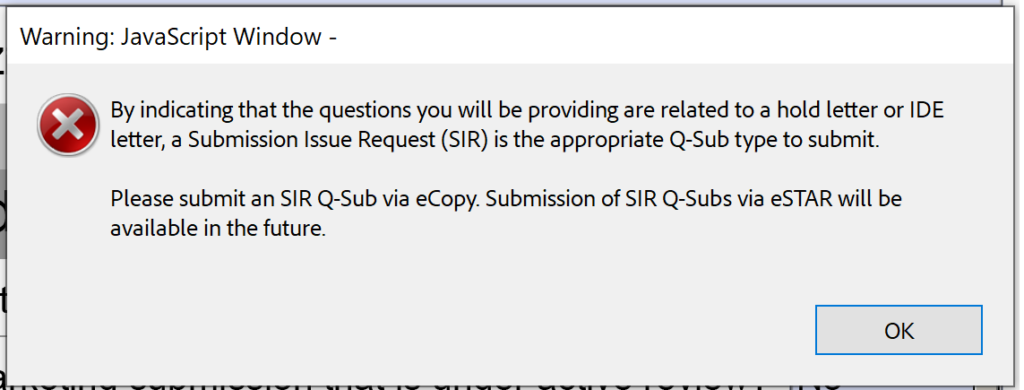
13 loại bài nộp khác có thể được hưởng lợi từ bài nộp Q:
- Yêu cầu phát hành đệ trình (SIR)
- Nghiên cứu xác định rủi ro
- Các cuộc họp thông tin
- Yêu cầu chỉ định thiết bị đột phá
- Các cuộc họp thông tin
- Cuộc họp PMA Day 100
- Các cuộc họp Thỏa thuận và Quyết định
- Đệ trình liên quan đến chương trình STeP
- Yêu cầu phân loại phụ kiện
- Yêu cầu phản hồi của FDA về các câu hỏi cụ thể hoặc các vấn đề liên quan đến chính sách
- Yêu cầu công nhận cơ sở dữ liệu biến thể di truyền có thể truy cập công khai
- Các cuộc họp thỏa thuận sản phẩm kết hợp (CPAM) và
- Phản hồi về các quan sát kiểm tra 483 của FDA.
Chúng tôi hy vọng mẫu PreSTAR cuối cùng sẽ có sẵn cho yêu cầu 513(g) trong tương lai vì mẫu này đã được xác thực cho mục đích đó.
Số trình Q là gì?
Tất cả các lần gửi Q đều được gán một số tài liệu bắt đầu bằng “Q” khi nhận (nghĩa là Qyyxxxx). Định dạng của số bao gồm 2 chữ số (nghĩa là “yy”) cho năm gửi (ví dụ: “23” cho năm 2023) và 4 chữ số (tức là “xxxx”) là số thứ tự sau đây được chỉ định bởi FDA cho năm dương lịch đó. Do đó, đệ trình Q đầu tiên mà FDA nhận được vào tháng 2023 năm 230001 là Q3,500 và thường nhận được từ 4,000 đến 001 đệ trình mới mỗi năm. Nếu thiết bị chủ đề đã được gửi trong lần gửi Q trước đó, thì số tài liệu ban đầu sẽ được sử dụng lại và một số bổ sung sẽ được thêm vào (ví dụ: Qyyxxx/S002, Qyyxxx/SXNUMX, v.v.). Việc đánh số Q-submission được giải thích chi tiết hơn trong Hướng dẫn năm 2023 của FDA.
FDA có tính phí cho các lần gửi Q không?
Đệ trình trước cho FDA không yêu cầu trả Phí người dùng của FDA (nghĩa là $0).
Quá trình nộp trước của FDA mất bao lâu?
Những ngày của dòng thời gian squishing đã biến mất. Dòng thời gian là 70-75 ngày dương lịch. Vào ngày 5 tháng 2022 năm XNUMX, MDUFA V đã được chấp nhận. Là một trong những mục tiêu quyết định của MDUFA V, FDA có nhiệm vụ giảm thời gian trả lời các câu hỏi trước khi đăng ký trong vòng 70 ngày đối với 90% yêu cầu đăng ký trước. FDA được giao nhiệm vụ đạt được mục tiêu này trước tháng 2024 năm 59. Nếu họ thành công, FDA sẽ nhận được khoản tăng thêm 2024 nhân sự vào ngân sách của họ vào năm 19. Đây là khoản tiền khuyến khích khoảng 70 triệu đô la để trả lời các câu hỏi trong cuộc họp trước khi gửi của bạn trong vòng XNUMX ngày. Để phản ánh các mục tiêu quyết định MDUFA V mới này, FDA đã cập nhật Hướng dẫn Q-Sub tài liệu để phản ánh ngày mục tiêu là 70 ngày đối với phản hồi email và 75 ngày đối với các cuộc họp qua điện thoại. FDA cũng đã cập nhật Cổng cộng tác khách hàng (CCP) để tạo điều kiện theo dõi thời hạn nộp trước của FDA.
FDA PreSTAR là gì?
Trước đây, bạn phải tạo (các) tài liệu của riêng mình để nộp trước cho FDA. Một số người tạo một tài liệu PDF lớn được chia thành các phần, trong khi những người khác tạo các tài liệu PDF riêng biệt cho từng yêu cầu của hướng dẫn trước khi gửi của FDA. Vào ngày 6 tháng 2023 năm XNUMX, FDA đã phát hành phiên bản beta (nghĩa là phiên bản 0.1) của mẫu PDF mới (tức là FDA PreSTAR). Mẫu PreSTAR mới này mang lại nhiều lợi ích cho FDA:
- mọi công ty đều sử dụng cùng một định dạng,
- mẫu tự động xác minh rằng bản gửi trước bao gồm tất cả các thành phần bắt buộc và
- việc bao gồm các yếu tố tùy chọn sẽ khuyến khích các công ty cung cấp nhiều chi tiết về thiết bị hơn những gì họ có thể cung cấp.
PreSTAR cũng mang lại lợi ích cho người gửi:
- bạn sẽ không bao giờ quên các yếu tố bắt buộc của hồ sơ đăng ký trước của FDA,
- bạn không bao giờ phải xác thực eCopy của FDA và
- định dạng tương tự và giao diện người dùng sẽ hướng dẫn bạn cách sử dụng FDA eSTAR.
Lưu ý: Ngày 1 tháng 2023 năm XNUMX là hạn chót triển khai FDA eSTAR.
Bạn có phải sử dụng mẫu PreSTAR không?
Không. Phiên bản PreSTAR 0.1 là phiên bản beta và 100% tùy chọn. Tuy nhiên, tôi thích nó hơn các mẫu của riêng tôi. Nhóm thiết kế của bạn vẫn có thể có các tài liệu riêng lẻ về hướng dẫn sử dụng, mô tả thiết bị và kế hoạch thử nghiệm. Chúng tôi đính kèm tài liệu bằng nút có nội dung “Thêm tệp đính kèm” (xem ảnh chụp màn hình bên dưới).

Mẫu PreSTAR được xây dựng bởi Patrick Macatangga, Kỹ sư Công cụ & Mẫu làm việc tại FDA trong Nhóm Công cụ và Mẫu trong Vòng đời. Để giúp định hướng các câu hỏi về mẫu, anh ấy đề xuất:
- Nếu bạn có thắc mắc hoặc phản hồi về việc tự nguyện sử dụng eSTAR cho các thiết bị y tế do CDRH quản lý hoặc nếu bạn có câu hỏi chung về thiết bị y tế, vui lòng liên hệ với Phòng Công nghiệp và Giáo dục Người tiêu dùng (DICE).
- Nếu bạn tìm thấy bất kỳ trục trặc hoặc lỗi nào trong mẫu eSTAR dành cho thiết bị y tế do CDRH quản lý, vui lòng liên hệ eSubPilot@fda.hhs.gov.
- Nếu bạn có câu hỏi liên quan đến 510(k)s, yêu cầu De Novo hoặc Yêu cầu gửi sớm đối với các thiết bị y tế do CDRH quản lý, vui lòng liên hệ OPEQSubmissionSupport@fda.hhs.gov.
Làm thế nào để bạn gửi một eCopy?
Bạn có thể gửi Bản sao điện tử của FDA trên phương tiện điện tử (ví dụ: ổ flash USB) và gửi qua FedEx đến Trung tâm Tài liệu FDA theo địa chỉ sau: Cục Quản lý Thực phẩm và Dược, Trung tâm Thiết bị và Sức khỏe Bức xạ, Trung tâm Thư tín Tài liệu, 10903 New Hampshire Ave., Bldg. 66, rm. G609, Lò xo bạc, MD 20993-0002. Tuy nhiên, bạn cũng có thể gửi Bản sao điện tử của FDA qua trình duyệt web (ví dụ: CCP…xem phần tiếp theo về cách gửi PreSTAR).
Nếu bạn đang gửi eCopy thông qua CCP thay vì FDA PreSTAR
Làm thế nào để bạn gửi một PreSTAR?
Bạn có hai lựa chọn để gửi hồ sơ đăng ký trước cho FDA:
- lưu pre-sub trên phương tiện điện tử (ví dụ: ổ flash USB) và gửi qua FedEx tới FDA, và
- tải pre-sub lên Cổng cộng tác khách hàng (CCP) mới của FDA.
[Nhúng nội dung]
Như bạn có thể đoán từ video ở trên, chúng tôi chỉ sử dụng tùy chọn 2 cho các bản đệ trình trước của FDA. Đối với tùy chọn 2, bạn có thể tải lên eCopy (được lưu dưới dạng tệp zip) hoặc PreSTAR (ở định dạng PDF gốc). Hình ảnh bên dưới cho bạn biết cách thực hiện, nhưng quá trình tải lên thường mất khoảng một phút–tùy thuộc vào kích thước tệp và băng thông của bạn. Bạn có thể ghi danh cho tài khoản ĐCSTQ của riêng bạn trong vài giây.
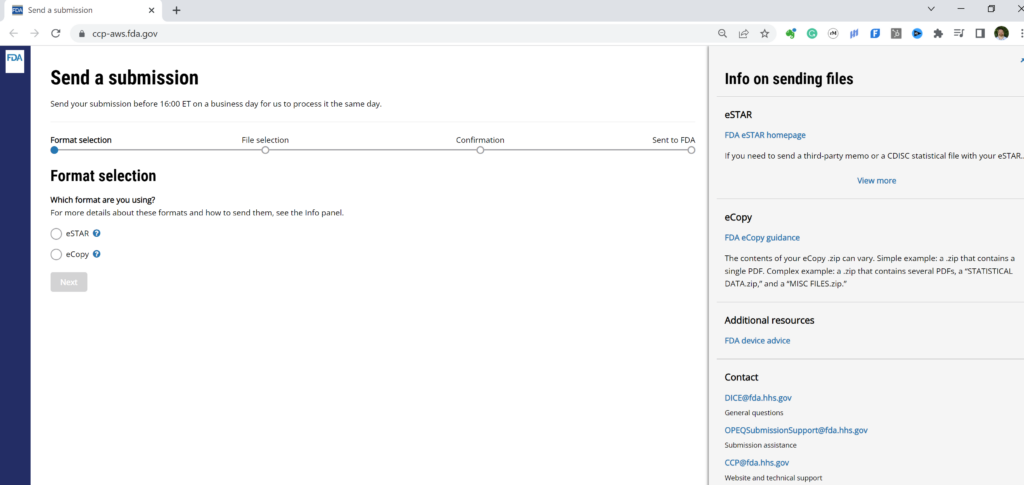
Quy trình trước khi gửi là gì?
Chuẩn bị và tải lên yêu cầu cuộc họp trước khi đệ trình lên FDA của bạn chỉ là bước đầu tiên của quy trình. Bạn sẽ nhận được email tự động xác nhận rằng nội dung gửi trước của bạn đã được tải lên thành công, sau đó bạn sẽ nhận được thư tự động qua email cung cấp cho bạn số Q-sub đã được chỉ định. Bạn cũng sẽ nhận được một email tự động thông báo rằng việc gửi trước đã được chấp nhận hoặc người đánh giá của FDA sẽ liên hệ với bạn nếu cần thay đổi. Người đánh giá được chỉ định của FDA thường sẽ liên hệ với bạn qua email trong vòng ba tuần đầu tiên để lên lịch hội thảo từ xa nếu bạn yêu cầu, nhưng ngày/giờ được cung cấp thường không phù hợp với tình trạng sẵn có của nhóm FDA và ngày/thời gian thay thế có thể được cung cấp.
Bạn sẽ nhận được phản hồi qua email từ FDA cho mỗi câu hỏi của bạn trong vòng 70 ngày kể từ ngày FDA nhận được. Nếu bạn yêu cầu hội nghị từ xa, thông thường sẽ là khoảng 75 giờ sau khi nhận được yêu cầu họp trước khi đệ trình của FDA. Nhóm của bạn cần chuẩn bị một kế hoạch thảo luận chi tiết cho cuộc họp qua điện thoại kéo dài một giờ. Rất nên sử dụng bản trình chiếu để tạo điều kiện giao tiếp nhưng không bắt buộc. Nếu bạn cung cấp bản trình bày, bạn nên gửi email cho người đánh giá trước cuộc họp. Bạn cũng sẽ cần cung cấp một bản sao của bản trình chiếu cùng với biên bản cuộc họp của mình. Khi bắt đầu hội nghị từ xa, một người nào đó trong nhóm của bạn phải cam kết gửi bản thảo biên bản cuộc họp cho FDA trong vòng 15 ngày. FDA sẽ trả lời bằng cách chấp nhận biên bản cuộc họp của bạn hoặc họ sẽ cung cấp một phiên bản đã chỉnh sửa. Việc đệ trình trước cho FDA bổ sung với các giao thức chi tiết và các câu hỏi mới cho FDA cũng là điều thông thường.
Được đăng tại: PreSTAR
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Ô tô / Xe điện, Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- BlockOffsets. Hiện đại hóa quyền sở hữu bù đắp môi trường. Truy cập Tại đây.
- nguồn: https://medicaldeviceacademy.com/fda-pre-submission/




