Từ ngày 1 tháng 2024 năm XNUMX, một số thiết bị mỹ phẩm không được sản xuất, nhập khẩu, bán khi chưa có giấy chứng nhận đăng ký thiết bị y tế, trong đó bao gồm thiết bị tần số vô tuyến (RF). Để biết danh sách các thiết bị, vui lòng nhấp vào nhấp vào ĐÂY
NMPA đã phát hành phiên bản cuối cùng của “Hướng dẫn đăng ký thiết bị thẩm mỹ tần số vô tuyến” vào ngày 12 tháng 2023 năm XNUMX.
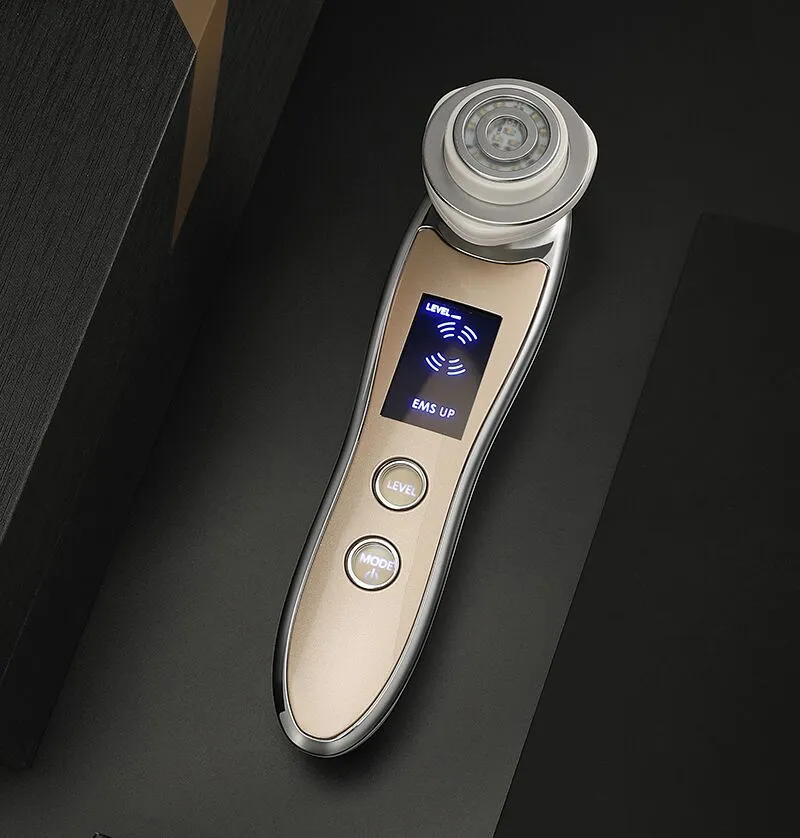
Thiết bị thẩm mỹ tần số vô tuyến (RF), thiết bị loại III, dùng để chỉ các sản phẩm sử dụng năng lượng điện như dòng điện tần số vô tuyến (thường là 200kHz trở lên) hoặc điện trường (thường là 13.56 hoặc 40.68 MHz) để tác động lên các mô của con người để tạo ra hiệu ứng nhiệt để điều trị da chảy xệ, giảm nếp nhăn trên da, thu nhỏ lỗ chân lông, làm săn chắc/nâng mô da hoặc điều trị mụn trứng cá, sẹo hoặc giảm mỡ (làm mềm hoặc phân hủy mỡ). Chúng bao gồm các thiết bị đứng, máy tính để bàn và thiết bị cầm tay.
Những công ty lớn trong thị trường thẩm mỹ RF bao gồm Alma Lasers, Cymedics Cynosure, Beco Medical, EndyMed, Inmode, Lumenis, Lutronic, Ibramed INDIBA, SharpLight Technologies, Venus Concept, Candela và Solta Medical, một số trong đó đã vào Trung Quốc.
Xem xét các khu vực tập trung
Hướng dẫn thiết bị RF dài 29 trang trình bày chi tiết các khu vực trọng tâm đánh giá. Các yếu tố chính được mô tả như sau:
- Bộ phận đăng ký
Nó phải đáp ứng các yêu cầu của “Hướng dẫn cho Bộ phận đăng ký thiết bị y tế”, và dựa trên nguyên tắc kỹ thuật, thành phần cấu trúc, chỉ số hoạt động và phạm vi ứng dụng của sản phẩm.
Thiết bị thẩm mỹ RF dạng đứng / để bàn và thiết bị thẩm mỹ RF cầm tay nên được chia thành các đơn vị đăng ký riêng biệt:
Đối với thiết bị thẩm mỹ RF dạng đứng/để bàn, thiết bị chính và phụ kiện thường được khai báo là cùng một thiết bị đăng ký. Đối với phụ kiện tần số vô tuyến sử dụng một lần cũng có thể khai báo riêng nhưng phải ghi rõ thông tin của máy chủ sử dụng. Điện cực trung tính có thể được khai báo như một thành phần của sản phẩm hoặc được sử dụng cùng với điện cực trung tính chung.
Bột nhão dẫn điện, chất làm mát độc lập, bể làm mát và các sản phẩm khác được sử dụng cùng với thiết bị thẩm mỹ tần số vô tuyến không phải là đơn vị đăng ký giống như thiết bị thẩm mỹ tần số vô tuyến. Các phụ kiện chức năng phi y tế như miếng dán da và bút đánh dấu được sử dụng trong quá trình điều trị thường không được coi là thành phần của sản phẩm.
- Yêu cầu về chỉ số hiệu suất
Tần số hoạt động, tải danh định, công suất danh định của mỗi chế độ, năng lượng đầu ra và mật độ năng lượng với tất cả các điện cực trị liệu có sẵn phải được xác định rõ ràng. Xóa tất cả các thông số có thể điều chỉnh và chế độ có chế độ đầu ra xung phải chỉ định tần số xung và khoảng thời gian xung.
Các yêu cầu về diện tích và kích thước của các điện cực trị liệu phải được quy định. Điện cực ma trận điểm và điện cực microneedle phải có kích thước điện cực và khoảng cách phân bố rõ ràng. Điện cực microneedle phải chỉ định chiều dài của microneedle và nếu nó có thể điều chỉnh được thì phạm vi điều chỉnh và phương pháp điều chỉnh cũng phải được chỉ định.
Nếu nó chứa một điện cực trung tính, nó phải đáp ứng các yêu cầu về giới hạn vi sinh vật có liên quan.
Nếu có công tắc chân thì công tắc chân phải đáp ứng các yêu cầu của YY 1057.
- Yêu cầu chức năng
Nếu có chức năng đo nhiệt độ, phạm vi đo nhiệt độ và độ chính xác của phép đo phải được chỉ định. Nếu nó có chức năng điều khiển nhiệt độ, thì phạm vi điều khiển nhiệt độ và độ chính xác của điều khiển phải được chỉ định.
Nếu nó có chức năng làm mát, vị trí của bề mặt làm mát phải được mô tả trong sơ đồ sản phẩm, và phạm vi điều chỉnh và độ chính xác kiểm soát của nhiệt độ làm mát phải được chỉ định.
Nếu nó có chức năng áp suất âm, phạm vi và độ chính xác của các thông số áp suất âm cần được làm rõ.
- Yêu cầu về an toàn điện
An toàn chung phải đáp ứng các yêu cầu của tiêu chuẩn GB 9706.1. Đối với thiết bị được thiết kế để sử dụng trong môi trường gia đình hoặc môi trường y tế không chuyên nghiệp khác, thiết bị đó phải đáp ứng các yêu cầu của tiêu chuẩn YY 9706.111.
Đối với các sản phẩm điều trị sử dụng hiệu ứng dòng điện để tác động lên cơ thể người, độ an toàn đặc biệt phải đáp ứng các yêu cầu của tiêu chuẩn GB 9706.202 (GB 9706.4). Thiết bị điều trị sử dụng hiệu ứng điện trường để tác động lên cơ thể người cần xem xét các yêu cầu an toàn đặc biệt tương ứng theo đặc điểm thiết kế của nó. Ví dụ, tần số 40.68MHz thuộc dải tần số sóng cực ngắn và cần đáp ứng các yêu cầu của tiêu chuẩn GB 9706.203.
- Nghiên cứu phần mềm
Phần mềm thiết bị thẩm mỹ RF thường được thể hiện dưới dạng các thành phần phần mềm và các báo cáo nghiên cứu phần mềm liên quan phải được cung cấp theo các yêu cầu liên quan đối với các thành phần phần mềm trong Nguyên tắc đăng ký và đánh giá phần mềm thiết bị y tế (Sửa đổi năm 2022).
Nếu liên quan đến việc xuất dữ liệu thiết bị và các thông số điều trị, các tài liệu nghiên cứu liên quan đến an ninh mạng phải được cung cấp theo các yêu cầu của Hướng dẫn xem xét đăng ký an ninh mạng thiết bị y tế (Sửa đổi năm 2022).
- Nghiên cứu sinh học
Cần đánh giá khả năng tương thích sinh học của các bộ phận tiếp xúc trực tiếp hoặc gián tiếp của con người với thành phẩm. Các thành phần dự kiến tiếp xúc với bệnh nhân trong thiết bị thẩm mỹ RF chủ yếu là điện cực trị liệu và điện cực trung tính.
Điện cực trị liệu và điện cực trung tính được sử dụng trong điều trị không xâm lấn dự kiến sẽ tiếp xúc trong thời gian ngắn với da của bệnh nhân. Theo các yêu cầu của GB / T 16886.1, việc đánh giá tính tương thích sinh học ít nhất phải xem xét các yêu cầu sau: độc tính tế bào, nhạy cảm và kích ứng da. Các phụ kiện cho phương pháp điều trị xâm lấn (bao gồm điện cực mạng tinh thể và microneedle) dự kiến sẽ tiếp xúc với da hoặc mô dưới da bị tổn thương và việc đánh giá tính tương thích sinh học ít nhất phải xem xét các yêu cầu sau: độc tính tế bào, nhạy cảm và phản ứng trong da. Ngoài ra, một số điện cực microneedle cần được sử dụng với vỏ bảo vệ cụ thể. Vỏ bọc dự kiến sẽ tiếp xúc với da của bệnh nhân. Tuy nhiên, vì điện cực microneedle sẽ xuyên qua da trong quá trình sử dụng, vỏ có thể tiếp xúc với da hoặc mô bị tổn thương. Do đó, kiểm tra kích thích Xem xét các phản ứng trong da có tham chiếu đến các điện cực microneedle.
Đối với các thiết bị cầm tay, tay cầm của thiết bị và các điện cực điều trị dự kiến sẽ tiếp xúc trong thời gian ngắn với da của bệnh nhân và việc đánh giá tính tương thích sinh học nên xem xét tính độc tế bào, nhạy cảm và kích ứng da. Khi thực hiện đánh giá tính tương thích sinh học, thiết bị có thể được coi là tổng thể, hoặc có thể được xem xét riêng theo tay cầm và điện cực điều trị tiếp xúc với các bộ phận khác nhau của cơ thể con người.
Để có được ba phần quan trọng của đánh giá tính tương thích sinh học mà NMPA đã đề cập trong hướng dẫn, vui lòng gửi email cho chúng tôi theo địa chỉ info@ChinaMedDevice.com
Phác thảo Hướng dẫn
Hướng dẫn bao gồm bảy phần sau:
1. Thông tin quy định
a) Tên sản phẩm
b) Các hạng mục quản lý
c) Khối đơn vị đăng ký
d) Giấy chứng nhận niêm yết ở nước ngoài (sản phẩm nhập khẩu)
2. Thông tin tóm tắt
a) Tổng quan
b) Mô tả sản phẩm
c) Phạm vi áp dụng và chống chỉ định
3. Thông tin quản lý rủi ro
4. Yêu cầu kỹ thuật của sản phẩm
a) Thông tin cơ bản
b) Yêu cầu về chỉ số hiệu suất
c) Yêu cầu chức năng
d) Yêu cầu về an toàn điện
e) Yêu cầu về khả năng tương thích điện từ
5. Báo cáo thử nghiệm
6. Tài liệu nghiên cứu
a) Nghiên cứu hiệu suất
b) Nghiên cứu cơ chế hoạt động
c) Mối quan hệ giữa liều lượng và các nghiên cứu về an toàn năng lượng
d) Nghiên cứu phần mềm
e) Nghiên cứu sinh học
f) Nghiên cứu làm sạch, khử trùng, khử trùng
g) Nghiên cứu độ ổn định
h) Thử nghiệm động vật
i) Sử dụng Nghiên cứu Môi trường
j) Yêu cầu Đánh giá Lâm sàng
7. Quy cách sản phẩm và mẫu nhãn mác
Cùng với hướng dẫn là ba chỉ mục:
- Các điểm rủi ro chính của Thiết bị thẩm mỹ r RF
- Yêu cầu về hiệu suất phát xạ tương thích điện từ đối với Thiết bị thẩm mỹ RF
- Các tiêu chuẩn áp dụng cho các thiết bị thẩm mỹ RF
Để có bản sao hướng dẫn bằng tiếng Anh có chỉ mục, vui lòng gửi email cho chúng tôi theo địa chỉ info@ChinaMedDevice.com. Chúng tôi tính phí danh nghĩa cho bản dịch.
Các nhà sản xuất phải đối mặt với những yêu cầu khắt khe hơn nhiều trong việc quản lý vòng đời sản phẩm của họ. Xin vui lòng bấm vào nhấp vào ĐÂY để đọc thêm
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- PlatoSức khỏe. Tình báo thử nghiệm lâm sàng và công nghệ sinh học. Truy cập Tại đây.
- nguồn: https://chinameddevice.com/rf-equipment-nmpa/