Tính chất màng sinh học
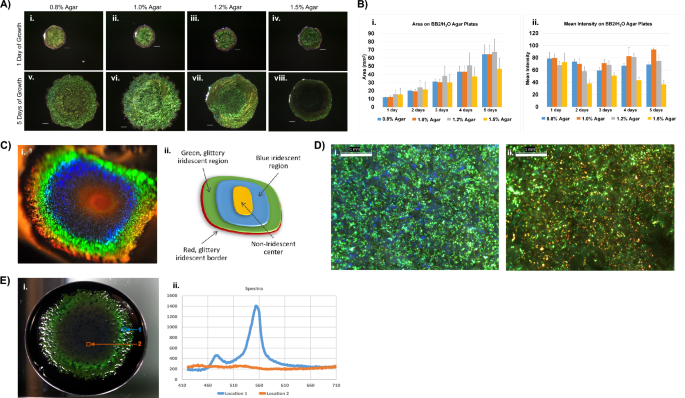
Cellulophaga lytica 7489 màng sinh học phát triển trong 24 giờ trên BB2/H2Môi trường O chứa các nồng độ thạch khác nhau được so sánh (Hình. 1A, B). Các kiểu màu khác nhau sau 5 ngày với 1.0% agar hỗ trợ các khuẩn lạc sáng hơn. Môi trường nuôi cấy chứa nhiều hơn 1.2% agar cho phép phát triển, mặc dù sự lan rộng của các khuẩn lạc bị hạn chế so với môi trường chứa 1% agar hoặc ít hơn. Màng sinh học từ thạch 1.5% nhỏ hơn với cường độ điểm ảnh trung bình thấp hơn. Trừ khi được ghi chú cụ thể, dữ liệu còn lại trong nghiên cứu này dựa trên màng sinh học từ các đĩa thạch 1% có chứa BB2/H2O. Tiếp tục ủ trên thạch 1% dẫn đến màng sinh học có màu chuyển sắc, đồng tâm (Hình. 1C). Mặc dù kích thước và cường độ tương đối của các vùng này khác nhau giữa các mẫu, thứ tự màu sắc trong màng sinh học trưởng thành không thay đổi. Ngoài ra, các trung tâm màng sinh học thường chuyển sang màu vàng cam, có thể là do sắc tố zeaxanthin được biết là có trong C. lytica29. Tiến dần ra ngoài, các dải màu tiếp theo có màu xanh lam, sau đó là màu xanh lá cây lấp lánh và một dải hẹp màu đỏ xung quanh chu vi của màng sinh học. Độ phóng đại tiết lộ rằng màu sắc là khảm trong đó màu chiếm ưu thế trong các miền milimet này xác định màu vĩ mô cảm nhận được (Hình. 1D). Điều quan trọng là, các bức tranh khảm cho thấy tiềm năng của C. lytica màng sinh học để phản ánh một loạt các màu sắc.
Với những điều kiện sinh trưởng cụ thể, C. lytica 7489 tạo ra màng sinh học óng ánh mạnh mẽ mặc dù trước đây được báo cáo là thiếu màu. (A) Tiêu biểu C. lytica 7489 màng sinh học được phát triển ở 27°C trên BB2/H2O đĩa thạch chứa 0.8%, 1.0%, 1.2% hoặc 1.5% agar. Màng sinh học được chụp mỗi ngày trong 5 ngày. Nồng độ thạch ảnh hưởng đến độ bão hòa màu và độ nở của DSM 7489 C. lytica màng sinh học. Thanh tỷ lệ = 1 mm. (B) Các phép đo diện tích (i) và cường độ trung bình (ii) của màng sinh học trong A được ghi lại hàng ngày bằng ImageJ. Dữ liệu được trình bày dưới dạng trung bình cho từng mốc thời gian với độ lệch chuẩn được hiển thị là ±lỗi (n = 10 cho mỗi mốc thời gian). (C) C. lytica 7489 có khả năng tạo ra dải màu đậm như thể hiện trong bức ảnh chụp màng sinh học này thu được từ một góc xem xiên (i) và sơ đồ hiển thị màu đồng tâm (ii). (D) Hình ảnh quang học cho thấy các vùng của màng sinh học xuất hiện màu xanh lá cây (i) và đỏ (ii) về mặt vĩ mô là khảm của các màu sắc điểm. (thanh = 1 mm) (E) Một khối dữ liệu siêu phổ đại diện cho thấy các biến thể theo vùng cụ thể về cường độ tín hiệu trong màng sinh học trưởng thành. (i) Màng sinh học được nuôi trong đĩa petri 10 cm trên thạch dinh dưỡng có chứa mực đen. Lưu ý rằng máy dò là bình thường đối với bề mặt của màng sinh học. Vị trí của nó là nguyên nhân làm giảm cường độ phản xạ so với màng sinh học trong (C-Tôi). Các vùng bên ngoài của màng sinh học tạo ra một cực đại sắc nét đặc biệt tập trung ở gần 550nm cho thấy sự phản xạ mang tính xây dựng và mạch lạc qua màng sinh học. (ii, vị trí 1) Ngược lại, các phản xạ ở vùng trung tâm vẫn ở gần đường cơ sở. (ii, vị trí 2)
Một hệ thống siêu phổ để bàn Resonon đã được sử dụng để tạo ra các khối dữ liệu đại diện cho các phản ứng quang học số lượng lớn của sự sống C. lytica màng sinh học (Hình. 1E). Quang phổ bao trùm phạm vi nhìn thấy được thu thập và cho thấy cường độ tăng lên tập trung gần 550 nm. Đỉnh sắc nét cho thấy rằng các phản xạ mang tính xây dựng và mạch lạc xảy ra thông qua màng sinh học. Ngược lại, cường độ liên quan đến trung tâm của màng sinh học vẫn ở gần mức cơ bản. Trong các thí nghiệm khác, sử dụng hình học tán xạ ngược và các góc kích thích thay đổi, sự phụ thuộc vào góc phát hiện đã được thiết lập (Hình bổ sung. 1).
Sắp xếp tế bào, đóng gói và hình thái bên trong C. lytica 7489 màng sinh học
Các nghiên cứu trước đây của Vi khuẩn Flavobacteria màng sinh học tiết lộ rằng khoảng cách tế bào và hình thái ảnh hưởng đến bước sóng phản xạ21,30. Để hiểu được sự khác biệt về màu sắc trong C. lytica 7489 màng sinh học, kỹ thuật kính hiển vi bổ sung đã được áp dụng. sự sắp xếp của C. lytica trong các màng sinh học được hiển thị bằng kính hiển vi đồng tiêu của các màng sinh học cố định được nhuộm bằng SYTO9 (Hình XNUMX). 2MỘT). Các vùng của màng sinh học không liên kết với ánh kim chứa các tế bào được định hướng ngẫu nhiên, mặc dù người ta cũng quan sát thấy các cụm nhỏ của các tế bào thẳng hàng. Các cấu trúc hình cầu, cũng có mặt trong khu vực này, tăng về số lượng khi mặt phẳng hình ảnh tiếp cận chất nền (Hình bổ sung. 2MỘT). Ngược lại, các tế bào trong vùng ánh kim được đóng gói chặt chẽ và sắp xếp thành các lớp phẳng, đa tinh thể như được xác nhận trong phép biến đổi Fourier nhanh (FFT) của hình ảnh của vùng ánh kim màu lục (Hình bổ sung. 2B). Thứ tự vẫn tồn tại trên hàng chục micron với ranh giới hạt được biểu thị bằng sự thay đổi hướng của các ô.
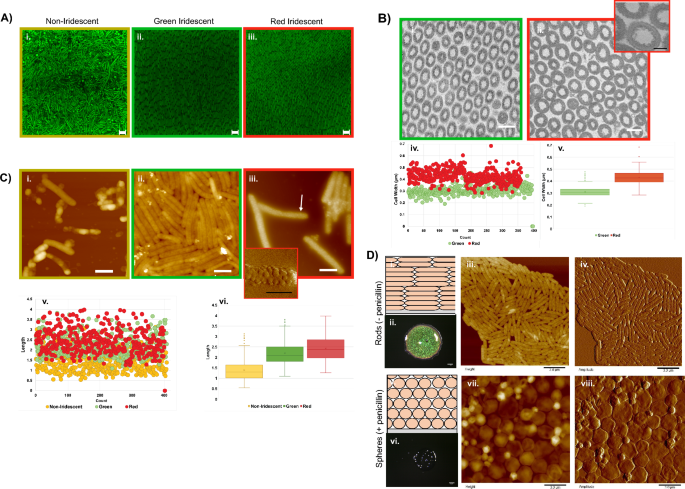
Kính hiển vi của các tế bào màng sinh học. (A) Hình ảnh tiêu điểm của màng sinh học được nhuộm bằng SYTO9 cho thấy tổ chức tế bào khác nhau giữa vùng không ánh kim (i) và vùng ánh kim (ii, iii) (bar = 2.0 µm). (B) Hình ảnh mặt cắt ngang của kính hiển vi điện tử truyền qua (TEM) của vùng màu xanh lá cây (i) và màu đỏ (ii). (bar = 0.5 Pha) Hình nhỏ (iii) hiển thị các phần nhô ra nhỏ xung quanh thành tế bào (bar = 200 nm). Số đo chiều rộng (iv, v) cũng khác nhau tùy theo vùng. (C) Hình ảnh chiều cao của kính hiển vi lực nguyên tử (AFM) của các vùng không ánh kim (i), ánh kim xanh lục (ii) và ánh kim đỏ (iii) cho thấy các hình thái tế bào riêng biệt được liên kết với từng vùng (bar = 1.0 µm). Inset (iv) là hình ảnh biên độ AFM của vùng được biểu thị bằng mũi tên (bar = 0.5 Pha). Các phép đo chiều dài từ các vùng màng sinh học được chỉ định (v, vi). (D) Màng sinh học 2 ngày tuổi phát triển trong điều kiện môi trường xung quanh trên BB2/H2O agar (thanh thang đo quang học = 1 mm; thanh AFM = 3 Pha). Sơ đồ hiển thị sự sắp xếp điển hình của các tế bào trong màng sinh học óng ánh (i). Hình ảnh quang học của màng sinh học óng ánh. (ii) Hình ảnh chiều cao AFM (iii) và biên độ (iv) của các tế bào từ màng sinh học óng ánh cho thấy hình thái hình que điển hình. Sơ đồ cho thấy sự sắp xếp dự đoán của các tế bào trong màng sinh học được phát triển khi thêm penicillin dưới mức gây chết người (v). Hình ảnh quang học của màng sinh học cho thấy penicillin gây chết người phụ phá vỡ cấu trúc màu sắc. (vi) Hình ảnh chiều cao AFM (vii) và biên độ (viii) của các tế bào xác nhận chuyển đổi thành hình cầu do điều trị bằng penicillin.
Các thành phần nhúng của sinh vật nhân thực góp phần tạo nên ánh kim trong các mô có thể được xử lý và thao tác trong quá trình nghiên cứu. C. lytica tuy nhiên, ánh kim có nguồn gốc từ các tế bào độc lập, liên kết lỏng lẻo, dễ dàng bị phân tách bởi các rối loạn cơ học, bao gồm cả sự nhiễu loạn do hydrat hóa quá mức. Liên kết chéo các tế bào với glutaraldehyd bảo tồn ánh kim và cho phép loại bỏ các màng sinh học nguyên vẹn khỏi môi trường thạch để mô tả đặc tính bằng kính hiển vi điện tử truyền qua (TEM). Ảnh vi điện tử mặt cắt ngang của cố định C. lytica 7489 màng sinh học đã xác nhận tính tuần hoàn ở các vùng óng ánh (Hình. 2B). Các ô trong vùng màu xanh lục và đỏ có chiều rộng trung bình lần lượt là 310 nm và 428 nm, cho thấy rằng những thay đổi về chiều rộng của ô đã góp phần tạo nên sự biến đổi màu sắc. Ngoài ra, hình ảnh TEM độ phóng đại cao hơn của các tế bào từ vùng màu đỏ cho thấy các phần nhô ra nhỏ xung quanh thành tế bào (Hình. 2B-iii). Hình ảnh bên của màng sinh học, thu được bằng kính hiển vi điện tử quét (SEM) cho thấy trật tự xảy ra thông qua toàn bộ độ dày của màng sinh học nằm trong khoảng từ 15 đến 60 µm (Hình bổ sung. 2C).
Do sự khác biệt về chiều rộng được quan sát thấy trong dữ liệu TEM và sự liên kết với các vùng cụ thể của màng sinh học, chúng tôi đã tìm cách so sánh hình thái của các tế bào bằng kính hiển vi lực nguyên tử (AFM) (Hình XNUMX). 2C). Các tế bào từ vùng không ánh kim không đều, liên kết với các phần lồi hình cầu và thường bị xẹp. Ngược lại, các tế bào từ cả vùng ánh kim màu đỏ và màu xanh lá cây duy trì hình thái và kích thước đều đặn, như mong đợi với vi khuẩn hình que khỏe mạnh. Bất chấp những nỗ lực lặp đi lặp lại để phá vỡ các tập hợp, các tế bào từ các vùng ánh kim màu xanh lá cây vẫn liên kết chặt chẽ với nhau, cho thấy các đặc tính bề mặt tế bào cũng thay đổi theo vùng (Hình XNUMX). 2C-ii). Ngược lại, các tế bào từ vùng màu đỏ thường được bao phủ bởi các túi màng (Hình. 2C-iii và iv và Hình bổ sung. 3). Vi khuẩn gram âm bao gồm C. lytica được biết là tạo ra các túi màng ngoài31,32. Tuy nhiên, độ che phủ hoàn toàn trên bề mặt của các túi rất ấn tượng. Các hình ảnh AFM được xác định rõ hơn cho thấy rằng các phần nhô ra của màng được quan sát thấy trong các mặt cắt TEM là các túi. So sánh độ dài của các ô từ các vùng khác nhau cho thấy rằng các ô không ánh kim ngắn hơn các ô trong vùng màu lục hoặc đỏ với các giá trị trung bình lần lượt là 1.39 µm, 2.20 µm và 2.42 µm (Hình XNUMX). 2Cv, vi). Kết hợp lại với nhau, dữ liệu hình ảnh chỉ ra các cấu trúc liên kết bề mặt và kích thước khác nhau tùy thuộc vào vị trí của các tế bào trong màng sinh học.
Peptidoglycan ở vi khuẩn gram âm là một polyme giống như cái lồng mang lại sự ổn định cơ học cho tế bào. Nằm giữa màng tế bào chất và màng ngoài, hình dạng của nó quyết định hình thái của vi khuẩn. Kháng sinh lysozyme và beta lactam được biết đến rộng rãi là phá vỡ peptidoglycan và dẫn đến ly giải tế bào. Tuy nhiên, ở liều dưới mức gây chết, vi khuẩn Gram âm bao gồm E. coli sống sót sau quá trình điều trị nhưng được chuyển đổi từ dạng que sang dạng cầu33,34,35. Để xác định xem màu sắc có cần peptidoglycan nguyên vẹn hay không, 30 µg/mL penicillin đã được thêm vào các đĩa thạch trước khi cấy với C. lytica (Sung. 2D). Sau 48 giờ, màng sinh học được xử lý thiếu ánh kim do sự chuyển đổi của C. lytica thành hình cầu, cho thấy tầm quan trọng của peptidoglycan đối với ánh kim. Những kết quả này cũng cho thấy rằng thuốc thử thay đổi hình dạng ngoại sinh có thể được sử dụng để tác động đến tính chất quang học của màng sinh học.
Khả năng mở rộng và khả năng điều chỉnh của màng sinh học cho sản xuất
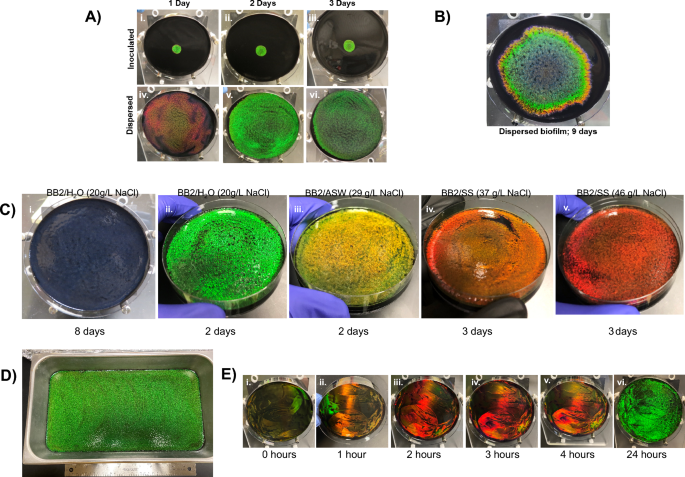
Cellulophaga lytica màng sinh học mở rộng hoàn toàn từ điểm cấy và hiển thị các màu có dải (Hình XNUMXb). 1MỘT). Sự tạo khuôn này có thể là hậu quả của sự khác biệt theo thời gian về hình thái tế bào do những thay đổi trong môi trường địa phương gây ra (ví dụ như lượng dinh dưỡng, pH, chất chuyển hóa, v.v.) trong quá trình phát triển của tế bào. Vì màng sinh học đơn sắc sẽ biểu thị các hình thái nhất quán, chúng tôi lập luận rằng việc thêm đủ các ô cùng một lúc vào toàn bộ bề mặt thạch sẽ đồng thời đưa tất cả các ô vào cùng một môi trường và đồng bộ hóa màu phản chiếu. Giả thuyết này đã được kiểm tra bằng cách so sánh các màng sinh học được bắt đầu bằng chất cấy 100µL cục bộ với những màng mà chất cấy có cùng thể tích được phân tán trên thạch bằng cách sử dụng máy rải tế bào. (Quả sung. 3A) Các bức ảnh đại diện cho thấy rằng sau 1 ngày phát triển trong điều kiện môi trường xung quanh, các màng sinh học được cấy truyền phản chiếu ánh kim màu lục sáng quanh tâm đĩa trong khi các màng sinh học phân tán có màu đỏ lan tỏa trên bề mặt đĩa. Sau 2 ngày phát triển, cả hai chế phẩm đều cho màu xanh lục sáng óng ánh mặc dù các màng sinh học phân tán bao phủ toàn bộ bề mặt thạch. Ánh kim trong màng sinh học phân tán suy yếu đáng kể sau 3 ngày. Với thời gian bổ sung, màng sinh học được cấy mở rộng để bao phủ hầu hết bề mặt thạch (Hình. 3B). Do đó, việc phân tán các tế bào vừa rút ngắn thời gian để đạt được ánh kim tối ưu vừa mở rộng diện tích của đĩa được bao phủ bởi vi khuẩn đơn sắc có trật tự.
Vì Kientz et al. cho thấy độ mặn ảnh hưởng đến màu sắc của màng sinh học CECT8139, màng sinh học DSM 7489 cũng được thử nghiệm tương tự27 (Sung. 3C). Phương tiện được tăng cường với chất tương tự muối biển Instant Ocean (BB2/ASW) hoặc Lake Products Sea Salt ASTM D1141-98 (BB2/SS). So với màng sinh học phân tán trên BB2/H2O, sự phát triển trên BB2/ASW và BB2/SS đã tạo ra các khuẩn lạc gần như đơn sắc với sự dịch chuyển màu đỏ tương ứng với lượng chất tương tự muối biển được thêm vào môi trường. Cho rằng các chất tương tự khác nhau chủ yếu ở nồng độ NaCl, chúng tôi đã kiểm tra xem việc tăng nồng độ NaCl có đủ để tạo ra màu chuyển đỏ hay không bằng cách phát triển màng sinh học trên BB2/H2Các đĩa O được bổ sung lượng NaCl khác nhau (Hình bổ sung. 4MỘT). Việc tăng nồng độ NaCl trong các tấm cục bộ dẫn đến màu chuyển sang màu đỏ, do đó cho phép các thuộc tính của màng sinh học được thao tác ngoại sinh. Các dải thể hiện trong hình. 1 phản chiếu cái phạm vi màu sắc có thể được tạo ra bởi C. lytica màng sinh học. Ở đây chúng tôi chỉ ra rằng màu đỏ đó, một màu ban đầu trên BB2/H2Các đĩa thạch O, được tạo ra bằng cách tăng độ mặn của môi trường tăng trưởng trong khi màu xanh lam được tạo ra bằng cách kéo dài thời gian tăng trưởng. Kết hợp lại với nhau, chúng tôi kết luận rằng khía cạnh thời gian của màu sắc bắt nguồn từ phản ứng của tế bào đối với môi trường địa phương.
Màng sinh học đơn sắc. (A) So sánh màng sinh học được cấy (i–iii) so với màng sinh học phân tán (iv–vi) ở nhiệt độ môi trường. Đỉnh màng sinh học phân tán có màu đơn sắc và lấp đầy đĩa sau 2 ngày (v). (B) Trong khi đó, màng sinh học được cấy sẽ phát triển màu sắc theo dải và cần nhiều thời gian hơn đáng kể để phủ lên bề mặt. (C) Hình ảnh cho thấy sự phân tán đó C. lytica các tế bào dẫn đến các màng sinh học đơn sắc có nhiều màu sắc khác nhau có lẽ bằng cách cho tất cả các tế bào tiếp xúc đồng thời với các điều kiện tăng trưởng đồng nhất (chất dinh dưỡng, chất chuyển hóa, v.v.). Phạm vi màu sắc có thể được truy cập bằng cách kéo dài thời gian tăng trưởng (i) hoặc thay đổi độ mặn của môi trường (ii – v) bằng cách sử dụng chất mô phỏng nước biển. NaCl hiệu quả trong công thức được đưa ra trong ngoặc đơn. Các tấm được trồng trong điều kiện môi trường xung quanh trong thời gian chỉ định. (D) Một màng sinh học lớn màu xanh lá cây được tạo ra trong 3 ngày ở điều kiện môi trường xung quanh bằng cách phân tán chất cấy theo tỷ lệ trên bề mặt của chảo 41 x 23 cm. (E) Ứng dụng tuần tự và phân tán các phần dịch nuôi cấy đậm đặc gấp 50 lần làm giảm quá trình hình thành màng sinh học đơn sắc trong 24 giờ hoặc ít hơn, cho thấy rằng các tế bào bắt đầu tổ chức ngay lập tức và mật độ tế bào sẽ là một yếu tố quan trọng cần xem xét đối với các ứng dụng sản xuất công nghiệp. Các tấm được ủ ở 27 ° C giữa các ứng dụng tế bào. Các thử nghiệm bổ sung được hiển thị trong hình bổ sung 4Đ, F.
Phân tán chất cấy lớn hơn theo tỷ lệ trên bề mặt thạch 41 cm x 23 cm tạo ra màng sinh học đơn sắc lấp đầy bề mặt sau 3 ngày ủ ở nhiệt độ phòng, trong khi chất cấy cục bộ dẫn đến vùng óng ánh hạn chế (Hình. 3D, Bổ sung 4B). Để tiếp tục giảm thời gian tạo màng sinh học đơn sắc diện tích lớn, chúng tôi đã kiểm tra xem việc tăng các tế bào trong chất cấy có dẫn đến ánh kim nhanh hơn hay không. Cụ thể, nuôi cấy qua đêm được cô đặc trước khi phân tán các tế bào trên môi trường thạch. Tốc độ xuất hiện ánh kim tương quan với nồng độ nếp gấp của chất cấy phân tán trên bề mặt (Hình bổ sung. 4C). Một chiến lược phân lớp tăng tốc hơn nữa sự hình thành ánh kim trong đó các tế bào tập trung gấp 50 lần được áp dụng liên tiếp vào các đĩa thạch (Hình. 3E, Hình bổ sung. 4E, 4F, 5, 6) Đáng chú ý là phản xạ màu vàng và đỏ rực rỡ xuất hiện sớm, phù hợp với trình tự tạo màu trong màng sinh học được cấy trong đó màu đỏ thoáng qua được nhìn thấy ở ngoại vi của đĩa được cấy theo sau là màu xanh lá cây. Vào lúc 24 giờ, toàn bộ tấm phản chiếu màu xanh lá cây. Cùng với nhau, những kết quả này cho thấy rằng các tế bào có thể tổ chức nhanh chóng thành các cấu trúc quang tử và số lượng tế bào đó là một yếu tố hạn chế đối với sự hình thành các màng sinh học óng ánh.
Kết hợp màng sinh học vào vật liệu
Sự phát triển trên các chất nền xốp bao gồm giấy lọc định tính (Whatman, Lớp 2), màng polyester track-etch (Sterlitech), vải cotton và lụa trên thạch dinh dưỡng đã được thử nghiệm. Khả năng lưu giữ và khuếch tán chất dinh dưỡng của môi trường cho phép màng sinh học phát triển và mở rộng trên các chất nền này. Điều quan trọng là, các mẫu màu phản chiếu tương tự như các mẫu của màng sinh học được phát triển trực tiếp trên các đĩa thạch (Hình XNUMX). 4). Trong số các chất nền được thử nghiệm, giấy lọc được chọn để nghiên cứu thêm do chất lượng của màng sinh học óng ánh, chi phí chất nền thấp và tính linh hoạt. Sau khi tăng trưởng, màng sinh học liên quan đến giấy (PAB) được chuyển sang môi trường thạch có chứa glutaraldehyde để cố định nhằm duy trì ánh kim. Bài báo tạo điều kiện thuận lợi cho việc xử lý màng sinh học trong quá trình mô tả đặc tính và xử lý tiếp theo. Ánh kim của PAB bị mất sau khi sấy khô, nhưng nhanh chóng được phục hồi khi thêm nước (Hình 4). PAB chịu đựng được nhiều chu kỳ sấy khô và bù nước với sự mất ánh kim tối thiểu. Hình ảnh AFM của màng sinh học giấy cố định đã xác nhận sự sắp xếp tinh thể của các tế bào (Hình bổ sung. 7B).
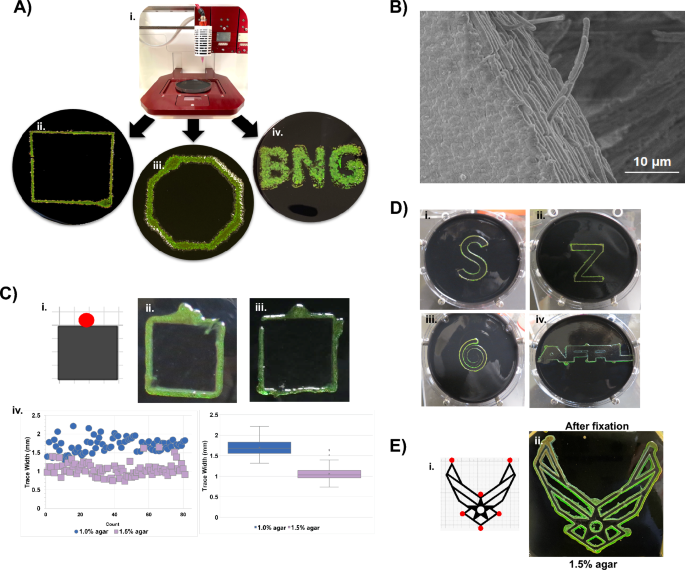
Sự phát triển xung quanh của màng sinh học óng ánh trên chất nền xốp bao gồm cả giấy tạo điều kiện thuận lợi cho việc xử lý để mô tả đặc tính và xử lý xuôi dòng. (A) C. lytica màng sinh học được phát triển trong điều kiện môi trường xung quanh trên nhiều loại chất nền xốp. (B) Giấy lọc Whatman 2 đặt trên thạch dinh dưỡng là một trong số các chất nền xốp cho phép C. lytica để tạo thành các khuẩn lạc óng ánh. Như trên đĩa thạch, màng sinh học liên quan đến giấy sống (PAB) có màu xanh sau 3 ngày tăng trưởng trên đỉnh BB2/H2O agar (Ai) và chuyển sang màu đỏ khi độ mặn tăng như trên BB2/SS (A-ii). (C) PAB giữ được ánh kim sau khi lấy ra khỏi môi trường thạch và cố định bằng glutaraldehyde (Bi). Làm khô các PAB cố định bằng nitơ làm chúng mất đi ánh kim (B-ii). Tuy nhiên, màu cấu trúc được phục hồi khi bù nước (B-iii). (D) Các PAB sống giữ được khả năng phản ứng với các dấu hiệu môi trường. PAB từ BB2/H2Thạch O chủ yếu phản chiếu màu xanh lá cây cho đến khi chúng được chuyển sang các đĩa BB2/SS nơi các phản xạ chuyển sang màu đỏ (Ci và C-ii, tương ứng). Tương tự, PAB bắt nguồn trên đĩa thạch BB2/SS có màu đỏ nhưng chuyển sang màu xanh lục khi đặt trên đĩa thạch BB2/H2O (C-iv và Cv, tương ứng). Trong cả hai trường hợp, màng sinh học có thể trở lại màu ban đầu khi được đưa trở lại điều kiện phương tiện ban đầu (C-iii và C-vi). Màng sinh học cố định không hiển thị hành vi năng động này (C-vii và C-viii).
C. lytica có thể được sử dụng như một mực sinh học óng ánh. (A) Thiết kế in 3D có chứa C. lytica được tạo ra trên thạch bằng cách sử dụng thiết lập Allevi 3 Bioprinter (Ai đến A-iv). Như đã trình bày trước đây đối với màng sinh học phân tán, độ mặn tăng lên làm dịch chuyển màu đỏ C. lytica sự phản chiếu của mực. (Hình bổ sung. 9) (B) Ảnh SEM của cạnh màng sinh học in 3D hiển thị các tế bào được sắp xếp theo thứ tự của màng sinh học in. (C, D) C. lytica theo dõi các cạnh của mẫu giấy (ví dụ: sơ đồ trong Ci). Vòng tròn màu đỏ trên thiết kế tiêu bản biểu thị vị trí tiêm chủng. Các tế bào hoạt động giống như một loại mực sinh học tự in để viết các mẫu khác nhau trong điều kiện môi trường xung quanh. (B) Việc tăng nồng độ thạch từ 1.0% (C-ii) lên 1.5% (C-iii) làm giảm độ rộng của vạch như được tiết lộ trong phép đo Keyence (C-iv). Kết quả này cho thấy rằng chuyển động trượt được điều biến theo cách giới hạn các tế bào gần hơn với khuôn mẫu trên môi trường thạch có nồng độ cao hơn. (D) Các dấu vết bổ sung cho thấy BACTracing có thể được sử dụng với các hình dạng có độ phức tạp, góc độ và kết nối khác nhau. Nồng độ thạch có thể được sử dụng để hạn chế các dấu vết khi khoảng cách giữa các đặc điểm nhỏ như trường hợp của các mẫu phức tạp như Biểu tượng Lực lượng Không quân (bổ sung Hình. 6c). (E) Mẫu của một mẫu phức tạp (i) và mẫu đối chiếu BACTraced của nó (ii) sau khi cố định cho thấy rằng mẫu ánh kim có thể được bảo tồn.
PAB sống (tức là không cố định) vẫn giữ được khả năng phản ứng với các tín hiệu môi trường. Ví dụ: PAB trên BB2/H2Các đĩa thạch O chủ yếu phản chiếu màu xanh lá cây cho đến khi chúng được chuyển sang các đĩa BB2/SS nơi phản xạ chuyển sang màu đỏ và ngược lại (Hình. 4D). Trong cả hai trường hợp, màng sinh học trở lại màu ban đầu khi được đưa trở lại tình trạng phương tiện ban đầu (Hình bổ sung. 8MỘT). Sự đảo ngược này không xảy ra khi các tế bào được cố định bằng glutaraldehyde, xác nhận rằng khả năng cảm nhận và phản ứng của các tế bào sống là cần thiết cho sự thay đổi màu sắc. Cũng giống như màng sinh học phân tán và cục bộ, các thuốc thử ngoại sinh như penicillin và lysozyme có thể được chuyển đến màng sinh học thông qua chất nền giấy để kiểm soát các đặc tính của màng sinh học (Hình bổ sung. 8B).
Cellulophaga lytica màng sinh học như mực óng ánh
Tìm cách phát triển các loại mực vi khuẩn được đặt hàng dựa trên C. lytica, một máy in sinh học Allevi 3™ đã được sử dụng để ký gửi các ô theo các mẫu được lập trình sẵn và Google SketchUp để tạo các tệp thiết kế STL từ hình dạng đến chữ cái. Các nền văn hóa được in duy trì các mẫu mong muốn trên BB2/H2Các đĩa O sau khi ủ và phát triển ở 27°C (Hình XNUMX). 5MỘT). Các mẫu cũng được in trên các đĩa thạch BB2/ASW nơi độ mặn tăng lên lại làm chuyển màu đỏ. (Bổ sung Hình. 9A) Các ảnh SEM tiếp theo của màng sinh học liên kết ngang cho thấy vi khuẩn được đóng gói chặt chẽ và sắp xếp theo hình in (Hình. 5B).
Sự vận động của vi khuẩn là cần thiết để tạo ra màng sinh học óng ánh20,30. Các hình ảnh đồng tiêu từ nghiên cứu này cho thấy sự liên kết giữa các ô có khả năng là do dòng tế bào có hướng trên bề mặt thạch kết hợp với các tương tác giao diện. Chúng tôi đã đưa ra giả thuyết rằng các chướng ngại vật trên đường di chuyển của các tế bào sẽ làm thay đổi hướng của dòng tế bào và sự điều hướng gây cản trở này có thể dẫn đến một loại mực vi khuẩn “tự in”. Để kiểm tra ý tưởng này, các tiêu bản giấy được đặt trên các đĩa thạch dinh dưỡng trước khi thêm chất cấy vào bên cạnh giấy (Hình. 5C, Hình bổ sung. 9B) Trong quá trình ủ, các tế bào tạo ra các dấu vết óng ánh dọc theo các cạnh của mẫu thông qua một quy trình mà chúng tôi gọi là theo dõi tập thể tự trị của vi khuẩn (hay còn gọi là “BACTracing”). BACTracing xảy ra trên cả đĩa thạch 1% và 1.5%, tuy nhiên, nồng độ thạch cao hơn dẫn đến vết hẹp hơn. Nhiệt độ cũng ảnh hưởng đến chất lượng của các mẫu được tạo bằng BACTracing (Hình bổ sung. 10). Các mẫu ngày càng phức tạp được in bằng cách sử dụng một số lượng nhỏ các vị trí cấy cho thấy rằng BACTracing có thể là một cách tiếp cận dễ dàng để in vật liệu sống tiên tiến (Hình. 5E).
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Ô tô / Xe điện, Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- PlatoSức khỏe. Tình báo thử nghiệm lâm sàng và công nghệ sinh học. Truy cập Tại đây.
- ChartPrime. Nâng cao trò chơi giao dịch của bạn với ChartPrime. Truy cập Tại đây.
- BlockOffsets. Hiện đại hóa quyền sở hữu bù đắp môi trường. Truy cập Tại đây.
- nguồn: https://www.nature.com/articles/s41598-023-38797-0