Các vi hạt F16BP nằm trong phạm vi có khả năng thực bào
Để chứng minh sức mạnh của chiến lược như vậy, PFK15 (khối−6-Phosphofructo-2-Kinase Fructose-2,6-Biphosphatase 3-PFKFB3) đã được chọn để ngăn chặn quá trình đường phân, vì đây là một trong những bước giới hạn tốc độ trong quá trình đường phân20. Hơn nữa, Fructose-1,6-BiPhosphate (F16BP), được tạo ra bởi phosphofructokinase (PFK), là một bước hạ lưu của PFKFB3, đã được chọn làm chất chuyển hóa để tạo ra các hạt có thể thực bào21. Các vi hạt dựa trên F16BP được tạo ra bằng cách sử dụng hóa học canxi-photphat. Sự tán xạ ánh sáng động chứng minh rằng kích thước của các hạt này là 2.3 ± 0.4 µm (Hình XNUMX). 1b) và chụp ảnh vi mô điện tử cho thấy các hạt này có hình thái cầu nhẵn (Hình XNUMX). 1c). Sử dụng ánh xạ 1H NMR và EDX, người ta đã xác định được rằng F16BP được tích hợp trong các vi hạt này (Hình XNUMX). 1c; S1) và các hạt có tỷ lệ Canxi và Phốt pho (Ca:P) là 2 ± 0.14 (Hình XNUMX). 1c).
Các vi hạt F16BP bị thực bào bởi DC
Để kiểm tra xem MP F16BP có thể giải phóng F16BP hay không, động học giải phóng trong dung dịch muối đệm phốt phát đã được thực hiện. Người ta quan sát thấy rằng các MP F16BP có thể giải phóng F16BP trong 6 giờ một cách bền vững (Hình XNUMX). S2). Những dữ liệu này đã chứng minh rằng MP được tạo ra có chứa F16BP, nằm trong phạm vi DC có thể thực bào được và có thể giải phóng F16BP để có khả năng cho phép quá trình đường phân tiến triển. Ngoài F16BP, các hạt của các chất chuyển hóa đối chứng khác như ribulose 5 phosphate (R5P), axit Phosphoenolpyruvic (PEP) và fructose-6 phosphate (F6P) cũng được tạo ra (Hình XNUMX). S3). Trong nghiên cứu này, PBS được chọn để bắt chước các điều kiện sinh lý của phốt phát in vivo và sự giải phóng F16BP trong môi trường này đã được xác định22. Hơn nữa, vì các DC được kích hoạt dự kiến sẽ tồn tại trong 1–3 ngày in vivo sau quá trình thực bào, nên hoạt động ngắn hạn hoặc tính ổn định của MP F16BP là điều mong muốn23.
Để kiểm tra xem các hạt này có thể bị thực bào bởi DC hay không, hình ảnh đồng tiêu đã được thực hiện. Cụ thể, các MP F16BP được tạo ra với FITC xen kẽ bên trong các hạt. Các DC có nguồn gốc từ tủy xương (DC) sau đó được ủ với các hạt này trong 60 phút và nhuộm màu để tìm Actin và hạt nhân, đồng thời thực hiện chụp ảnh huỳnh quang. Cytochalasin D với sự có mặt của MP F16BP-FITC đã được sử dụng làm đối chứng. Người ta quan sát thấy rằng các DC có thể liên kết với các hạt một cách hiệu quả và các lát cắt đồng tiêu theo hướng z chứng minh rằng các hạt đã được nội hóa (Hình XNUMX). S4).
Các vi hạt F16BP giải cứu quá trình glycolysis ở DC trong ống nghiệm
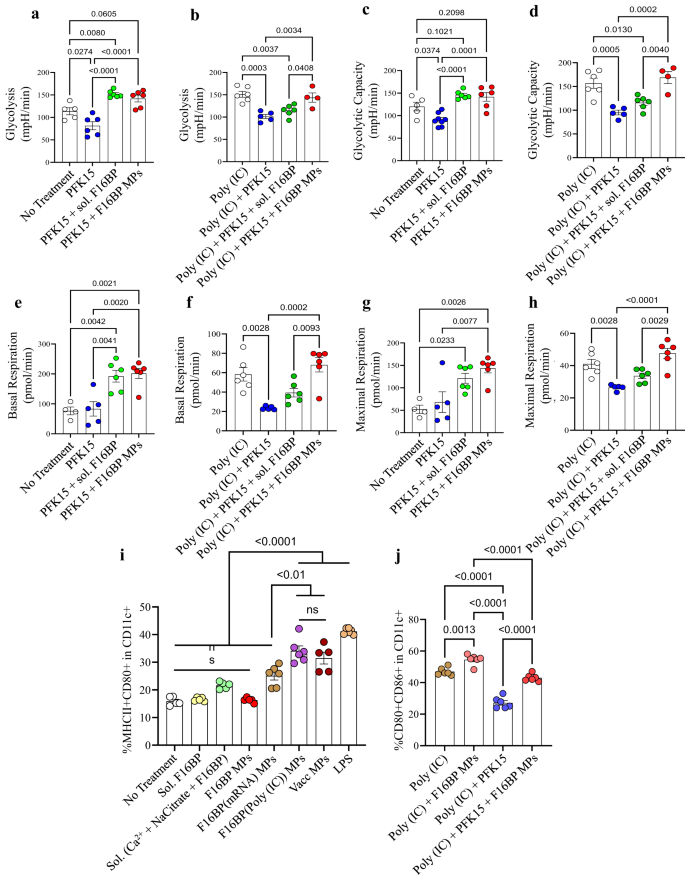
Tiếp theo, khả năng của các MP F16BP trong việc giải cứu quá trình glycolysis ở DC với sự có mặt của chất ức chế glycolytic PFK15 đã được thử nghiệm bằng cách sử dụng các xét nghiệm thông lượng ngoại bào. DC được nuôi cấy bằng MP PFK15, F16BP, Fructose-6-Phosphate hòa tan (F6P-ngược dòng của PFKFB3) hoặc MP PFK15 + F16BP hoặc các thành phần riêng lẻ của MP F16BP trong 2 giờ và tốc độ axit hóa ngoại bào (ECAR–tỷ lệ phép đo glycolysis) đã thu được. Người ta quan sát thấy rằng PFK15 mang lại khả năng glycolysis và glycolytic (y-axis-ECAR) thấp hơn so với đối chứng không điều trị (Hình XNUMX). 2a–d; S5). Điều quan trọng là khả năng glycolysis và glycolytic cao hơn đáng kể ở MP F16BP ngay cả khi có sự hiện diện của PFK15, so với chỉ kiểm soát PFK15 (Hình XNUMX). 2a–d). Ngoài ra, với sự có mặt của poly(IC) (một tác nhân kích hoạt cho DC)24, PFK15 làm giảm khả năng glycolysis và glycolytic, và các MP F16BP có thể giải quyết sự suy giảm này ngay cả khi có sự hiện diện của PFK15 (Hình XNUMX). 2e–h). Nhìn chung, những dữ liệu này cho thấy rằng các MP F16BP có khả năng thực bào có thể giải cứu quá trình glycolysis ở DC ngay cả khi có chất ức chế glycolytic PFK15, và do đó có thể được sử dụng cho các liệu pháp miễn dịch trong đó nhắm mục tiêu vào quá trình glycolysis của tế bào ung thư. Điều này rất quan trọng vì trong điều kiện viêm, DC cần thực hiện mức độ glycolysis tăng cường để hỗ trợ sản xuất protein gây viêm.11,25.
a–d Các DC được điều trị bằng MP F16BP đã giải cứu khả năng glycolysis và glycolytic khỏi sự ức chế glycolytic (PFK15), trong ống nghiệm (n = 6; thử nghiệm ANOVA Tukey một chiều), e–h DC được xử lý bằng MP F16BP tăng tốc hô hấp cơ bản và tối đa ngay cả khi bị ức chế glycolytic (PFK15), trong ống nghiệm (n = 6; Kiểm định ANOVA Tukey một chiều). i Các hạt vắc xin tạo ra tần số MHCII + CD86+ trong CD11c+ DC cao hơn đáng kể so với các biện pháp kiểm soát thành phần riêng lẻ của MP (n = 6; Kiểm định ANOVA Tukey một chiều). j Các nghị sĩ F16BP có thể giải cứu việc kích hoạt DC ngay cả khi có sự hiện diện của PFK15 (PFK15 conc. = 25 µM) (n = 6; Kiểm định ANOVA Tukey một chiều). Dữ liệu được biểu diễn dưới dạng sai số trung bình ± tiêu chuẩn.
Kích hoạt giải cứu vi hạt F16BP của DC trong ống nghiệm
Để kiểm tra xem MP F16BP có thể điều chỉnh chức năng của DC hay không, vắc xin F16BP MP dựa trên mRNA và peptide đã được chế tạo. Những vắc-xin này được tạo ra bằng cách xen kẽ kháng nguyên peptide khối u ác tính di-phosphory hóa với protein liên quan đến Tyrosine 2 (pTRP2), và poly (IC) và mRNA có nguồn gốc từ các tế bào khối u ác tính, có chứa một số nhóm phốt phát trong xương sống của chúng (Hình XNUMX). S6). Vì pTRP2p và poly(IC) có các nhóm photphat nên các phân tử này có thể được tích hợp vào MP F16BP bằng cách sử dụng hóa chất canxi-photphat. Lượng pTRp2 và poly(IC) được kết hợp trong MP F16BP được xác định lần lượt là 78 ± 3.4 và 50.9 ± 7.9 µg. Tiếp theo, các MP F16BP được xen kẽ với poly (IC) và pTRP2 được ủ với DC qua đêm và phương pháp tế bào học dòng chảy được sử dụng để kiểm tra xem các hạt này có thể kích hoạt DC hay không (Hình XNUMX). 2i,j). Người ta quan sát thấy rằng các hạt vắc-xin tạo ra tần số MHCII + CD86+ trong CD11c+ DC cao hơn đáng kể so với các biện pháp kiểm soát thành phần riêng lẻ của MP (Hình XNUMX). 2i). Ngoài ra, người ta còn quan sát thấy rằng PFK15 có thể giảm kích hoạt DC (CD80 + CD86+ trong CD11c + ) ngay cả khi có sự hiện diện của poly(IC) và F16BP MP có thể cứu hoạt động kích hoạt DC ngay cả khi có sự hiện diện của PFK15 (Quả sung. 2j). Ngoài ra, các ion canxi ở nồng độ được thêm vào DC dưới dạng F16BP MP, không dẫn đến thay đổi cấu hình kích hoạt (MHCII + CD80+ trong CD11c + ) của DC (Hình XNUMX). S5). Những dữ liệu này chỉ ra rằng MP vắc xin dựa trên F16BP giải cứu kích hoạt DC ngay cả khi có PFK15, điều này rất quan trọng nếu cần tạo ra phản ứng vắc xin ung thư in vivo khi có sự ức chế glycolysis.
Để phân tích sâu hơn xem DC được điều trị bằng công thức F16BP MP có điều chỉnh phản ứng của tế bào T hay không, phản ứng tế bào lympho hỗn hợp tổng hợp (MLR) đã được thực hiện. DC có nguồn gốc từ tủy xương C57BL/6j được điều trị với các điều kiện khác nhau (Hình XNUMX). S7) trong 2 giờ và sau đó nuôi cấy tế bào T phân lập từ chuột C57BL/6j trong 60 giờ. Sau đó, các tế bào được nhuộm màu theo CD4, CD8, CD44, Tbet, RORɣT, GATA3, CD25 và Foxp3 và được phân tích bằng phương pháp tế bào học dòng chảy. Người ta quan sát thấy rằng các MP F16BP, F16BP(pTRP2), F16BP(poly(IC), F16BP(pTRP2+poly(IC)), PFK15 + F16BP MP và PFK15 + F16BP(pTRP2+poly(IC)) đều được điều chỉnh tăng đáng kể tần số của các tế bào Th1 được kích hoạt, Th17 được kích hoạt và các tế bào Tc1 được kích hoạt, đồng thời điều chỉnh giảm tần số của Th2, Tregs và Th2 được kích hoạt (Hình XNUMX). S7). Điều thú vị là người ta quan sát thấy rằng việc xử lý DC bằng MP F16BP đã dẫn đến những thay đổi lớn nhất trong quá trình phân cực và kích hoạt tế bào T. Sự thay đổi này được quan sát thấy ngay cả khi có sự hiện diện của tá dược poly(IC) hoặc kháng nguyên pTRP2. Hơn nữa, F16BP hòa tan và các thành phần của nó được thêm vào DC tạo ra tần số Th1, Tc1 và Th17 được kích hoạt thấp hơn đáng kể so với F16BP MP trong tất cả các kết hợp có thể có. Những dữ liệu này cho thấy rằng sự hiện diện của các hạt rất quan trọng trong việc làm lệch tần số tế bào T gây viêm trong phản ứng MLR.
Vắc-xin F16BP với chất ức chế glycolytic tạo ra phản ứng chống khối u mạnh mẽ
Để kiểm tra xem phương pháp điều chỉnh chuyển hóa miễn dịch nhằm giải cứu quá trình glycolysis với sự có mặt của chất ức chế glycolytic và tạo ra liệu pháp miễn dịch vắc-xin ung thư hay không, các dạng mô hình chuột u ác tính có tính xâm lấn cao đã được chọn. Cụ thể, MP vắc-xin được tiêm dưới da ở chuột có chứa YUMM1.1 (BRAF ở chuộtv600e đột biến tương tự như con người) khối u ác tính và khả năng làm giảm sự phát triển của khối u cũng như điều chỉnh các phản ứng miễn dịch bẩm sinh và thích ứng đã được thử nghiệm.
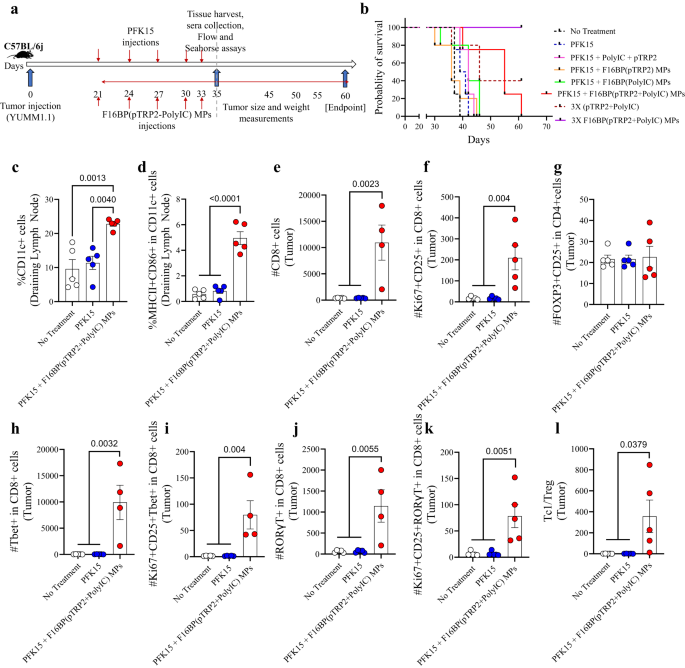
Trong mô hình khối u ác tính này, 0.75 × 106 Các tế bào YUMM1.1 được tiêm dưới da ở chuột có hệ miễn dịch bình thường C57BL/6j và PFK15 được tiêm luân phiên mỗi ngày trong suốt thời gian nghiên cứu. Hơn nữa, F16BP(pTRP2+poly(IC)) đã được tiêm dưới da vào cùng ngày tiêm PFK15 (Hình XNUMX). 3a). Trong ống nghiệm, người ta xác định rằng PFK15 có hiệu quả trong việc ngăn chặn sự tăng sinh của tế bào ung thư YUMM1.1 (Hình XNUMX). S8). Người ta quan sát thấy rằng nhóm điều trị bằng vắc xin MP PFK15 + đã giúp tăng đáng kể tỷ lệ sống sót của chuột (ngày 60 - điểm cuối) và sự phát triển khối u chậm hơn so với tất cả các biện pháp kiểm soát khác nhau (Hình XNUMX). 3b; S9). Sự gia tăng tỷ lệ sống sót ở MP vắc xin có liên quan đến sự gia tăng dân số DC và quần thể DC hoạt hóa trong các hạch bạch huyết bẹn đang thoát nước vào ngày thứ 35, điều này cho thấy rằng MP vắc xin có thể điều chỉnh các phản ứng miễn dịch bẩm sinh (Hình XNUMX). 3c, d). F16BP rất cần thiết trong việc tạo ra phản ứng chống khối u ở chuột vì nếu không có F16BP, chuột không thể sống sót sau ngày thứ 45. Hơn nữa, gấp 3 lần liều lượng MP F16BP (pTPR2+ poly IC) mà không có PFK15 có thể loại bỏ các khối u hiện có, vốn không được phát hiện cho đến khi ngày thứ 60 (Hình XNUMX). 3b; S9). Ngoài ra, người ta cũng phát hiện ra rằng poly(IC) và pTRP2 cần được kết hợp trong MP F16BP và việc tiêm MP F16BP với chất hòa tan (poly(IC) + pTRP2), không làm giảm sự phát triển khối u ở chuột (Hình XNUMX). S9). Bản thân các MP F16BP có thể đẩy nhanh quá trình glycolysis ở các tế bào khác nhau ở chuột, như đã được quan sát thấy trong ống nghiệm ở DC. Sự tăng tốc quá trình glycolysis này sau đó có thể khiến phản ứng miễn dịch bị lệch về phía phản ứng chống khối u. Tuy nhiên, biện pháp kiểm soát này chưa được thử nghiệm trên chuột và là một hạn chế của nghiên cứu này. Trong khối u, không quan sát thấy sự khác biệt đáng kể về số lượng tế bào T CD4 + của các nhóm điều trị khác nhau; tuy nhiên, có sự gia tăng đáng kể về số lượng tế bào CD4+ tăng sinh và kích hoạt ở chuột được điều trị bằng MP vắc xin so với các nhóm điều trị khác (Hình XNUMX). S10a). Hơn nữa, không có sự khác biệt đáng kể nào được quan sát thấy về số lượng tế bào T-helper loại 1 (Th1) và các tế bào Th1 được kích hoạt và tăng sinh; sự gia tăng đáng kể về T-helper loại 17 (Th17) và các tế bào Th17 được kích hoạt và tăng sinh đã được quan sát thấy ở những con chuột được điều trị bằng vắc-xin MP so với các nhóm điều trị khác (Hình XNUMX). S10a). Người ta cũng quan sát thấy rằng khi chuột được điều trị bằng PFK15 và bằng pTRP2 hòa tan và poly (IC) hòa tan mà không có F16BP, điều đó đã dẫn đến mức DC hoạt hóa tăng lên so với đối chứng không điều trị, tuy nhiên, DC không được điều biến ở các nhóm khác. các cơ quan (Hình. S10b). Hơn nữa, nếu không có F16BP, công thức này không điều chỉnh các phản ứng của tế bào T gây viêm so với đối chứng không điều trị (Hình XNUMX). S10c). Những dữ liệu này gợi ý rằng F16BP được yêu cầu trong công thức để tạo ra phản ứng tế bào T gây viêm. Hơn nữa, trong khối u, có sự gia tăng đáng kể về số lượng tế bào T CD8 + và tế bào T CD8 + tăng sinh và hoạt hóa ở chuột được điều trị bằng MP vắc xin so với các nhóm điều trị khác cho thấy sự giảm động lực phát triển của khối u ở chuột được điều trị bằng vắc xin. phản ứng của MP vắc xin (Hình XNUMX). 3e, f). Không có sự khác biệt đáng kể nào được quan sát thấy ở các tế bào T điều hòa ở các nhóm điều trị khác nhau (Hình XNUMX). 3g). Ngoài ra, có sự gia tăng đáng kể về số lượng Tc1, Tc17 cũng như các tế bào Tc1 và Tc17 tăng sinh và kích hoạt ở chuột được điều trị bằng vắc-xin MP so với các nhóm điều trị khác (Hình XNUMX). 3h–k). Ngoài ra, tỷ lệ Tc1/Treg tăng đáng kể đã được quan sát thấy ở những con chuột được điều trị bằng vắc-xin MP so với các nhóm điều trị khác (Hình XNUMX). 3l). Những dữ liệu này chứng minh rằng MP vắc xin có thể tạo ra các phản ứng miễn dịch thích ứng chống viêm mạnh mẽ trong khối u.
a Sơ đồ trình bày tiêm dưới da Vacc MP, in vivo, b Đường cong Kaplan–Meir cho thấy khả năng sống sót cao hơn đáng kể của chuột được điều trị bằng Vacc MP, c, d Những con chuột được điều trị bằng Vacc MP có tỷ lệ phần trăm tổng số cũng như DC được kích hoạt trong bạch huyết thoát nước cao hơn đáng kể (n = 5; Bài kiểm tra ANOVA Tukey một chiều), e, f Chuột được điều trị bằng Vacc MP có số lượng Tc và Tc được kích hoạt và tăng sinh cao hơn đáng kể so với các nhóm điều trị khác (n = 4 hoặc 5; Bài kiểm tra ANOVA Tukey một chiều), g Không có sự khác biệt đáng kể về số lượng Tregs được quan sát giữa các nhóm điều trị (n = 5; Bài kiểm tra ANOVA Tukey một chiều), h–k Chuột được điều trị bằng Vacc MP có số lượng tế bào Tc, Tc1, Tc1 và Tc17 được kích hoạt và tăng sinh cao hơn đáng kể (n = 4; Bài kiểm tra ANOVA Tukey một chiều), l Tỷ lệ Tc1/Treg cao hơn đáng kể đã được quan sát thấy ở những con chuột được điều trị bằng Vacc MP so với nhóm đối chứng (n = 4; Kiểm định ANOVA Tukey một chiều). Dữ liệu được biểu diễn dưới dạng sai số trung bình ± tiêu chuẩn.
Vắc xin F16BP duy trì chức năng trao đổi chất của tế bào DC và tế bào T trong cơ thể
Để kiểm tra xem các tế bào DC hoặc T có duy trì chức năng trao đổi chất sau khi điều trị hay không, những con chuột có khối u đã được tiêu hủy và các tế bào từ các khối u, lá lách và LN bẹn được phân lập. Những tế bào này sau đó được nuôi cấy bằng 2NBDG và dòng chảy được sử dụng để xác định mức hấp thu của 2NBDG đại diện cho mức độ đường phân. Người ta quan sát thấy rằng trong khối u, gMFI của 2NBDG trong CD80 + DC và đại thực bào cao hơn đáng kể ở MP PFK15 + F16BP (polyIC) so với điều kiện chỉ PFK15, tuy nhiên, chúng không khác biệt đáng kể so với kiểm soát không điều trị (Hình XNUMX). S11a–g). Ở lá lách, gMFI của 2NBDG ở DC, CD80+ DC, nhưng không phải ở CD206+ DC cao hơn đáng kể ở chuột được điều trị bằng MP PFK15 + F16BP(polyIC) so với tất cả các đối chứng (Hình XNUMX). S11h–j). Những xu hướng này đã bị đảo ngược trong các đại thực bào được phân lập từ lá lách của chuột được điều trị bằng MP PFK15 + F16BP (polyIC) so với tất cả các đối chứng (Hình XNUMX). S11k–m). Những dữ liệu này cho thấy rằng một cách có hệ thống, các MP điều chế quá trình glycolysis được điều chế khác nhau của DC và đại thực bào. Trong các LN bẹn, gMFI của 2NBDG cũng được điều chỉnh lại trong các CD80+ DC được kích hoạt và CD206+ DC (Hình XNUMX). S11n–s). Do đó, xét nghiệm 2NBDG đã chứng minh rằng quá trình glycolysis DC và đại thực bào vẫn được duy trì trong khối u, lá lách và dẫn lưu LN bẹn. Một nghiên cứu tương tự đã được thực hiện đối với các tế bào T thích nghi để hiểu được độ dẻo glycolytic trong các tế bào này. Đáng chú ý, người ta quan sát thấy rằng các tế bào CD45- phân lập từ khối u có 2NBDG gMFI thấp hơn đáng kể ở chuột được điều trị bằng MP PFK15, PFK15+ F16BP + poly(IC) hòa tan và PFK15 + F16BP(polyIC) so với đối chứng không điều trị. (Quả sung. S12a). Dữ liệu này cho thấy MP hoặc các phần hòa tan của MP không thể điều chỉnh đáng kể quá trình glycolysis của các tế bào không miễn dịch hoặc các tế bào này có mức độ dẻo trao đổi chất cao hơn so với các tế bào miễn dịch. Hơn nữa, gMFI của 2NBDG trong các tế bào T-helper trong khối u không khác biệt đáng kể ở MP PFK15 + F16BP (polyIC) so với nhóm kiểm soát không điều trị và hai tình trạng này cao hơn đáng kể so với các nhóm đối chứng khác (Hình XNUMX). S12b). gMFI của 2NBDG trong tế bào T CD8 + trong khối u không khác biệt đáng kể ở MP PFK15 + F16BP (polyIC) so với nhóm đối chứng không điều trị (Hình XNUMX). S12c), nhưng cao hơn điều kiện F15BP + poly(IC) hòa tan PFK16+ hòa tan. Ở lá lách, không có sự khác biệt đáng kể được quan sát thấy ở các tế bào T CD4 +, tuy nhiên, các tế bào T CD8 + có 2NBDG gMFI cao hơn so với đối chứng ở chuột được điều trị bằng MP PFK15 + F16BP(polyIC), nhưng không khác biệt so với đối chứng không điều trị (Quả sung. S12d, e). Ngoài ra, trong các hạch bạch huyết bẹn, chuột được điều trị bằng MP PFK15 + F16BP (polyIC) đã giảm 2NBDG gMFI so với nhóm đối chứng không điều trị (Hình XNUMX). S12f, g). Xét nghiệm 2NBDG của tế bào T cho thấy rằng trong khối u, cả tế bào T CD4+ và CD8+ đều duy trì quá trình đường phân ngay cả sau khi nuôi cấy ex vivo và do đó có thể hỗ trợ các phản ứng chống khối u in vivo. Nhìn chung, những dữ liệu này đã chứng minh rằng các MP vắc xin cung cấp F16BP và có thể giải cứu các DC có thể tạo ra các phản ứng miễn dịch mạnh mẽ chống lại một dạng khối u ác tính hung hãn.
F16BP giải cứu quá trình trao đổi chất DC được chuyển giao nuôi dưỡng ở chuột
Ngoài chiến lược tiêm vắc xin dưới da, việc chuyển giao nuôi DC đã được thử nghiệm tại các phòng khám để điều trị ung thư tuyến tiền liệt.26,27,28. Tuy nhiên, những chiến lược này không thành công lắm ở các phòng khám một phần do hiệu quả thấp trong việc cải thiện khả năng sống sót. Để kiểm tra tính linh hoạt của hệ thống F16BP-PFK15, một mô hình u ác tính B16F10 tích cực khác đã được chọn và khả năng chuyển giao nuôi DC được nạp MP đã được sử dụng làm phương thức điều trị (Hình XNUMX). 4a). Trong mô hình này, các DC được nạp MP F16BP xen kẽ với mRNA được phân lập từ tế bào ung thư B16F10 và poly (IC) (Vacc DC) và được chuyển tiếp vào chuột chứa khối u B16F10. Khả năng điều chỉnh các phản ứng miễn dịch thích ứng, giảm sự phát triển của khối u và cải thiện khả năng sống sót của liệu pháp tế bào này đã được đo lường.
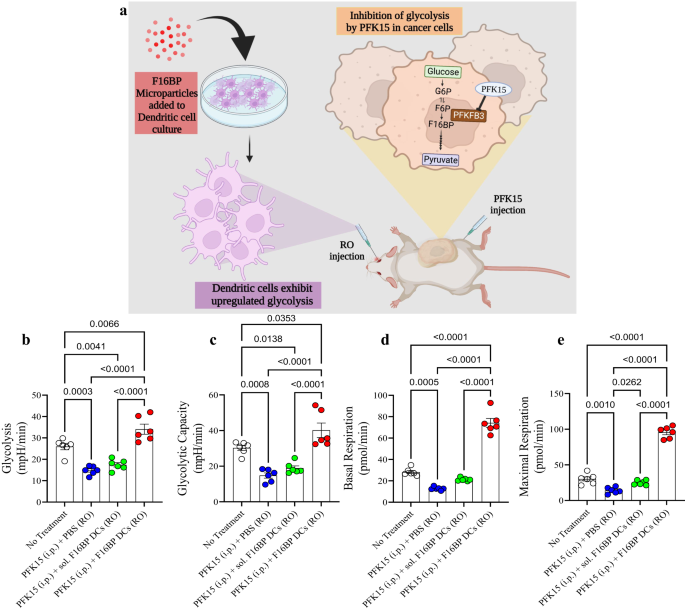
a Sơ đồ biểu diễn mô hình trị liệu tế bào nuôi dưỡng được sử dụng. b, c Những con chuột được tiêm DC được chuyển tiếp nuôi cùng với các MP F16BP có thể giải cứu khả năng phân giải đường và phân giải đường khỏi sự ức chế đường phân (PFK15), in vivo (n = 6; Bài kiểm tra ANOVA Tukey một chiều), d, e Chuột được tiêm DC được chuyển tiếp nuôi cùng với MP F16BP đã tăng tốc hô hấp cơ bản và tối đa ngay cả khi bị ức chế glycolytic (PFK15), in vivo (n = 6; Kiểm định ANOVA Tukey một chiều). Dữ liệu được biểu diễn dưới dạng sai số trung bình ± tiêu chuẩn.
Đầu tiên, để kiểm tra xem MP F16BP (không có poly (IC) hoặc mRNA) có thể giải cứu DC in vivo hay không, MP F16BP đã được nạp vào DC bằng cách ủ các hạt này với DC trong 2 giờ. Tiếp theo, các DC này được truyền tĩnh mạch ở chuột và PFK15 được tiêm trong màng bụng. DC được phân lập từ lá lách và các xét nghiệm thông lượng ngoại bào được thực hiện trên các tế bào này. Người ta hy vọng rằng các DC được phân lập từ lá lách này sẽ là hỗn hợp của cả DC lách nội sinh và DC được chuyển giao tiếp theo. Người ta quan sát thấy rằng các MP F16BP có thể giải cứu khả năng glycolysis và glycolytic của DC theo quan sát bằng các giá trị ECAR tăng lên khi có PFK15 so với các biện pháp kiểm soát (Hình XNUMX). 4b, c). Hơn nữa, các nghị sĩ F16BP cũng có thể giải cứu hô hấp cơ bản và tối đa của DC khi có PFK15, so với các biện pháp kiểm soát (Hình XNUMX). 4d, e). Dữ liệu này đã chứng minh rằng các hạt này không chỉ có thể giải cứu quá trình phân hủy đường và hô hấp của ty thể trong các tế bào này trong ống nghiệm mà còn cả in vivo và do đó có thể tạo ra các phản ứng trị liệu miễn dịch chức năng.
Giải cứu trao đổi chất của DC tạo ra liệu pháp miễn dịch tế bào nuôi dưỡng mạnh mẽ
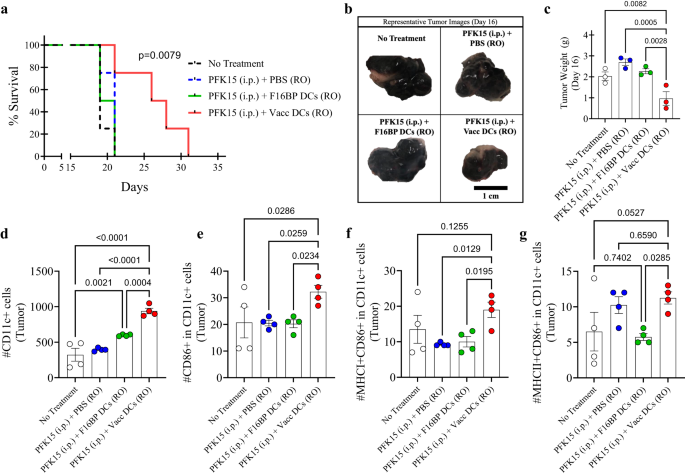
Để kiểm tra xem liệu việc giải cứu trao đổi chất ở DC có thể được áp dụng cho liệu pháp tế bào nuôi dưỡng hay không, việc chuyển giao nuôi dưỡng vắc xin DC đã được thử nghiệm trên chuột (Hình XNUMX). S13). Đầu tiên, trong ống nghiệm, người ta xác định rằng PFK15 có hiệu quả trong việc ngăn chặn sự tăng sinh của tế bào ung thư B16F10 (Hình XNUMX). S14). Cụ thể là 0.75 × 106 Các tế bào B16F10 được tiêm vào chuột có hệ miễn dịch bình thường C57BL/6j và PFK15 được tiêm cách ngày trong suốt thời gian nghiên cứu (Hình XNUMX). S13). Ngoài ra, các DC ex vivo được nạp F16BP(mRNA+poly(IC)) (Vacc DC) hoặc DC được nạp F16BP MP đã được chuyển tiếp bằng cách sử dụng phương pháp tiêm quỹ đạo retro (RO) vào ngày 6 và 19 (Hình XNUMX). S13). Người ta quan sát thấy rằng khả năng sống sót của những con chuột nhận Vacc DC + PFK15 tăng lên đáng kể so với tất cả các đối chứng và khối u phát triển chậm hơn ở những con chuột nhận Vacc DC so với đối chứng (Hình XNUMX). 5a; S15). Dữ liệu này được chứng thực thêm bằng trọng lượng khối u và hình ảnh thu được vào nửa điểm của nghiên cứu vào ngày 16 (Hình XNUMX). 5b, c). Những dữ liệu này chỉ ra rằng chỉ sau hai lần tiêm Vacc DC, đã có phản ứng mạnh mẽ chống lại khối u, sau đó làm giảm sự phát triển của khối u ở chuột.
a Đường cong Kaplan–Meir cho thấy khả năng sống sót cao hơn đáng kể của những con chuột được điều trị bằng Vacc MP được chuyển giao nuôi dưỡng (n = 10, p <0.001), b Hình ảnh khối u đại diện của các nhóm điều trị khác nhau vào ngày 16. c Chuột được điều trị bằng Vacc DC được chuyển nuôi có trọng lượng khối u thấp hơn đáng kể so với các nhóm điều trị khác, in vivo (n = 3; Kiểm định ANOVA Tukey một chiều). d, e Tổng số DC cũng như DC được kích hoạt cao hơn đáng kể đã được quan sát thấy ở những con chuột được điều trị bằng Vacc DC được chuyển nuôi so với các nhóm điều trị khác, in vivo (n = 4; Kiểm định ANOVA Tukey một chiều). f Các DC kích hoạt MHCI+ cao hơn đáng kể đã được quan sát thấy ở những con chuột được điều trị bằng Vacc DC được chuyển tiếp nuôi so với các nhóm điều trị khác, in vivo (n = 4; Kiểm định ANOVA Tukey một chiều). g Các DC được kích hoạt MHCII+ cao hơn đáng kể đã được quan sát thấy ở những con chuột được điều trị bằng các DC Vacc được chuyển tiếp nuôi so với các DC F16BP, in vivo (n = 4; Kiểm định ANOVA Tukey một chiều). Dữ liệu được biểu diễn dưới dạng sai số trung bình ± tiêu chuẩn.
Tiếp theo, để kiểm tra xem Vacc DC có thể điều chỉnh các phản ứng miễn dịch sau khi sử dụng hay không, vào ngày 16, lá lách, hạch bạch huyết và khối u được phân lập từ các tình trạng khác nhau và nhuộm màu để xác định hồ sơ kích hoạt của DC và tế bào T. Người ta quan sát thấy rằng tổng số DC và DC được kích hoạt trong các khối u đối với Vacc DC cao hơn đáng kể so với tất cả các biện pháp kiểm soát (Hình XNUMX). 5d, e). Hơn nữa, Vacc DC cũng điều chỉnh tăng số lượng DC có MHCI + CD86 + CD11c+ trong khối u so với các nhóm điều trị khác, cho thấy Vacc DC hỗ trợ kích hoạt DC in vivo (Hình XNUMX). 5f). Ngoài ra, Vacc DC cũng điều chỉnh tăng số lượng DC có MHCII + CD86 + CD11c+ trong khối u so với các DC F16BP được chuyển tiếp nuôi, cho thấy Vacc DC nghiêng về các phản ứng liên quan đến MHCII trong cơ thể (Hình XNUMX). 5g). Những dữ liệu này chỉ ra rằng quá trình glycolysis có thể cần thiết để DC có khả năng xâm nhập vào lá lách và khối u, và MP F16BP cung cấp khả năng cho DC để xảy ra quá trình glycolysis.
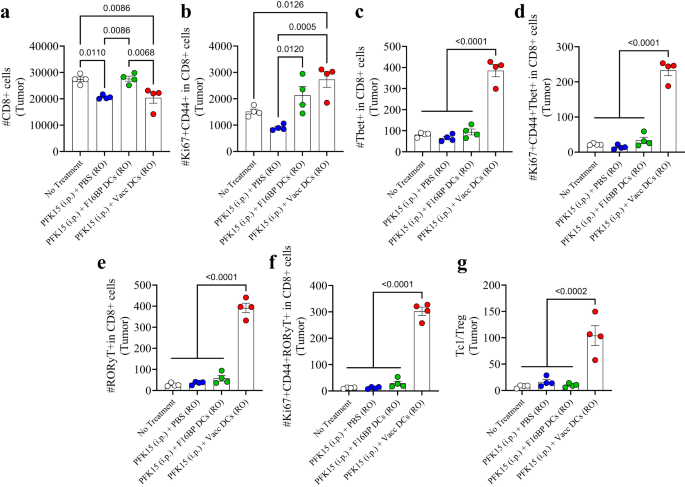
Các phản ứng của tế bào T thích nghi trong khối u bị lệch về phía các phản ứng gây viêm (Hình XNUMX). 6a–g; S16). Người ta quan sát thấy rằng chỉ riêng việc điều trị PFK15 đã làm giảm đáng kể tổng số tế bào T CD8 + trong khối u và các DC được nạp F16BP có thể đưa con số này bằng với mức kiểm soát không điều trị (Hình XNUMX). 6a). Với số lượng tế bào T CD8+ này, người ta quan sát thấy rằng có sự gia tăng gấp 2-3 lần số lượng tế bào T được kích hoạt và tăng sinh (Ki67+CD44+ trong CD8+) trong khối u ở nhóm Vacc DC so với nhóm đối chứng (Hình XNUMX). 6b). Hơn nữa, lượng Tbet+ gây độc tế bào trong tế bào T CD4+ (Tc8) tăng đáng kể gấp 1 lần trong nhóm Vacc DC so với tất cả các nhóm khác (Hình XNUMX). 6c). Hơn nữa, số lượng tế bào Tc1 được kích hoạt và tăng sinh cao hơn> 10 lần trong nhóm Vacc DC so với tất cả các điều kiện điều trị khác (Hình XNUMX). 6d). Tương tự, số lượng tế bào Tc17 (RORγt+ trong CD8+), và Tc17 được kích hoạt và tăng sinh (RORγt+Ki67+CD44+ trong CD8+), đang nổi lên như một loại tế bào gây viêm quan trọng gây chết tế bào ung thư, cũng >10- gấp cao hơn đáng kể so với mức kiểm soát trong các khối u (Hình XNUMX). 6e, f). Ngoài quần thể Tc, Vacc DC còn dẫn đến giảm số lượng tế bào T-helper (Th), tế bào Th được kích hoạt và tăng sinh, Th1 (Tbet+ trong CD4+), Th2 (GATA3+ trong CD4+), Th1 được kích hoạt và tăng sinh (Tbet+CD44+Ki67+ trong CD4+), và số lượng tế bào Th2 được kích hoạt và tăng sinh (GATA3+CD44+Ki67+ trong CD4+) trong nhóm Vacc DC (Hình XNUMX). S16). Có sự giảm đáng kể về số lượng Treg (CD25+Foxp3+ trong CD4+) trong khối u ở chuột được điều trị bằng Vacc DC so với chuột không được điều trị (Hình XNUMX). S16). Hơn nữa, có sự gia tăng đáng kể về Th17 (RORγt+ trong CD4 + ) và các tế bào Th17 được kích hoạt và tăng sinh (RORγt+Ki67+CD44+ trong CD4+) trong khối u ở chuột được điều trị bằng Vacc DC so với tất cả các nhóm khác (Hình XNUMX). . S16). Hơn nữa, tỷ lệ tế bào Tc1 và tế bào Treg cao gấp 5–10 lần trong khối u của chuột được điều trị bằng Vacc DC so với nhóm chứng (Hình XNUMX). 6g). Những dữ liệu này cho thấy rằng Vacc DC có thể tạo ra phản ứng miễn dịch thích ứng mạnh mẽ chống lại các khối u, điều này có thể chủ yếu được thúc đẩy bởi sự gia tăng quần thể tế bào Tc1 và Tc17.
a, b Sự biến đổi đáng kể của tổng số tế bào (CD8+) cũng như các tế bào T gây độc tế bào được kích hoạt và tăng sinh (Ki67+CD44+ trong CD8+) đã được quan sát thấy ở những con chuột được điều trị bằng Vacc DC được chuyển tiếp nuôi so với các nhóm điều trị khác, in vivo (n = 4; Kiểm định ANOVA Tukey một chiều). c–f Tổng Tc1 cao hơn đáng kể (Tbet+ trong CD8+), Tc1 được kích hoạt và tăng sinh (Tbet+Ki67+CD44+ trong CD8+), tổng Tc17 (RORɣT+ trong CD8+), Tc17 được kích hoạt và tăng sinh (RORɣT+Ki67+CD44+ trong CD8+) đã được quan sát thấy ở những con chuột được điều trị với các Vacc DC được chuyển tiếp nuôi so với các nhóm điều trị khác, in vivo (n = 4; Kiểm định ANOVA Tukey một chiều). g Tỷ lệ gây độc tế bào so với tế bào T điều hòa (Tc1/Treg) cao hơn đáng kể đã được quan sát thấy ở những con chuột được điều trị bằng Vacc DC được chuyển nuôi nuôi so với các nhóm điều trị khác, in vivo (n = 4; Kiểm định ANOVA Tukey một chiều). Dữ liệu được biểu diễn dưới dạng sai số trung bình ± tiêu chuẩn.
Vì Vacc DC được sử dụng một cách có hệ thống nên các hạch bạch huyết ở lách và cổ cũng được phân tích về những thay đổi trong phản ứng miễn dịch bẩm sinh và thích nghi (Hình XNUMX). S17–S20). Đáng chú ý, tần số chung của DC (CD11c+) và DC kích hoạt (MHCII+CD86+ trong CD11c+, MHCI+CD86+ trong CD11c+, CD86+ trong CD11c+, MHCI+ trong CD11c+, MHCII+ trong CD11c+) ở lá lách cao hơn đáng kể so với đối chứng; tuy nhiên, sự khác biệt này không được quan sát thấy ở các hạch bạch huyết cổ (Hình XNUMX). S17 và S18). Những phát hiện này cho thấy rằng việc chuyển giao DC chủ yếu tạo ra phản ứng miễn dịch bằng cách điều chỉnh các phản ứng miễn dịch bẩm sinh ở lá lách. Ngược lại với khối u, người ta quan sát thấy rằng ở lá lách, tần số Th17 ở các nhóm Vacc DC giảm đáng kể so với tất cả các nhóm đối chứng (Hình XNUMX). S19), tần số Th2 tăng đáng kể so với tất cả các điều khiển (Hình XNUMX). S19) và tần số Tc17 giảm đáng kể so với chỉ riêng PFK15 và các điều khiển DC PFK15 + F16BP (Hình XNUMX). S20). Những phát hiện này chỉ ra rằng mặc dù Vacc DC được sử dụng một cách có hệ thống, nhưng các phản ứng miễn dịch thích ứng gây viêm chủ yếu được tìm thấy trong khối u chứ không phải ở lá lách. Ngoài ra, Vacc DC được phân lập từ lá lách của chuột cũng duy trì ECAR và OCR cao hơn so với nhóm đối chứng (Hình XNUMX). S21). Để kiểm tra xem thành phần F16BP của công thức có quan trọng trong việc tạo ra các phản ứng miễn dịch bẩm sinh và thích nghi hay không. DC được nạp mRNA hòa tan + poly hòa tan (IC) đã được tiêm vào chuột theo quỹ đạo ngược và các phản ứng miễn dịch bẩm sinh và thích nghi được tạo ra trong iLN, lá lách và các khối u đã được thử nghiệm và so sánh với đối chứng không điều trị. Người ta nhận thấy rằng để tăng khả năng gây viêm cả DC và phản ứng tế bào T, F16BP được nạp trong DC là rất cần thiết, vì không có sự khác biệt đáng kể nào được quan sát thấy giữa kiểm soát không điều trị và DC được nạp mRNA hòa tan + poly (IC) hòa tan trong các cơ quan này (Quả sung. S22).
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Ô tô / Xe điện, Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- PlatoSức khỏe. Tình báo thử nghiệm lâm sàng và công nghệ sinh học. Truy cập Tại đây.
- ChartPrime. Nâng cao trò chơi giao dịch của bạn với ChartPrime. Truy cập Tại đây.
- BlockOffsets. Hiện đại hóa quyền sở hữu bù đắp môi trường. Truy cập Tại đây.
- nguồn: https://www.nature.com/articles/s41467-023-41016-z