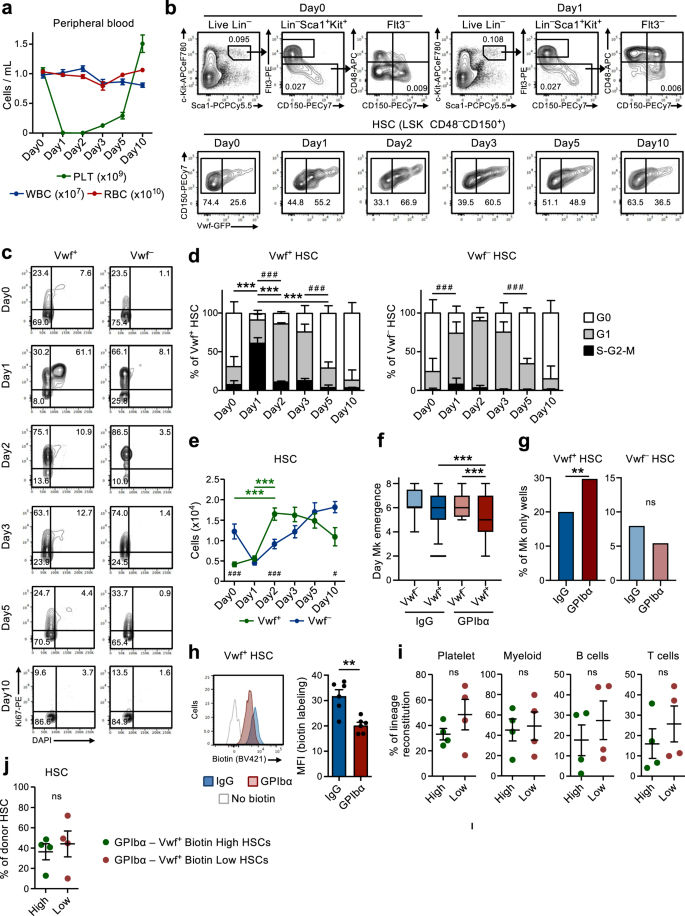
Sự suy giảm tiểu cầu cấp tính nhanh chóng thu hút các HSC không hoạt động vào sự tăng sinh
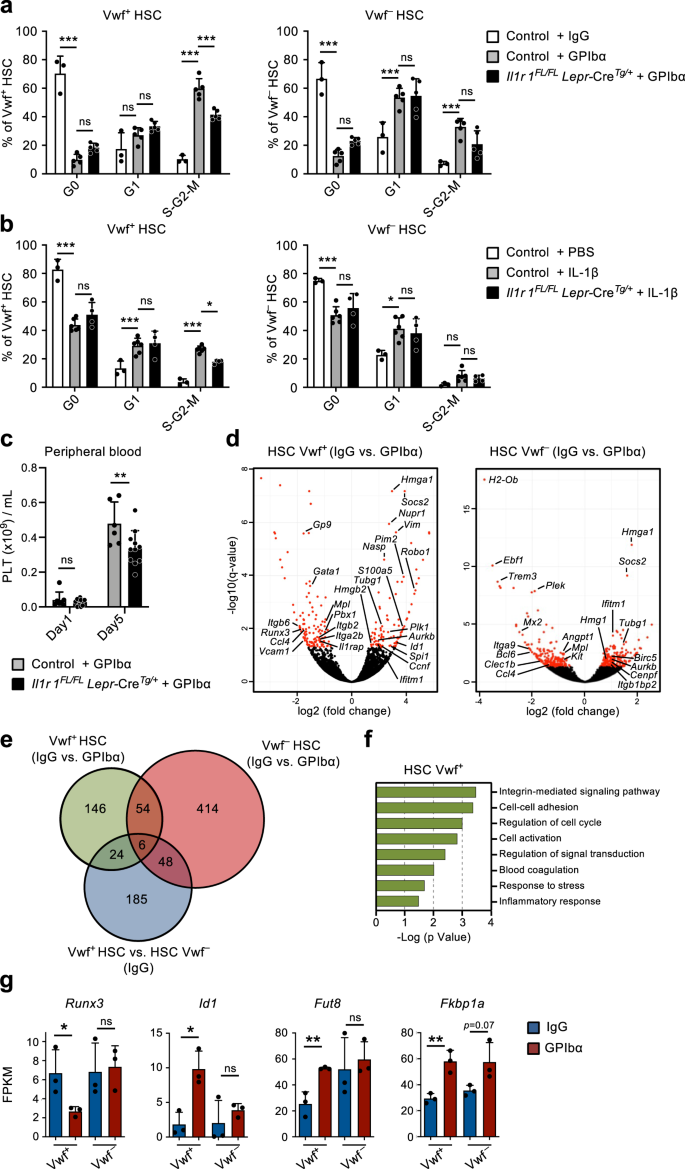
Phù hợp với các nghiên cứu trước đây9, tiêm một liều kháng thể kháng GPIbα duy nhất để vwf-GFP, để bắt chước tình trạng giảm tiểu cầu quan sát thấy ở những bệnh nhân mắc bệnh ban xuất huyết giảm tiểu cầu miễn dịch (ITP), làm cạn kiệt tiểu cầu nhanh chóng và hiệu quả trong vòng 1 ngày mà không ảnh hưởng đáng kể đến các dòng tế bào máu khác (Hình XNUMX). 1a). Điều này đi kèm với sự kích hoạt chu kỳ tế bào nhanh chóng (trong vòng 1 ngày) của Lin–sc1+c-Bộ+ (LSK) Flt3–CD48–CD150+ HSC. Việc tuyển dụng vào chu kỳ tế bào hoạt động được ưu tiên quan sát trong vòng vwf-GFP+ (Vwf+) Khoang HSC (Hình. 1b–d), được làm giàu trong HSC thiên vị tiểu cầu nhưng chủ yếu chứa HSC tái tạo đa dòng9,18. Trong khi hơn 60% Vwf+ LSKFlt3–CD48–CD150+ HSC bước vào giai đoạn S-G2-M của chu kỳ tế bào, chỉ một phần nhỏ vwf-GFP– (Vwf–) HSC đã nhập S-G2-M. Tuy nhiên, hầu hết Vwf– HSC đã chuyển từ giai đoạn không hoạt động (G0) sang giai đoạn G1 được kích hoạt nhiều hơn (Hình XNUMX). 1c, d).
(Liên quan đến Hình bổ sung. 1 và 2). a Phân tích động học của các thông số tế bào máu ngoại vi sau khi sử dụng kháng thể kháng GPIbα. Chuột ngày 0 được điều trị bằng kháng thể kiểm soát kiểu mẫu IgG. Dữ liệu đại diện cho giá trị trung bình ± SEM của chuột 10 (Ngày0), 13 (Ngày 1), 10 (Ngày 2), 9 (Ngày 3), 8 (Ngày 5) và 7 (Ngày 10) từ 14 thí nghiệm độc lập. Tiểu cầu PLT, bạch cầu WBC, hồng cầu RBC. b Hồ sơ FACS đại diện và chiến lược chọn lọc của vwf-GFP+ (Vwf+) Và vwf-GFP– (Vwf–) LSKFlt3–CD150+CD48– HSC tại thời điểm được chỉ định sau khi cạn kiệt tiểu cầu. Các số trong cổng / góc phần tư biểu thị tần số (trung bình của tất cả các con chuột được phân tích) của quần thể tế bào được kiểm soát trong tổng số tế bào sống (bảng trên) hoặc giữa các HSC (bảng dưới). c, d Phân tích chu kỳ tế bào của Vwf+ và Vwf– LSKFlt3–CD150+CD48– HSC tại thời điểm được chỉ định sau khi tiểu cầu cạn kiệt. c Hồ sơ FACS chu kỳ tế bào đại diện của Vwf+ (trái) và Vwf– (phải) HSC trong G0 (DAPI–ki67–) G1 (DAPI–ki67+) hoặc S-G2-M (DAPI+ki67+) các giai đoạn của chu kỳ tế bào. Các số trong cổng biểu thị tần số (trung bình của tất cả các con chuột được phân tích) của tổng số HSC. d Phân bố pha chu kỳ tế bào trung bình ± SD của Vwf+ (trái) và Vwf– (phải) HSC. Dữ liệu từ chuột 5 (Ngày0), 5 (Ngày1), 3 (Ngày2), 5 (Ngày3), 5 (Ngày5) và 4 (Ngày10) từ 6 thí nghiệm độc lập. ***p <0.001; **p < 0.01 đối với phần chu kỳ tế bào S-G2-M; # # #p < 0.001 đối với phần chu kỳ tế bào G1 (cả hai đều sử dụng ANOVA 2 chiều với nhiều phép so sánh của Tukey); e Số tuyệt đối của Vwf+ và Vwf– HSC (mỗi 2 chân, xem phương pháp). Dữ liệu trung bình ± SEM của 8 (Ngày0), 8 (Ngày1), 7 (Ngày2), 5 (Ngày3), 6 (Ngày5) và 5 (Ngày10) từ 9 thí nghiệm độc lập. ***p < 0.001 đối với Vwf+ HSC (ANOVA 2 chiều với nhiều so sánh của Tukey); #p <0.05 và # # #p < 0.001 để so sánh Vwf+ so với Vwf– HSC (ANOVA 2 chiều với nhiều so sánh của Sidak). Thời điểm xuất hiện của Mk đầu tiên (f) và tần số khuẩn lạc chỉ có tế bào Mk (g) trong Vwf đơn nuôi cấy–hoặc Vwf+ HSC được phân lập từ chuột sau 16 giờ điều trị bằng IgG hoặc GPIbα. Dữ liệu từ 138, 364, 147 và 451 khuẩn lạc có nguồn gốc từ tế bào đơn được phân tích lần lượt từ 5 lần sao chép sinh học trong 4 thí nghiệm độc lập. f Đường giữa biểu thị phần trung vị, giới hạn ô biểu thị phần trăm 25–75, phần râu đánh dấu phần trăm 5–95. Các ô nằm ngoài phần trăm 5–95 được đánh dấu là các ngoại lệ. P các giá trị được tính toán bằng phép thử Kruskal–Wallis với nhiều phép so sánh của Dunn. g P giá trị được tính bằng phép thử chính xác Fisher hai phía. ***p <0.001; **p < 0.01; *p < 0.05; ns, không đáng kể (p > 0.05). h Phân tích tăng sinh biotin của vwf-GFP+ HSC 2 ngày sau điều trị bằng IgG hoặc GPIbα. Biểu đồ đại diện (trái) và giá trị trung bình ± SD MFI (được chuẩn hóa cho MFI của Không kiểm soát ghi nhãn biotin; phải) từ 6 con chuột trong mỗi nhóm trong 3 thí nghiệm độc lập. **p < 0.01; được tính bằng t-test hai phía. Sự phục hồi lâu dài (16 tuần) của các dòng tế bào tiểu cầu, tủy và bạch huyết trong máu (i) và của ngăn BM HSC (j) bởi biotin cao và biotin thấp vwf-GFP+ Phân số HSC 2 ngày sau khi tiểu cầu cạn kiệt. 50 tế bào được cấy cho mỗi con chuột. Dữ liệu đại diện cho giá trị trung bình ± SEM của 4 nhà tài trợ trong 2 thí nghiệm độc lập. Mỗi dấu chấm đại diện cho giá trị trung bình của 2 con chuột nhận được cấy ghép cho mỗi người hiến. ns, không đáng kể (p > 0.05); được tính bằng t-test hai phía. Xem thêm Hình bổ sung. 1 và 2.
Tiếp theo, chúng tôi tìm cách khám phá thêm cơ sở cơ học để kích hoạt HSC được quan sát thấy sau khi cạn kiệt tiểu cầu. Kháng thể kháng GPIbα liên kết với GPIbα (CD42b), thụ thể của trombin và VWF19, dẫn đến hoạt hóa tiểu cầu, khử sialyl và sau đó thanh thải tiểu cầu theo cách độc lập với thụ thể Fc20. GPIbα được biểu hiện cụ thể trong dòng tiểu cầu megakaryocytic (Mk), bao gồm cả MkP, nhưng quan trọng đối với các nghiên cứu của chúng tôi và như những người khác đã báo cáo trước đây21, biểu thức GPIbα hầu như không thể phát hiện được trên HSC (Hình bổ sung. 1a). Sau sự suy giảm tiểu cầu ban đầu, số lượng tiểu cầu dần hồi phục, với số lượng tiểu cầu bình thường được thiết lập lại trong khoảng thời gian từ ngày thứ 5 đến ngày thứ 10 sau khi cạn kiệt (Hình XNUMX). 1a). Đáng chú ý, sự suy giảm tiểu cầu này đã khiến số lượng Vwf tăng gấp 4 lần.+ LSKFlt3–CD48–CD150+ HSC trước 2 ngày, trong khi Vwf– HSC tăng với động học chậm hơn sau lần giảm ban đầu (Hình XNUMX). 1e). Sau đó, Vwf+/Vwf– Tỷ lệ HSC và số lượng tuyệt đối dần trở lại bình thường, đồng thời với việc bình thường hóa số lượng tiểu cầu (Hình XNUMX). 1a, e). Sự gia tăng của Vwf+ HSC cũng đi kèm với sự gia tăng có chọn lọc về số lượng LSK Flt3–CD48+CD150+ tập hợp con của MPP (Hình XNUMX). 1b và Hình bổ sung. 1b) được chứng minh là có độ lệch Mk22. Hơn nữa, MkP23 cũng tăng đáng kể vài ngày sau khi Vwf tăng+ HSC, trong khi các tiền thân erythroid (Pre-CFU-E) và myeloid (GMP) không bị ảnh hưởng đáng kể (Hình bổ sung. 1c, d). Đáng chú ý, mặc dù chúng có biểu hiện GPIbα mạnh mẽ và phù hợp với cơ chế không phụ thuộc vào Fc mà kháng thể này dẫn đến sự suy giảm tiểu cầu.20, MkP ban đầu giảm nhẹ (mặc dù không đáng kể) trong khi Mks không bị cạn kiệt trong BM khi sử dụng kháng thể (Hình bổ sung. 1d–g). Sau khi kích hoạt ban đầu nhanh chóng, HSC nhanh chóng trở lại trạng thái không hoạt động với sự phân bố pha chu kỳ tế bào bình thường được quan sát thấy sau 5 ngày suy giảm tiểu cầu (Hình XNUMX). 1c, d). Một kháng thể đơn dòng thay thế (NIT E)20 tiểu cầu cạn kiệt và Vwf được kích hoạt+ và Vwf– Chu kỳ tế bào HSC theo cách tương tự như kháng thể kháng GPIbα (Hình bổ sung. 2a, b). Điều trị bằng kháng thể GPIbα đi kèm với tình trạng lách to nhẹ và thoáng qua với số lượng Vwf tăng lên+ nhưng không phải Vwf– HSC ở lá lách (Hình bổ sung. 2c, d).
Việc tuyển dụng LSKFlt3 không hoạt động–CD48–CD150+ Các tế bào BM tăng sinh khi kích hoạt và suy giảm tiểu cầu cấp tính cho thấy sự tồn tại của một cơ chế phản hồi trong đó các HSC không hoạt động được tuyển dụng để thiết lập lại cân bằng nội môi Mk và tiểu cầu. Để điều tra xem liệu HSC từ chuột bị suy giảm tiểu cầu có hiệu quả hơn trong việc tạo ra Mks hay không, chúng tôi đã sử dụng xét nghiệm biệt hóa in vitro Mk/GM đơn bào. Tính nhân bản của Vwf đơn+ hoặc Vwf– LSKFlt3–CD48–CD150+ HSC được phân lập từ chuột trong cân bằng nội môi (IgG) hoặc sau khi suy giảm tiểu cầu (GPIbα) là tương tự (~ 80%; Hình bổ sung. 2e). Tuy nhiên, Vwf đơn+ HSC phân lập từ chuột bị suy giảm tiểu cầu biệt hóa thành Mks nhanh hơn Vwf– HSC từ chuột bị suy giảm tiểu cầu hoặc Vwf+ HSC phân lập từ chuột trong cân bằng nội môi (Hình XNUMX). 1f) và cũng tạo ra số lượng khuẩn lạc cao hơn chỉ bao gồm Mks (Hình XNUMX). 1g và Hình bổ sung. 2f,g). Các tổ tiên được cam kết bằng Mk giống như thân cây có kiểu hình giống HSC trước đây đã được chứng minh là có khả năng sinh sôi nảy nở để đáp ứng với tình trạng giảm tiểu cầu do poly(I:C) gây ra24. Vì vậy, để xác định rõ ràng hơn rằng LSKFlt3–CD48–CD150+ Các tế bào BM được tạo ra để sinh sôi nảy nở để đáp ứng với sự suy giảm tiểu cầu do kháng GPIbα gây ra bao gồm các HSC tái sinh lâu dài thực sự, chúng tôi đã sử dụng chuột H2B-mCherry doxycycline-cảm ứng (tet-ON)6,25. Trong hệ thống này, một xung điều trị doxycycline dẫn đến việc kết hợp các histon được gắn nhãn mCherry vào các nucleosome, chúng phân chia đồng đều giữa các tế bào con khi tế bào sinh sôi nảy nở. Phù hợp với phân tích chu kỳ tế bào (Hình XNUMX). 1c, d), sự suy giảm tiểu cầu do kháng GPIbα gây ra dẫn đến sự tăng sinh của HSC, bằng chứng là sự pha loãng nhãn mCherry tăng lên sau 3 ngày (Hình bổ sung. 2h). Điều quan trọng là FACS đã sắp xếp mCherrylo (tăng sinh) LSKFlt3–CD48–CD150+ các tế bào được sắp xếp từ những con chuột bị suy giảm tiểu cầu có khả năng phục hồi đa dòng lâu dài (LT; 16 tuần) in vivo (Hình bổ sung. 2i), chứng minh rằng sự suy giảm tiểu cầu do kháng GPIbα gây ra sẽ thu hút các LT-HSC mạnh vào sự tăng sinh. Để so sánh trực tiếp hơn Vwf+ Các HSC được kích hoạt hoặc duy trì ở trạng thái không tăng sinh sau khi tiểu cầu cạn kiệt, chúng tôi đã sử dụng phương pháp ghi nhãn không xâm lấn dựa trên việc tiêm dẫn xuất biotin N-hydroxilsulfosuccinimide (Biotin), phương pháp này dán nhãn hiệu quả cho các protein màng của tất cả các tế bào BM26. Khi tế bào phân chia, các protein màng được dán nhãn sẽ được phân bổ đều giữa các tế bào con cho phép phân tích lịch sử phân chia tế bào trong cơ thể. Tương tự, với mô hình H2B-mCherry, sự suy giảm tiểu cầu dẫn đến giảm khả năng gắn nhãn biotin của Vwf+ HSC (Hình. 1h) và cả Vwf– HSC (Hình bổ sung. 2j). Sự khác biệt quan sát được trong chu kỳ tế bào và phân tích tăng sinh của Vwf– HSC có thể phản ánh mối quan hệ phân cấp được mô tả trước đây giữa Vwf+ và Vwf– HSC9. Do đó, sự sinh sôi nảy nở của Vwf+ HSC có thể biệt hóa thành Vwf– HCS, chất mang lịch sử pha loãng nhãn biotin. Điều quan trọng là FACS đã sắp xếp Vwf+Biotinlo (tăng sinh) LSKFlt3–CD48–CD150+ các tế bào được sắp xếp từ những con chuột bị thiếu tiểu cầu (Hình bổ sung. 2k, tôi) có tiềm năng phục hồi đa dòng dài hạn (LT; 16 tuần) in vivo (Hình XNUMX). 1i), chứng minh rằng sự suy giảm tiểu cầu do kháng GPIbα gây ra sẽ thu hút các LT-HSC mạnh vào sự tăng sinh. Trong khi có khả năng bổ sung tiểu cầu, không có sự sai lệch tiểu cầu đáng kể nào được quan sát thấy ở Vwf+ HSC tăng sinh để đáp ứng với sự suy giảm tiểu cầu, so với HSC không tăng sinh (BiotinHi) Vwf+ HSC (Hình. 1i). Bất chấp điều đó, cả hai phần biotin của Vwf+ HSC đã thể hiện sự phục hồi LT-HSC tương tự (Hình XNUMX). 1j) và nhìn chung có hiệu quả như nhau trong việc tạo ra Vwf+ và Vwf– Các ngăn HSC (Hình bổ sung. 2m). Điều này phù hợp với việc các LT-HSC được xác định về mặt chức năng đang được tuyển dụng vào quá trình phổ biến và với thực tế là tỷ lệ tương đối của Vwf+ và Vwf– HSC phần lớn trở lại bình thường sau khi cân bằng nội môi được thiết lập lại (Hình XNUMX). 1b, e).
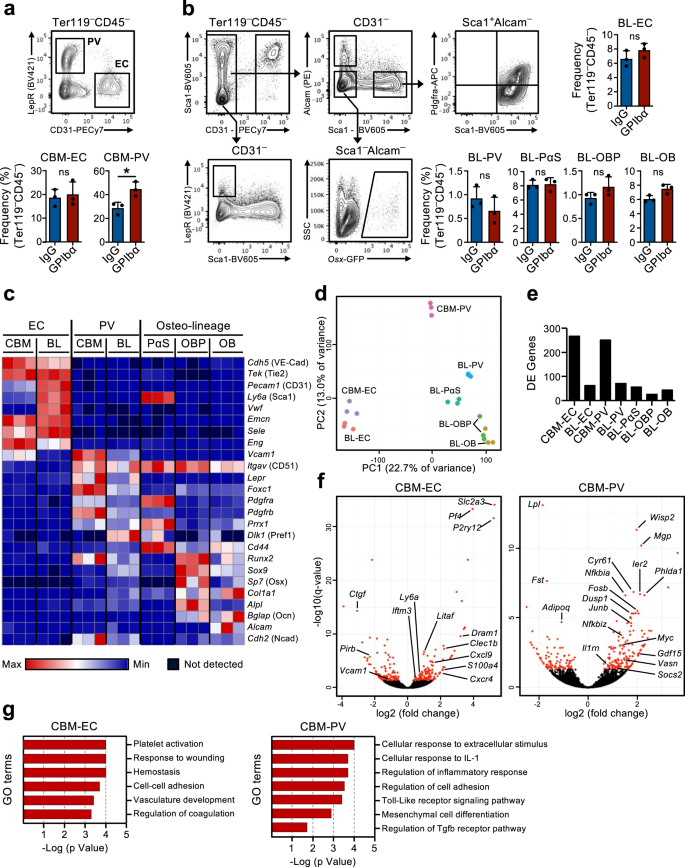
Lập trình lại phiên mã của hốc HSC để đáp ứng với sự suy giảm tiểu cầu cấp tính
Sự tồn tại của một cơ chế phản hồi trong đó các HSC không hoạt động được tuyển dụng vào quá trình tăng sinh để đáp ứng với sự suy giảm tiểu cầu ngụ ý rằng các HSC trong BM phải có khả năng cảm nhận được nhu cầu sản xuất tiểu cầu. Chúng tôi đã đưa ra giả thuyết rằng các tế bào hốc mô đệm trong tủy xương có thể tham gia vào quá trình này. Trên thực tế, những thay đổi trong hốc BM sau khi tiểu cầu cạn kiệt đã được đề xuất trước đây16,17 nhưng sự tham gia của các tế bào thích hợp cụ thể trong việc điều chỉnh chức năng HSC trong bối cảnh này chưa được chứng minh trực tiếp. Do đó, chúng tôi đã sử dụng phân tích trình tự RNA toàn cầu của các quần thể tế bào thích hợp BM cũng như HSC đặc trưng trước đó để nghiên cứu các tương tác phân tử có thể có giữa các tế bào này, liên quan đến phản ứng HSC đối với sự suy giảm tiểu cầu. Đối với điều này, các tế bào không tạo máu được phân lập từ hai mô tả27,28,29 các vùng giải phẫu riêng biệt trong BM: tế bào BM trung tâm (CBM) và tế bào lót xương (BL) (Hình bổ sung. 3a). Trong CD45–Ter119– các tế bào không tạo máu ở cả phân số BL và CBM, các quần thể tế bào thích hợp riêng biệt được xác định là CD31Hi tế bào nội mô (EC) và CD31–bệnh cùi+ tế bào quanh mạch máu (PV). Trong phần BL chúng tôi đã xác định thêm CD31–Alcam–Pdgfrα+sc1+ (PαS) tiền thân trung mô, cũng như CD31–Alcam–sc1–osx-GFP+ tiền thân nguyên bào xương (OBP) và CD31–Alcam+sc1– nguyên bào xương (OB) (Hình XNUMX). 2a, b). Phân tích tế bào học dòng chảy của các tế bào này được phân lập từ chuột trong cân bằng nội môi và 1 ngày sau khi cạn kiệt tiểu cầu không cho thấy những thay đổi lớn trong thành phần tế bào, bên cạnh sự gia tăng nhỏ nhưng đáng kể trong các tế bào CBM-PV (Hình XNUMX). 2a, b). Phân tích trình tự RNA cho thấy sự phân cụm rõ rệt của các quần thể nội mô, trung mô và HSC khác nhau (Hình bổ sung. 3b). Sự biểu hiện của các dấu hiệu đã biết xác định các quần thể tế bào thích hợp riêng biệt (Hình XNUMX). 2c và dữ liệu bổ sung 1) và, của các chất điều hòa tạo máu khác nhau được nhóm lại theo kiểu biểu hiện gen (Hình bổ sung. 3c và dữ liệu bổ sung 1), tiếp tục xác nhận danh tính tế bào riêng biệt của họ. Ngoài ra, phân tích thành phần chính (PCA) của các quần thể tế bào thích hợp cho thấy sự phân tách của các tế bào dòng nội mô và trung mô dọc theo trục thành phần chính (PC) 1 và, sự phân tách sâu hơn của các quần thể trung mô dọc theo trục PC2 dựa trên giai đoạn biệt hóa (Hình XNUMX). 2d). Phân tích biểu hiện gen khác biệt, so sánh các tế bào thích hợp được phân lập từ chuột trong cân bằng nội môi và sự suy giảm tiểu cầu sau 1 ngày, cho thấy số lượng lớn gen biểu hiện khác biệt (DE) trong các tế bào CBM-EC (266 gen) và CBM-PV (249 gen) (Hình XNUMX). . 2e, f và dữ liệu bổ sung 2, 3). Ngược lại, số lượng gen DE thấp hơn nhiều đã được phát hiện trong các quần thể thích hợp khác, bao gồm cả BL-EC và BL-PV liên quan đến xương tương ứng) (Hình XNUMX). 2e, f, Hình bổ sung. 3d, e và dữ liệu bổ sung 2–4), gợi ý sự tham gia thích hợp của CBM trong việc đáp ứng với tình trạng giảm tiểu cầu. Phân tích bản thể gen (GO) được thực hiện trên các gen DE từ CBM-EC nêu bật các quá trình sinh học liên quan đến hoạt hóa/đông máu tiểu cầu (Pf4, Clec1b, P2ry12), phản ứng với căng thẳng (Iftm3, Litaf, S100a4) và độ bám dính của tế bào (Vcam1, Ctgf) (Hình. 2g và dữ liệu bổ sung 5). Phân tích GO trên gen CBM-PV DE cho thấy các quá trình sinh học liên quan đến tình trạng viêm và đặc biệt là phản ứng của tế bào đối với Interleukin-1 (IL-1) gây viêm (Hình XNUMX). 2g và dữ liệu bổ sung 5). Các quá trình sinh học khác được nêu bật trong các tế bào CBM-PV là tín hiệu thụ thể giống Toll (TLR)-4, trong đó các đường truyền tín hiệu ở hạ lưu của thụ thể được chia sẻ một phần với tín hiệu IL-1, cũng như sự biệt hóa trung mô và tín hiệu TGFβ (Vasn, Fst, Wisp2, Cyr61) (Hình. 2f,g).
(Liên quan đến Hình bổ sung. 3). Các chiến lược phân tích và chọn lọc FACS để phân loại các tế bào nội mô và mô đệm trong tủy xương trung tâm (CBM; a) và màng xương (BL; b) ngăn tế bào của chuột sau 1 ngày suy giảm tiểu cầu (điều trị bằng kháng thể GPIbα). Chuột đối chứng nhận được kháng thể đối chứng isotype (IgG). Biểu đồ thanh biểu thị tần số trung bình ± SD (%) của từng quần thể tế bào trong tổng số CD45 không tạo máu–Ter119– tế bào. Dữ liệu được lấy từ 3 con chuột mỗi nhóm trong 3 (a) và 2 (b) các thí nghiệm độc lập. *p < 0.05; ns không đáng kể (p > 0.05); được đánh giá bằng t-test hai mặt. c–g Phân tích trình tự RNA của các khoang tế bào nội mô/mô đệm của chuột sau 1 ngày suy giảm tiểu cầu. c Biểu hiện (FPKM) của các gen đặc trưng cho các quần thể tế bào thích hợp khác nhau. d Phân tích thành phần chính của biểu hiện gen bình thường hóa của các quần thể tế bào khác nhau được nghiên cứu. e Số lượng gen biểu hiện khác nhau (DE) giữa chuột được điều trị bằng IgG và GPIbα (được điều chỉnh p giá trị (q)<0.05), trong mỗi quần thể tế bào thích hợp được điều tra. f Các lô núi lửa và g thuật ngữ bản thể gen (GO) phân tích các gen biểu hiện khác nhau trong các tế bào nội mô CBM (EC) và Lepr+ tế bào quanh mạch máu (PV). TRONG f, các chấm đỏ biểu thị gen DE đáng kể (q < 0.05. Đối với tất cả dữ liệu bảng biểu thị giá trị trung bình ± SD FPKM của 3 lần sao chép sinh học từ 2 thí nghiệm độc lập. Nguyên bào xương OB, tiền thân nguyên bào xương OBP, PαS Pdfgrα+sc1+ tiền thân trung mô. Xem thêm Hình bổ sung. 3.
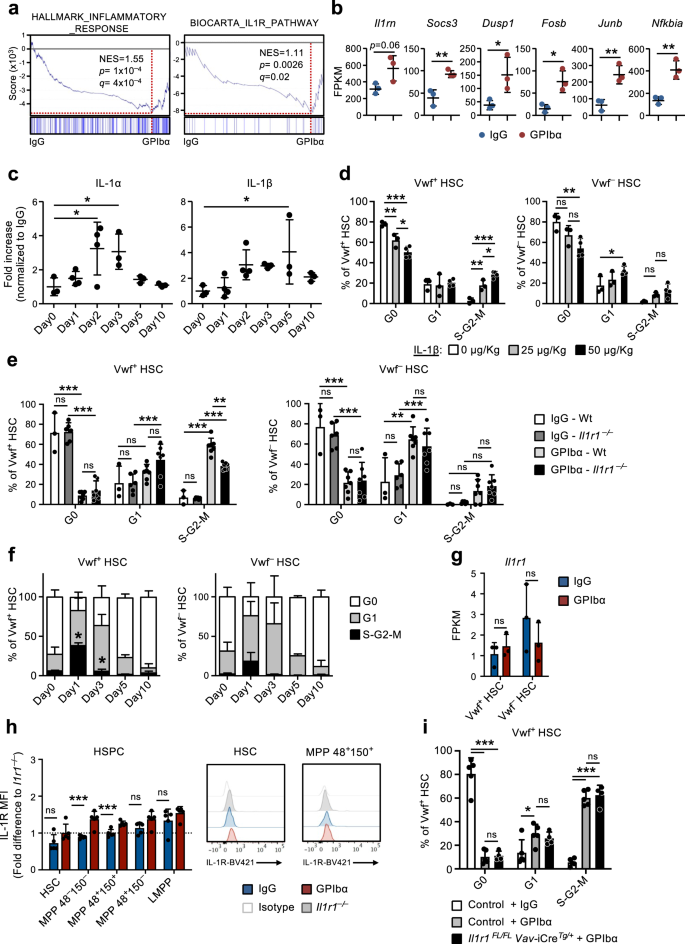
Tín hiệu IL-1 trong các tế bào không tạo máu rất quan trọng đối với phản ứng HSC đối với sự suy giảm tiểu cầu
Phân tích làm giàu bộ gen (GSEA) đã xác nhận sự làm giàu của các gen liên quan đến phản ứng viêm và tín hiệu thụ thể IL-1 được quan sát thấy trong các tế bào CBM-PV phân lập từ chuột được điều trị bằng GPIbα (Hình XNUMX). 3a). Những gen này bao gồm Il1rn (gen mục tiêu IL-1 và chất đối kháng đường truyền tín hiệu IL-1), Socs3 và dusp1 (bộ điều chỉnh đường truyền tín hiệu IL-1) và Fosb, rác rưởi và nfkbia (các thành phần của đường dẫn được kích hoạt ở hạ lưu tầng tín hiệu IL-1) (Hình XNUMX). 3b). Để nghiên cứu sâu hơn về vai trò của tình trạng viêm vô trùng trong quá trình này, chúng tôi đã phân tích mức độ của các cytokine gây viêm khác nhau trong dịch ngoại bào BM của chuột được điều trị bằng GPIbα. Phân tích này cho thấy mức độ suy giảm tiểu cầu sau IL-1α và IL-1β tăng lên đáng kể (Hình XNUMX). 3c), với động học song song với sự giãn nở và chuẩn hóa tiếp theo của Vwf+ HSC (Hình. 1e). Sự gia tăng ban đầu tương tự cũng được thấy ở TNFα mặc dù điều này được duy trì sau thời gian Vwf+ Trạng thái chu kỳ tế bào HSC đã bình thường hóa (Hình bổ sung. 4a). Các cytokine gây viêm khác phần lớn không thay đổi (IL-6 và IL-12) hoặc giảm ở giai đoạn sau (INFγ) sau khi suy giảm tiểu cầu (Hình bổ sung. 4a). Ở trạng thái ổn định, IL-1 được chứng minh chủ yếu được sản xuất bởi các tế bào T tuần hoàn (IL-1α) và bạch cầu hạt (IL-1β)30. Trong bộ dữ liệu của chúng tôi phân tích cả biểu thức IL-1 Il1a và Il1b hầu như không thể phát hiện được trong các quần thể tế bào thích hợp khác nhau cũng như trong HSC (Hình bổ sung. 4b), trong khi Mks chính (Hình bổ sung. 4c, d) cho thấy biểu hiện cao, đặc biệt là Il1a (Hình bổ sung. 4b).
(Liên quan đến Hình bổ sung. 5). a Phân tích làm giàu bộ gen (GSEA) của dữ liệu biểu hiện gen toàn cầu từ các tế bào CBM-PV cho các bộ gen được chỉ định. NES, điểm làm giàu chuẩn hóa (hoặc điểm tỷ lệ). b Biểu hiện của các gen liên kết với đường truyền tín hiệu IL-1 trong các tế bào CBM-PV sau 1 ngày suy giảm tiểu cầu. Dữ liệu đại diện cho giá trị trung bình ± SD FPKM của 3 lần sao chép sinh học từ 2 thí nghiệm độc lập. **p < 0.01; *p < 0.05 (t-test hai mặt). c Nồng độ trung bình ± SD của IL-1α và IL-1β trong dịch ngoại bào tủy xương phân lập từ chuột tại các thời điểm được chỉ định sau khi tiểu cầu bị suy giảm (điều trị bằng kháng thể GPIbα). Chuột đối chứng (Ngày 0) nhận được kháng thể kiểm soát isotype (IgG). Dữ liệu được lấy từ chuột 3 (Ngày0), 4 (Ngày1), 4 (Ngày2), 3 (Ngày3), 3 (Ngày5) và 3 (Ngày10) từ 4 thí nghiệm độc lập. *p < 0.05 (ANOVA 1 chiều với nhiều so sánh của Dunnett). d Phân tích chu kỳ tế bào của Vwf+ (trái) và Vwf– (phải) HSC từ chuột sau 1 ngày tiêm tĩnh mạch lượng IL-1β được chỉ định. Dữ liệu là trung bình ± SD của 3 con chuột nhận 0 hoặc 25 μg/Kg và 4 con chuột nhận 50 μg/Kg IL-1β, trong 2 thí nghiệm độc lập. Phân tích chu kỳ tế bào của Vwf+ (trái) và Vwf– (phải) HSC từ Wt và Il1r1- / - chuột 1 ngày (e) hoặc cho HSC từ Il1r1- / - chuột tại thời điểm được chỉ định (f) sau khi tiểu cầu cạn kiệt. e Dữ liệu trung bình ± SD từ 3 (IgG-Wt), 6 (IgG-Il1r1- / -) 7 (GPIbα -Wt) và 7 (GPIbα –Il1r1- / -) chuột từ 5 thí nghiệm độc lập. f Tần số trung bình ± SD từ chuột 6 (Ngày0), 7 (Ngày1), 3 (Ngày3), 3 (Ngày5) và 3 (Ngày10) trong 4 thí nghiệm độc lập. *p < 0.05 (so với cùng phân tích của Wt Vwf+ và Vwf– HSC trong hình. 1d). g, h Il1r1/Phân tích biểu thức IL-1R (h) ở cấp độ RNA theo trình tự RNA (FPKM) trong Vwf+ và Vwf– HSC và (i) ở mức protein bằng phương pháp tế bào học dòng chảy trong các tập hợp con HSPC, được phân lập từ chuột trong cân bằng nội môi hoặc suy giảm tiểu cầu sau 1 ngày. h Dữ liệu FPKM trung bình ± SD của 3 lần sao chép sinh học cho mỗi điều kiện. i Dữ liệu trung bình ± SD của cường độ huỳnh quang trung bình (MFI) được chuẩn hóa thành MFI của quần thể tế bào tương đương trong Il1r1- / - chuột được phân tích trong cùng một thí nghiệm. Dữ liệu được lấy từ 5 con chuột cho mỗi điều kiện, trong 2 thí nghiệm độc lập. i Phân tích chu kỳ tế bào của vwf-tdCà chua+ HSC từ chuột bị xóa có điều kiện Il1r1 trong tất cả các tế bào tạo máu (Il1r1FL/FL Vav-CreTg/+) 1 ngày sau khi tiểu cầu cạn kiệt. Kiểm soát bao gồm vwf-tdCà chua+ HSC từ Il1r1FL/+ Vav-CreTg/+, Il1r1+ / + Vav-CreTg/+ và ồ-Cre+ / + chuột (đại diện cho kiểu gen không bị mất chức năng IL-1R). Dữ liệu biểu thị tần số trung bình ± SD của 5 (control-IgG), 5 (control-GPIbα) và 4 (Il1r1FL/FL Vav-CreTg/+-GPIbα) từ 3 thí nghiệm độc lập. ***p <0.001; **p < 0.01; *p < 0.05; ns không đáng kể (p > 0.05); sử dụng t-test hai mặt (b, g, h) hoặc ANOVA 2 chiều với nhiều so sánh của Tukey (d–f, i). Xem thêm Hình bổ sung. 4.
Việc sử dụng IL-1 tái tổ hợp cho chuột dẫn đến việc kích hoạt chu kỳ tế bào của Vwf+ và Vwf– HSC (Hình. 3d), với Vwf+ HSC được tuyển dụng ở mức độ cao hơn vào giai đoạn S-G2-M của chu kỳ tế bào (Hình bổ sung. 4e), tương thích với IL-1 làm trung gian kích hoạt HSC để đáp ứng với tình trạng giảm tiểu cầu do kháng GPIbα gây ra. Để nghiên cứu cụ thể hơn về giả thuyết này, chúng tôi đã gây ra sự suy giảm tiểu cầu ở những con chuột thiếu IL-1R (Il1r1–/–), có ngăn HSC bình thường30 và số lượng tiểu cầu bình thường. Điều quan trọng là, Il1r1–/– chuột cho thấy tần suất đạp xe tích cực (S-G2-M) giảm đáng kể Vwf+ HSC sau khi cạn kiệt tiểu cầu (Hình XNUMX). 3e, f), so với chuột hoang dã (Wt) được xử lý bằng GPIbα. Sự thật là Il1r1 Sự thiếu hụt không loại bỏ hoàn toàn việc kích hoạt chu trình tế bào của HSC để đáp ứng với điều trị GPIbα cho thấy có liên quan đến các cơ chế khác (độc lập với IL-1). Đồng ý với điều này, trước đây chúng tôi đã cho thấy mức độ THPO tăng lên trong huyết thanh sau 1 ngày suy giảm tiểu cầu9. Để xác định các tín hiệu khác có khả năng phối hợp với IL-1 trong quá trình kích hoạt sự suy giảm tiểu cầu sau HSC, chúng tôi đã phân tích biểu hiện của các bộ điều chỉnh HSC đã biết, bao gồm tgfb1 và Pf4, trước đây có liên quan đến sự im lặng của HSC31,32; Và fgf1, trước đây liên quan đến sự tăng sinh HSC32. Phân tích trình tự RNA của các quần thể tế bào thích hợp riêng biệt cho thấy sự điều chỉnh tăng gấp 20 lần của Pf4 trong CBM-EC (Hình bổ sung. 4f), trong khi không có sự thay đổi nào trong biểu thức của tgfb1 và fgf1 đã được quan sát. Chúng tôi đã nghiên cứu thêm về mức độ protein của các chất điều hòa này trong tình trạng suy giảm tiểu cầu sau dịch ngoại bào BM. Theo phân tích biểu hiện gen, nồng độ TGFβ1 và FGF1 không bị thay đổi, nhưng PF4 đã tăng đáng kể sau 1 ngày suy giảm tiểu cầu qua trung gian GPIbα (Hình bổ sung. 4g). Với vai trò được mô tả trước đây của PF4 trong việc tạo ra sự im lặng của HSC31,33, mức độ PF4 tăng lên được quan sát thấy trong dịch ngoại bào BM khó có thể giải thích được sự kích hoạt của sự suy giảm tiểu cầu sau tăng sinh HSC.
Giải trình tự RNA cho thấy mức độ rất thấp (≈1 FPKM) của Il1r1 bảng điểm trong HSC (Hình XNUMX). 3g). Phân tích tế bào học dòng chảy cho thấy mức protein IL-1R không thể phát hiện được trên HSC và mức thấp trên một số tập hợp con MPP (Hình XNUMX). 3h và Hình bổ sung. 5a). Ngoài việc thiếu biểu hiện IL-1R có thể phát hiện được, không có gen liên quan đến tín hiệu IL-1 nào được điều hòa trong CBM-PV được phát hiện là được điều hòa trong Vwf+ hoặc Vwf– HSC sau điều trị GPIbα (Hình bổ sung. 5b). Mặc dù chúng tôi không quan sát thấy biểu hiện IL-1R có thể phát hiện được trong các HSC được xác định kiểu hình, IL-1 trước đây đã được đề xuất để kích hoạt HSC30. Do đó, để điều tra xem IL-1 có thể trực tiếp làm trung gian cho việc kích hoạt HSC sau giảm tiểu cầu do kháng GPIbα gây ra hay không, chúng tôi đã gây ra sự suy giảm tiểu cầu trong Il1r1FL/FL ồ-iCreTg/+ chuột nhắm mục tiêu xóa Il1r1 đến tất cả các tế bào tạo máu, bao gồm cả HSC. Phân tích PCR kỹ thuật số giọt của Vwf+ và Vwf– HSC xác nhận hiệu suất loại bỏ >99% Il1r1 các alen nổi bởi Vav-iCre ở cả Vwf+ và Vwf– Các tập hợp con HSC (Hình bổ sung. 5c). Trái ngược với những gì chúng tôi quan sát thấy ở dòng mầm Il1r1–/– chuột (Hình. 3e, f), Il1r1FL/FL ồ-iCreTg/+ chuột cho thấy sự kích hoạt chu trình tế bào do GPIbα gây ra hiệu quả tương đương của Vwf+ HSC như ở chuột Wt (Hình XNUMX). 3i). Cùng với nhau, những kết quả này chứng minh rằng tín hiệu IL-1R trực tiếp thông qua HSC hoặc các tế bào tạo máu khác không liên quan đến việc kích hoạt chu kỳ tế bào riêng biệt của HSC để đáp ứng với sự suy giảm tiểu cầu và thay vào đó cho thấy vai trò của tín hiệu IL-1 không tạo máu trong quá trình này.
Sự suy giảm tiểu cầu dẫn đến việc kích hoạt tín hiệu IL-1 trong các tế bào quanh mạch máu
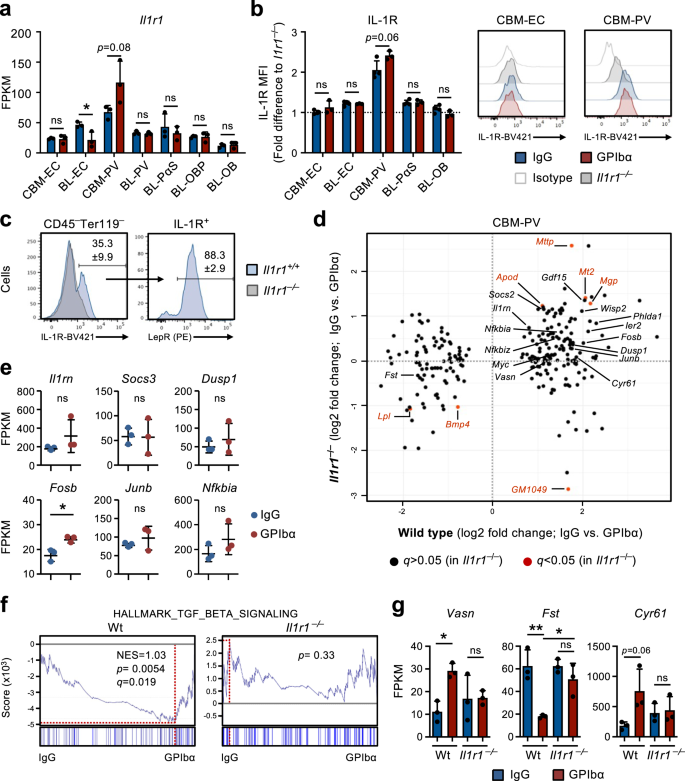
Nghiên cứu của chúng tôi trong Il1r1FL/FLồ-iCreTg/+chuột và phân tích trình tự RNA của các tế bào hốc BM cho thấy rằng tín hiệu IL-1 trong các tế bào thích hợp, thay vì HSC hoặc các tế bào tạo máu khác, có thể đóng vai trò trong việc kích hoạt phản hồi của HSC sau khi cạn kiệt tiểu cầu. Trong số các tế bào thích hợp, tế bào CBM-PV cho thấy mức độ phiên mã cao nhất của Il1r1 biểu thức (Hình. 4a) và cũng cho thấy biểu hiện protein IL-1R rõ rệt, trong khi tất cả các quần thể tế bào mô đệm/nội mô khác hầu như âm tính với biểu hiện bề mặt tế bào IL-1R có thể phát hiện được (Hình XNUMX). 4b). Trên thực tế, hầu hết tất cả biểu thức IL-1R trong CBM đều có thể được gán cho Lepr+ Tế bào PV (Hình. 4c), thể hiện mức độ cao hơn của các cơ quan quản lý HSC quan trọng như Cxcl12 và kitl, so với IL-1R nội mạc–/Lo Tế bào BL-PV (Hình bổ sung. 3c). Điều quan trọng là việc so sánh các gen DE trong các tế bào CBM-PV từ Wt và Il1r1–/– chuột ở trạng thái cân bằng nội môi và sau khi điều trị bằng GPIbα cho thấy phần lớn gen DE được xác định ở chuột Wt sau khi tiểu cầu bị suy giảm (Hình XNUMX). 2f và 3b) không được biểu hiện khác biệt trong các tế bào CBM-PV từ các tế bào bị cạn kiệt tiểu cầu Il1r1–/– chuột (Hình. 4d), bao gồm các gen liên quan trực tiếp đến việc kích hoạt đường truyền tín hiệu IL-1 (Hình XNUMX). 4e). Ngoài các gen liên quan đến tín hiệu IL-1, chúng tôi đã tìm thấy bằng chứng về các con đường DE phụ thuộc IL-1R có liên quan đến sự điều hòa bên ngoài của sự tăng sinh HSC, bao gồm cả con đường truyền tín hiệu TGFβ (Hình XNUMX). 2g và 4d, f, g)34. Điều này bao gồm việc tăng quy định về Vasn (Vasorin), chất ức chế trực tiếp tín hiệu TGFβ35 trước đây có liên quan đến việc kích hoạt HSC36. Bao gồm các gen DE phụ thuộc IL-1R khác fst (Folistatin), chất ức chế trực tiếp tín hiệu BMP/Activin37 và trước đây đã được chứng minh là có tác dụng ức chế sự biệt hóa Mk từ các tế bào tiền thân tạo máu38và các gen liên quan đến sự bám dính của tế bào và liên kết/điều hòa integrin (Hình XNUMX). 2f,g và 4d–g).
a Phân tích trình tự RNA của Il1r1 biểu hiện gen (FPKM) trong các tế bào thích hợp khác nhau được phân lập từ chuột ở trạng thái cân bằng nội môi (được điều trị bằng IgG) hoặc suy giảm tiểu cầu sau 1 ngày (được điều trị bằng GPIbα). Dữ liệu FPKM trung bình ± SD của 3 lần sao chép sinh học từ 2 thí nghiệm độc lập. b, c Phân tích tế bào học dòng chảy biểu hiện IL-1R trong các quần thể tế bào nội mô/mô đệm khác nhau được phân lập từ chuột trong cân bằng nội môi hoặc suy giảm tiểu cầu sau 1 ngày. Dữ liệu trung bình ± SD của cường độ huỳnh quang trung bình (MFI) được chuẩn hóa thành MFI của quần thể tế bào tương đương trong Il1r1- / - chuột được phân tích trong cùng một thí nghiệm (b). c Tần suất bệnh phong+ Tổng số tế bào PV trong IL-1R+ Các tế bào không tạo máu CBM được phân lập từ chuột trong cân bằng nội môi. Dữ liệu từ 4 con chuột (IgG) và 3 (GPIbα) trong 2 thí nghiệm độc lập. d Phân tích trình tự RNA của các tế bào CBM-PV phân lập từ Il1r1+ / + và Il1r1- / - chuột ở trạng thái cân bằng nội môi và sau khi cạn kiệt tiểu cầu, để biểu hiện gen đáp ứng điều trị CBM-PV-GPIbα. Dữ liệu từ 3 lần sao chép sinh học cho mỗi điều kiện. e Sự biểu hiện của các gen liên kết với con đường truyền tín hiệu IL-1 trong các tế bào CBM-PV phân lập từ Il1r1- / - chuột sau 1 ngày cạn kiệt tiểu cầu. Dữ liệu FPKM trung bình ± SD của 3 lần sao chép sinh học cho mỗi điều kiện. GSEA của dữ liệu biểu hiện gen toàn cầu cho bộ gen được chỉ định (f) và biểu hiện (FPKM; Giá trị trung bình ± SD) của các gen được chỉ định (g), trong các ô CBM-PV từ loại hoang dã và Il1r1- / - chuột ở trạng thái cân bằng nội môi và sau khi cạn kiệt tiểu cầu. Dữ liệu từ 3 con chuột cho mỗi điều kiện. NES, điểm làm giàu chuẩn hóa (hoặc điểm tỷ lệ). *p <0.05; **p < 0.01; ns, không đáng kể (p > 0.05); sử dụng t-test hai mặt (a, b, e) và ANOVA 2 chiều với nhiều so sánh Tukey'a (g).
Tín hiệu IL-1 trong các tế bào quanh mạch máu là rất quan trọng để kích hoạt tối ưu Vwf+ HSC
Để nghiên cứu trực tiếp hơn về vai trò của tín hiệu IL-1 trong các tế bào CBM-PV trong việc kích hoạt Vwf+ HSC để đáp ứng với tình trạng giảm tiểu cầu, chúng tôi đã gây ra sự suy giảm tiểu cầu ở chuột bằng cách xóa có điều kiện Il1r1 đặc biệt ở Lepr+ Tế bào PV (Hình bổ sung. 5d). Il1r1FL/FLbệnh cùi-CreTg/+ chuột cho thấy sự giảm đáng kể trong việc đạp xe tích cực (S-G2-M) Vwf+ HSC, so với chuột đối chứng được điều trị bằng GPIbα (Hình XNUMX). 5a). Việc giảm kích hoạt chu kỳ tế bào có thể so sánh với mức giảm được quan sát thấy ở dòng mầm bị xóa Il1r1–/– chuột (Hình. 3e, f), ủng hộ Lepr đó+ Các tế bào CBM-PV là các tế bào chính liên quan đến việc kích hoạt Vwf phụ thuộc IL-1R+ HSC đáp ứng với tình trạng giảm tiểu cầu do thuốc kháng GPIbα gây ra. Chứng thực những phát hiện này, việc sử dụng IL-1 tái tổ hợp để Il1r1FL/FLbệnh cùi-CreTg/+ chuột dẫn đến việc tuyển dụng Vwf giảm+ HSC thành S-G2-M hoạt động (Hình XNUMX). 5b). Hơn nữa, việc xóa cụ thể của Il1r1 ở Lepr+ Tế bào PV dẫn đến sự chậm trễ nhỏ nhưng đáng kể trong việc phục hồi tiểu cầu sau khi tiểu cầu bị suy giảm (Hình XNUMX). 5c).
(Liên quan đến Hình bổ sung. 6). a–c Phân tích chuột bị xóa có điều kiện Il1r1 ở Lepr+ tế bào quanh mạch máu (Il1r1FL/FL bệnh cùi-CreTg/+) chuột sau khi cạn kiệt tiểu cầu. Kiểm soát bao gồm Il1r1FL/+ bệnh cùi-CreTg/+, Il1r1+ / + bệnh cùi-CreTg/+, Il1r1FL/FL bệnh cùi-CreTg/+ (chỉ IgG) và bệnh cùi-Cre+ / + chuột. a Phân tích chu kỳ tế bào của Vwf+ và VWF– HSC sau 1 ngày suy giảm tiểu cầu. Dữ liệu biểu thị tần số trung bình ± SD của 3 (control-IgG), 5 (control-GPIbα) và 5 (Il1r1FL/FL bệnh cùi-CreTg/+-GPIbα) từ 3 thí nghiệm độc lập. b Phân tích chu kỳ tế bào của Vwf+ và VWF– HSC từ chuột sau 1 ngày tiêm tĩnh mạch 50ug/Kg IL-1β. Dữ liệu là trung bình ± SD của 3 (control-IgG), 6 (control-GPIbα) và 4 (Il1r1FL/FL bệnh cùi-CreTg/+-GPIbα) từ 3 thí nghiệm độc lập. c Phân tích máu ngoại vi về sự phục hồi tiểu cầu tại thời điểm được chỉ định sau khi tiểu cầu cạn kiệt. Số lượng tiểu cầu trung bình ± SD từ 6 (đối chứng) và 11 (Il1r1FL/FL bệnh cùi-CreTg/+) chuột trong 3 thí nghiệm độc lập. d–g Phân tích biểu hiện gen khác biệt ở Vwf+ và Vwf– HSC được phân lập từ chuột hoang dã sau 1 ngày bị suy giảm tiểu cầu (điều trị GPIbα). d Sơ đồ núi lửa của các gen biểu hiện khác nhau ở Vwf+ và Vwf– HSC. Các chấm đỏ biểu thị các gen có sự khác biệt biểu hiện đáng kể (được điều chỉnh p giá trị (q)<0.05). e Biểu đồ Venn hiển thị số lượng gen biểu hiện khác nhau trong Vwf+ và Vwf– HSC sau sự suy giảm tiểu cầu và giữa các tập hợp con HSC này trong cân bằng nội môi (IgG). f Phân tích thuật ngữ GO về các quá trình/con đường sinh học được điều chỉnh tăng trong Vwf+ HSC sau khi tiểu cầu cạn kiệt. g Biểu hiện (FPKM) của các gen liên quan đến tín hiệu Activin/BMP trong Vwf+ và Vwf– HSC từ chuột Wt trong cân bằng nội môi và suy giảm tiểu cầu sau 1 ngày. Tất cả dữ liệu (d–g) biểu thị dữ liệu trung bình ± SD FPKM của 3 lần sao chép sinh học cho mỗi kiểu gen và điều kiện. *p <0.05; **p <0.01; ***p < 0.001; ns không đáng kể (p > 0.05); sử dụng ANOVA 2 chiều với nhiều so sánh của Tukey (a, b), ANOVA 2 chiều với nhiều so sánh của Sidak (c) và kiểm định t hai phía (g). Xem thêm Hình bổ sung. 5.
Để hiểu rõ hơn về cách Vwf+ HSC được tuyển dụng vào quá trình tăng sinh để đáp ứng với sự suy giảm tiểu cầu do kháng GPIbα gây ra, chúng tôi đã thực hiện giải trình tự RNA của Vwf+ và Vwf– HSC. Giải trình tự RNA của Vwf+ HSC đã xác định được 230 gen biểu hiện khác nhau sau khi cạn kiệt tiểu cầu, trong đó 170 gen được biểu hiện khác biệt ở Vwf+ và không phải Vwf– HSC và 24 trong số này đã được phân biệt Vwf+ và Vwf– HSC trong cân bằng nội môi, bao gồm các gen liên quan đến dòng tiểu cầu/Mk (Hình XNUMX). 5d, e, Hình bổ sung. 5e, f và dữ liệu bổ sung 6, 7). So sánh Vwf+ và Vwf– HSC từ những con chuột bị suy giảm tiểu cầu cho thấy sự phong phú của các gen kích hoạt chu kỳ tế bào ở Vwf+ HSC, xác nhận ở cấp độ phân tử sự kích hoạt ưu tiên của Vwf+ HSC để đáp ứng với sự suy giảm tiểu cầu (Hình bổ sung. 5g và dữ liệu bổ sung 8). Các gen biểu hiện khác nhau ở Vwf+ HSC sau khi kích hoạt và suy giảm tiểu cầu chủ yếu liên quan đến tín hiệu integrin và độ bám dính của tế bào, được biết là được điều chỉnh bởi tín hiệu TGFβ39, mà còn cả chu kỳ tế bào, đông máu và phản ứng với căng thẳng/viêm (Hình XNUMX). 5 ngày – thứ sáu). Mặc dù chúng tôi không thể loại trừ sự tham gia của các con đường truyền tín hiệu khác trong việc điều hòa các gen này, phù hợp với sự điều hòa giảm của fst trong các tế bào CBM-PV (Hình XNUMX). 4g), các gen mục tiêu Activin/BMP ứng cử viên Runx3 và ID140 lần lượt được điều chỉnh tăng và giảm ở Vwf+ nhưng không phải Vwf– HSC sau sự suy giảm tiểu cầu (Hình XNUMX). 5g). Đáng chú ý, gen của α1,6-fucosyltransferase (fut8) điều chỉnh một cách khác biệt hoạt động của thụ thể TGFβ và Activin41 và cũng là chất điều chỉnh tín hiệu integrin42 đã được tìm thấy được quy định cụ thể trong Vwf+ HSC sau sự suy giảm tiểu cầu. Ngoài ra, để đáp ứng với tình trạng suy giảm tiểu cầu do thuốc kháng GPIbα gây ra, Vwf+ HSC nhưng không phải Vwf- HSC được điều chỉnh tăng fkbp1a, một bộ điều chỉnh nội bào của tín hiệu Smad điều chỉnh cường độ và thời lượng của tín hiệu xuôi dòng của các thụ thể TGFβ, Activin và BMP43,44 (Sung. 5g). Cùng với việc điều chỉnh giảm fst trong các tế bào CBM-PV (Hình XNUMX). 4g), những dữ liệu này cho thấy rằng sự thay đổi từ tín hiệu TGFβ tăng cường không hoạt động sang kích hoạt tín hiệu Activin/BMP có thể dẫn đến thay đổi hoạt động integrin, độ bám dính tế bào và trạng thái chu kỳ tế bào của HSC để đáp ứng với sự kích hoạt và suy giảm tiểu cầu cấp tính.
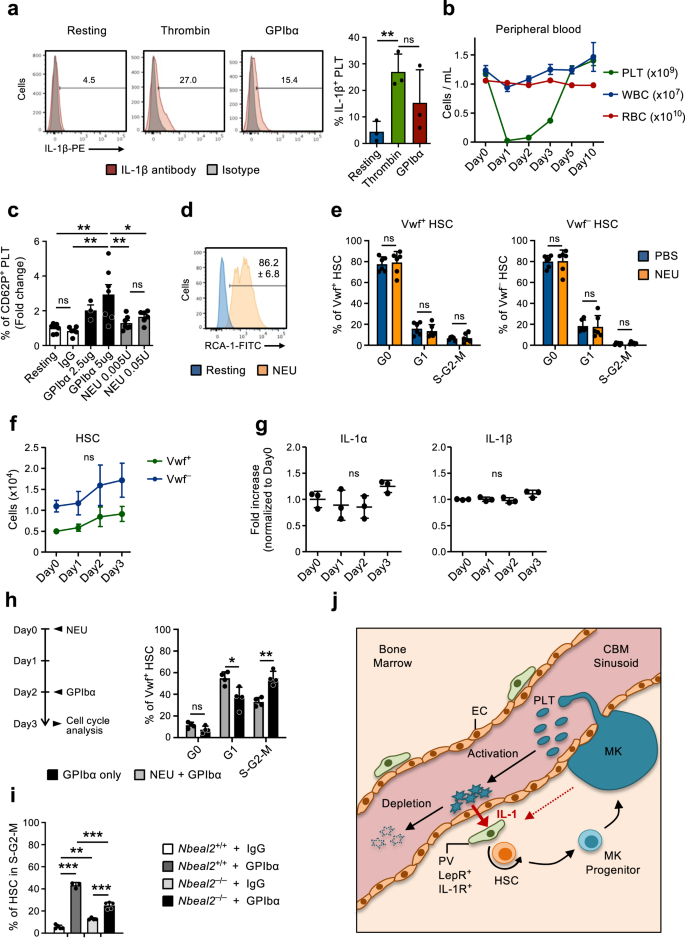
Kích hoạt tiểu cầu là điều cần thiết cho phản ứng HSC đối với sự suy giảm tiểu cầu
Phân tích biểu hiện gen của CBM-EC cho thấy một số gen được điều chỉnh tăng khi suy giảm tiểu cầu có liên quan đến hoạt hóa và đông máu tiểu cầu (Hình XNUMX). 2f,g). Điều này phù hợp với cơ chế tiêu thụ tiểu cầu thường xuyên45, ở đây được mô phỏng theo sự suy giảm tiểu cầu qua trung gian GPIbα, hoạt động bằng cách gây ra sự kích hoạt tiểu cầu độc lập với Fc, dẫn đến sự chuyển dịch sialidase neuraminidase-1 (NEU) của tiểu cầu sang màng, khử muối và sau đó giải phóng ở gan20. Hơn nữa, tiểu cầu được công nhận là chất trung gian quan trọng của tình trạng viêm46,47 và nhanh chóng điều chỉnh lại biểu hiện protein IL-1 khi kích hoạt (Hình XNUMX). 6a), như được hiển thị trước đây bởi những người khác48,49,50. Điều này hỗ trợ vai trò kích hoạt tiểu cầu và tiêu thụ tiếp theo trong việc làm trung gian cho quá trình kích hoạt Vwf phụ thuộc IL-1 được quan sát ở đây+ HSC để đáp ứng với giảm tiểu cầu. Để nghiên cứu sâu hơn về khả năng này, chúng tôi đã điều trị chuột bằng NEU51, tương tự như phương pháp xử lý GPIbα (Hình XNUMX). 1a) dẫn đến sự suy giảm tiểu cầu hiệu quả (Hình XNUMX). 6b) nhưng bỏ qua sự kích hoạt tiểu cầu20. Trong khi điều trị bằng GPIbα kích hoạt tiểu cầu một cách hiệu quả trong ống nghiệm, được đo bằng nhuộm P-Selectin (CD62P) bề mặt, điều trị NEU trong ống nghiệm chỉ dẫn đến kích hoạt tiểu cầu rất nhẹ và chỉ ở nồng độ cao (Hình XNUMX). 6c). Tuy nhiên, hoạt động NEU trong ống nghiệm đã được xác nhận bởi thầu dầu communis ghi nhãn agglutinin I (RCA-1) (Hình XNUMX). 6d), liên kết đặc biệt với các protein đã khử sialylat20. Mặc dù làm cạn kiệt tiểu cầu in vivo với hiệu quả tương tự, không giống như điều trị bằng thuốc kháng GPIbα, điều trị NEU không dẫn đến kích hoạt chu kỳ tế bào HSC (Hình XNUMX). 6e) cũng không làm tăng đáng kể số lượng Vwf+ hoặc Vwf– HSC (Hình. 6f), LSK Flt3–CD48+CD150+ MPP, tiền MegE và MkP trong BM (Hình bổ sung. 6a, b). Đáng chú ý, ở những con chuột được điều trị bằng NEU, nồng độ IL-1α và IL-1β trong BM hầu như không thay đổi (Hình XNUMX). 6g). Những kết quả này cho thấy rằng thay vì chỉ mất tiểu cầu, sự suy giảm tiểu cầu do kích hoạt kháng GPIbα có liên quan đến quá trình kích hoạt HSC phụ thuộc IL-1 được quan sát. Các nghiên cứu trước đây cho thấy vai trò của Mks và các yếu tố được tiết ra của chúng trong việc điều hòa sự phát triển / tăng sinh của HSC31,32,33,52. Vì Mks cũng biểu hiện GPIbα, để thể hiện cụ thể hơn vai trò của tiểu cầu trong hoạt hóa HSC được quan sát để đáp ứng với điều trị bằng kháng thể kháng GPIbα, độc lập với Mks, chúng tôi đã sử dụng kháng thể kháng GPIbα cho những con chuột trong đó tiểu cầu đã bị cạn kiệt một cách hiệu quả với NEU -điều trị (Hình XNUMX) 6b), không làm thay đổi số lượng Mks33. Việc xử lý NEU-GPIbα tuần tự này dẫn đến giảm kích hoạt chu kỳ tế bào của Vwf+ HSC, khi so sánh với điều trị GPIbα đơn thuần (Hình XNUMX). 6h), xác nhận sự tham gia của tiểu cầu trong quá trình này. Tuy nhiên, thực tế là một số kích hoạt HSC đã được quan sát thấy ở những con chuột có tiểu cầu bị suy giảm NEU, khi so sánh với những con chuột đối chứng có số lượng tiểu cầu bình thường (Hình XNUMX). 1d và 3e), cũng hỗ trợ vai trò của Mks trong quá trình kích hoạt HSC được quan sát để đáp ứng với việc điều trị bằng kháng thể kháng GPIbα.
(Liên quan đến Hình bổ sung. 4). a Biểu hiện IL-1β ở tiểu cầu ở trạng thái nghỉ hoặc sau khi kích hoạt in vitro (3 giờ) bằng kháng thể trombin hoặc GPIbα. (Trái), hồ sơ FACS đại diện. Các số trong ô là tần số trung bình từ 3 thí nghiệm độc lập. (Phải) Tần số IL-1β+ tiểu cầu; trung bình ± SD của 3 lần sao chép sinh học cho mỗi điều kiện trong 3 thí nghiệm độc lập. Mỗi bản sao sinh học bao gồm các tiểu cầu được tập hợp từ 2-3 con chuột. b Phân tích động học của các dòng tế bào máu ngoại vi sau khi sử dụng Neuraminidase (NEU) in vivo. Dữ liệu đại diện cho giá trị trung bình ± SEM của 10 (Ngày0), 7 (Ngày1), 8 (Ngày2), 9 (Ngày3), 6 (Ngày5) và 3 (Ngày10) từ 6 thí nghiệm độc lập. Tiểu cầu PLT, bạch cầu WBC, hồng cầu RBC. c Biểu hiện của P-selectin bề mặt (CD62P) trên tiểu cầu được đo bằng phương pháp tế bào học dòng chảy sau khi ủ trong ống nghiệm với kháng thể GPIbα hoặc NEU, ở nồng độ được chỉ định. Dữ liệu biểu thị các thay đổi trung bình ± SD của % CD62P+ các tế bào trong mỗi tình trạng liên quan đến tiểu cầu (nghỉ) không được điều trị, gồm 7 (Nghỉ ngơi), 6 (IgG), 3 (GPIbα-2,5ug), 7 (GPIbα-5ug), 7 (NEU 0.005U) và 6 (NEU 0.05U) trong 3 thí nghiệm độc lập. d Hoạt tính neuraminidase (NEU) in vitro trong tiểu cầu ở trạng thái nghỉ hoặc sau 30 phút điều trị bằng NEU, được phân tích bằng liên kết RCA-1. Hồ sơ đại diện từ 1 trên 3 bản sao sinh học. Các con số biểu thị trung bình ± SD% RCA-1+ tiểu cầu. e Phân bố pha chu kỳ tế bào trung bình ± SD của Vwf+ (trái) và Vwf– (phải) HSC sau 1 ngày suy giảm tiểu cầu với NEU. Dữ liệu từ 6 con chuột cho mỗi điều kiện, trong 3 thí nghiệm độc lập. f Đánh giá dựa trên FACS về khoang HSC trong tủy xương của chuột tại các thời điểm được chỉ định sau khi cạn kiệt tiểu cầu với NEU. Dữ liệu đại diện cho số tuyệt đối của vwf-GFP+ (Vwf+) hoặc vwf-GFP– (Vwf–) HSC (trung bình ±SEM) tại các thời điểm được chỉ định sau khi cạn kiệt tiểu cầu. Dữ liệu được lấy từ chuột 5 (Ngày0), 4 (Ngày1), 5 (Ngày2) và 6 (Ngày3) trong 4 thí nghiệm độc lập. Không có thay đổi đáng kể nào được quan sát thấy về số lượng Vwf+ hoặc Vwf– HSC tại bất kỳ thời điểm nào. g Mức trung bình ± SD (tăng gấp đôi so với Ngày0) của các cytokine được chỉ định trong dịch ngoại bào tủy xương được phân lập từ chuột tại các thời điểm được chỉ định sau khi tiểu cầu bị suy giảm do Neuraminidase. Dữ liệu từ 3 con chuột cho mỗi điểm thời gian trong 2 thí nghiệm độc lập. h Chuột được điều trị bằng NEU vào ngày 0, sau đó sử dụng kháng thể GPIbα vào ngày thứ 2 và được phân tích vào ngày thứ 3 (trái) để phân bổ giai đoạn chu kỳ tế bào ở Vwf+ HSC (phải). Chuột đối chứng chỉ được điều trị bằng kháng thể GPIbα và được phân tích 1 ngày sau đó. Dữ liệu biểu thị tần số trung bình ± SD của 4 con chuột trong mỗi nhóm trong 2 thí nghiệm độc lập. i HSC trong S-G2-M trong Nbeal2- / - chuột suy giảm tiểu cầu sau 1 ngày (GPIbα). Dữ liệu biểu thị tần số trung bình ± SD của ô là 5 (Wt-IgG), 3 (Wt-GPIbα), 4 (Nbeal2- / --IgG) và 5 (Nbeal2- / --GPIbα) cho mỗi điều kiện từ 3 thí nghiệm độc lập. j Sơ đồ mô tả cơ chế phản hồi được đề xuất. Trong khi được tiêu thụ, tiểu cầu đã hoạt hóa sẽ tiết ra IL-1, chất này kích hoạt các tế bào PV biểu hiện IL-1R để tạo ra sự tăng sinh và biệt hóa HSC đối với dòng tiểu cầu. Như đã chỉ ra, Mks cũng có thể góp phần vào việc tuyển dụng HSC được mô tả vào sự tăng sinh để đáp ứng với việc điều trị bằng kháng thể kháng GPIbα dẫn đến suy giảm tiểu cầu phụ thuộc vào kích hoạt. Đối với tất cả dữ liệu ***p <0.001; **p < 0.01; *p < 0.05 (Chỉ biểu thị cho những khác biệt đáng kể) sử dụng ANOVA 1 chiều với nhiều so sánh của Tukey (a, c, f, i), ANOVA 2 chiều với nhiều so sánh của Sidak (e, h) hoặc nhiều so sánh của Dunnett (g); ns không đáng kể. Xem thêm Hình bổ sung. 6.
Tiểu cầu lưu trữ nhiều chất điều biến viêm trong hạt tiểu cầu, chúng được giải phóng khi kích hoạt tiểu cầu53,54. Để điều tra thêm xem liệu việc giải phóng hàm lượng hạt tiểu cầu có cần thiết để kích hoạt HSC qua trung gian GPIbα hay không, chúng tôi đã gây ra sự suy giảm tiểu cầu (điều trị bằng GPIbα) ở những con chuột bị thiếu hụt Nbeal2 (Nbeal2–/–), thiếu hạt α tiểu cầu55. Nbeal2–/– chuột có khả năng tạo máu tổng thể bình thường mặc dù số lượng tiểu cầu giảm nhẹ và HSC tăng nhẹ (Hình bổ sung. 6c–e). Một ngày sau khi điều trị bằng thuốc kháng GPIbα Nbeal2–/– chuột có tần suất HSC đạp xe tích cực giảm đáng kể khi so sánh với chuột Wt, mặc dù tần số HSC đang trong chu kỳ trước khi điều trị cao hơn (Hình XNUMX). 6i). Cùng với nhau, những phát hiện này cho thấy IL-1 và các chất điều hòa khác được tiết ra khi kích hoạt tiểu cầu có thể đóng vai trò điều chỉnh việc kích hoạt HSC để đáp ứng với tình trạng giảm tiểu cầu.
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- PlatoSức khỏe. Tình báo thử nghiệm lâm sàng và công nghệ sinh học. Truy cập Tại đây.
- nguồn: https://www.nature.com/articles/s41467-023-41691-y