Ontwerpcontroles kunnen overweldigend zijn, maar u kunt het proces leren met behulp van deze stapsgewijze handleiding voor het implementeren van ontwerpcontroles. Implementatie van ontwerpcontroles
Implementatie van ontwerpcontroles
U kunt ontwerpcontroles op elk moment tijdens het ontwikkelingsproces implementeren, maar hoe eerder u uw ontwerpproces implementeert, hoe nuttiger ontwerpcontroles zullen zijn. De eerste stap bij het implementeren van ontwerpcontroles is het creëren van en ontwerpcontroleprocedure. Je hebt ook minimaal twee van de volgende extra nodig kwaliteitssysteemprocedures:
- Risicobeheerprocedure (SYS-010)
- Softwareontwikkeling en -validatie (SYS-044)
- Bruikbaarheidsprocedure (SYS-048)
- Werkinstructie Cybersecurity (WI-007)
A risicobeheerbestand (in overeenstemming met ISO 14971:2019) is vereist voor alle medische apparaten, en bruikbaarheidstechniek of menselijke factorentechniek (in overeenstemming met IEC-62366 1) is vereist voor alle medische apparaten. De hierboven genoemde software- en cyberbeveiligingsprocedures zijn alleen vereist voor producten met 1) software en/of firmware, en 2) draadloze functionaliteit of een toegangspunt voor verwisselbare media (bijv. USB-flashdrive of SD-kaart).
Stap 2: Training Design Controls
Hoewel de eis voor ontwerpcontroles al meer dan 25 jaar bestaat, zijn er nog steeds veel te veel ontwerpteams die moeite hebben met het begrijpen van deze eisen. De regelgeving voor medische hulpmiddelen is complex, maar ontwerpcontroles vormen het meest complexe proces in elk kwaliteitssysteem. De reden hiervoor is dat elk van de zeven subclausules een miniproces vertegenwoordigt dat qua complexiteit gelijkwaardig is aan CAPA-oorzaakanalyse. Veel bedrijven kiezen ervoor om voor ieder subartikel een aparte werkinstructie te maken.
De trainingsfilosofie van Medical Device Academy is om processen terug te brengen tot afzonderlijke stappen die snel kunnen worden opgenomen en geïmplementeerd. We gebruiken onafhankelijke formulieren om elke stap te ondersteunen en ontwikkelen trainingen met praktijkvoorbeelden, in plaats van gedetailleerde procedure(s) uit te schrijven. De aanpak die wij leren haalt de complexiteit uit uw lichaam ontwerpcontroleprocedure (SYS-008). In plaats daarvan vertrouwen we op de structuur van stapsgewijze formulieren die in elke fase van het ontwerpproces worden ingevuld.
Als u geïnteresseerd bent in een ontwerpcontroletraining: Rob Packard zal gastheer zijn van de derde editie van onze Webinar voor ontwerpcontroles on Vrijdag 11 augustus 2023, om 9 uur EDT.
Stap 3: Gegevens verzamelen over post-market surveillance
Toezicht na het op de markt brengen is momenteel niet vereist door de FDA in 21 CFR 820, maar wel door ISO 13485:2016 in clausule 7.3.3c) (dat wil zeggen: “[Ontwerp- en ontwikkelingsinputs] omvatten…toepasselijke output(s) van risicomanagement"). Verwacht wordt dat de FDA de plannen voor de overgang naar ISO 13485 in boekjaar 2024 zal vrijgeven, maar de meeste bedrijven denken ten onrechte dat de FDA geen rekening hoeft te houden met toezicht na het op de markt brengen bij het ontwerpen van nieuwe apparaten. Dit is niet correct. Er zijn drie manieren waarop de FDA verwacht dat er rekening wordt gehouden met post-market surveillance wanneer u een nieuw apparaat ontwikkelt:
- Klachten en bijwerkingen die verband houden met eerdere versies van het apparaat en apparaten van concurrenten moeten worden geïdentificeerd als input voor het risicobeheerproces voor identificatie van gevaren.
- Als het apparaat software bevat, moeten bestaande kwetsbaarheden in de kant-en-klare software (inclusief besturingssystemen) worden geïdentificeerd als onderdeel van het cyberbeveiligingsrisicobeoordelingsproces.
- Tijdens het menselijke factorenproces moet u zoeken naar bekende gebruiksfouten die verband houden met eerdere versies van het apparaat en apparaten van concurrenten; Bekende gebruiksgerelateerde risico's moeten ook eventuele gebruiksfouten omvatten die tijdens formatieve toetsen zijn geïdentificeerd.
Hoewel de FDA momenteel geen naleving van ISO 13485 vereist, erkent de FDA wel ISO 14971:2019, en post-market surveillance wordt geïdentificeerd als input voor het risicobeheerproces in clausule 4.2 (zie opmerking 2), clausule 10.4 en Bijlage A.2.10.
Stap 4: Het maken van een ontwerpplan
U bent verplicht uw ontwerpplan bij te werken naarmate het ontwikkelingsproject vordert. Bij de meeste ontwerp- en ontwikkelingsprojecten duurt het een jaar voordat het bedrijf klaar is om een indiening van 510k in te dienen bij de FDA. Maak je daarom geen zorgen over het perfect maken van je eerste versie van het plan. Je hebt een jaar de tijd om veel verbeteringen aan te brengen in je ontwerpplan. U moet uw ontwerpplan op zijn minst bijwerken tijdens elke ontwerpbeoordeling. Eén ding dat echter belangrijk is om in uw eerste versie vast te leggen, is het juiste regelgevingstraject voor uw beoogde markten. Als u niet zeker weet in welke markten u van plan bent te lanceren, kunt u één markt selecteren en er later meer toevoegen, of u kunt er een paar selecteren en er later een of meer verwijderen. Uw ontwerpplan moet de middelen identificeren die nodig zijn voor het ontwikkelingsproject, en u moet inschatten wanneer u verwacht elk van uw ontwerpbeoordelingen uit te voeren.
Inhoud van uw ontwerpplan
De vereiste voor ontwerpplannen wordt vermeld in zowel Clausule 7.3.1 van de ISO-normen als Sectie 21 CFR 820.30b van de FDA QSR. Je kunt je plan zo gedetailleerd maken als nodig is, maar ik raad aan om eenvoudig te beginnen en details toe te voegen. Uw eerste versie van een ontwerpplan moet de volgende taken bevatten:
- Identificatie van het regelgevingstraject op basis van de risicoclassificatie van het apparaat en de toepasselijke geharmoniseerde normen.
- Ontwikkeling van een risicobeheersplan
- Goedkeuring van uw ontwerpplan (1st ontwerpbeoordeling)
- Initiële identificatie van gevaren
- Documentatie en goedkeuring van gebruikersbehoeften en ontwerpinvoer (2nd ontwerpbeoordeling)
- Analyse van risicobeheersingsopties
- Herhaalde ontwikkeling van het productontwerp
- Risico analyse
- Documentatie en goedkeuring van ontwerpresultaten, implementatie van risicobeheersingsmaatregelen (3rd ontwerpbeoordeling)
- Ontwerpverificatie en verificatie van de effectiviteit van risicobeheersingsmaatregelen (4th ontwerpbeoordeling)
- Ontwerpvalidatie en verificatie van de effectiviteit van risicobeheersingsmaatregelen die niet alleen met verificatietests konden worden geverifieerd
- Klinische evaluatie en baten-risicoanalyse (5th ontwerpbeoordeling)
- Ontwikkeling van een post-market surveillanceplan met een post-market risicobeheerplan
- Ontwikkeling van een ontwerpindex van het Device Master Record/Technical File (DMR/TF).
- Regelgevende goedkeuring (bijv. 510k-goedkeuring) en sluiting van het Design History File (DHF)
- Commerciële uitgave (6th en definitieve ontwerpbeoordeling)
- Bekijk de geleerde lessen en initieer acties om het ontwerpproces te verbeteren
Stap 5: Maak een gedetailleerd testplan
Uw testplan moet aangeven aan welke erkende normen u van plan bent te voldoen, en eventuele vereisten die niet van toepassing zijn, moeten worden geïdentificeerd en gedocumenteerd met een rechtvaardiging voor de niet-toepasselijkheid. De eerste versie van uw testplan zal een vroege versie zijn van uw gebruikersbehoeften en ontwerp ingangen. U kunt echter verwachten dat de ontwerpinvoer verschillende keren zal veranderen. Nadat u feedback van toezichthouders heeft ontvangen, moet u mogelijk eenmalig wijzigingen aanbrengen in de ontwerpinvoer. Mogelijk moet u ook wijzigingen aanbrengen als u niet slaagt voor uw tests (dwz voorafgaande tests, verificatietests of validatietests). Als uw bedrijf “De Lean Startup”-methodologie, zal uw eerste versie van de ontwerpinputs voor een minimaal levensvatbaar product (dwz MVP) zijn. Naarmate u verder komt in uw iteratief ontwikkelproces, voeg je ontwerpinvoer toe en verwijder je deze op basis van feedback van klanten en voorlopige tests. Uw doel moet zijn om vroegtijdig en snel te falen, omdat u niet bij de verificatietest wilt komen en dan faalt. Daarom voeren we een 'ontwerpstop' uit voordat we beginnen met de ontwerpverificatietests en de ontwerpoverdrachtsactiviteiten.
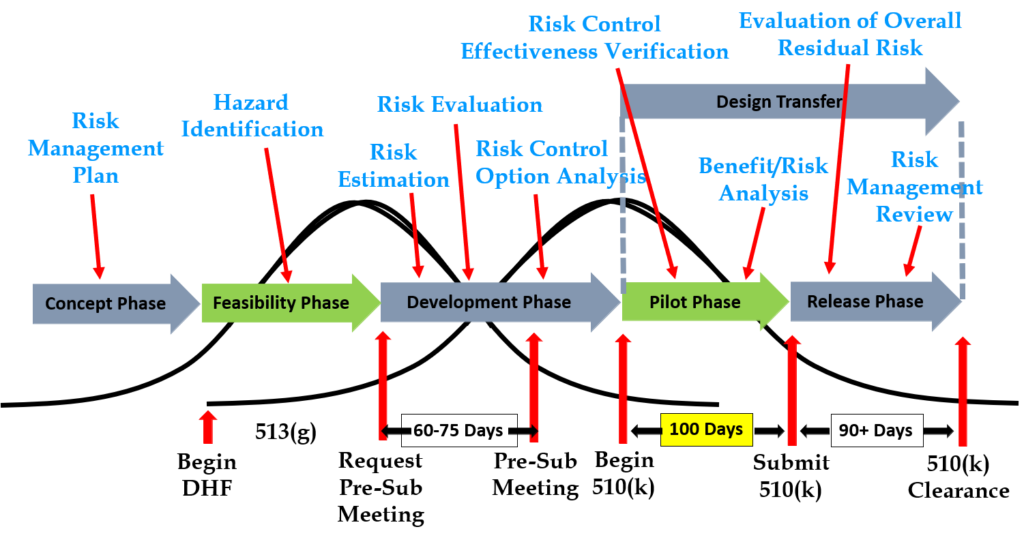
Stap 6: Vraag een pre-indieningsvergadering aan bij de FDA
Ontwerpinvoer moet worden geverifieerd door het gebruik van een verificatieprotocol. Als u voor elke ontwerpinvoer externe standaarden identificeert, kunt u de verificatieactiviteiten gemakkelijker voltooien, omdat verificatietests gemakkelijker te identificeren zijn. Sommige normen bevatten geen testvereisten, en er zijn vereisten die niet overeenkomen met een externe norm. IEC 62366-1 is bijvoorbeeld een internationale norm voor usability-engineering, maar de norm bevat geen specifieke testvereisten. Daarom moeten fabrikanten hun eigen testprotocol ontwikkelen voor de validatie van de geïmplementeerde technische controles op het gebied van bruikbaarheid. Als uw bedrijf een nieuw sterilisatieproces ontwikkelt (bijvoorbeeld UV-sterilisatie), moet u ook uw eigen verificatietestprotocollen ontwikkelen. In deze gevallen moet u de conceptprotocollen indienen bij de FDA (samen met de bijbehorende risicoanalysedocumentatie) om feedback en overeenstemming met uw testplan te verkrijgen. De methode voor het verkrijgen van schriftelijke feedback en overeenstemming met een voorgesteld testplan is het indienen van een verzoek tot een vergadering voorafgaand aan de indiening bij de FDA (dwz PreSTAR).
Stap 7: Iteratieve ontwikkeling is hoe ontwerpcontroles echt werken
Ontwerpcontroles werden in 1996 een wettelijke vereiste in de VS toen de FDA de voorschriften voor het kwaliteitssysteem bijwerkte. Destijds was het “V-diagram” vrij nieuw en beperkt tot softwareontwikkeling. Daarom heeft de FDA toestemming gevraagd aan Health Canada om het “Watervaldiagram” opnieuw af te drukken in de ontwerpcontrolerichtlijnen die de FDA heeft vrijgegeven. Beide diagrammen zijn modellen. Ze vertegenwoordigen geen best practices, en ze beweren niet dat ze representeren hoe het ontwerpproces in de meeste bedrijven wordt uitgevoerd. De belangrijkste informatie die door het “Watervaldiagram” wordt gecommuniceerd, is dat gebruikersbehoeften worden gevalideerd terwijl ontwerpinvoer wordt geverifieerd. Het diagram is niet bedoeld om te communiceren dat het ontwerpproces lineair is of moet voortkomen uit de behoeften van de gebruiker, naar het ontwerpen van inputs en vervolgens naar het ontwerpen van outputs. Het “V-Diagram” is bedoeld om te communiceren dat er meerdere niveaus van verificatie- en validatietests plaatsvinden, en dat het ontwikkelingsproces iteratief is naarmate softwarefouten worden geïdentificeerd. Beide modellen helpen bij het onderwijzen van ontwerp- en ontwikkelingsconcepten, maar geen van beide is bedoeld om wettelijke vereisten te impliceren. Een van de beste lessen die we ontwerp- en ontwikkelingsteams kunnen leren is dat het nodig is om eenvoudige tests te ontwikkelen om ontwerpconcepten te screenen, zodat ontwerpconcepten vroegtijdig en snel kunnen mislukken, voordat het ontwerp bevroren is. Dit proces wordt ‘analyse van risicobeheersingsopties’ genoemd en is vereist in clausule 7.1 van ISO 14971:2019.
Stap 8: “Ontwerp bevriezen”
Ontwerpresultaten zijn tekeningen en specificaties. Zorg ervoor dat u ze up-to-date houdt en de wijzigingen beheert. Wanneer u het ontwerp uiteindelijk goedkeurt, is dit de goedkeuring van uw ontwerpresultaten (dwz de selectie van opties voor risicobeheersing). De definitieve selectie van ontwerpresultaten of risicobeheersingsmaatregelen wordt vaak uitgevoerd als een formele ontwerpbeoordelingsbijeenkomst. De reden hiervoor is dat de kosten van ontwerpverificatie aanzienlijk zijn. Er is geen regelgevende of wettelijke vereiste voor een ‘ontwerpbevriezing’. In feite zijn er veel voorbeelden waarbij veranderingen worden verwacht, maar het team besluit toch door te gaan met de verificatietests. De beste praktijk die door de sector van medische hulpmiddelen is ontwikkeld, is het uitvoeren van een ‘ontwerpbevriezing’. De ontwerpuitvoer is “bevroren” en er zijn geen verdere wijzigingen toegestaan. Het bevriezen van het ontwerp is simpelweg bedoeld om het bedrijfsrisico te verkleinen dat er tweemaal geld wordt uitgegeven aan verificatietests omdat de ontwerpresultaten tijdens het testproces zijn gewijzigd. Als een apparaat de test niet doorstaat, zal het nodig zijn om het ontwerp te veranderen en de tests te herhalen, maar als iedereen in het ontwerpteam het erover eens is dat de noodzaak voor veranderingen klein is en het bedrijf moet beginnen met testen, is de kans kleiner dat er veranderingen zullen worden doorgevoerd. nadat het testen is begonnen.
Stap 9: Begin met het ontwerpoverdrachtproces
Ontwerpoverdracht is geen eenmalige gebeurtenis in de tijd. De overdracht begint met de vrijgave van uw eerste tekening of specificatie tot aan de inkoop en eindigt met de commerciële vrijgave van het product. Het meest voorkomende voorbeeld van een ontwerpoverdrachtsactiviteit is de goedkeuring van prototypetekeningen als een definitief vrijgegeven tekening. Dit is gebruikelijk bij gegoten onderdelen. Verschillende iteraties van het plastic onderdeel kunnen worden geëvalueerd met behulp van 3D-geprinte onderdelen en machinaal bewerkte onderdelen, maar om het onderdeel consistent tegen de beoogde kosten te maken, is doorgaans een spuitgietmatrijs nodig. De kosten van de mal kunnen tussen de 40 en 100 dollar liggen, maar het is moeilijk om het ontwerp te veranderen zodra de mal is gebouwd. De doorlooptijd voor spuitgietmatrijzen bedraagt vaak 10-14 weken. Daarom kan een ontwerpteam beginnen met het ontwerpoverdrachtsproces voor gegoten onderdelen voordat een ontwerpbevriezing wordt uitgevoerd. Een ander onderdeel dat mogelijk eerder als definitief ontwerp wordt vrijgegeven, is een printplaat (PCB). Elektronische componenten zoals weerstanden, condensatoren en geïntegreerde schakelingen (IC's) zijn mogelijk kant-en-klaar verkrijgbaar, maar de onbewerkte PCB heeft een langere doorlooptijd en wordt op maat gemaakt voor uw apparaat.
Stap 10: Verificatie van ontwerpcontroles
Voor het testen van ontwerpverificatie zijn vooraf goedgekeurde protocollen en vooraf gedefinieerde acceptatiecriteria vereist. Waar mogelijk moeten ontwerpverificatieprotocollen worden gestandaardiseerd in plaats van projectspecifiek te zijn. Informatie over de traceerbaarheid naar de gekalibreerde apparatuuridentificatie en testmethoden moet worden opgenomen als een variabele die handmatig in een lege ruimte wordt ingevoerd wanneer het protocol wordt uitgevoerd. De filosofie achter deze aanpak is om één keer een protocol te maken en het voor altijd te herhalen. Dit resulteert in een verificatieproces dat consistent en voorspelbaar is, maar elimineert ook de noodzaak van beoordeling en goedkeuring van het protocol voor elk nieuw project. Gestandaardiseerde protocollen hoeven geen leverancier of data voor de tests te specificeren, maar u kunt overwegen om de leverancier(s) en de duur van de tests in uw ontwerpinvoer te documenteren om u te helpen bij het projectbeheer en de planning. Mogelijk wilt u ook een gestandaardiseerd sjabloon gebruiken voor het formaat en de inhoud van uw protocol en rapport. De FDA biedt een leidraad specifiek voor het rapportformaat en de inhoud voor niet-klinische prestatietests.
Stap 11: Validatie van ontwerpcontroles
Ontwerpvalidatie is vereist om aan te tonen dat het apparaat voldoet aan de behoeften van de gebruiker en de patiënt. Gebruikersbehoeften zijn doorgaans de indicaties voor gebruik, inclusief veiligheids- en prestatie-eisen. Ontwerpvalidatie moet meer zijn dan bench-testen. Zorg ervoor dat diermodellen, gesimuleerde anatomische modellen, eindige-elementenanalyse en klinische studies bij mensen in aanmerking worden genomen. Eén doel van ontwerpvalidatie is het aantonen van de prestaties voor de indicaties voor gebruik, maar het valideren dat geïmplementeerde risicobeheersingsmaatregelen effectief zijn in het voorkomen van gebruiksgerelateerde risico's is ook belangrijk. Daarom zijn summatieve validatietests op menselijke factoren één type ontwerpvalidatie. Bij het testen van menselijke factoren zal doorgaans sprake zijn van gesimuleerd gebruik met de definitieve versie van het apparaat en de beoogde gebruikers. Validatietests vereisen doorgaans niet-klinische prestatietests naast elkaar met een predikaatapparaat voor een indiening van 510k, terwijl voor CE-markering inzendingen doorgaans klinische gegevens van mensen nodig zijn om de veiligheid en prestaties aan te tonen.
Stap 12: FDA 510k-indiening
Pre-market notificatie door de FDA, of 510k indiening, is het meest voorkomende type goedkeuring dat vereist is voor medische hulpmiddelen in de VS. Inzendingen bij de FDA kunnen doorgaans eerder worden ingediend dan in andere landen, omdat de FDA geen certificering van het kwaliteitssysteem of samenvattende technische documenten vereist, en de gegevens over prestatietests meestal niet-klinische benchtoptests zijn. Voor FDA 510k-inzendingen is ook geen procesvalidatie voor productie vereist. Daarom wordt de meeste verificatie en validatie uitgevoerd op “productie-equivalenten” die in kleine hoeveelheden zijn gemaakt voordat het commerciële productieproces werd gevalideerd. Het kwaliteitssysteem en de validatie van het productieproces kunnen worden voltooid tijdens de FDA 510k-beoordeling.
Stap 13: De definitieve ontwerpbeoordeling
Ontwerprecensies moeten gedefinieerde deliverables hebben. We raden aan een formulier te ontwerpen voor het documenteren van de ontwerpbeoordeling, waarin de resultaten voor elke ontwerpbeoordeling worden geïdentificeerd. Het formulier moet ook de minimaal vereiste deelnemers per functie definiëren. Andere deelnemers aan de ontwerpbeoordeling moeten worden aangemerkt als optioneel, in plaats van als verplichte beoordelaars en goedkeurders. Als er voor uw ontwerpbeoordelingsproces te veel mensen nodig zijn, zal dit op de lange termijn gevolgen hebben voor de beoordeling en goedkeuring van ontwerpwijzigingen.
De enige vereiste ontwerpbeoordeling is een definitieve ontwerpbeoordeling om de commerciële release van uw product goed te keuren. Houd de DHF niet open na commerciële introductie. Alle wijzigingen na dat punt moeten onder productiecontrole vallen en wijzigingen moeten worden gedocumenteerd in het (DMR)/Technisch Dossier (TF). Als apparaatwijzigingen een nieuwe 510k-inzending vereisen, moet u een nieuw ontwerpproject en DHF maken voor de apparaatwijziging. De nieuwe DHF heeft mogelijk geen wijzigingen in de gebruikersbehoeften en ontwerpinputs, maar u kunt wel kleine wijzigingen ondergaan (een verandering in de sterilisatiemethode vereist bijvoorbeeld testen op herziene ontwerpinputs).
Stap 14: FDA-registratie
Binnen 30 dagen na de eerste distributie van het product in de VS moet u uw vestiging bij de FDA registreren. De registratie moet jaarlijks worden vernieuwd tussen 1 oktober en 31 december en registratie is voor elke faciliteit vereist. Als uw bedrijf buiten de VS is gevestigd, heeft u een initiële importeur nodig die is geregistreerd en moet u zich registreren voordat u het product naar de VS kunt verzenden. Niet-Amerikaanse bedrijven moeten ook een Amerikaanse agent die in de VS woont. Op het moment van registratie bij de FDA wordt van uw bedrijf verwacht dat het voldoet aan alle voorschriften voor de kwaliteitssysteem, UDI, rapportage van medische apparatuur en correcties/verwijderingen.
Stap 15: Post-market surveillance is de ontwerpcontrole-input voor het volgende ontwerpproject
Een van de vereiste resultaten van uw definitieve ontwerpbeoordeling is uw DMR-index. De DMR-index zou een dubbele functie moeten vervullen: hij moet ook voldoen aan de technische documentatievereisten voor andere landen, zoals Canada en Europa. Een Technical File Index bevat echter aanvullende documenten die in de VS niet vereist zijn. Eén van die documenten is uw plan voor post-market surveillance en de resultaten van post-market surveillance. Dat toezicht na het op de markt brengen is een input voor uw ontwerpproces voor de volgende generatie producten. Eventuele gebruiksfouten, softwarefouten of suggesties voor nieuwe functionaliteit moeten worden gedocumenteerd als post-market surveillance en worden beschouwd als potentiële input voor het ontwerpproces voor toekomstige ontwerpprojecten.
Stap 16: Bewaak uw ontwerpcontroleproces
Audit uw ontwerpcontroleproces om mogelijkheden voor verbetering en preventieve acties te identificeren. Audits moeten een beoordeling van de meetgegevens van het ontwerpproces omvatten, en u kunt overwegen kwaliteitsdoelstellingen vast te stellen voor de verbetering van het ontwerpproces. Deze laatste stap, en de standaardisatie van ontwerpverificatieprotocollen in stap vijf (5), worden in een andere stap in meer detail besproken blog van de Medical Device Academy.
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. Automotive / EV's, carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- ChartPrime. Verhoog uw handelsspel met ChartPrime. Toegang hier.
- BlockOffsets. Eigendom voor milieucompensatie moderniseren. Toegang hier.
- Bron: https://medicaldeviceacademy.com/design-controls-implementation/



