Deze blog biedt een diepgaande duik in de nieuwste versie van de FDA eSTAR, versie 5.0, uitgebracht op 6 december 2023.
Waarom heeft de FDA de nieuwe eSTAR-versie uitgebracht als v5.0 in plaats van v4.4?
Een grote versie-update bestaat uit beleidswijzigingen, wijzigingen in de regelgeving of grote wijzigingen aan de sjabloon en wordt aangegeven met een grote versienummerverhoging (bijvoorbeeld 4.3 naar 5.0). Een kleine versie-update bestaat uit andere wijzigingen en wordt aangegeven met een kleine versienummerverhoging (bijvoorbeeld 4.3 naar 4.4). Als er beleids- of regelgevingswijzigingen plaatsvinden, wordt vóór de implementatiedatum een nieuwe hoofdversie van de eSTAR gemaakt en wordt de vorige versie van de eSTAR verwijderd. In dit geval, door PMA-inhoud in te schakelen, worden updates van de internationale pilot van de eSTAR met Health Canada, en de implementatie van cyberbeveiligingsdocumentatievereisten worden beschouwd als grote veranderingen die de noodzaak van een grote versie-update (dat wil zeggen 5.0) veroorzaken in plaats van een kleine versie-update (dat wil zeggen 4.4). Deze wijzigingen zijn van toepassing op de IVD eSTAR en niet-IVD eSTAR. Als u over het algemeen niet bekend bent met de FDA eSTAR, bezoek dan onze 510k cursuspagina.
Wat is de deadline voor het gebruik van v5.0?
Versie 4.3 van de FDA eSTAR, zowel de nIVD- als de IVD-versie, wordt verwijderd van de FDA-website op 4 februari 2024. Alle inzendingen die worden ingediend met een verlopen versie van de eSTAR worden afgewezen. Als u al informatie naar een oudere versie van de sjabloon heeft geüpload, moet u naar de onderkant van de eSTAR scrollen en de gegevens naar een HTML-bestand exporteren. Vervolgens importeert u het HTML-bestand in de nieuwere versie van de eSTAR. Eventuele bijlagen die u aan de oudere versie van de sjabloon hebt toegevoegd, worden niet geëxporteerd en u moet alle bijlagen aan de nieuwe sjabloon toevoegen.
PMA-inhoud is ingeschakeld in de nieuwe FDA eSTAR
Eerdere versies van de FDA eSTAR bevatten de functionaliteit voor inzendingen voor goedkeuring vóór de markt (PMA)., maar in versie 5.0 heeft de FDA deze functionaliteit eindelijk ingeschakeld. 510k-inzendingen zijn er in drie typen: 1) Traditioneel, 2) Verkort en 3) Speciaal. PMA-inzendingen hebben ook verschillende typen. Er zijn twee soorten PMA-inzendingen voor een nieuw apparaat: traditioneel en modulair. Helaas is de FDA eSTAR niet bedoeld voor PMA's die gebruik maken van de modulaire aanpak. Voor apparaten van klasse 3 heeft de FDA strengere controles op wijzigingen dan apparaten van klasse 1 en 2. Daarom is een PMA-supplement is vereist voor de volgende typen wijzigingen aan door PMA goedgekeurde apparaten:
- nieuwe indicaties voor gebruik;
- veranderingen in etikettering;
- veranderingen in faciliteiten voor productie of verpakking;
- veranderingen in productiemethoden;
- veranderingen in kwaliteitscontroleprocedures;
- veranderingen in sterilisatieprocedures;
- veranderingen in verpakking;
- veranderingen in de prestatie- of ontwerpspecificaties, en
- verlenging van de houdbaarheidsdatum.
Er zijn verschillende soorten PMA-supplementen, maar slechts drie soorten supplementen kunnen de FDA eSTAR gebruiken: 1) Panel-Track, 2) 180 dagen en 3) Real Time. Om te bepalen welk type PMA-supplement u moet gebruiken, heeft de FDA richtlijnen gepubliceerd wijzigingen aan apparaten die onderworpen zijn aan het goedkeuringsproces vóór het op de markt brengen.
PMA-inhoud
De volgende secties in de FDA eSTAR zijn specifiek voor de inhoudsvereisten voor PMA-inzendingen:
- Informatie over het kwaliteitsmanagementsysteem
- Faciliteitsinformatie
- Plannen voor post-marktonderzoek (PMS).
- Voeg een uitsluitingsverklaring toe, of een milieubeoordelingsrapport in overeenstemming met 21 CFR 814.20(b)(11)
Health Canada voert een pilot uit met de FDA eSTAR
De FDA eSTAR-pilot van Health Canada is nu vol met in totaal 10 deelnemers (oorspronkelijk waren er slechts 9 gepland). De pilot zal het gebruik van eSTAR testen voor aanvragen ingediend bij Health Canada. De resultaten van de pilot zouden binnenkort bekend moeten zijn, en dan verwachten we een uitbreiding van de pilot naar een breder aantal aanvragers. We hoorden geruchten dat de HC eSTAR te ingewikkeld was. Hopelijk is v5.0 vereenvoudigd.
Waren er wijzigingen in het EMC-testgedeelte?
EMC-labelvragen zijn samengevoegd tot één vraag in plaats van vier, omdat er in deze sectie meestal slechts één citaat wordt gegeven. Hieronder vindt u een kopie van de oudere versie.
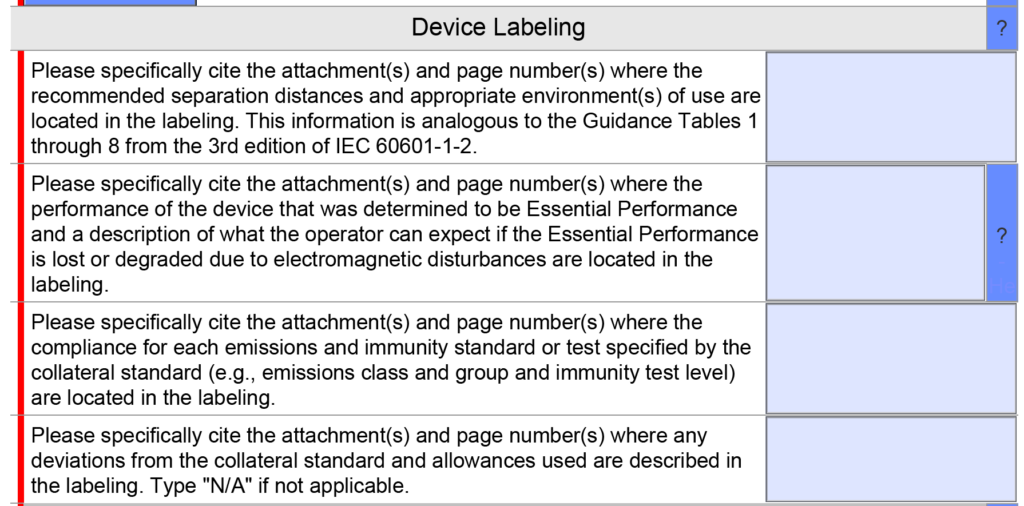
De bijgewerkte versie 5.0 wordt hieronder weergegeven en heeft slechts één vraag, maar de helptekst is gewijzigd.

Heeft de FDA eSTAR nu meer cyberbeveiligingsdocumentatie nodig?
Bhoomika Joyappa heeft onze werkinstructie cybersecurity (WI-007) om de bijgewerkte FDA-richtlijnen voor cyberbeveiligingsdocumentatie aan te pakken. De herzieningen zijn eerder deze maand voltooid en u kunt de bijgewerkte sjablonen op onze website kopen. We hebben onze abonnees ook verteld dat ze moeten anticiperen op een aanzienlijke herziening van de FDA eSTAR  sjabloon wanneer dit gebeurt. De release van de bijgewerkte eSTAR-versie duurde iets meer dan twee maanden, en de verandering resulteerde in een sectie van drie pagina's gewijd aan cyberbeveiligingsdocumentatie. De vorige versies van de sjabloon bevatten een vereiste voor documentatie van cyberbeveiligingsrisicobeheer en een cyberbeveiligingsbeheerplan/-plan voor voortdurende ondersteuning. De volgende documenten moeten in dit gedeelte worden bijgevoegd als cyberbeveiliging op uw apparaat van toepassing is:
sjabloon wanneer dit gebeurt. De release van de bijgewerkte eSTAR-versie duurde iets meer dan twee maanden, en de verandering resulteerde in een sectie van drie pagina's gewijd aan cyberbeveiligingsdocumentatie. De vorige versies van de sjabloon bevatten een vereiste voor documentatie van cyberbeveiligingsrisicobeheer en een cyberbeveiligingsbeheerplan/-plan voor voortdurende ondersteuning. De volgende documenten moeten in dit gedeelte worden bijgevoegd als cyberbeveiliging op uw apparaat van toepassing is:
- risicobeheer – rapport (bijlage)
- risicobeheer – dreigingsmodel (bijlage)
- lijst met bedreigingsmethodologieën (tekstvak)
- verificatie die de documentatie van het bedreigingsmodel bevat (ja/nee vervolgkeuzelijst):
- mondiale systeemvisie
- Schadeoverzicht voor meerdere patiënten
- Weergave van updatemogelijkheden/patchmogelijkheden
- Weergaven van beveiligingsgebruiksscenario's
- cyberbeveiligingsrisicobeoordeling (bijlage)
- paginanummers waar methodologie en acceptatiecriteria zijn gedocumenteerd (tekstvak)
- verificatie dat bij de risicobeoordeling het gebruik van waarschijnlijkheid voor de waarschijnlijkheidsbeoordeling wordt vermeden en in plaats daarvan gebruik wordt gemaakt van exploiteerbaarheid (keuzelijst ja/nee)
- software stuklijst of SBOM (bijvoegen)
- softwareniveau van ondersteuning en datum einde ondersteuning voor elk softwareonderdeel (bijlage)
- besturingssysteem en gebruikte versie (tekstvak)
- veiligheids- en beveiligingsbeoordeling van kwetsbaarheden (bijlage)
- beoordeling van eventuele onopgeloste afwijkingen (bijlage)
- gegevens uit het monitoren van cyberbeveiligingsstatistieken (bijlage)
- informatie over beveiligingscontroles (bijlage)
- paginanummers waar elke beveiligingscontrole wordt geadresseerd (tekstvak):
- Authenticatiecontroles
- Autorisatiecontroles
- Cryptografiecontroles
- Code-, gegevens- en uitvoeringsintegriteitscontroles
- Vertrouwelijkheidscontroles
- Controles voor gebeurtenisdetectie en logboekregistratie
- Veerkracht- en herstelcontroles
- Besturingselementen voor firmware- en software-updates
- architectuuraanzichten (bijvoegen)
- cyberbeveiligingstests (bijlage)
- paginanummers waar cyberbeveiligingslabels worden vermeld (tekstvak)
Wijzigingen in het onderdeel Steriliteit omvatten onder meer een bijgewerkte vraag over EO-residuen
In de steriliteitssectie van de FDA eSTAR was er een vraag over residuen van sterilisatiemiddelen. De vraag was specifiek: “Wat zijn de maximale niveaus van restanten van sterilisatiemiddel die op het apparaat achterblijven?” Ook de ruimte voor het invoeren van de informatie was klein.
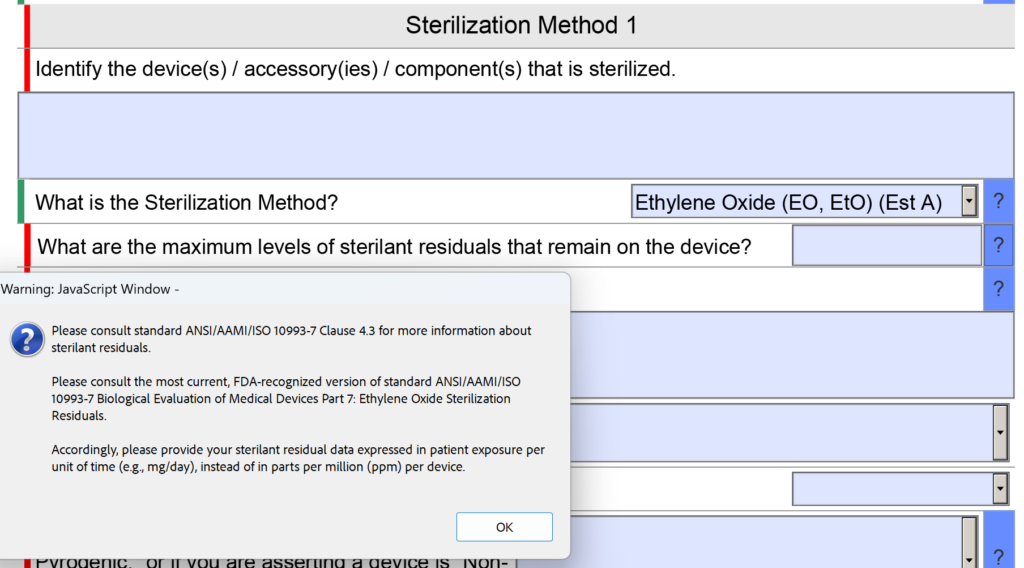
Nu wordt de vraag opnieuw geformuleerd: “Wat zijn de maximale niveaus van residuen van sterilisatiemiddelen die op het apparaat achterblijven, en wat is uw verklaring waarom deze niveaus acceptabel zijn voor het type apparaat en de verwachte duur van het patiëntcontact?” Er is geen wijziging aangebracht in de helptekst voor deze vraag.
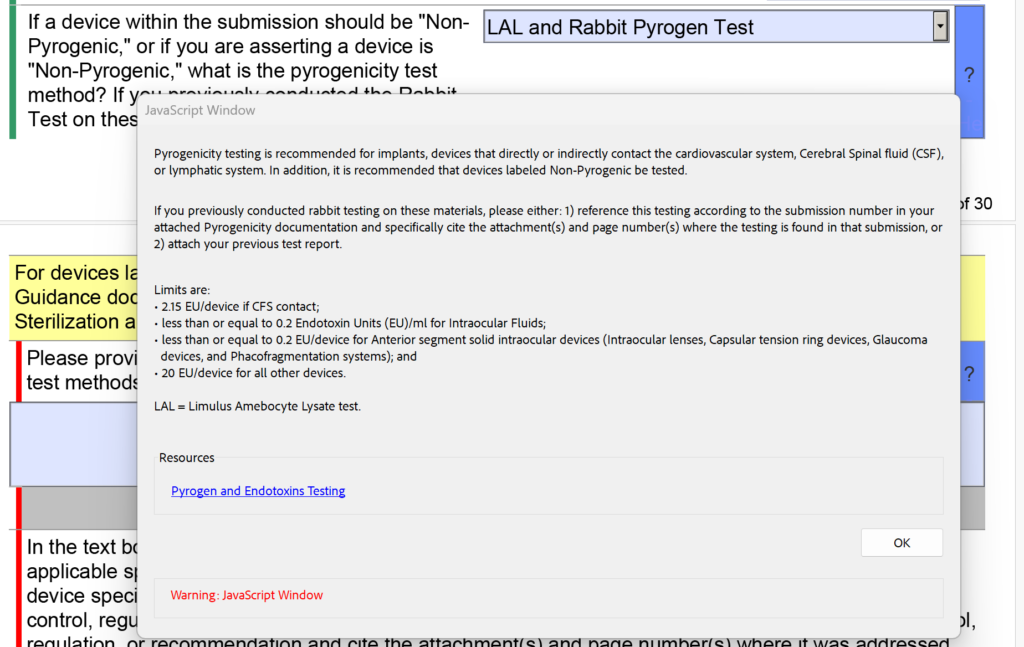
Naast de wijzigingen in de steriliteitssectie met betrekking tot EO-residuen, heeft de FDA ook het vervolgkeuzemenu en de helptekst voor pyrogeniteitstests aangepast. Er waren afzonderlijk opties voor ‘LAL’ en ‘Rabbit Test’, maar nu zijn deze gecombineerd in ‘LAL en Rabbit Pyrogen Test’. Bovendien is de volgende helptekst toegevoegd: “Als u eerder konijnentests op deze materialen hebt uitgevoerd, kunt u: 1) naar deze tests verwijzen volgens het indieningsnummer in uw bijgevoegde Pyrogeniciteitsdocumentatie en specifiek de bijlage(n) en het paginanummer vermelden (s) waar de tests in die inzending voorkomen, of 2) voeg uw vorige testrapport bij.
Wat is de deadline voor het gebruik van v5.0?
Veel klanten zeggen dat ze een foutmelding krijgen wanneer ze de FDA eSTAR-sjabloon proberen te openen. Dit komt omdat ze de eSTAR openen vanuit een PDF-viewer in plaats van Adobe Acrobat Pro.

Sommige mensen willen geld besparen door in plaats daarvan de gratis Adobe Acrobat Reader-software te gebruiken, maar hierdoor kunt u de eSTAR niet correct invullen. Daarom heeft de FDA een pop-upbericht toegevoegd als Adobe Acrobat Reader wordt gebruikt.
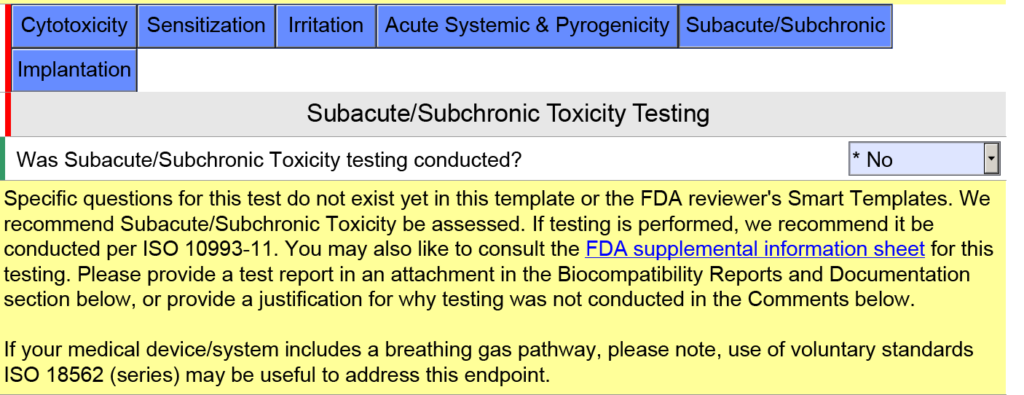
Hoe worden apparaten met een ademgastraject beoordeeld op biocompatibiliteit?
In de onderstaande schermopname heb ik met opzet ‘Oppervlakapparaat: slijmvliesmembraan’ geselecteerd als het type weefselcontact voor een ademhalingsgaswegapparaat, omdat bij het apparaat een mondstuk in uw mond wordt geplaatst (d.w.z. slijmvliesmembraan). Dit is een veel voorkomende fout. In versie 5.0 van de FDA eSTAR verduidelijkt de FDA dat deze apparaten moeten worden beoordeeld als ‘extern communicerend’ en dat het weefselcontact ‘weefsel/bot/dentine’ is. Concreet bestaat het weefselcontact uit de longen. Om deze reden heeft de FDA de onderstaande helptekst in het JavaScript-venster toegevoegd met betrekking tot de toepasbaarheid van ISO 18562-1, -2, -3 en -4.
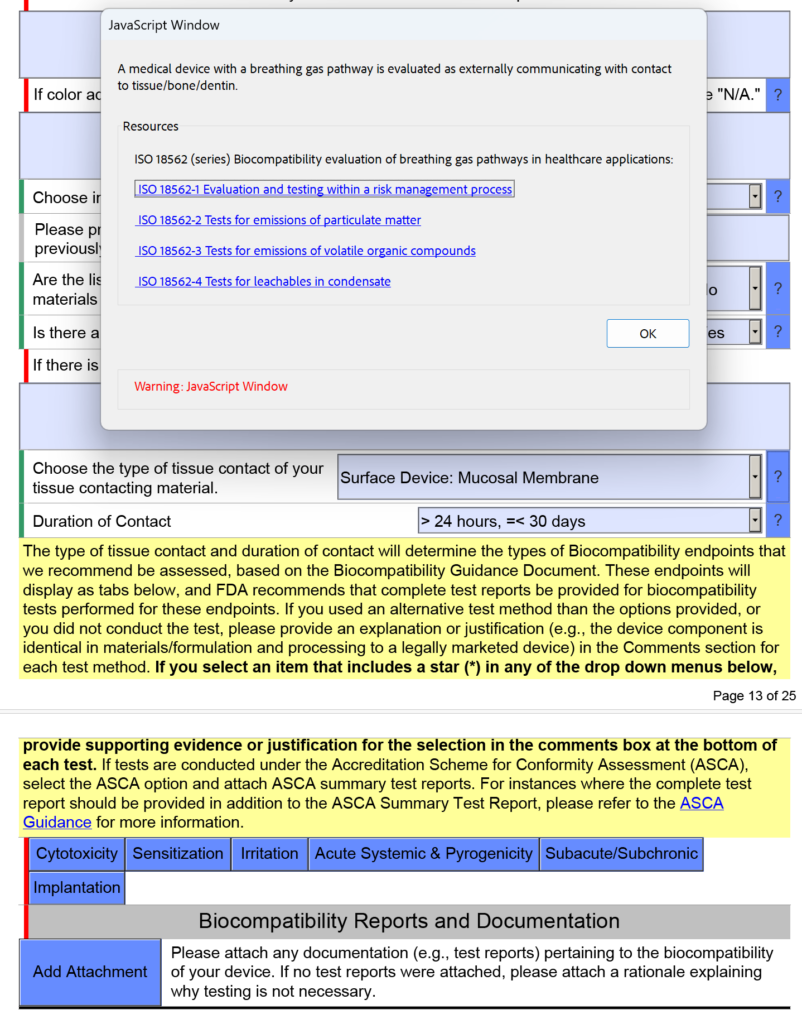
Aanvullende vragen en begeleiding verschijnen wanneer u op de afzonderlijke blauwe vakjes hierboven klikt. Voor het blauwe vak met het label ‘Subacute/Subchronisch’ vindt u aanvullende helptekst met betrekking tot de ISO 18562-normen. Een soortgelijke helptekst wordt gevonden wanneer u op het blauwe vakje met het label 'Acute systemische en pyrogeniteit' klikt.

Wat is een herinnering voor dwarsdoorsnedewijziging?
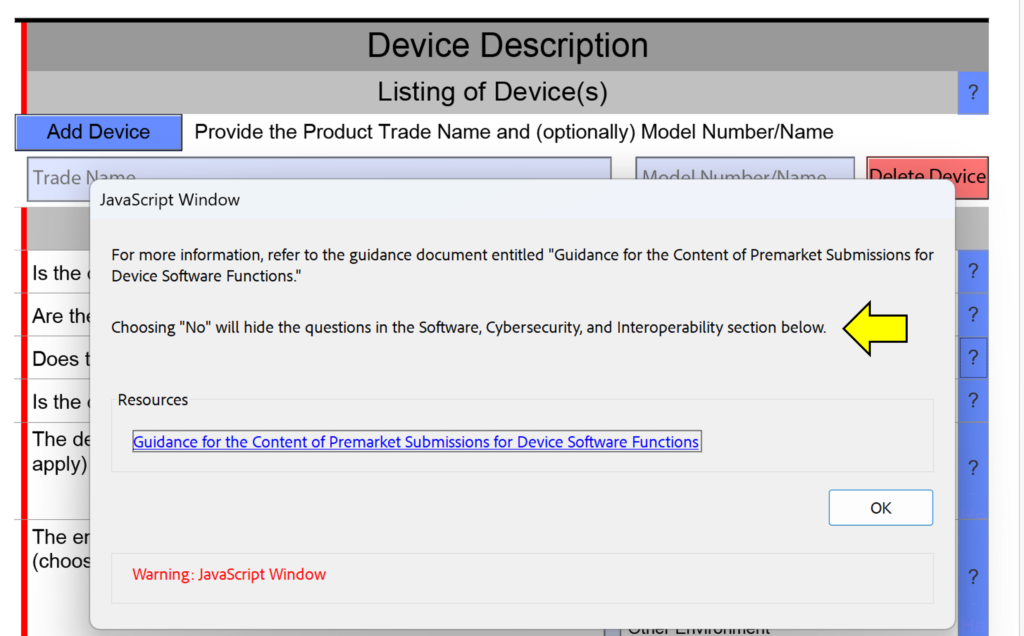
Een van de kleine wijzigingen die in deze FDA eSTAR-versie zijn aangebracht, is de toevoeging van “herinneringen aan wijzigingen in de dwarsdoorsnede” aan de helptekst in het gedeelte met de apparaatbeschrijving. Dit is niet bedoeld om te voorkomen dat u vragen in uw inzending beantwoordt, want als u een gedeelte van de inzending mist omdat u “Nee” hebt geantwoord in plaats van “Ja”, zal de FDA-beoordelaar deze fout tijdens het technische beoordelingsproces identificeren. Dit heeft tot gevolg dat uw inzending in de wacht wordt gezet en dat de beoordelingstijdklok wordt teruggezet op nul dagen wanneer u uw inzending opnieuw indient met de aangebrachte correcties. De onderstaande schermafbeelding toont een voorbeeld van een van deze herinneringen voor dwarsdoorsnedewijzigingen.
Welke wijzigingen zijn er aangebracht in het gedeelte over klinische tests van de FDA eSTAR?
Het klinische testgedeelte wordt nu weergegeven tijdens gebruik PDF-XWijziging bewerken, maar we raden u aan alleen Adobe Acrobat Pro te gebruiken om de FDA eSTAR te bewerken. Deze wijziging is een bugfix en is specifiek voor de nIVD eSTAR. De IVD eSTAR en de nIVD eSTAR bevatten beide een sectie over klinische tests binnen de sectie prestatietests, maar de sectie prestatietests is te vinden in de FDA eSTAR vaardigheden de sectie elektrische veiligheid en EMC-testen, terwijl de sectie prestatietesten wordt gevonden na het gedeelte over elektrische veiligheid en EMC-testen. Als uw bedrijf van plan is klinische gegevens in te dienen bij een toekomstige indiening bij de FDA, hebben we de volgende aanbevelingen:
- kijk de CDRH Leer webinars over het onderwerp 21 CFR 812
- voer een teleconferentie voorafgaand aan de indiening uit om vragen te stellen over uw klinische onderzoeksprotocol vóór de indiening van de IRB of de indiening van de ethische beoordelingsraad
- voordat u het pre-sub-vergaderingsverzoek indient, kijk welke algemene klinische informatie de FDA wil voor een De Novo- of PMA-indiening in de FDA eSTAR

Let op: Het bovenstaande klinische gedeelte is alleen te vinden in de FDA eSTAR als u een De Novo- of PMA-inzending selecteert. Als u een 510k-inzending met klinische gegevens indient, wordt het klinische gedeelte afgekort zoals hieronder weergegeven.

- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://medicaldeviceacademy.com/fda-estar/



