Thí nghiệm động vật
Trứng đã thụ tinh và phôi nhận được cung cấp bởi các nhà lai tạo địa phương và cPGC được lấy từ phôi gà 2.5 ngày tuổi. Việc sử dụng các tế bào này và phôi 6 ngày tuổi không yêu cầu bất kỳ sự chấp thuận về mặt đạo đức nào vì chúng được thu thập từ độ tuổi trước khi hoàn thành XNUMX/XNUMX thời gian ủ bệnh. Nghiên cứu được báo cáo theo hướng dẫn ARRIVE.
phương tiện văn hóa cPGC
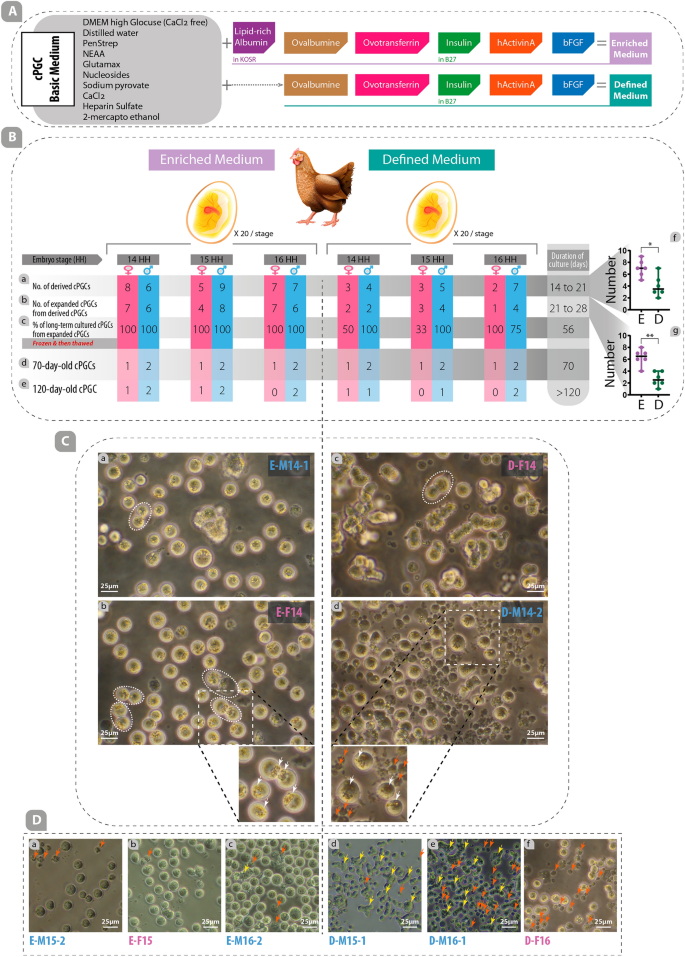
Trong nghiên cứu này, cả môi trường được làm giàu và môi trường xác định đều được sử dụng để nuôi cấy, nhân giống và duy trì cPGC trong nuôi cấy lâu dài (Hình XNUMX). 1A, 2MỘT). Môi trường cơ bản cPGC được chuẩn bị bằng cách pha loãng môi trường DMEM (glucose cao, không glutamine, không canxi; Cat#: 21068028) đến độ thẩm thấu cuối cùng là 250 mOsm (bằng cách trộn 700 ul môi trường và 210 ul nước cất). Môi trường này được bổ sung 2.0 mM GlutaMax, 1X Axit amin không thiết yếu (NEAA), 1X Penicillin/Streptomycin (Pen/Strep), 1 mM ß-mercaptoetanol, 1X nucleoside, 0.4 mM pyruvate, 0.1 mg/mL natri heparin (Sigma ) và 0.15 mM CaCl2 (Sung. 2MỘT). Để tạo ra môi trường xác định, 0.2% ovalbumin (Sigma), 10ug/mL ovotransferrin (Sigma), chất bổ sung 1X B-27, 30 ng/mL hActivin A (Peprotech; nguồn gốc E.Coli, Cat#: 120-14E), và 5 ng/mL bFGF (Peprotech; nguồn gốc E.coli, Cat#: 100-18B) đã được thêm vào môi trường cơ bản cPGC (Hình XNUMX). 2MỘT). Bằng việc bổ sung các chất bổ sung sau đây vào môi trường cơ bản cPGC, một môi trường được làm giàu đã được tạo ra: 1% KOSR chủ yếu chứa albumin giàu lipid, 0.2% ovalbumin (Sigma), 10ug/mL ovotransferrin (Sigma), chất bổ sung 1X B-27 , 30 ng/mL hActivin A (có nguồn gốc từ Peprotech; E.Coli) và 5 ng/mL bFGF (có nguồn gốc từ Peprotech; E.Coli) (Hình XNUMX). 2MỘT). Tất cả các thành phần được sử dụng trong nghiên cứu này đều được lấy từ Thermo Fisher Scientific, Hoa Kỳ, trừ khi có quy định khác.
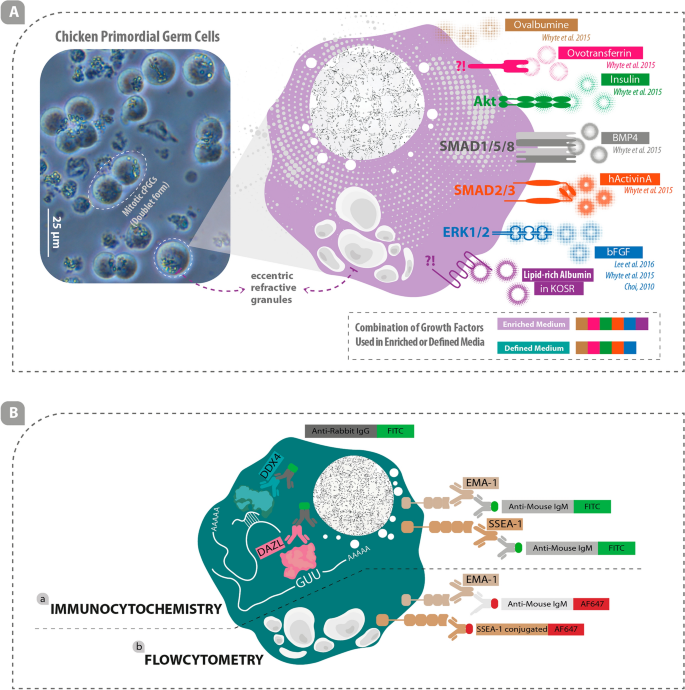
Mô tả thực tế và sơ đồ về cPGC, các yếu tố tăng trưởng liên quan đến sự tồn tại và tăng sinh của cPGC trong ống nghiệm và các dấu hiệu đặc hiệu tế bào gốc/tế bào mầm trong cPGC. (A) Nuôi cấy cPGC 120 ngày tuổi với nhiều tế bào đôi và các hạt khúc xạ lệch tâm nổi bật (trái) và một số yếu tố tăng trưởng quan trọng liên quan đến sự tồn tại và tăng sinh của cPGC được minh họa (phải). (B-a) Hóa mô miễn dịch được thực hiện bằng cách sử dụng các kháng thể chính chống lại protein DDX4 và DAZL cũng như các dấu hiệu bề mặt tế bào EMA1 và SSEA1. Kháng thể thứ cấp liên hợp được sử dụng để dán nhãn cho kháng thể chính. (B-b) Phương pháp tế bào học dòng chảy được thực hiện bằng kháng thể sơ cấp EMA1 được đánh dấu bằng kháng thể thứ cấp liên hợp và kháng thể sơ cấp liên hợp được sử dụng để phát hiện chất đánh dấu bề mặt tế bào SSEA1. (IgG: Globulin miễn dịch G; IgM: Globulin miễn dịch M; FITC: Fluorescein isothiocyanate; AF647: Alexa Fluor 647).
Môi trường được làm giàu cải thiện khả năng tạo dẫn xuất, mở rộng, nuôi cấy lâu dài và tốc độ tăng sinh của cPGC. (A) Các thành phần của môi trường cơ bản cPGC được bổ sung một số loại yếu tố tăng trưởng để tạo thành môi trường giàu dinh dưỡng (đặc biệt chứa albumin giàu lipid do KOSR cung cấp) hoặc môi trường xác định (không có KOSR). (B) Tỷ lệ của các cPGC có nguồn gốc (a), mở rộng (b), nuôi cấy dài hạn (c), 70 ngày tuổi (d) và 120 ngày tuổi (e) được so sánh trong môi trường được làm giàu và xác định. Số lượng cPGC dẫn xuất (f) và mở rộng (g) trong môi trường được làm giàu được so sánh với số lượng trong môi trường xác định. (C) Các tính năng cụ thể của cPGC được nuôi cấy trong môi trường được làm giàu và xác định đã được so sánh. Các đường gạch ngang hình bầu dục biểu thị dạng song song của cPGC (a, b, c). Trong các hình nhỏ, các hạt khúc xạ lệch tâm (mũi tên trắng) và tế bào chết (mũi tên đỏ) được mô tả (E: được làm giàu, D: được xác định, M: nam, F: nữ, giai đoạn 14,15,16: HH). (D) So sánh số lượng tế bào chết (mũi tên đỏ) và tế bào vón cục (mũi tên vàng) trong các dòng tế bào khác nhau của cPGC được nuôi cấy trong môi trường được làm giàu và xác định. *: p < 0.05, **: p < 0.01 có ý nghĩa thống kê.
Tu luyện, tạo nguồn gốc, mở rộng và nuôi cấy lâu dài cPGC trong môi trường được xác định và phong phú
Máu phôi được phân lập từ động mạch chủ lưng của trứng gà thịt Hubbard JA57 màu mỡ ở ba giai đoạn phát triển khác nhau (giai đoạn HH 14, 15 và 16; xem chi tiết trong hình bổ sung. S1). Các mẫu được lấy để xác định giới tính của phôi. Để bắt đầu nuôi cấy sơ cấp, tối thiểu 1 µL máu phôi được đặt trực tiếp vào 100 µL môi trường được làm giàu hoặc xác định trong các đĩa 96 giếng. Các cPGC xuất hiện trong môi trường nuôi cấy sơ cấp của máu phôi từ ngày 14 đến ngày 21 (CPGC có nguồn gốc; Hình XNUMX). 2Ba). Trong thời gian này các tế bào máu bị ly giải hoàn toàn và biến mất. Các cPGC dẫn xuất được chuyển sang đĩa 48 giếng để mở rộng từ ngày 21 đến ngày 28 (Các cPGC mở rộng; Hình XNUMX). 2Bb), sau đó đến các đĩa 24 giếng để tăng sinh thêm và nuôi cấy lâu dài (CPGC nuôi cấy dài hạn; Hình XNUMX). 2Bc). Sau 56 ngày nuôi cấy, cPGC nuôi cấy dài hạn được đông lạnh ở mật độ 0.5–1 × 106 tế bào trên mỗi cryovial. Sau ba ngày, hai cPGC đực và một cái được rã đông và nuôi cấy lại, đồng thời được đánh giá về tốc độ tăng sinh. cPGC 70 ngày tuổi (Hình XNUMX). 2Bd) và cPGC 120 ngày tuổi (Hình XNUMX). 2Be) được sử dụng để xét nghiệm chất xúc tiến, hóa mô miễn dịch, đo tế bào theo dòng chảy và qPCR. Trong nghiên cứu này, một dòng tế bào đã được thiết lập được xác định bằng thời gian nuôi cấy hơn 120 ngày (cPGC 120 ngày tuổi; Hình XNUMX). 2Là).
xét nghiệm tăng sinh
Hai cPGC nam và một nữ 60 ngày tuổi từ mỗi chủng phân lập được nuôi cấy trong môi trường được làm giàu và xác định với mật độ 2 × 103 tế bào trên mỗi giếng của đĩa 24 giếng (Ngày 0: 2000 tế bào/giếng được nuôi cấy). Các tế bào được đếm cách ngày từ ngày 0 đến ngày 10 (Hình bổ sung. S2A, B, C). Để thực hiện xét nghiệm, 10 µL cPGC được lấy từ mỗi đĩa giếng tại mỗi thời điểm, nhuộm bằng thuốc nhuộm Trypan Blue (Thermo Fischer, Hoa Kỳ), nạp vào máy đo huyết sắc tố và đếm. Môi trường được thay đổi hai ngày một lần trong suốt quá trình thí nghiệm.
Phân tích các dấu hiệu đặc hiệu của tế bào mầm và tế bào gốc bằng phương pháp hóa mô miễn dịch
EMA1, chất đánh dấu bề mặt tế bào đặc hiệu tế bào mầm và DAZL/DDX4, chất đánh dấu tế bào chất đặc hiệu tế bào mầm, cũng như SSEA1, chất đánh dấu bề mặt tế bào đặc hiệu tế bào gốc, được dán nhãn bằng các kháng thể chính cụ thể (Anti-SSEA1 và Anti- Kháng thể chính EMA1 được mua từ DSHB, Hoa Kỳ; Kháng thể chính chống DAZL và Anti-DDX4 được mua lần lượt từ Abcam, Hoa Kỳ và Biotem, Pháp) (Hình XNUMX). 1Ba). IgM FITC chống chuột (JIR, Hoa Kỳ) đã được sử dụng làm kháng thể thứ cấp để phát hiện kháng thể chính Anti-SSEA1 / Anti-EMA1 (Hình XNUMX). 1Ba) và IgG FITC chống thỏ (JIR, Hoa Kỳ) đã được sử dụng làm kháng thể thứ cấp để phát hiện các kháng thể chính Anti-DAZL/Anti-DDX4 (Hình XNUMX). 1Ba).
Mỗi nhóm 5×104 các tế bào được rửa hai lần với 2% FBS-DPBS (dung dịch muối đệm phốt phát của Dulbecco) và pha loãng trong 100 μL BSA lạnh 1% (albumin huyết thanh bò) -DPBS. Các phiến kính có 2 điểm và bộ lọc được đặt vào các khe của cytospin với các bộ lọc bằng bìa cứng hướng vào tâm của cytospin (Thermo Fisher Scientific, Hoa Kỳ). 100 μL của mỗi mẫu nhanh chóng được chia vào các giếng của cytospin và các tế bào được quay tế bào ở tốc độ 500 vòng / phút trong 5 phút. Các bộ lọc đã bị xóa khỏi các slide mà không tiếp xúc với các ô được gắn vào các slide. Để kiểm tra hình thái của tế bào, mỗi slide được kiểm tra dưới kính hiển vi. Tất cả các phiến kính sau đó được cố định bằng 100 μL paraformaldehyd 4% (Thermo Fisher Scientific, Hoa Kỳ) trong 10 phút. Để ghi nhãn DAZL/DDX4, các phiến kính được xử lý trong 15 phút ở nhiệt độ phòng bằng triton X-0.5 100%. Các phiến kính được rửa hai lần bằng BSA-DPBS lạnh 1% trong 5 phút và sau đó được ủ trong BSA-DPBS lạnh 1% trong 30 phút. Mỗi kháng thể chính, được chuẩn bị trong 2% BSA với độ pha loãng thích hợp (0.25 µg/mL đối với Anti-SSEA1; 0.5 µg/mL đối với Anti-EMA1; 1:2000 đối với Anti-DDX4; 1:500 đối với Anti-DAZL), được đổ vào trên các phiến kính và ủ qua đêm trong buồng ẩm ở nhiệt độ 4°C. Ngày hôm sau, mỗi slide được rửa hai lần bằng BSA-DPBS lạnh 1% trong 5 phút. Kháng thể thứ cấp thích hợp (1:500 Anti-Mouse IgM-FITC; 1:500 Anti-Rabbit IgG-FITC) đã được thêm vào và ủ trong buồng ướt 4 ° C trong 1 giờ. Các phiến kính được rửa hai lần bằng BSA-DPBS lạnh 1% trong 5 phút. Các slide tương ứng với EMA1 và SSEA1 được nhuộm bằng DAPI để nhuộm hạt nhân. Các slide tương ứng với DAZL và DDX4 được nhuộm bằng 1μM TO-PRO-3 (Thermo Fisher Scientific, Hoa Kỳ) để nhuộm hạt nhân. Sau đó, tất cả các slide được gắn bằng ProLong Diamond Antifade Mounting Medium (Thermo Fisher Scientific, Hoa Kỳ) và được niêm phong bằng DPX (Không chứa Phthalate) (Thermo Fisher Scientific, Hoa Kỳ). Các hình ảnh tương ứng với EMA1 và SSEA1 được phân tích bằng kính hiển vi phát quang (Leica, Đức) và các hình ảnh tương ứng với DAZL và DDX4 được phân tích bằng kính hiển vi đồng tiêu (Leica, Đức).
Phân tích các dấu hiệu đặc hiệu của tế bào mầm và tế bào gốc bằng phương pháp đo dòng chảy
Các cPGC được dán nhãn bằng các kháng thể chính bao gồm EMA1 (pha loãng 1:100; DSHB, Hoa Kỳ) và AF1 liên hợp SSEA647 (pha loãng 1:125; Santa Cruz, Hoa Kỳ) (Hình XNUMX). 1Bb). IgM AF647 chống chuột (pha loãng 1:500; JIR, Hoa Kỳ) đã được sử dụng làm kháng thể thứ cấp để dán nhãn kháng thể chính EMA1 (Hình XNUMX). 1Bb). Để dán nhãn cho các ô, 5 × 105 cPGC (được nuôi cấy trong môi trường được làm giàu hoặc xác định) đã được đếm và ly tâm. Sau đó, viên tế bào được hòa lại trong 1 mL DPBS chứa 5% FBS. Sau khi ly tâm, phần nổi phía trên được loại bỏ và các tế bào được nối lại và ủ trong 100 μL mỗi kháng thể chính trong 1 giờ. Các tế bào được dán nhãn EMA1 được ly tâm và ủ với 100 μL kháng thể thứ cấp IgM AF647 chống chuột trong 30 phút. 900 µL DPBS chứa 5% FBS được thêm vào tất cả các ống và ly tâm. Chất nổi phía trên được loại bỏ và các tế bào được treo lại trong 300 μL DPBS chứa 5% FBS. Các tế bào đối chứng chỉ được dán nhãn bằng kháng thể thứ cấp IgM AF647 chống chuột. Tất cả các bước ly tâm được thực hiện ở tốc độ 1200 vòng / phút trong 3 phút. Phân tích tế bào học dòng chảy được thực hiện bằng thiết bị BD (BD Bioscatics, USA).
Phân tích các gen liên quan đến tính đa năng bằng RT-qPCR
Mức độ biểu hiện của cNANOG và cPOU5F3/OCT4 bảng điểm được định lượng bằng RT-qPCR. Tổng số RNA được chiết xuất từ cPGC bằng cách sử dụng Bộ cách ly RNA (Qiagen, Đức) và 500 ng RNA được sao chép ngược bằng cách sử dụng Bộ tổng hợp cDNA RevertAid First Strand (Thermo Fisher Scientific, Hoa Kỳ) và các đoạn mồi hexamer ngẫu nhiên. qPCR được tiến hành với 50 ng cDNA trong phản ứng 20 µL với RealQ Plus 2 × Master Mix Green (Ampliqon, Đan Mạch) và thiết bị PCR thời gian thực của hệ sinh học ứng dụng (Thermo Fischer, Hoa Kỳ) với ba bản sao kỹ thuật. Các mồi được sử dụng để khuếch đại cNANOG (kích thước sản phẩm PCR: 183 bp) là 5′-GGGATTTATCTACCACAGAATGG-3′ và 5′-CACAGCCATGAACGGATA-3′. Để khuếch đại cOCT4 (kích thước sản phẩm PCR: 87 bp) mồi tiến và mồi ngược là 5′-ACGCTCTATGGGAAGATGTTC-3′ và 5′-CTTCAGCTTGCACATGTTCTTA-3). Mồi xuôi 5′-GAGAAGATGACACAGATC-3′ và mồi ngược 5′-CAGAGTCCATCACAATAC-3 được sử dụng để khuếch đại cACTB (Kích thước sản phẩm PCR: 118 bp). Quy trình PCR bao gồm bước biến tính ban đầu ở 94 (toán học{^circ{rm C} }) trong 15 phút, tiếp theo là 45 chu kỳ biến tính ở 94 (toán học{^circ{rm C} }) trong 30 giây, ủ (ở 50 (toán học{^circ{rm C} }) cho cNANOG và cOCT4 và ở 55 (toán học{^circ{rm C} }) cho cACTB) trong 30 giây và kéo dài ở 72 (toán học{^circ{rm C} }) trong 20 giây, sau đó kéo dài thêm 10 giây ở 72 (toán học{^circ{rm C} }) cho việc thu thập dữ liệu. Phân tích đường cong nóng chảy được thực hiện trong khoảng từ 60 đến 95 (toán học{^circ{rm C} }).
Để tìm ra nhiệt độ phản ứng thích hợp nhất và nồng độ mồi tốt nhất, đồng thời để tối ưu hóa đường cong khuếch đại và nấu chảy, các phản ứng qPCR khác nhau đã được thực hiện. Chuỗi pha loãng của cDNA đã được chuẩn bị để tạo ra các đường cong chuẩn cho cNANOG, cOCT4và ACTB các gen sử dụng hỗn hợp tổng thể SYBR Green qPCR (Ampliqon, Đan Mạch). Để đạt được mục đích này, 2 uL cDNA từ mỗi độ pha loãng đã được thêm vào 18 µL SYBR Green qPCR Mastermix trong ba lần lặp lại kỹ thuật và được đọc theo thời gian thực. Để tạo một đường cong tiêu chuẩn (Hình bổ sung. S3), nhật ký10 nồng độ cDNA cho cNANOG, cOCT4và ACTB các gen được vẽ theo số ngưỡng chu kỳ (Ct). Chúng tôi sử dụng phương trình E = − 1 + 10^(–1/độ dốc) để tính hiệu suất phản ứng. Tỷ lệ biểu hiện gen của cNANOG và cOCT4 các gen trên ACTB gen được tính toán bằng phương pháp Pfaffl28.
Đánh giá sự mở rộng dòng vô tính của cPGC
Khả năng của phương tiện truyền thông hỗ trợ việc mở rộng dòng vô tính của cPGC đã được đánh giá. Một cPGC đơn lẻ được thu thập bằng cách sử dụng vi kim thủy tinh dưới kính hiển vi huỳnh quang và chuyển vào một ngăn duy nhất của đĩa 96 giếng, chứa 100 µL môi trường được làm giàu. Các tế bào được cho ăn 2 ngày một lần bằng cách thay thế 3/XNUMX môi trường cho đến khi thu được số lượng tế bào thích hợp (~ > XNUMX (lần) 104/mỗi giếng của đĩa 96 giếng).
Nguồn và chuẩn bị plasmid
Các plasmid transposon được biến đổi từ vectơ pBP (vectơ transposon PiggyBac) là món quà hào phóng từ phòng thí nghiệm J. Silva (Đại học Cambridge, Vương quốc Anh). Công cụ quảng bá DAZL và DDX4 đã được nhân bản bằng cách khuếch đại PCR từ DNA bộ gen của gà và được nhân bản riêng lẻ trong vectơ pBP (Hình bổ sung XNUMX). S4Aa, Ab, Ba, Bb). Plasmid transposease đã được sửa đổi từ pCMV6-XL5 (Origene Technologies, Ref: pCMV6-XL5) trong đó gen transposease đến từ phòng thí nghiệm Austin Smith (Viện nghiên cứu tế bào gốc, Đại học Edinburgh, Vương quốc Anh) và được nhân bản trong pCMV6-XL5.
Chuyển đổi cPGC
Để chuẩn bị hỗn hợp plasmid, 2 µg DDX4-tdTomato transposon (Hình bổ sung. S4Aa) và 2 µg heoBac transposease được trộn với dung dịch đệm R (được cung cấp trong bộ NEON; Thermo Fisher Scientific, Hoa Kỳ) với thể tích cuối cùng là 10 µL. Để chuẩn bị huyền phù tế bào, 1 × 106 Các cPGC 120 ngày tuổi đã được đếm và chia thành dạng viên. Sau đó, các tế bào được rửa bằng DPBS, tạo thành viên lại và treo lại trong 10 µL dung dịch đệm R. Để chuẩn bị hỗn hợp chuyển nhiễm, 10 µL hỗn hợp plasmid đã được thêm vào huyền phù tế bào 10 µL. Sử dụng pipet NEON và đầu pipet được cung cấp trong bộ sản phẩm (Thermo Fisher Scientific, Hoa Kỳ), 10 µL hỗn hợp chuyển hóa được hút nhẹ nhàng và đầu tip được nạp vào buồng NEON. Quá trình điện hóa được thực hiện bằng cách áp dụng điện áp 650, 850 hoặc 1050 V trong 50 mili giây và 1 xung. Sau khi lấy đầu nhọn ra khỏi buồng NEON, các tế bào được phân phối nhẹ nhàng vào đĩa 24 giếng chứa môi trường làm giàu đã được làm ấm trước. Các tế bào được ủ trong 24 giờ và môi trường được thay đổi hàng ngày sau đó. Để đánh giá hiệu quả của quá trình chuyển nhiễm, một phần tế bào được tạo thành từng viên, rửa hai lần bằng DPBS lạnh và được treo lại trong 200 µL DPBS lạnh. Huyền phù được phân tích bằng phương pháp tế bào học dòng chảy.
Xét nghiệm Promoter
Các cPGC được chuyển hóa/điện hóa bằng các plasmid chứa 2xHS4-DDX4-tdTomato (Hình bổ sung. S4Aa) hoặc 2xHS4-DAZL-tdTomato (Hình bổ sung. S4Ba) để đánh giá chức năng của trình khởi động trong cPGC 120 ngày tuổi.
Đánh giá sự di chuyển tuyến sinh dục của cPGC được nuôi cấy trong môi trường được làm giàu
Trước khi tiêm, trứng màu mỡ 2.5 ngày được đặt thẳng đứng với đầu dẹt hướng lên trên và để ủ tối thiểu một giờ mà không xoay. Trứng được lau bằng ethanol 70%. Một cửa sổ hình tròn 30 mm được mở ở đầu dẹt của quả trứng bằng một mũi khoan nhỏ. Các cPGC dương tính với tdTomato được mở rộng vô tính/không chọn lọc, được nuôi cấy trong môi trường được làm giàu trong hai tuần, đã được tiêm thành công vào động mạch chủ lưng của 2.5 phôi gà 14 ngày tuổi (ở giai đoạn HH 16–5) với thể tích 5 µL chứa 10 × XNUMX3 tế bào. Cửa sổ được bịt kín bằng Parafilm và trứng được tiêm được ủ ở nhiệt độ 37.7 ± 2 ° C với độ ẩm tương đối 60% và lắc theo góc 45 ° mỗi giờ cho đến ngày thứ 6 (ở giai đoạn HH 26–28). Các tuyến sinh dục sáu ngày tuổi (ở giai đoạn HH 26–28) được mổ xẻ bằng kéo mịn và chuyển sang đĩa petri chứa DPBS lạnh. Sự hiện diện của các cPGC dương tính với tdTomato cục bộ đã được đánh giá trong tất cả các tuyến sinh dục được mổ xẻ bằng kính hiển vi soi nổi huỳnh quang (Leica, Đức).
Kiểm tra thống kê
Để phân tích thống kê dữ liệu liên quan đến RT-qPCR, tốc độ dẫn xuất và tốc độ mở rộng, thử nghiệm Mann–Whitney đã được thực hiện. Dữ liệu được coi là có ý nghĩa thống kê tại p < 0.05 và p <0.01.
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Ô tô / Xe điện, Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- BlockOffsets. Hiện đại hóa quyền sở hữu bù đắp môi trường. Truy cập Tại đây.
- nguồn: https://www.nature.com/articles/s41598-023-39536-1