Designkontroller kan vara överväldigande, men du kan lära dig processen med den här steg-för-steg-guiden för att implementera designkontroller. Implementering av designkontroller
Implementering av designkontroller
Du kan implementera designkontroller när som helst under utvecklingsprocessen, men ju tidigare du implementerar din designprocess desto mer användbara blir designkontroller. Det första steget för att implementera designkontroller är att skapa och förfarande för konstruktionskontroller. Du behöver också minst två av följande ytterligare kvalitetssystemets förfaranden:
- Riskhanteringsprocedur (SYS-010)
- Mjukvaruutveckling och validering (SYS-044)
- Användbarhetsprocedur (SYS-048)
- Arbetsinstruktion för cybersäkerhet (WI-007)
A riskhanteringsfil (i enlighet med ISO 14971: 2019) krävs för all medicinsk utrustning, och användbarhetsteknik eller human factors engineering (i enlighet med IEC 62366-1) krävs för all medicinsk utrustning. Programvaran och cybersäkerhetsprocedurerna som anges ovan krävs endast för produkter med 1) programvara och/eller firmware och 2) trådlös funktionalitet eller en åtkomstpunkt för flyttbara media (t.ex. USB-minne eller SD-kort).
Steg 2: Design styr träning
Även om kravet på designkontroller har funnits i mer än 25 år, finns det fortfarande alldeles för många designteam som kämpar med att förstå dessa krav. Regelverk för medicintekniska produkter är komplexa, men designkontroller är den mest komplexa processen i alla kvalitetssystem. Anledningen till detta är att var och en av de sju underklausulerna representerar en miniprocess som i komplexitet är likvärdig med CAPA-grundorsaksanalys. Många företag väljer att skapa separata arbetsinstruktioner för varje underparagraf.
Medical Device Academys träningsfilosofi är att destillera processer ner till diskreta steg som kan absorberas och implementeras snabbt. Vi använder oberoende formulär för att stödja varje steg och utvecklar utbildningar med praktiska exempel, istället för att skriva en eller flera detaljerade förfaranden. Tillvägagångssättet vi lär ut tar bort komplexiteten från din konstruktionskontrollprocedur (SYS-008). Istället förlitar vi oss på strukturen av steg-för-steg-formulär som fylls i i varje steg av designprocessen.
Om du är intresserad av designkontrollträning kommer Rob Packard att vara värd för den 3:e upplagan av vår Design Controls utbildningswebinarium on Fredagen den 11 augusti 2023, klockan 9:30 EDT.
Steg 3: Insamling av övervakningsdata efter utsläppandet på marknaden
Eftermarknadsövervakning krävs för närvarande inte av FDA i 21 CFR 820, men det krävs enligt ISO 13485:2016 i paragraf 7.3.3c) (dvs. riskhantering"). FDA förväntas släppa planerna för övergången till ISO 13485 under räkenskapsåret 2024, men de flesta företag tror felaktigt att FDA inte kräver övervägande efter marknadsövervakning när de designar nya enheter. Detta är inte korrekt. Det finns tre sätt som FDA förväntar sig att eftermarknadsövervakning ska beaktas när du utvecklar en ny enhet:
- Klagomål och negativa händelser i samband med tidigare versioner av enheten och konkurrerande enheter bör identifieras som input till riskhanteringsprocessen för identifiering av faror.
- Om enheten innehåller programvara, bör befintliga sårbarheter i den vanliga programvaran (inklusive operativsystem) identifieras som en del av riskbedömningsprocessen för cybersäkerhet.
- Under processen för mänskliga faktorer bör du söka efter kända användningsfel associerade med tidigare versioner av enheten och konkurrerande enheter; kända användningsrelaterade risker bör även inkludera eventuella användningsfel som identifierats under formativ testning.
Även om FDA för närvarande inte kräver efterlevnad av ISO 13485, erkänner FDA ISO 14971:2019, och övervakning efter marknadsintroduktion identifieras som en input till riskhanteringsprocessen i paragraf 4.2 (se not 2), paragraf 10.4 och Bilaga A.2.10.
Steg 4: Skapa en designplan
Du måste uppdatera din designplan allt eftersom utvecklingsprojektet fortskrider. De flesta design- och utvecklingsprojekt tar ett år innan företaget är redo att lämna in en ansökan på 510 XNUMX till FDA. Oroa dig därför inte för att göra din första version av planen perfekt. Du har ett år på dig att göra många förbättringar av din designplan. Du bör åtminstone uppdatera din designplan under varje designgranskning. En sak som dock är viktig att fånga i din första version är den korrekta regulatoriska vägen för dina avsedda marknader. Om du inte är säker på vilka marknader du planerar att lansera på kan du välja en marknad och lägga till fler senare, eller så kan du välja några och ta bort en eller flera senare. Din designplan bör identifiera de resurser som behövs för utvecklingsprojektet, och du bör uppskatta när du förväntar dig att genomföra var och en av dina designgranskningar.
Innehållet i din designplan
Kravet på designplaner anges i både paragraf 7.3.1 i ISO-standarderna och avsnitt 21 CFR 820.30b i FDA QSR. Du kan göra din plan så detaljerad som du behöver, men jag rekommenderar att du börjar enkelt och lägger till detaljer. Din första version av en designplan bör innehålla följande uppgifter:
- Identifiering av den regulatoriska vägen baserat på enhetens riskklassificering och tillämpliga harmoniserade standarder.
- Utveckling av en riskhanteringsplan
- Godkännande av din designplan (1st design recension)
- Initial riskidentifiering
- Dokumentation och godkännande av användarbehov och designinput (2nd design recension)
- Riskkontroll alternativ analys
- Återkommande utveckling av produktdesignen
- Riskanalys
- Dokumentation och godkännande av designutdata implementering av riskkontrollåtgärder (3rd design recension)
- Designverifiering och verifiering av effektiviteten hos riskkontrollåtgärder (4th design recension)
- Designvalidering och verifiering av effektiviteten av riskkontrollåtgärder som inte kunde verifieras med enbart verifieringstestning
- Klinisk utvärdering och nytta/riskanalys (5th design recension)
- Utveckling av en plan för övervakning efter marknaden med en plan för riskhantering efter marknadsintroduktion
- Utveckling av ett utkast till Device Master Record/Technical File (DMR/TF) Index
- Regulatoriskt godkännande (t.ex. 510k clearance) och stängning av Design History File (DHF)
- Kommersiell release (6th och slutlig designgranskning)
- Gå igenom lärdomar och initiera åtgärder för att förbättra designprocessen
Steg 5: Skapa en detaljerad testplan
Din testplan måste ange vilka erkända standarder du planerar att följa, och alla krav som inte är tillämpliga ska identifieras och dokumenteras med en motivering för att det inte är tillämpligt. Den första versionen av din testplan kommer att vara en tidig version av dina användarbehov och designingångar. Du bör dock förvänta dig att designingångarna ändras flera gånger. Efter att du har fått feedback från regulatorer kan du behöva göra ändringar i designingångarna. Du kan också behöva göra ändringar när du misslyckas med din testning (dvs. preliminär testning, verifieringstestning eller valideringstestning). Om ditt företag följer "Lean Startup”-metod, kommer din första version av designinmatningarna att vara för en lägsta livskraftig produkt (dvs. MVP). När du går vidare genom din iterativ utvecklingsprocess, kommer du att lägga till och ta bort designindata baserat på kundfeedback och preliminära tester. Ditt mål bör vara att misslyckas tidigt och misslyckas snabbt eftersom du inte vill komma till ditt verifieringstest och misslyckas. Det är därför vi genomför en "designfrysning" innan vi påbörjar designverifieringstestning och designöverföringsaktiviteter.
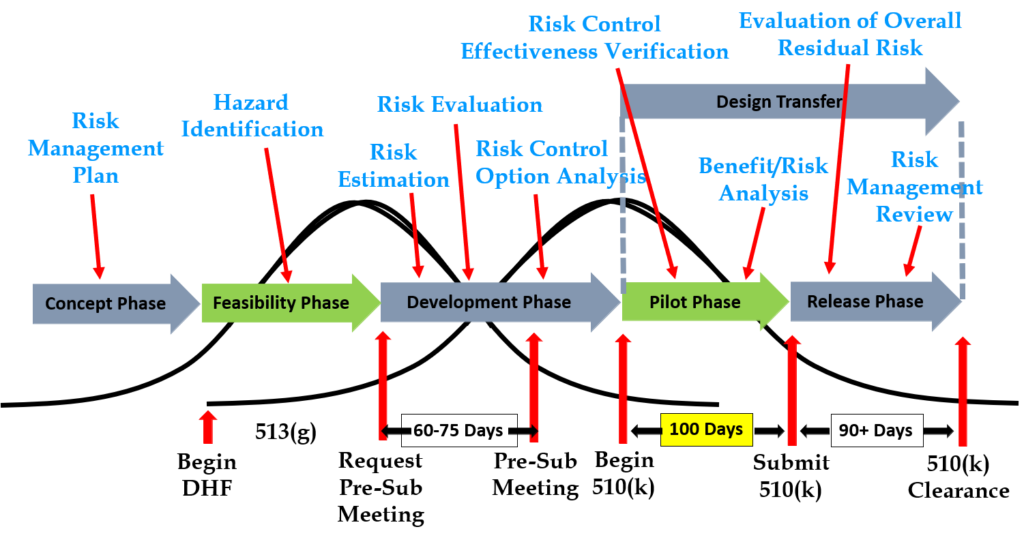
Steg 6: Begär ett förhandsmöte med FDA
Designingångar måste vara kravverifierade genom användning av ett verifieringsprotokoll. Om du identifierar externa standarder för varje designingång kommer du att ha lättare att slutföra verifieringsaktiviteterna, eftersom verifieringstester blir lättare att identifiera. Vissa standarder innehåller inte provningskrav, och det finns krav som inte motsvarar en extern standard. Till exempel är IEC 62366-1 en internationell standard för användbarhetsteknik, men standarden innehåller inga specifika testkrav. Därför måste tillverkare utveckla sitt eget testprotokoll för validering av de implementerade kontrollerna för användbarhetsteknik. Om ditt företag håller på att utveckla en ny steriliseringsprocess (t.ex. UV-sterilisering), måste du också utveckla dina egna verifieringstestprotokoll. I dessa fall bör du skicka in utkastet till protokoll till FDA (tillsammans med tillhörande riskanalysdokumentation) för att få feedback och överenskommelse med din testplan. Metoden för att få skriftlig feedback och överenskommelse med en föreslagen testplan är att skicka in en mötesförfrågan före inlämning till FDA (dvs. PreSTAR).
Steg 7: Iterativ utveckling är hur designkontroller verkligen fungerar
Designkontroller blev ett lagkrav i USA 1996 när FDA uppdaterade kvalitetssystemets regelverk. På den tiden var "V-diagrammet" ganska nytt och begränsat till mjukvaruutveckling. Därför begärde FDA tillstånd från Health Canada att trycka om "Waterfall Diagram" i designkontrollvägledningen som FDA släppte. Båda diagrammen är modeller. De representerar inte bästa praxis, och de gör inte anspråk på att representera hur designprocessen går till i de flesta företag. Den primära informationen som kommuniceras av "Waterfall Diagram" är att användarnas behov valideras medan designinmatningar verifieras. Diagrammet är inte avsett att kommunicera att designprocessen är linjär eller måste utgå från användarbehov, till designingångar och sedan till designutgångar. "V-Diagram" är tänkt att kommunicera att det finns flera nivåer av verifiering och valideringstestning som förekommer, och utvecklingsprocessen är iterativ när programvarubuggar identifieras. Båda modellerna hjälper till att lära ut design- och utvecklingskoncept, men ingen av dem är avsedd att innebära juridiska krav. En av de bästa lärdomarna att lära design- och utvecklingsteam är att detta är ett behov av att utveckla enkla tester för att screena designkoncept så att designkoncept kan misslyckas tidigt och misslyckas snabbt – innan designen fryses. Denna process kallas "riskkontrollalternativanalys" och den krävs i klausul 7.1 i ISO 14971:2019.
Steg 8: "Design Freeze"
Designutdata är ritningar och specifikationer. Se till att du håller dem uppdaterade och kontrollera ändringarna. När du slutligen godkänner designen är detta godkännande av dina designresultat (dvs val av riskkontrollalternativ). Det slutliga urvalet av designresultat eller riskkontrollåtgärder genomförs ofta som ett formellt designgranskningsmöte. Anledningen till detta är att kostnaden för konstruktionsverifiering är betydande. Det finns inga lagstadgade eller lagliga krav på "designfrysning". Faktum är att det finns många exempel där förändringar förväntas men teamet bestämmer sig för att fortsätta med verifieringstestningen ändå. Den bästa praxis som utvecklats av medicinteknisk industri är att genomföra en "designfrysning". Designutgångarna är "frysta" och inga ytterligare ändringar är tillåtna. Handlingen att frysa designen är helt enkelt avsedd att minska affärsrisken att spendera pengar på verifieringstestning två gånger eftersom designutgångarna ändrades under testprocessen. Om en enhet misslyckas med testning kommer det att bli nödvändigt att ändra designen och upprepa testningen, men om alla personer i designteamet är överens om att behovet av ändringar är avlägset och företaget bör börja testa är det mindre troligt att ändringar kommer att göras efter att testet börjar.
Steg 9: Börja designöverföringsprocessen
Designöverföring är inte en enskild händelse i tiden. Överföringen börjar med releasen av din första ritning eller specifikation till inköp och slutar med den kommersiella releasen av produkten. Det vanligaste exemplet på en designöverföringsaktivitet är godkännandet av prototypritningar som en slutgiltig frigiven ritning. Detta är vanligt för gjutna delar. Flera iterationer av plastdelen kan utvärderas med 3D-tryckta delar och bearbetade delar, men för att konsekvent göra komponenten för målkostnaden behövs vanligtvis en formsprutning. Kostnaden för formen kan vara $40-100K, men det är svårt att ändra designen när formen väl är byggd. Ledtiden för formsprutning är ofta 10-14 veckor. Därför kan ett designteam påbörja designöverföringsprocessen för gjutna delar innan en designfrysning genomförs. En annan komponent som kan släppas tidigare som en slutlig design är ett kretskort (PCB). Elektroniska komponenter som motstånd, kondensatorer och integrerade kretsar (IC) kan vara tillgängliga från hyllan, men det råa PCB:et har längre ledtid och är anpassat för din enhet.
Steg 10: Verifiering av designkontroller
Designverifieringstestning kräver förgodkända protokoll och fördefinierade acceptanskriterier. När det är möjligt bör protokoll för designverifiering standardiseras istället för att vara projektspecifika. Information om spårbarhet till den kalibrerade utrustningens identifiering och testmetoder bör inkluderas som en variabel som läggs in manuellt i ett tomt utrymme när protokollet exekveras. Filosofin bakom detta tillvägagångssätt är att skapa ett protokoll en gång och upprepa det för alltid. Detta resulterar i en verifieringsprocess som är konsekvent och förutsägbar, men det eliminerar också behovet av granskning och godkännande av protokollet för varje nytt projekt. Standardiserade protokoll behöver inte ange en leverantör eller datum för testningen, men du kan överväga att dokumentera leverantören/leverantörerna och testets varaktighet i dina designingångar för att hjälpa till med projektledning och planering. Du kanske också vill använda en standardiserad mall för formatet och innehållet i ditt protokoll och din rapport. FDA tillhandahåller en vägledande dokument specifikt för rapportformatet och innehållet för icke-klinisk prestationstestning.
Steg 11: Validering av designkontroller
Designvalidering krävs för att visa att enheten uppfyller användarens och patientens behov. Användarbehov är vanligtvis indikationerna för användning – inklusive säkerhets- och prestandakrav. Designvalidering bör vara mer än bänktestning. Se till att djurmodeller, simulerade anatomiska modeller, finita elementanalys och kliniska studier på människa beaktas. Ett syfte med designvalidering är att visa prestanda för indikationerna för användning, men att validera att implementerade riskkontroller är effektiva för att förebygga användningsrelaterade risker är också viktigt. Därför är summativ valideringstestning av mänskliga faktorer en typ av designvalidering. Testning av mänskliga faktorer kommer vanligtvis att involvera simulerad användning med den slutliga versionen av enheten och avsedda användare. Valideringstestning kräver vanligtvis icke-klinisk prestandatestning sida vid sida med en predikatenhet för en 510 XNUMX inlämning, medan CE-märkningsinlämningar vanligtvis kräver mänskliga kliniska data för att visa säkerhet och prestanda.
Steg 12: Inlämning av FDA 510k
FDA pre-market notification, eller 510k inlämning, är den vanligaste typen av myndighetsgodkännande som krävs för medicinsk utrustning i USA. FDA-inlämningar är vanligtvis möjliga att lämna in tidigare än andra länder, eftersom FDA inte kräver certifiering av kvalitetssystem eller sammanfattande tekniska dokument, och prestandatestningsdata är vanligtvis icke-kliniska tester på bänk. FDA 510k-inlämningar kräver inte heller inlämnande av processvalidering för tillverkning. Därför utförs de flesta verifieringar och valideringar på "produktionsekvivalenter" som tillverkades i liten volym innan den kommersiella tillverkningsprocessen valideras. Validering av kvalitetssystemet och tillverkningsprocessen kan slutföras under FDA 510k granskning.
Steg 13: Den slutliga designgenomgången
Designrecensioner bör ha definierade resultat. Vi rekommenderar att du utformar ett formulär för att dokumentera designgranskningen, som identifierar leveranserna för varje designgranskning. Formuläret bör också definiera det minsta antal deltagare som krävs per funktion. Andra deltagare i designgranskning bör identifieras som valfria – snarare än nödvändiga granskare och godkännare. Om din designgranskningsprocess kräver för många personer kommer detta att ha en långsiktig inverkan vid granskning och godkännande av designändringar.
Den enda designgranskningen som krävs är en slutlig designgranskning för att godkänna den kommersiella utgåvan av din produkt. Håll inte DHF öppen efter kommersiell release. Alla ändringar efter den punkten bör vara under produktionskontroll och ändringar bör dokumenteras i (DMR)/Technical File (TF). Om enhetsmodifieringar kräver en ny 510k-inlämning, bör du skapa ett nytt designprojekt och DHF för enhetsmodifieringen. Den nya DHF:en kanske inte har några ändringar i användarens behov och designingångar, men du kan ha mindre ändringar (t.ex. en förändring i steriliseringsmetoden kräver testning till reviderade designingångar).
Steg 14: FDA-registrering
Inom 30 dagar efter den första produktdistributionen i USA måste du registrera din anläggning hos FDA. Anmälan måste förnyas årligen mellan 1 oktober och 31 december och registrering krävs för varje anläggning. Om ditt företag är beläget utanför USA behöver du en första importör som är registrerad och du måste registrera dig innan du kan skicka produkten till USA. Företag som inte är amerikanska måste också ange en Amerikansk agent som bor i USA. Vid tidpunkten för FDA-registrering förväntas ditt företag vara kompatibelt med alla bestämmelser för kvalitetssystem, UDI, rapportering av medicintekniska produkteroch korrigeringar/borttagningar.
Steg 15: Övervakning efter marknaden är indata för designkontroll för nästa designprojekt
En av de nödvändiga resultaten av din slutliga designgranskning är ditt DMR-index. DMR-indexet bör ha en dubbel funktion genom att även uppfylla tekniska dokumentationskrav för andra länder, såsom Kanada och Europa. Ett tekniskt filindex innehåller dock ytterligare dokument som inte krävs i USA. Ett av dessa dokument är din plan för övervakning efter marknadsintroduktion och resultaten av övervakningen efter marknaden. Denna övervakning efter marknaden är en input till din designprocess för nästa generations produkter. Eventuella användningsfel, programvarubuggar eller förslag på ny funktionalitet bör dokumenteras som övervakning efter marknaden och betraktas som potentiella input till designprocessen för framtida designprojekt.
Steg 16: Övervaka din designkontrollprocess
Granska din designkontrollprocess att identifiera möjligheter till förbättringar och förebyggande åtgärder. Revisioner bör inkludera en genomgång av designprocessens mätvärden, och du kan överväga att fastställa kvalitetsmål för att förbättra designprocessen. Detta sista steg, och standardiseringen av designverifieringsprotokoll i steg fem (5), diskuteras mer i detalj i en annan blogg av Medical Device Academy.
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Fordon / elbilar, Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- PlatoHealth. Biotech och kliniska prövningar Intelligence. Tillgång här.
- ChartPrime. Höj ditt handelsspel med ChartPrime. Tillgång här.
- BlockOffsets. Modernisera miljökompensation ägande. Tillgång här.
- Källa: https://medicaldeviceacademy.com/design-controls-implementation/



