Bereiding van Mel-PLGA NP's
Eenstaps nanoprecipitatie-oplosmiddelvervluchtigingsmethode werd gebruikt voor de synthese van Mel-PLGA NP's26. Twintig mg PLGA (P2191, lactide:glycolide (50:50), molecuulgewicht 30,000-60,000, Sigma Aldrich, VS) werd opgelost in aceton (één ml); en twee mg Mel (73-31-4, molecuulgewicht 232.28, Sigma Aldrich, VS) werd toegevoegd, gevolgd door een half uur centrifugeren om de organische fase [2% (w/v)] te vormen. De gevormde organische fase werd geïnjecteerd in gedestilleerd H2O onder voortdurend roeren gedurende een half uur; gevolgd door verdamping van aceton (bij 37°C onder vacuüm).
Karakterisering van Mel-PLGA NP's
De geproduceerde Mel-PLGA NP's werden verkregen door vriesdrogen en bewaard bij 4°C. De vorm van de bereide nanodeeltjes werd waargenomen met een transmissie-elektronenmicroscoop (TEM). Malvern.
Zetasizer-apparaat werd gebruikt om de grootte en het zeta-potentieel van nanodeeltjes te bepalen.
Inkapselingsefficiëntie (EE%) en medicijnbelading (DL%) van Mel-PLGA NP's26
De hoeveelheid Mel in Mel-PLGA NP's werd bepaald door middel van hogedrukvloeistofchromatografie (HPLC). Waar Mel-PLGA NP's werden opgelost in aceton gevolgd door ultrageluid om de ingekapselde Mel vrij te geven. De oplossing werd twintig minuten bij 3000 rpm gecentrifugeerd om PLGA neer te slaan. De Mel opgelost in het supernatant vertegenwoordigde de ingekapselde massa in NP's. De Mel-afgifte uit Mel-PLGA NP's werd bepaald door één ml NP's te verdunnen met negen ml fosfaatgebufferde zoutoplossing (PBS, pH 7.4); gevolgd door incubatie bij 37°C op een schudapparaat. Op 0, 20, 40, 60, 80 en 100 uur werd 300 µl van de oplossing verwijderd (vervangen door hetzelfde volume met PBS) en 3000 minuten bij 30 rpm gecentrifugeerd. Het EE% en DL% werden berekend met de volgende vergelijkingen:
$${text{EE}}% = left( {{text{mass}};{text{of}};{text{Mel}};{text{in}};{text{Mel}} – {text {PLGA}};{text{NPs}}/{text{total}};{text{mass}};{text{of}};{text{Mel}}} rechts) maal {1}00.$$
$${text{DL}}% = left( {{text{mass}};{text{of}};{text{Mel}};{text{in}};{text{Mel}} – {text {PLGA }};{text{NPs}}/{text{totaal}};{text{massa}};{text{of}};{text{Mel}} – {text{PLGA}};{text{ NP's}}} rechts) maal {1}00.$$
In vitro effecten van Mel-PLGA NP's
In vitro antioxiderende werking van Mel-PLGA NP's 27
Het antioxiderende vermogen van bereide Mel-PLGA NP's is beoordeeld op basis van hun vrije radicalen wegvangende effecten via 1-difenyl-1-picrylhydrazyl [DPPH (2, Sigma Aldrich, VS)]. Eenvoudigweg werden verschillende concentraties NP's (van 281,689 tot 3.9 μg/ml) gemengd met één ml DPPH/ethanoloplossing (1000 mM), geschud en 0.1 minuten met rust gelaten bij 30°C. De absorptie werd gemeten bij 25 nm met ascorbinezuur als referentiestof. DPPH-wegvangende activiteit% = [(A0-EEN1)/EEN0]× 100. De absorptie van het monster was A1, terwijl de absorptie van de controlereactie A was0.
In vitro cytotoxiciteitseffect van Mel-PLGA NP's
De veiligheid van het gebruik van Mel-PLGA NP's werd in vitro onderzocht voordat het in vivo werd gebruikt. Caco2-cellen (Sigma Aldrich, VS) werden bij 37 ° C in 5% CO2 en een relatieve vochtigheid van 95% gekweekt in Dulbecco's gemodificeerd Eagle-medium (DMEM) aangevuld met NaHCO3 (2.2 g/l), d-glucose (4.5 g/l), 1% niet-essentiële aminozuren, 10% foetaal runderserum, 100 IE/ml penicilline en 0.1 mg/ml streptomycine (alle materialen gebruikt in het kweekproces werden gekocht bij Sigma Aldrich, VS). In vitro cytotoxiciteitstests werden uitgevoerd volgens Alaa et al.28. 100 µl/putje van 105 Caco2-cellen in weefselkweekplaten werden 37 uur bij 24 ° C geïncubeerd om de ontwikkeling van celmonolagen mogelijk te maken. Na medium decanteren werd een wasmedium gebruikt om de monolagen te wassen. Gegradeerde concentraties van Mel-PLGA NP's werden geproduceerd door NP's te combineren met RPMI-medium. De geproduceerde NPs-verdunning werd verdund tot 0.1 ml, aan de putjes toegevoegd en vervolgens nog eens 24 uur met rust gelaten. De putjes ontvingen 20 µl MTT (3-(4,5-dimethylthiazool-2-yl)-2-5-difenyltetrazoliumbromide) in een concentratie van 5 mg/ml. De platen werden vijf minuten geschud om menging van MTT te garanderen, en vervolgens vier uur bij 37 ° C met 5% COXNUMX geïncubeerd2. Om het ontwikkelde formazan op te lossen werd 200 µl dimethylsulfoxide (DMSO) op de platen aangebracht. Bij 560 nm werd de absorptie (die direct verband hield met formazan) gemeten.
In vitro coagulatie-effect van Mel-PLGA NP's29
De coagulatieactiviteit van bereide Mel-PLGA NP's werd getest om hun effect te voorspellen bij toediening in vivo. De anticoagulerende activiteit van Mel-PLGA NP's werd beoordeeld door de stollingstijd in seconden bij 37°C te meten, waarbij heparine als controle diende. Volgens de aanbevelingen van de fabrikant werden reagentia voor protrombinetijd (PT) en partiële tromboplastinetijd (PTT) (voorgeïncubeerd bij 37°C gedurende 5 minuten) gebruikt. In het kort werden rattenplasma (900 μl) en verschillende Mel-PLGA NPs-concentraties (100 μl) of heparine opgelost in zoutoplossing gecombineerd. De test werd driemaal voltooid en de stollingstijd werd geregistreerd.
In vitro ontstekingsremmend (hemolyse-remming) effect van Mel-PLGA NP's
Het ontstekingsremmende effect van Mel-PLGA NP's werd bepaald door de hemolyse-remmingstest volgens Anosike et al..30. Vers gehepariniseerd rattenbloed (5 ml) werd 2500 minuten bij 15 rpm gecentrifugeerd; daarna werd de resulterende pellet opgelost met isotone buffer (die equivalent was aan het volume van de bovenstaande vloeistof). Verschillende doses Mel-PLGA NP's (van 100 tot 1000 μg/ml) werden gecombineerd met 5 ml gedestilleerd water om een hypotone oplossing te creëren. Dezelfde doseringen NP's werden gecombineerd met een isotone oplossing (5 ml); en indomethacine werd als controle gebruikt. NPs-oplossingen en controle ontvingen 0.1 ml van de geproduceerde erytrocytensuspensie, die vervolgens een uur bij 37 ° C werd geïncubeerd voordat deze gedurende drie minuten bij 1500 rpm werd gecentrifugeerd. Een spectrofotometer werd gebruikt om het vrijgekomen hemoglobine in het supernatant bij 540 nm te kwantificeren, en het percentage hemolyseremming werd geschat met behulp van de formule: hemolyseremming (%) = 1−[(ODb−ODa)/(ODc−ODa)]× 100. Buitendiametera stond voor monsterabsorptie in een isotone oplossing, ODb voor monsterabsorptie in een hypotone oplossing, en ODc voor controle van de absorptie in een hypotone oplossing.
Dieren en experimenteel ontwerp
Mannelijke Sprague Dawley-ratten, met een gewicht van 200 g en een leeftijd van acht weken, werden gekocht bij het dierenhuis van de National Organization for Drug Control and Research (Caïro, Egypte). Alle experimentele procedures werden uitgevoerd in overeenstemming met de internationale richtlijnen voor de verzorging en het gebruik van proefdieren en voldeden aan de ARRIVE-richtlijnen. Twee doses Mel-PLGA NP's (5 en 10 mg/kg) werden in vivo onderzocht om de werkzaamheid van NP's bij de behandeling van door CCL4 geïnduceerd leverletsel te testen; en ook om de vereiste therapeutische dosis te vinden. Bovendien werden twee doses vrije Mel (5 en 10 mg/kg) gebruikt in de experimentele subgroepen en vergeleken met de subgroepen waaraan Mel-PLGA NP's werden toegediend, om het succes van bereide Mel-PLGA NP's bij het verminderen van de hoeveelheid toegediende Mel te bewijzen. Gezonde controlesubgroepen werden ontworpen als de subgroepen met door CCL4 geïnduceerd leverletsel om een kritische vergelijking en statistische analyse te bereiken. Daarom werden de dieren in twee groepen verdeeld: gezonde (H) en CCL4-levergewonde (I); elke groep werd verdeeld in vijf subgroepen (vijf ratten/subgroep):
-
Gezonde (H) groep:
H-controle GI: negatieve gezonde controleratten.
H Mel (5 mg/kg) GII: gezonde controleratten die 5 mg/kg Mel kregen.
H Mel (10 mg/kg) GIII: gezonde controleratten die 10 mg/kg Mel kregen.
H Mel-PLGA NP's (5 mg/kg) GIV: gezonde controleratten die 5 mg/kg Mel-PLGA NP's kregen.
H Mel-PLGA NP's (10 mg/kg) GV: gezonde controleratten die 10 mg/kg Mel-PLGA NP's kregen.
-
CCL4-levergewonde (I) groep:
Ik beheer onbehandelde GI: onbehandelde ratten met door CCL4 geïnduceerd leverletsel (positieve controle).
I Mel (5 mg/kg) GII: ratten met door CCL4 geïnduceerd leverletsel behandeld met 5 mg/kg Mel.
I Mel (10 mg/kg) GIII: ratten met door CCL4 geïnduceerd leverletsel behandeld met 10 mg/kg Mel.
I Mel-PLGA NP's (5 mg/kg) GIV: ratten met door CCL4 geïnduceerd leverletsel behandeld met 5 mg/kg Mel-PLGA NP's.
I Mel-PLGA NP's (10 mg/kg) GV: ratten met door CCL4 geïnduceerd leverletsel behandeld met 10 mg/kg Mel-PLGA NP's.
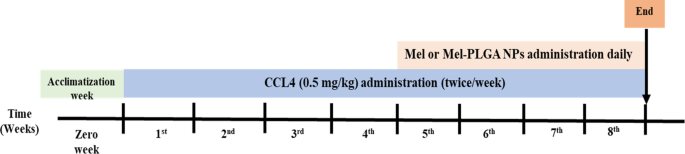
Naast de vehikelgroep (VG) die bestond uit gezonde ratten die gedurende de experimentele periode tweemaal per week 0.1 ml olijfolie kregen via intraperitoneale (ip) injectie. CCL4 werd opgelost in olijfolie en gedurende vier opeenvolgende weken tweemaal per week toegediend in een dosis van 0.5 mg/kg via ip-route. Na de inductie van leverbeschadiging werden Mel of Mel-PLGA NPs gedurende nog eens vier weken dagelijks via de ip-route toegediend (opmerking: ratten bleven tijdens de behandeling CCL4-doses ontvangen) (Fig. 1).
Aan het einde van het experiment werden ratten terminaal verdoofd met 50 mg/kg natriumpentobarbital31. Bloedmonsters werden verzameld via een hartpunctie. Nadat het bloed bij kamertemperatuur had laten stollen, werd serum na 1500 minuten centrifugeren bij 15 rpm verzameld en in porties verdeeld die bij -20°C moesten worden bewaard. Ratten uit alle experimentele groepen werden ontleed voor het verzamelen van organen (lever). In het kort werd de rat op zijn rug op de ontleedbak gelegd en zijn ledematen werden met behulp van tape vastgezet. De huid van de rat werd doorgesneden om de onderliggende spieren bloot te leggen. De buikwand werd losgetrokken en de lever werd voorzichtig verwijderd. Levermonsters (één g), uit alle experimentele groepen, werden gehomogeniseerd met behulp van koude Tris-HCl-buffer om leverhomogenaat (10%) te bereiden.
Biochemische analyse in serummonsters
Leverfunctieparameters werden gemeten om het hepatoprotectieve effect van Mel-PLGA NP's te evalueren. De niveaus van aspartaataminotransferase (AST), alaninetransaminase (ALT), albumine (ab234579, ab263883, ab108789, abcam, VS) en totaal bilirubine (MBS9389057, MyBiosource, VS) werden gemeten met ELISA-kits bij ratten volgens Farid et al..27.
Oxidatieve stressmarkers in leverweefselhomogenaten:
Het antioxiderende effect van bereide NP's werd in vivo bepaald door het meten van de lipideperoxidatiemarker malondialdehyde (MDA) en de antioxiderende enzymen. MDA (MBS268427, MyBioSource, VS), GPx (MBS744364, MyBioSource, VS), SOD (ab285310, VS) en CAT (P04762, CUSABIO, VS) niveaus werden gemeten met ELISA-kits van ratten volgens Farid et al.32 en Amr et al.33.
Cytokinenniveaus in homogenaten van leverweefsel
Het ontstekingsremmende effect van Mel-PLGA NP's werd bepaald door het meten van het niveau van pro-inflammatoire cytokines (TNF-α, IL-1β en IL-6) en het ontstekingsremmende cytokine (IL-10). Cytokineniveaus werden gemeten in de lever van ratten door IL-1β (MBS825017, MyBioSource, VS), TNF-α (ab100785, abcam, VK), IL-6 (P20607, CUSABIO, VS) en IL-10 (P29456, CUSABIO, VS). USA) ELISA-kits voor ratten volgens Farid et al.34.
Matrix-metalloproteïnasenniveaus in leverweefselhomogenaten:
Het effect van Mel-PLGA NP's op de hermodellering van leverweefsel werd geëvalueerd door MMP9 en TIMP1 te meten met ELISA-kits van ratten (respectievelijk MBS722532 en MBS2502910; MyBioSource, VS).
Flowcytometrie techniek
Flowcytometrietechniek werd gebruikt om het effect van bereide NP's op apoptose en intracellulaire apoptotische eiwitniveaus te vinden. Celculturen van hepatocyten werden geproduceerd onder gesteriliseerde omstandigheden. De poortader van ratten onder narcose werd geperfuseerd met collagenasebuffer. De lever werd na perfusie ontleed, de cellen werden gescheiden, gesuspendeerd in William's compleet medium, gefiltreerd door een nylonfilter (100 μm) en vervolgens gekweekt. Het niveau van apoptose in levercellen werd onderzocht met behulp van de Annexin-V-FITC / PI-apoptosedetectiekit (ab14085, abcam, VS). Levercellen werden gepermeabiliseerd door saponine (pH 7.4); en het anti-apoptotische eiwit Bcl2 (11-6992-42) en pro-apoptotische eiwitten [Bax (MA5-14,003), p53 (ab90363), caspase 3 (C92-605) en 8 (ab32125)] werden gemeten met flowcytometrie .
Histopathologisch en immunohistochemisch onderzoek:
Levercoupes werden onderzocht met behulp van de gewone hematoxyline- en eosinekleuringsmethode om de verschillende histopathologische veranderingen tussen experimentele groepen te beoordelen. Immunohistochemische kleuring werd gebruikt om het ontstekingsremmende effect van Mel-PLGA NP's te evalueren. De levermonsters werden gedehydrateerd met behulp van toenemende alcoholniveaus: 70% alcohol gedurende 1.5 uur, 90% alcohol gedurende 1.5 uur en absolute alcohol gedurende 3 uur. De lever werd vervolgens gedurende 4 uur geklaard in xyleen. Na het klaren ondergaan de leverspecimens de infiltratieprocedure, waarbij ze worden geïmpregneerd met zachte, zuivere paraffine via drie verschillende graden (elk een uur durend) bij 56 °C. De monsters werden vervolgens in blokken gerangschikt en ondergedompeld in paraffinewas bij 58 ° C. Voor histologische analyse werden paraffineschijfjes met een dikte van 4 micron gesneden, gekleurd met hematoxyline en eosine, gemonteerd in dibutylftalaat-polystyreenxyleen en vervolgens afgedekt.33,35. Voor immunohistochemisch onderzoek28, H2O2 (3%) [gevolgd door een PBS-wassing en een 60 minuten durende blokkering met runderserumalbumine (BSA, 5%)] werd gebruikt om de endogene peroxidase-activiteit te remmen. Levercoupes werden gewassen in PBS, na een incubatie van 30 minuten met het primaire antilichaam [anti-nucleaire factor-kappa beta (NF-кB) p65-antilichaam (ab86299, abcam, VS) of anti-C-reactief proteïne-antilichaam (C1688). , Sigma Aldrich, VS)]. Het mierikswortelperoxidase (HRP)-konijn anti-rat IgG secundair antilichaam (ab6734, abcam, VS) werd op levercoupes aangebracht en gedurende 60 minuten geïncubeerd. Voor de kleurontwikkeling werd 3-diaminobenzidine (DAB) gebruikt, waarbij de bruine kleur een positief resultaat betekende. Levercoupes werden gewassen en vervolgens tegengekleurd met hematoxyline (3%).
statistische analyse
De gegevens werden uitgedrukt als gemiddelde ± SD en onderzocht door middel van eenwegsvariantieanalyse (ANOVA) met behulp van SPSS versie 20.0 (SPSS Inc., Chicago, VS). Verschillen tussen gemiddelden werden onderzocht met de post-hoc-test van Tukey. Wanneer P < 0.05, waarden werden als significant beschouwd.
Ethische goedkeuring
Alle experimentele procedures en het onderhoud van dieren werden goedgekeurd door het Institutional Animal Care and Use Committee.
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://www.nature.com/articles/s41598-023-43546-4