Het gebruik van de nieuwe FDA eSTAR-sjabloon vereist ook een nieuw proces voor eSTAR-projectbeheer om uw 510k- en De Novo-inzendingen voor te bereiden.
Overzicht van tien (10) belangrijke veranderingen die voortvloeien uit de nieuwe FDA eSTAR-sjabloon
Vanaf 1 oktober 2023 allemaal 510k en De Novo-inzendingen voor de FDA vereisen nu het gebruik van de nieuwe FDA eSTAR-sjabloon en de sjabloon moet worden geüpload naar de FDA-klantsamenwerkingsportaal (CCP). Gisteren heeft de FDA een bijgewerkte richtlijn gepubliceerd waarin de vereisten voor elektronische indiening van 510k worden uitgelegd, maar er zijn tien (10) grote wijzigingen in het indieningsproces van de Medical Device Academy als gevolg van de nieuwe eSTAR-sjablonen:
- We hebben geen inhoudsopgave meer nodig.
- We gebruiken niet langer de volume- en documentstructuur.
- We zijn niet langer verplicht om te voldoen aan de sectie- of paginering van de gehele inzending.
- We maken ons geen zorgen meer over de RTA-screening of checklist (deze bestaat niet).
- We maken niet langer de moeite om een samenvatting te maken (deze is optioneel).
- We hebben geen sectie meer voor Klasse 3-apparaten, omdat er geen Klasse 3 510(k)-apparaten meer zijn.
- We gebruiken niet langer FDA-formulier 3514, omdat die inhoud nu in de eSTAR is opgenomen.
- Wij maken geen conformiteitsverklaring meer op, omdat de eSTAR er automatisch één aanmaakt.
- We raden niet langer aan een 510(k)-samenvatting te maken, omdat de eSTAR er automatisch een maakt
- We gebruiken FedEx niet langer, omdat we in plaats daarvan elektronisch naar FDA CCP kunnen uploaden.
Wat is er anders in de 510k-vereisten?
Ondanks alle waargenomen veranderingen in het pre-market-notificatieproces van de FDA (dwz het 510k-proces), zijn de vereisten voor formaat en inhoud niet veel veranderd. De belangrijkste recente wijziging in het 510k-proces was de vereiste om dit op te nemen cyberbeveiligingstests.
Overzicht van eSTAR-projectmanagement
Er waren 20 secties in een inzending van 510k. Het adviesteam van de Medical Device Academy heeft een sjabloon gemaakt voor de documenten die in elke sectie moeten worden opgenomen. eSTAR-projectmanagement is anders omdat er geen sectienummers zijn waarnaar u kunt verwijzen. Om het overzichtelijk te houden, raden we aan om aan het begin van elke bestandsnaam een of twee woorden te gebruiken om aan te geven in welke sectie het bestand thuishoort. De woorden moeten overeenkomen met de bladwijzers die door de FDA worden gebruikt. U moet er echter op letten dat u de bestandsnamen niet te lang maakt. Hieronder vindt u een lijst met alle secties:
- Administratieve informatie;
- Apparaat beschrijving;
- Predikaten en substantiële gelijkwaardigheid;
- Voordelen, risico's en beperkende maatregelen;
- Etikettering;
- Herverwerking, steriliteit en houdbaarheid;
- Biocompatibiliteit;
- Software/Firmware en cyberbeveiliging/interoperabiliteit
- Software;
- EMC, draadloze, elektrische, mechanische en thermische veiligheid;
- Prestatietesten;
- Kwaliteitsmanagement; En
- Administratieve documentatie.
Het gedeelte over voordelen, risico's en beperkende maatregelen is alleen van toepassing op De Novo-classificatieverzoeken. De sectie Kwaliteitsmanagement bevat subsecties voor informatie over het kwaliteitsmanagementsysteem, informatie over de faciliteit, post-marketstudies en referenties. In de meeste inzendingen zal echter alleen de subsectie Referenties zichtbaar zijn, omdat de andere drie subsecties deel uitmaken van de eSTAR-pilot van Health Canada. Andere secties en subsecties worden afgekort of verborgen, afhankelijk van de vervolgkeuzemenuselecties die u in de eSTAR selecteert. Het cyberbeveiligingsgedeelte blijft bijvoorbeeld verborgen als uw apparaat geen draadloze functionaliteit of een verwijderbaar opslagstation heeft.
Voor inzendingen van 510 is geen inhoudsopgave meer vereist
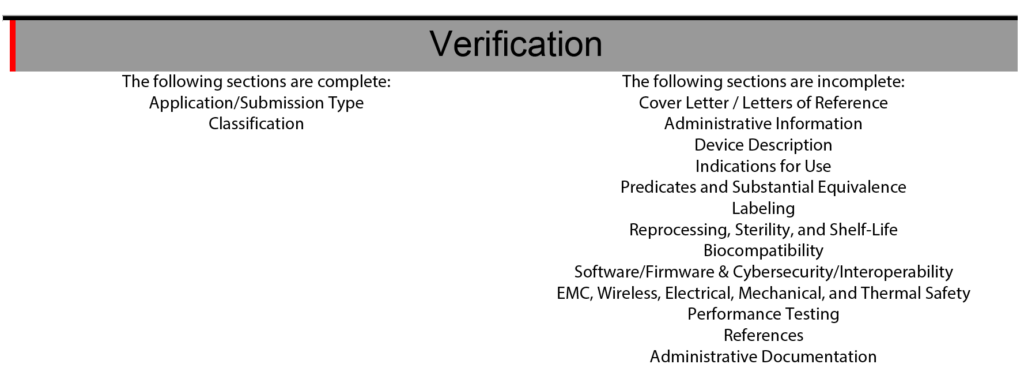
Voor 510 inzendingen met het FDA eCopy-formaat was een inhoudsopgave nodig, en Medical Device Academy gebruikte de inhoudsopgave als hulpmiddel voor projectbeheer. Soms gebruiken we nog steeds onze inhoudsopgave-sjabloon om opdrachten te communiceren en het 510k-project te beheren. De secties van de inhoudsopgave zouden ook een kleurcode hebben groen, blauw, geel en rood om de status van elke sectie te communiceren. FDA eSTAR-projectmanagement gebruikt een soortgelijk kleurcoderingsproces met gekleurde balken aan de zijkant van de sjabloon om aan te geven of de sectie onvolledig, compleet of optioneel is.

De eSTAR heeft ook een verificatiegedeelte aan het einde van de sjabloon om te helpen bij het eSTAR-projectbeheer. Het verificatiegedeelte vermeldt elk van de 13 belangrijkste onderdelen van een FDA eSTAR. Wanneer de secties zijn voltooid, wordt de naam van de sectie automatisch verplaatst van de rechterkant van de verificatiesectie naar de linkerkant. Gedurende de afgelopen twee jaar (2021 – 2023) van de implementatie van het eSTAR-sjabloon heb ik langzaam geleerd om alleen op de eSTAR te vertrouwen om de status van elke sectie te communiceren. Om verantwoordelijkheden toe te wijzen voor elke sectie van de 510k-inzending, gebruiken we nog steeds de eenvoudige lijsten van de inhoudsopgave en projectbeheertools zoals Asana. Het gebruik van de eSTAR-verificatiesectie om de status van elke 510k-sectie te controleren, vergroot ook de vaardigheid van ons team met de eSTAR, elke keer dat we deze gebruiken.
Dropbox gebruiken voor eSTAR-projectbeheer
PreSTAR-sjablonen voor een Q-Sub-vergadering zijn ongeveer de helft van de lengte (dwz 15 pagina's in plaats van 30+ pagina's) van een eSTAR-sjabloon, en voor de inzending van 510k zijn veel meer bijlagen nodig dan voor een Q-Sub. Daarom kunnen we doorgaans een herziene versie van de PreSTAR ter beoordeling naar een teamlid e-mailen, maar we kunnen geen e-mail gebruiken om een bijna volledige eSTAR met een teamlid te delen. Daarom maakt Medical Device Academy gebruik van dropbox om herzieningen van de eSTAR tussen teamleden te delen. Sommige van onze klanten gebruiken One Drive of Google Drive om revisies te delen. Voor elk type test maken we ook submappen aan. Hierdoor blijven alle documenten en testrapporten voor een sectie van de eSTAR op één plek. De softwarevalidatiedocumentatie wordt bijvoorbeeld georganiseerd in één submap van de Dropbox-map voor een 510k-project.
Bij het gebruik van FDA eCopies in plaats van de FDA eSTAR-sjabloon hebben we twintig submappen gebruikt, gelabeld en geordend op volumenummers 1-20. Sommige van deze twintig secties zijn nu verouderd (bijvoorbeeld de Klasse III-samenvatting) en andere (bijvoorbeeld de Indicaties voor gebruik) zijn rechtstreeks in de eSTAR-sjabloon geïntegreerd. Daarom heeft een team mogelijk slechts 20-8 submappen nodig om de documenten en testrapporten voor een project van 10k te ordenen. Normaal gesproken voegen we deze documenten en testrapporten pas toe aan het einde van de voorbereiding van de indiening, want als de FDA een nieuwe versie van de eSTAR vrijgeeft, zullen de bijlagen niet van een oudere versie van de eSTAR naar de nieuwe versie worden geëxporteerd.
Coördinatie van teamsamenwerking is van cruciaal belang voor succesvol eSTAR-projectmanagement
In het verleden gebruikte Medical Device Academy altijd een volume- en documentstructuur om een FDA eCopy te organiseren, omdat dit het mogelijk maakte dat meerdere teamleden tegelijkertijd aan dezelfde 510k-inzending werkten, zelfs uit verschillende landen. Veel klanten zullen SharePoint of Google Docs gebruiken om gelijktijdige samenwerking door meerdere gebruikers te vergemakkelijken. Helaas kan de eSTAR niet door twee gebruikers tegelijk worden bewerkt, omdat het een beveiligde sjabloon is die alleen in Adobe Acrobat Pro kan worden bewerkt. Daarom moet het team communiceren wanneer de eSTAR-sjabloon wordt bijgewerkt en herzieningen bijhouden. Voor de communicatie gebruiken wij een combinatie van instant messenger apps (bijvoorbeeld Slack of Whatsapp) en e-mail, terwijl revisies worden bijgehouden door de initialen en datum van de editor aan de bestandsnaam toe te voegen (bijvoorbeeld nIVD 4.3 rvp 12-5-2023. pdf).
Het belang van peer-reviews
Elke sectie van de FDA eSTAR moet worden ingevuld voordat de inzending kan worden geüpload naar de Customer Collaboration Portal (CCP). Als de FDA eSTAR onvolledig is, zal de CCP het bestand als onvolledig identificeren. U kunt het bestand niet uploaden. Als vragen in de eSTAR onjuist worden beantwoord, worden de secties die moeten worden ingevuld mogelijk niet geactiveerd vanwege de manier waarop de vragen zijn beantwoord. Hieronder staan twee voorbeelden van hoe de eSTAR-vragen onjuist kunnen worden beantwoord.
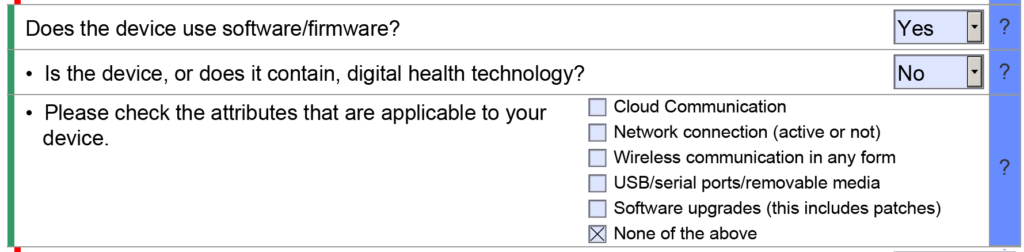
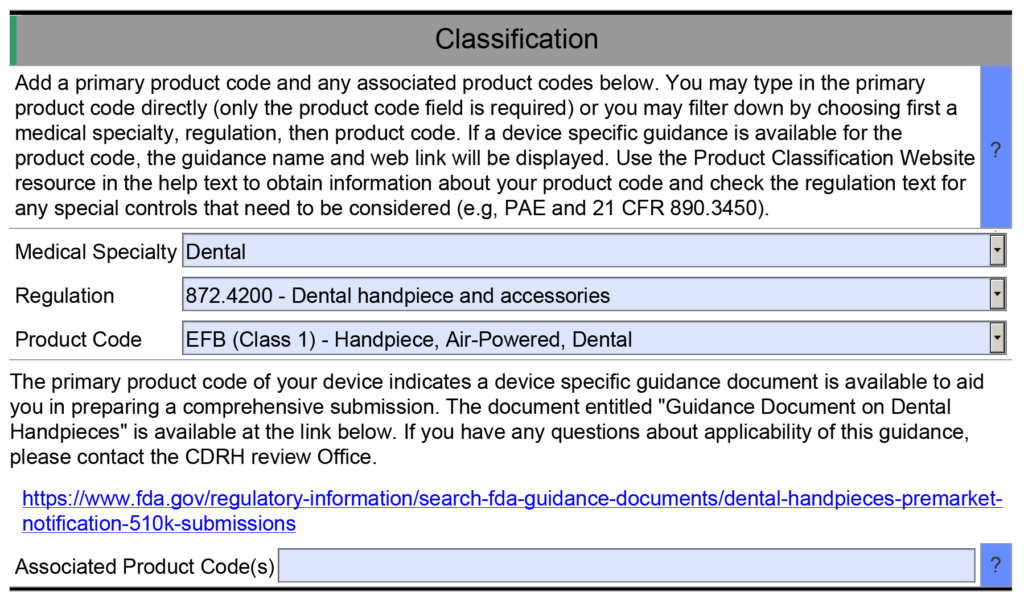
- Voorbeeld 1 – Een van de nuttige kenmerken van de FDA eSTAR is dat veel velden zijn gevuld met een vervolgkeuzemenu met antwoorden. Een voorbeeld vindt u in de sectie Classificatie van de eSTAR. In dit gedeelte moet de indiener de classificatie van het apparaat identificeren door drie vragen te beantwoorden: 1) beoordelingspanel, 2) classificatieregelgeving en 3) de drieletterige productcode. Elk van deze velden gebruikt een vervolgkeuzemenu om het veld in te vullen, en de vervolgkeuzeopties voor vraag twee en drie zijn afhankelijk van de antwoorden op de vorige vraag. Als u echter handmatig de productcode in het veld voor de derde vraag typt, zal de eSTAR geen toepasselijke richtlijnen voor speciale controles voor uw apparaat identificeren. Tenzij u al op de hoogte bent van een toepasselijk begeleidingsdocument voor speciale controles, beantwoordt u vragen in de eSTAR over speciale controles met 'N.v.t.'. De eSTAR identificeert alleen een begeleidend document voor speciale controles voor uw apparaat als u een productcode selecteert in het vervolgkeuzemenu, maar de FDA-recensent weet welke begeleidende documenten voor speciale controles van toepassing zijn. Daarom voert de FDA een technische screening van de eSTAR uit voordat de inhoudelijke beoordeling begint.
- Voorbeeld 2 – Als u de cumulatieve contactduur voor een extern communicerend apparaat < 24 uur aangeeft, verwacht het eSTAR-sjabloon dat u de volgende biocompatibiliteitseindpunten evalueert: cytotoxiciteit, sensibilisatie, irritatie, systemische toxiciteit en pyrogeniteit.
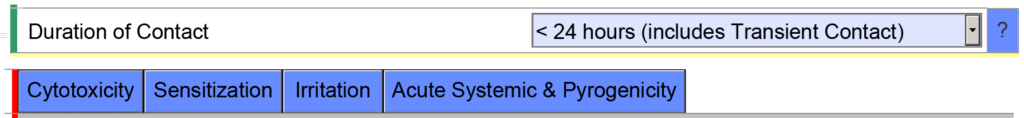
Als u echter aangeeft dat de cumulatieve duur van het contact < 30 dagen bedraagt, wordt het eSTAR-sjabloon gevuld met aanvullende biocompatibiliteitseindpunten. De eSTAR weet niet wat de cumulatieve gebruiksduur is, maar de FDA-recensent wel. Daarom voert de FDA een technische screening van de eSTAR uit voordat de inhoudelijke beoordeling begint.

Om er zeker van te zijn dat alle onderdelen van uw inzending compleet zijn, is het handig om een tweede persoon alle antwoorden te laten beoordelen om er zeker van te zijn dat alles correct is ingevuld. Zelfs ervaren consultants die wekelijks 510 inzendingen voorbereiden, kunnen een fout maken en een vraag verkeerd beantwoorden in een van de eSTAR-velden. Daarom mag u deze kritische kwaliteitscontrole niet overslaan.
Extra 510k-training
Het 510k-boek, “Hoe u uw 510k in 100 dagen kunt voorbereiden”, werd voltooid in 2017, maar het boek is alleen verkrijgbaar als onderdeel van onze 510k cursus serie bestaande uit 58+ webinars. Bezoek alstublieft de webinar-pagina om individuele webinars aan te schaffen.
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://medicaldeviceacademy.com/estar-project-management/



