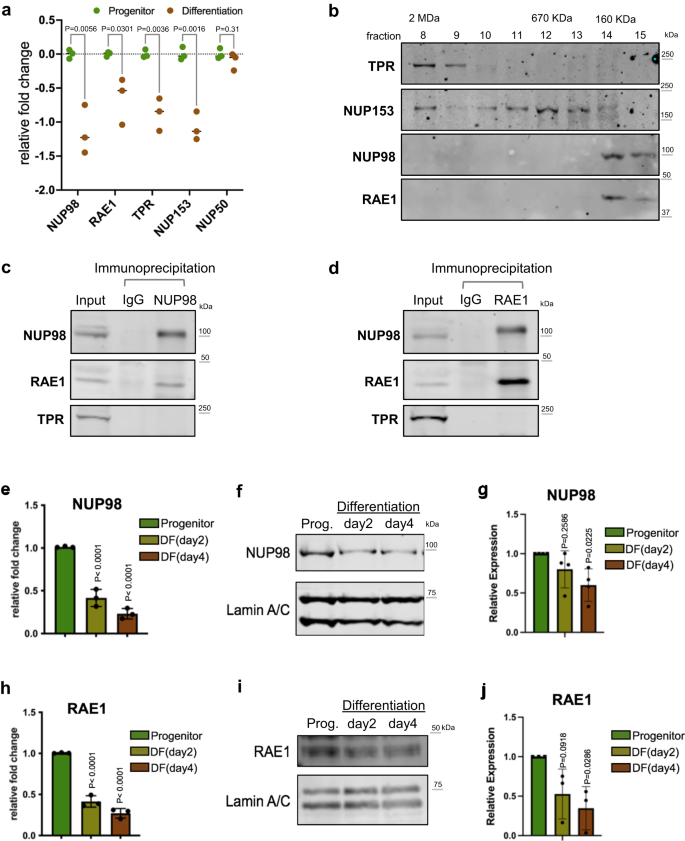
NUP98 と RAE1 には前駆細胞が豊富に含まれており、異なる複合体を構成しています
前駆状態のケラチノサイトと分化状態のケラチノサイトの間で、4 つの核バスケット NUP のうち 5 つが分化において大幅に下方制御されていることを確認しました (図 XNUMX)。 1a)、最近生成した RNA-seq データを活用20。 これらの核バスケット NUP の濃縮が前駆細胞の維持にどのような影響を与えるかを判断するために、これらの NUP が核内の他の複合体に存在するかどうかを調べました。 前駆状態ケラチノサイトの核から可溶性画分を抽出し、サイズ排除クロマトグラフィーを実行しました。 TPR と NUP153 は、2MDa までのより大きなタンパク質複合体サイズに対応する初期の画分の範囲で溶出しましたが、NUP98 と RAE1 は、160 KDa マーカー付近の後の画分でのみ溶出しました (図 XNUMX)。 1b)。 小さなタンパク質複合体に対応する同じ画分での NUP98 と RAE1 の共溶出は、これら 98 つのタンパク質が互いの NUP とは独立して会合している可能性があることを示唆しています。 これをテストするために、前駆状態ケラチノサイトからの核抽出を使用して免疫共沈降を実行しました。 NUP98 抗体は NUP1 と RAE1 の両方を免疫共沈降させました。 RAE1 抗体は、RAE98 と NUPXNUMX の両方を免疫共沈降させました。 どちらの免疫共沈降でも、TPR などの他のヌクレオポリンは濃縮されませんでした (図 XNUMX)。 1c、d)。 RNA は NUP98 と他のタンパク質との相互作用を媒介する可能性があるため23、RNase処理の有無にかかわらずNUP98-RAE1共免疫沈降を比較することでこれを調査しました。 興味深いことに、NUP98 と RAE1 の間の関連性は、RNase による影響を最小限に抑えました (補足図)。 1a)、この文脈では、NUP98-RAE1 相互作用には RNA 成分が必要ないことが示唆されます。 さらに、いくつかの FG ドメインを含む NUP を認識する mAb98 を使用して、NUP1 または RAE414 抗体によって免疫沈降したタンパク質をプローブしました。 mAb414 は入力ライセートで複数のバンドを検出しましたが、このバンドパターンは NUP98 または RAE1 抗体による免疫沈降では観察されませんでした (補足図)。 1b)。 これらのデータは、NUP98 と RAE1 が他の NUP とは独立して前駆体状態において役割を果たしている可能性があることを示唆しています。
a 核バスケット NUP の相対的な mRNA 発現。RNA-seq データに基づいて、前駆状態と分化した (4 日目) 初代ヒトケラチノサイトを比較します (対応のない複数の t 検定、N = 3 生物学的反復)。 b 前駆状態ケラチノサイトの核からの可溶性抽出物を使用した、サイズ排除クロマトグラフィー (SEC) の画分における核バスケット NUP の分布を示すウェスタンブロット。 SEC のタンパク質標準に対応する画分は上部に表示されます。 c, d 核(前駆状態ケラチノサイト)からの可溶性抽出物におけるNUP98とRAE1の間の免疫共沈降を示すウェスタンブロット。 NUP98 と RAE1 は互いに免疫共沈降しましたが、TPR などの他の核細孔サブユニットは共沈降しませんでした。 e ケラチノサイトの前駆体状態、分化初期(98 日目)および中期(2 日目)状態における相対的な NUP4 発現を mRNA レベルで比較する RT-qPCR(事後検定を伴う一元配置 ANOVA、N = 3 の生物学的複製、データは平均値 ± 標準偏差として表されます)。 f, g ローディングコントロールとしてラミンA/Cを使用した、ケラチノサイト分化におけるNUP98タンパク質発現を比較するウエスタンブロットおよび定量(事後検定を伴う一元配置分散分析、N = 4、データは平均±標準偏差として表されます)。 h ケラチノサイト分化における相対的な RAE1 mRNA 発現を比較する RT-qPCR (事後検定を伴う一元配置分散分析、データは平均 ± 標準偏差として表されます)。 i, j ローディングコントロールとしてラミンA/Cを使用した、ケラチノサイト分化におけるRAE1タンパク質発現レベルを比較するウェスタンブロットおよび定量(事後検定を伴う一元配置分散分析、N = 3、定量データは平均±標準偏差として表されます)。
前駆細胞状態から最終分化に移行するNUP98とRAE1の一時的発現をより深く理解するために、qRT-PCRとウェスタンブロッティングの両方を実行して、カルシウム誘導性ケラチノサイト分化の時間経過におけるそれらのmRNAとタンパク質レベルを定量しました。 NUP98 と RAE1 の有意な減少が 2 日目 (分化初期) に検出され、この減少は分化時間経過の 4 日目 (分化中期) まで延長されました (図 XNUMX)。 1e–j)。 これらのデータは、NUP98 および RAE1 の下方制御がケラチノサイト分化の初期事象であり、前駆細胞状態から分化への切り替えを制御する役割を果たしている可能性があることを示しています。
NUP98 または RAE1 のノックダウンは前駆細胞の再生能力を損なう
NUP98 または RAE1 の下方制御が前駆状態から分化への切り替えを促進するかどうかを判断するために、前駆状態のケラチノサイトにおける shRNA 媒介ノックダウンを活用し、その発現を分化状態に匹敵するレベルまで調整しました。 NUP98 または RAE1 の XNUMX つの独立した shRNA が mRNA およびタンパク質レベルで検証されました (図 XNUMX)。 2a、b、補足図 2a–d)。 これら 98 つの shRNA による NUP1 または RAE6 のいずれかの減少は、ケラチノサイトのクローン原性を減少させるのに十分でした (図 XNUMX)。 2c–f)。 前駆細胞の再生能力への影響におけるNUP98またはRAE1の役割を評価するために、皮膚表皮再生における前駆細胞の競合を実施しました。 GFP または DsRed を発現する前駆状態ケラチノサイトの 50:50 混合物を、液体と空気の界面で育てられた失活したヒト真皮上に播種しました。 この器官の再生プロセスは XNUMX 週間で完了し、建築的に忠実な人間の皮膚表皮を形成します。18,19。 GFP 発現ケラチノサイトは、コントロールの非ターゲティング shRNA を共発現しました。 DsRed 発現ケラチノサイトは、98 つの shRNA (非ターゲティング コントロール shRNA、NUP1 ターゲティング shRNA、または RAE98 ターゲティング shRNA) のいずれかを同時発現しました。 両方とも非ターゲティング対照shRNAを発現するケラチノサイトを使用して再生された表皮では、赤色蛍光ケラチノサイトと緑色蛍光ケラチノサイトが組織内で同等の発現を示し、GFPまたはDsRedの発現が前駆細胞の再生能力に差次的に影響を及ぼさないことが示されました。 対照的に、NUP1 または RAEXNUMX shRNA を共発現する赤色ケラチノ サイトは、対照 shRNA を共発現する緑色ケラチノ サイトと競合し、基底前駆細胞コンパートメントでの発現が減少しました (図 XNUMX)。 2g、h)。 これらの発見は、NUP98 と RAE1 の両方の高い発現レベルが前駆細胞の維持に不可欠であることを示唆しています。
a, b NUP3 または RAE98 を標的とする 1 つの独立した shRNA のノックダウン効率を示す RT-qPCR (事後検定を伴う一元配置分散分析、N = 3、データは平均 ± 標準偏差として表されます)。 c–f NUP98 または RAE1 ノックダウンを有するケラチノサイトと対照を比較したクローン原性アッセイの代表的な画像と定量化 (事後検定を伴う一元配置分散分析、N = 3、定量化データは平均 ± 標準偏差として表されます)。 g 表皮組織再生における競合アッセイの代表的な画像。 DsRed または GFP を発現する同数のケラチノサイトを混合し、ヒト真皮上に播種しました。 GFP 発現ケラチノサイトはコントロール shRNA を共発現し、DsRed 発現ケラチノサイトはコントロール shRNA または NUP98 または RAE1 を標的とする shRNA を共発現します (スケール バー = 125 μm)。 h 再生表皮の基底層における DsRed または GFP を発現するケラチノサイトの定量。データは平均 ± 標準偏差として表されます。 i NUP98 と RAE1 ノックダウンの差次的に発現された遺伝子の重複を示すベン図 (フィッシャーの直接確率検定、p = 1 × 10)-321). j NUP98 または RAE1 ノックダウンによる共有遺伝子の相対発現を示すヒートマップ。 k RNA-seq 解析によって特定された、NUP98 および RAE1 ノックダウンによって共有される上方制御または下方制御される遺伝子の上位 XNUMX つの遺伝子オントロジー (GO) 用語。
NUP98 または RAE1 ノックダウンによって影響を受ける主要な細胞プロセスを特定するために、RNA-seq を使用してトランスクリプトーム プロファイリングを実行しました。 合計で、NUP1493 ノックダウンで有意に変化した 98 個の遺伝子、RAE1401 ノックダウンで有意に変化した 1 個の遺伝子を同定しました(p < 0.05、両側、Wald 検定、2 つの独立した shRNA の平均倍率変化 > 1.5、個々の shRNA 倍率変化 > XNUMX、補足データ 1、補足データ 2)。 これら 597 つのセットは 1 個の遺伝子を共有します (p = 10 × XNUMX-321、フィッシャーの直接確率検定)、NUP98 または RAE1 ノックダウンのいずれかで同じ方向(上方制御または下方制御)に変化します(図 XNUMX)。 2i、j)。 上方制御される共有遺伝子のトップジーンオントロジー (GO) 用語には、表皮の発生とケラチノサイトの分化が含まれます。 共通の下方制御遺伝子の上位 GO タームは細胞分裂に関連しています (図 XNUMX)。 2k)。 さらに、これらの共有遺伝子の77%もカルシウム誘導分化において大幅に変化していることを特定しました(補足図)。 S2e)。 さらに、ミトコンドリア電位に敏感な 98 つの異なる色素を利用して、NUP1 または RAEXNUMX のノックダウンがアポトーシスを引き起こすのに十分であるかどうかを調査しました。 H で処理したポジティブコントロールのケラチノサイトでは染色が消失しましたが、2O2、NUP98またはRAE1ノックダウンのケラチノサイトは、コントロールノックダウンと同様の染色を保持しました(補足図。 2f、g)、ノックダウン戦略がアポトーシスを引き起こさなかったことを示唆しています。 したがって、これらの発見は、前駆細胞状態における NUP98 と RAE1 の濃縮が増殖の維持と分化の抑制に不可欠であることを示唆しています。
NUP98は前駆細胞維持における主要な調節因子のTSSの近くに結合する
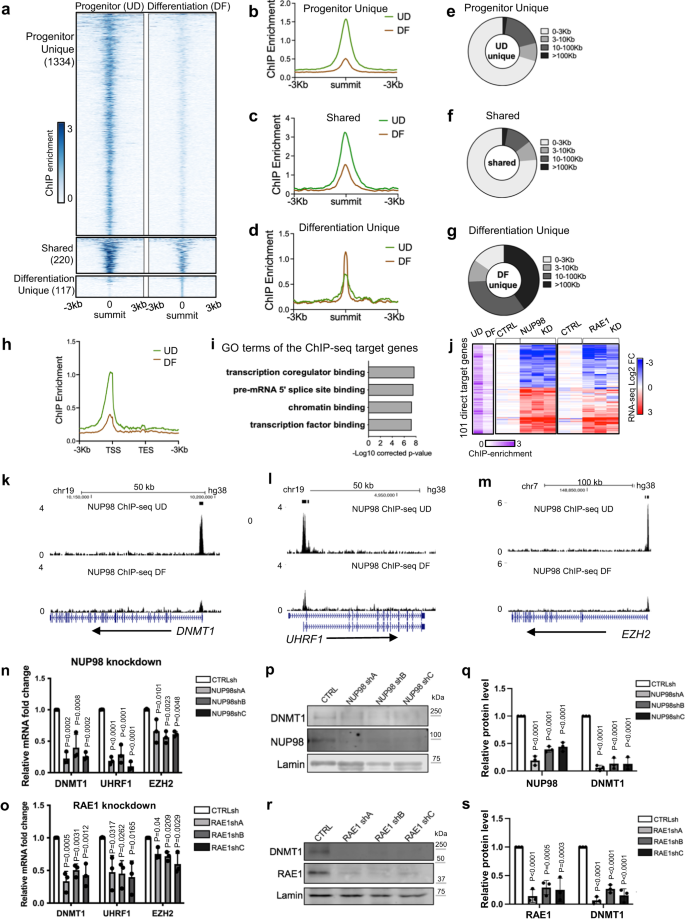
NUP98 は、異なる細胞型の中で異なるゲノム領域に結合することが報告されています。14,24。 NUP98 ゲノム結合が表皮前駆細胞の維持における遺伝子発現にどのように影響するかを調べるために、ケラチノサイトで NUP98 ChIP-seq を実行しました。 前駆状態のケラチノサイトでは、合計 1554 個の NUP98 ChIP ピークを特定しました。 ただし、分化状態では、NUP98 結合はこれらすべての領域にわたって減少します。 これらの NUP86 ChIP-seq ピークの大部分 (1334%、98 ピーク) は、前駆体状態では固有ですが、分化状態では固有ではありません。 これらのピークの 14% (220 ピーク) のみが分化状態でもコールされましたが、これらの領域での ChIP 濃縮も分化では減少します。 少数 (117) の NUP98 ChIP ピークが分化状態に固有のものとして同定され、そのほとんど (74.3%) は TSS から少なくとも 10 kb 離れたところに位置しています。 対照的に、前駆体状態で同定されたほとんどのピーク (71%) は、転写開始部位から 3 kb 以内に位置しています (図 XNUMX)。 3a–g、補足データ 3)。 したがって、前駆体状態から分化への切り替えには、特に転写開始部位付近でのNUP98ゲノム結合の全体的な減少が関与していました(図XNUMX)。 3h).
a–d 前駆体状態 (UD) と分化状態 (DF) の間の NUP98 ChIP 濃縮を比較するサミット中心のヒートマップと平均図。 e–g 最も近い転写開始部位 (TSS) までの距離に基づいて、NUP98 ChIP-seq ピークの分布を示す円グラフ。 h 標的遺伝子の転写開始部位と転写終了部位付近の NUP98 ChIP-seq 濃縮を比較した平均図。 i NUP98 ChIP-seq ピークに関連する最も近い遺伝子の上位遺伝子オントロジー (GO) 用語。 j NUP101 ChIP-seq エンリッチメントを特徴とする 98 個の遺伝子を示すヒートマップ。NUP98 ノックダウンにより大幅に変化します。 これらの遺伝子に関連する UD および DF における NUP98 ChIP の相対的濃縮、および NUP98 または RAE1 ノックダウンによるそれらの相対的発現が、これらの遺伝子ごとに並べて含まれています。 k–m NUP98 ChIP-seq エンリッチメントのブラウザー トラック例(UD と DF を比較)。 n, o NUP98 または RAE1 ノックダウンによる代表的な標的遺伝子の qRT-PCR 検証 (ポストホックテストによる一元配置分散分析、N = 3 生物学的複製、データは平均 ± 標準偏差として表されます)。 p–s ラミンをローディングコントロールとして使用し、DNMT1 タンパク質レベルを NUP98 または RAE1 ノックダウンと比較するウェスタンブロットおよび定量 (事後検定を伴う一元配置分散分析、N = 3、定量データは平均 ± 標準偏差として表されます)。
続いて、前駆体状態の NUP98 ChIP-seq 結合ピークに関連するこれらの遺伝子に注釈を付けました。 上位の GO 用語は、転写補助調節因子結合、クロマチン結合、転写因子結合に関連しています (図 XNUMX)。 3i)、これらの遺伝子が重要な生物学的プロセスの上流制御因子である可能性があることを示唆しています。 ChIP-seq ターゲットと NUP98 RNA-seq データの交差により、合計 101 個の直接ターゲット遺伝子が同定されました。 これら 101 個の直接標的遺伝子の大部分も、RAE1 ノックダウンで同様の上方制御または下方制御を示します (図 XNUMX)。 3j)。 興味深いことに、下方制御された直接標的遺伝子には、DNA メチルトランスフェラーゼ DNMT1 およびそのリクルーター URHF1 など、表皮前駆細胞の維持を制御する主要な制御因子が含まれています。6、ポリコームグループタンパク質EZH23 (イチジク。 3k–o)、DNA複製調節因子CDT1およびRRM2に加えて。 これらの直接標的遺伝子には、DUSP10 や JARID2 などの上方制御される遺伝子も含まれますが、これらはケラチノサイト分化の観点からはあまり特徴付けられていません (補足データ) 4).
スクリーニングした市販の抗体では高品質の ChIP-seq データが得られなかったため、RAE1 が NUP98 と一緒にクロマチンに結合するかどうかを確認するために、HA タグ付き RAE1 コンストラクトを生成し、ケラチノサイトで発現させました。 HA-RAE1は、前駆状態ケラチノサイト内のNUP98を共免疫沈降させました(補足図)。 3a)、HA タグが RAE1 と NUP98 の結合を妨げないことが確認されました。 二重架橋 ChIP-seq を使用して、RAE1 が NUP83 ChIP-seq ピーク領域の 98% に富んでいることを確認しました。 NUP98-RAE1 と重複する ChIP-seq ピークは、主に TSS の近くに位置していますが、NUP98 の固有のピークはありません (補足図)。 3b–f)。 NUP101 の 98 個の直接標的遺伝子のうち、これらの遺伝子のうち 96 個は、DNMT1 および EZH1 を含む RAE2 ChIP-seq 濃縮にも関連しています (補足図)。 3g-i)。 これらの発見は、NUP98 と RAE1 が TSS の近くで直接結合して遺伝子発現を調節していることを示唆しています。
DNMT1 は、ヒト表皮前駆細胞の維持の重要な調節因子として以前に特徴付けられています。6。 ウェスタンブロッティングを使用して、ケラチノサイト分化におけるDNMT1の劇的なダウンレギュレーションを確認しました(補足図)。 4a、b)。 前駆状態ケラチノサイトにおけるDNMT1ノックダウンの公開されたトランスクリプトームプロファイリングデータの活用6、我々は、DNMT1 ノックダウン時に差次的に発現される遺伝子を、NUP98 または RAE1 ノックダウン時に差次的に発現される遺伝子と比較しました。 これらのデータセットの交差により、合計 236 個の共通遺伝子が特定されました(補足図)。 4c、d)。 上方制御された共有遺伝子の上位 GO タームは、表皮の発達とケラチノサイトの分化に関連しています。 下方制御された遺伝子は細胞分裂と DNA 複製に関連しています (補足図)。 4e、f)。 さらに、前駆体条件で培養したケラチノサイトでは、NUP1またはRAE98のノックダウンによりDNMT1タンパク質レベルが大幅に低下することをウェスタンブロッティングを使用して検証しました(図XNUMX)。 3p–s)。 したがって、DNMT1 の下方制御は、NUP98 または RAE1 ノックダウンで観察される分化誘導および増殖阻害の少なくとも一部を説明します。 総合すると、これらのデータは、NUP98 と RAE1 のクロマチン結合が、DNMT1 などの重要な増殖/分化制御因子の発現を直接制御することにより、前駆細胞の維持に関与していることを示唆しています。
NUP98はクロマチン上でHDAC1と共局在し、遺伝子制御においてHDACと協力する
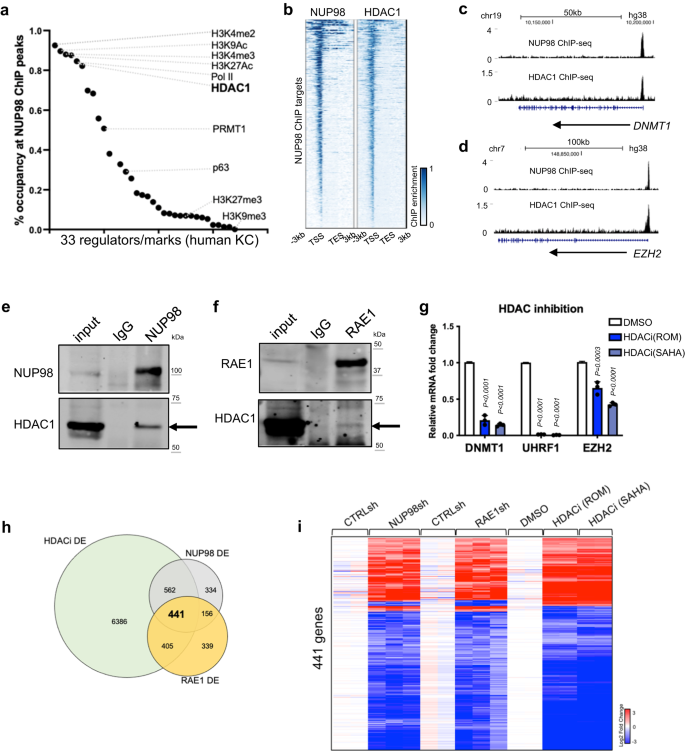
NUP98のクロマチンが増殖/分化プロセスの主要な調節因子をコードする遺伝子に結合することを考慮して、これらの特定のゲノム領域へのNUP98のクロマチン結合を促進する潜在的なメカニズムを調査しました。 モチーフ検索では、ゲノム結合部位の大部分を説明できる特定の転写因子は発見されませんでした。 次に、NUP98 ChIP-seq ピークを、同じ細胞型の初代ヒトケラチノサイトを使用して生成された他の転写調節因子およびヒストンマークの ChIP-seq ピークファイルと比較しました (図 XNUMX)。 4a、補足データ 5)。 転写開始部位近くの NUP98 の結合と一致して、NUP98 ChIP-seq ピーク領域はヒストン マーク (H80K3me4/2、H3K3Ac、H27K3Ac) および Pol II によって多く (>9%) 共占されています。 興味深いことに、HDAC1 はすべての NUP82 ChIP-seq ピークの 98% を共占しており、これは Pol II (85%) に匹敵し、系統特異的転写因子 p63 (29%) よりもはるかに高くなります。 NUP98 と同様に、HDAC1 も、DNMT98 や EZH1 などの NUP2 標的遺伝子の TSS 近くに結合します (図 XNUMX)。 4b–d)。 したがって、HDAC1 は、クロマチン結合および遺伝子制御において NUP98 と協力できる候補として際立っていました。
a NUP98 ChIP-seq ピーク領域における他のエピジェネティック マークまたは調節因子の占有。 b NUP98 ピークにおける NUP1 ChIP-seq と HDAC98 ChIP-seq を比較したヒートマップ。 c, d 代表的な標的遺伝子上の NUP98 と HDAC1 の共占有を示すブラウザー トラック。 e, f HDAC98 を検出するための NUP1 または RAE1 抗体を使用した架橋共免疫沈降。 g HDAC 阻害による RAE1-NUP98 標的遺伝子の相対発現を示す qRT-PCR (事後検定を伴う一元配置分散分析、N = 3、データは平均 ± 標準偏差として表されます)。 hNUP98、RAE1、および HDACi の差次的に発現される遺伝子の重複を示すベン図。 i NUP98 ノックダウン、RAE1 ノックダウン、および HDAC 阻害の間で共有される差次的に発現される遺伝子の発現を示すヒートマップ。
NUP98 と HDAC1 ChIP-seq ピークのこの広範な重複は、これら 98 つのタンパク質が物理的に相互に結合する可能性があることを示唆しています。 我々は架橋免疫沈降法を用いてこれを確認し、NUP1 または RAE1 抗体がケラチノサイト溶解物中の HDACXNUMX を共免疫沈降したことを確認しました(図 XNUMX)。 4e、f)。 HDAC が NUP98 および RAE1 と同様に遺伝子発現に影響を与えるかどうかを判断するために、HDAC 阻害剤のロミデプシン (ROM) および SAHA を利用しました。 これらの阻害剤は、前駆細胞状態で培養されたケラチノサイトに添加されると、DNMT98、UHRF1、EZH1 などの代表的な NUP2 直接標的遺伝子を一貫して下方制御しました (図 XNUMX)。 4g)。 RNA-seq を使用して、NUP74-RAE98 標的遺伝子の 1% も HDAC 阻害によって大幅に変化することをさらに特定しました (図 XNUMX)。 4時間、私は、補足データ 6)。 p300 は造血器悪性腫瘍における NUP98 融合タンパク質と相互作用するタンパク質としても同定されているため25、我々は、p300阻害がケラチノサイトにおけるNUP98の標的遺伝子発現を劇的に変化させないことを発見した(補足図)。 5a)、その HDAC が表皮前駆細胞の維持において NUP98 および RAE1 によって制御される標的遺伝子の調節に特に関与していることを裏付けています。
HDAC阻害によって誘発されるNUP98およびRAE1の標的遺伝子の遺伝子発現変化に基づいて、我々はHDAC1の役割をさらに調査した。 HDAC3 を標的とする合計 1 つの独立した shRNA を設計し、検証しました。 興味深いことに、これらの 98 つの shRNA はすべて、DNMT1 や UHRF1 などの NUP1 および RAEXNUMX の標的遺伝子を一貫して下方制御しました(補足図)。 5b)。 したがって、HDAC1 は、前駆体状態における NUP98 および RAE1 の標的遺伝子発現の制御に関与しています。 ケラチノサイトの分化プロセスでは、HDAC1 のタンパク質レベルはわずかに減少し、前駆細胞の状態と比較して、分化 54 日目の相対発現は平均 4% になります(補足図)。 5c)。 一貫して、HDAC1 ChIPの濃縮は、分化状態では中程度しか減少しませんでした(補足図)。 5d)。 さらに、前駆細胞状態と分化状態の間で、NUP1 結合部位における HDAC98 ChIP-seq の濃縮を比較しました(4 日目、補足図)。 5e–h)。 これらの部位の大部分 (92.1%) では、分化における HDAC1 結合の劇的な減少は示されませんでした。 これらの部位のごく一部 (7.7%) でのみ、HDAC1 濃縮が大幅な減少を示しました (倍率変化 > 2、p < 0.05)。 したがって、分化におけるこれらの部位における NUP1 の大幅な減少とは対照的に、分化における HDAC98 ChIP 濃縮は、分化における NUP98 結合部位におけるわずかな減少のみであり、このことは、共有結合部位における HDAC98 のクロマチン結合の維持に NUP1 が必要ではないことを示唆しています。
NUP98 クロマチン結合は HDAC 活性に依存します
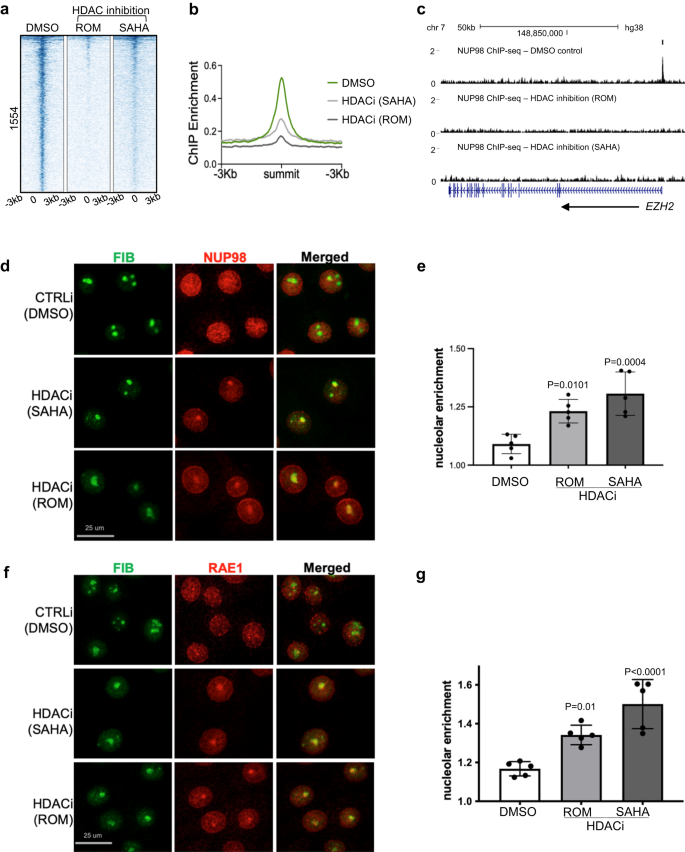
ゲノム結合部位および遺伝子制御においてNUP98とHDAC1が重複していることを考慮して、HDAC活性が上流で機能してNUP98ゲノム結合に影響を与えるかどうかを調べた。 HDAC 阻害の有無にかかわらず、ケラチノサイトで NUP98 ChIP-seq を実行しました。 注目すべきことに、NUP98 ChIP-seqシグナルは、SAHAまたはロミデプシンのいずれかを使用したHDAC阻害により減少しました(図XNUMX)。 5a – c)、NUP98 の標的遺伝子へのゲノム結合が HDAC 活性に依存していることを示唆しています。
a DMSO コントロールと比較した、HDAC 阻害 (ROM または SAHA を使用) による NUP98 ChIP 濃縮を示すヒートマップ。 b DMSO コントロールと比較した、HDAC 阻害 (ROM または SAHA を使用) による NUP98 ChIP 濃縮を示す平均プロファイル。 c 代表的な標的遺伝子を示すブラウザトラック EZH2、前駆体状態で培養されたケラチノサイトにおける、HDAC 阻害による NUP98 ChIP 濃縮と DMSO コントロールの比較。 d HDAC 阻害と DMSO 対照を比較した、NUP98 および核小体マーカー フィブリラリン (FIB) を標的とする抗体で共免疫染色されたケラチノサイトを示す代表的な画像 (スケール バー = 25 μm)。 e HDAC阻害対DMSO対照における核小体における相対的なNUP98濃縮の定量化(事後検定を伴う一元配置ANOVA、N=5、データは平均±標準偏差として表される)。 f, g HDAC 阻害剤と DMSO 対照で処理したケラチノサイトにおける RAE1 と FIB の共免疫染色 (スケール バー = 25 μm)、および定量化 (事後検定を伴う一元配置 ANOVA、N = 5、定量化データは平均 ± 標準として表されます)偏差)。
NUP98 の細胞内局在も HDAC 阻害によって影響を受けるかどうかを確認するために、DMSO 対照と比較して、HDAC 阻害のあるケラチノサイトで NUP98 免疫蛍光染色を実行しました。 対照条件では、NUP98 は核内に拡散した染色を示しましたが、その核周縁部の濃縮に加えて、SAHA または Romidespin による HDAC 阻害により、各核内で一貫して NUP1 の 2 ~ 98 個の凝集巣が生じました。 核小体マーカーであるフィブリリンとの共染色により、NUP98が核小体に局在していることが確認されました(図XNUMX)。 5d、e)。 NUP98 と同様に、RAE1 も HDAC 阻害により核小体に凝集しました (図 XNUMX)。 5f、g).
最近の論文では、転写ストレス下で核小体を標的とする FUS について説明しました。26。 私たちは、FUS が NUP98 および RAE1 の核小体の濃縮に関与しているかどうかを尋ねました。 対照と比較して、HDAC 阻害を伴う NUP98 と FUS の両方について共免疫蛍光染色を実行しました。 HDAC 阻害により NUP98 は核小体で一貫して濃縮されましたが、FUS の濃縮は検出されませんでした(補足図)。 6)。 これらのデータは、NUP98 および RAE1 の核小体標的化が、FUS の核小体への標的化に関与する機構とは独立していることを示唆しています。
NUP98 および RAE1 の核小体局在は、HDAC および HAT 活性によってバランスが保たれています
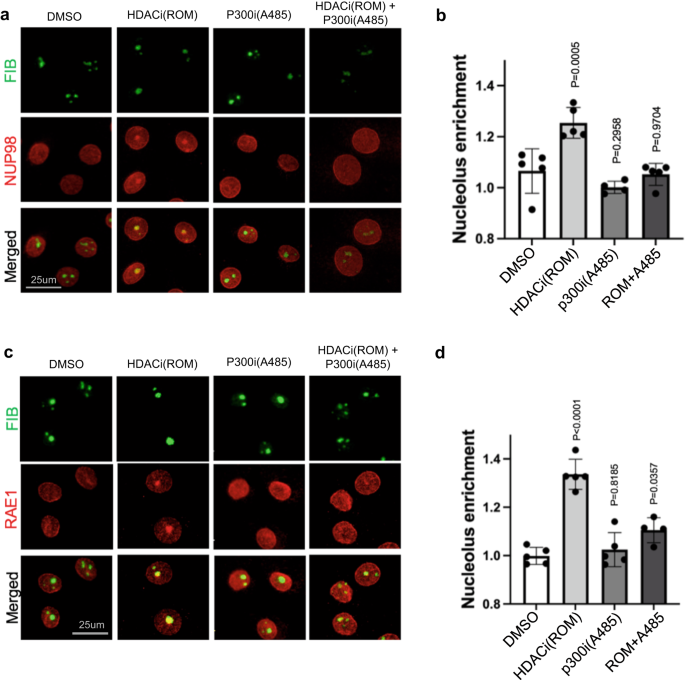
HDAC 阻害によって誘導される NUP98 および RAE1 の核小体の濃縮は、タンパク質のアセチル化がこのプロセスに関与している可能性があることを示唆しています。 これをテストするために、p300/CBP HAT 阻害剤 A485 および C646 を利用して、HDAC 阻害と組み合わせてタンパク質のアセチル化を阻害する実験を設計しました。27,28. 図に示すように、 6 および補足図 7、HAT 阻害単独では、NUP98 または RAE1 の核内局在は有意に変化しませんでした。 しかし、ケラチノサイトをHAT阻害剤で6時間前処理すると、HDAC阻害はNUP98またはRAE1の核小体局在を誘導できなくなりました。 HAT 阻害と HDAC 阻害の間のこの拮抗作用は、300 つの独立した p485/CBP 阻害剤 (A646 または C98) の間で一貫して観察されました。 これらのデータは、HDAC 阻害の結果として、NUP1 または RAEXNUMX の核小体局在化を媒介するタンパク質のアセチル化の役割を裏付けています。
a HDAC 阻害剤、ROM、および/または HAT 阻害剤 A98 で処理したケラチノサイトにおける NUP485 と核小体マーカー FIB の共免疫染色 (スケール バー = 25 μm)。 b これらの処理条件におけるNUP98核小体の濃縮の定量化(事後検定を伴う一元配置分散分析、N = 5、データは平均±標準偏差として表されます)。 c HDAC 阻害剤、ROM、および/または HAT 阻害剤 A1 で処理したケラチノサイトにおける RAE485 と核小体マーカー FIB の共免疫染色 (スケール バー = 25 μm)。 d これらの条件間での RAE1 核小体の濃縮の定量化 (事後検定を伴う一元配置分散分析、N = 5、データは平均 ± 標準偏差として表されます)。
HDAC阻害時の核小体局在化におけるNUP98とRAE1の間の相互依存性
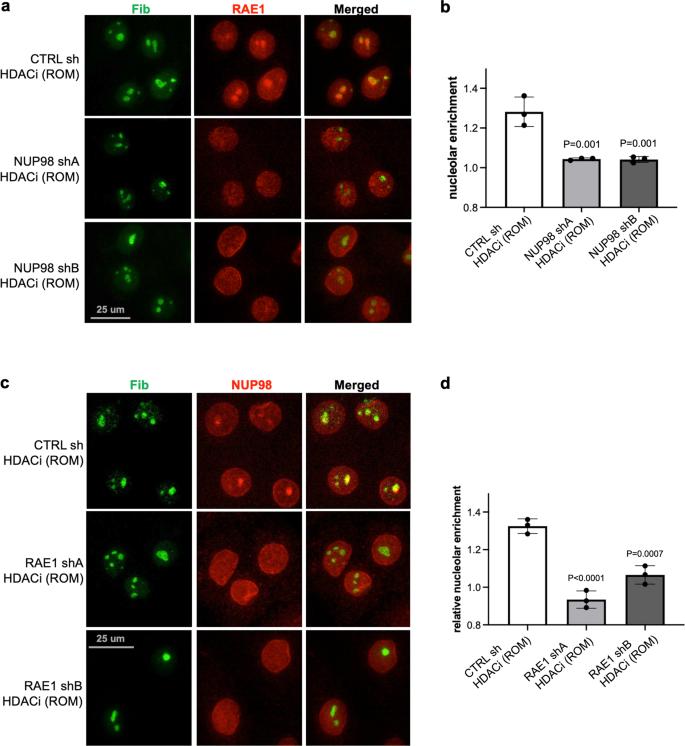
NUP98 と RAE1 の関連性を考慮して、HDAC 阻害に対する NUP98 の核小体標的化が RAE1 に依存するかどうかをさらに調べました。 コントロールの非ターゲティング shRNA を発現するケラチノ サイトは、HDAC 阻害でも依然として NUP98 凝集を示しましたが、この核小体凝集は、RAE1 をターゲティングする shRNA を発現するケラチノ サイトでは消失しました(図 XNUMX)。 7a、b)。 したがって、NUP98 の核小体の濃縮には、RAE1 の完全な機能が必要です。 我々はその後、HDAC 阻害に対する RAE1 の核小体標的化も NUP98 に依存するかどうかを調査しました。 NUP98 shA、NUP98 shB、またはコントロールの非ターゲティング shRNA を発現するケラチノサイトを HDAC 阻害剤 ROM で処理しました。 RAE1 の核小体ターゲティングは、NUP98 shRNA を発現するケラチノサイトでは廃止されましたが、非ターゲティング対照では廃止されませんでした。 NUP98を標的とする1つの独立したshRNAを使用しても、RAEXNUMXは核小体を標的としませんでした(図XNUMX)。 7c、d)。 RAE1 ノックダウンだけでは NUP98 核小体局在化は誘導されず、NUP98 ノックダウンは HDAC 阻害なしでは RAE1 核小体局在化を誘導しませんでした(補足図)。 8)。 これらの所見は、NUP98 と RAE1 が相互に依存して、HDAC 阻害時に核小体に局在することを示しています。
a, b NUP1 ノックダウンと対照ノックダウンで処理したケラチノサイトにおける RAE98 と核小体マーカー FIB の共免疫染色を示す代表的な画像 (スケール バー = 25 μm)、およびこれらの条件間での RAE1 核小体濃縮の定量化 (ポストホック テストを伴う一元配置 ANOVA、 N = 3、定量化データは平均 ± 標準偏差として表されます。 c, d RAE98 ノックダウンと対照ノックダウンで処理したケラチノサイトにおける NUP1 と核小体マーカー FIB の同時免疫染色 (スケール バー = 25 μm)、およびこれらの条件間での NUP98 核小体濃縮の定量化 (ポストホック テストによる一元配置 ANOVA、N = 3) 、定量化データは平均±標準偏差として表されます)。
総合すると、これらの発見は、NUP98 と RAE1 が、発現上昇と HDAC 活性という 98 つの条件下で重要なエピジェネティック制御因子に直接結合してその発現を制御することにより、前駆細胞の維持を促進するというモデルを示唆しています。 前駆体状態での発現の上昇により、NUP1 と RAE98 の可溶性核内プールの存在が可能になり、核細孔結合に加えてクロマチン結合が可能になります。 HDAC 活性は、NUP1 および RAE98 の核小体ターゲティングに拮抗するのにも不可欠であり、自己複製のための重要なエピジェネティック制御因子に対する NUPXNUMX ゲノムターゲティングを促進します (図 XNUMX)。 8).
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 自動車/EV、 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- ブロックオフセット。 環境オフセット所有権の近代化。 こちらからアクセスしてください。
- 情報源: https://www.nature.com/articles/s42003-023-05043-2