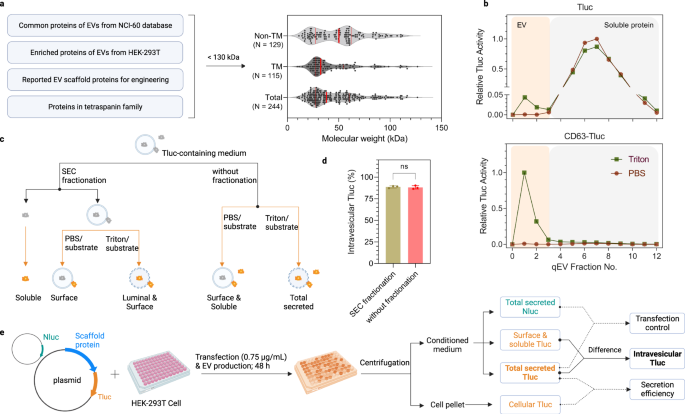
EVソーティングタンパク質をスクリーニングするための簡単なアッセイ
効率的な EV 選別タンパク質を求めて、文献レビューとプロテオミクス データベースに基づいて候補のリストが作成されました。 潜在的な候補は、(1) NCI-60 細胞全体の EV に豊富に含まれることが判明したタンパク質のいずれかに由来しました。29、(2)ヒト胎児腎上皮(HEK)-2T細胞が産生するEVに豊富に含まれるタンパク質34、(3) 以前の研究への参照として EV ソーティングタンパク質を報告32,33、および (4) テトラスパニン スーパーファミリーのすべてのタンパク質。 過剰発現/操作を容易にするために、130 kDa を超えるタンパク質は除外されました。 サイズ中央値 244 kDa の合計 38 個の候補が含まれ、そのうち 129 個が非膜貫通タンパク質、115 個が膜貫通タンパク質でした (図 XNUMX)。 1a; 完全なリストについては、データ ソース ファイルを参照してください)。
a EV ソーティングタンパク質候補の選択基準と概要。 赤い実線は、25%、50%、および 75% のパーセンタイル値を示します。 b Tluc または CD293-Tluc を発現する HEK-63T 細胞からの馴化培地の SEC 溶出プロファイル。 各画分における Tluc 活性を直接 (PBS グループ)、または膜溶解後 (Triton グループ) に定量化し、最も高いシグナルを示す画分に正規化しました。 EV と可溶性タンパク質は、それぞれフラクション 0 ~ 3 と 4 ~ 12 で回収されました。 c 馴化培地における Tluc フォームの分化スキーム。 d 分画および未分画培地を使用した CD63-Tluc の小胞内 Tluc のパーセンテージ。 結果は、XNUMX つの生物学的複製の平均 ± 標準偏差として示されます。 両面学生の t テスト(P > 0.9999)。 ns: 重要ではありません。 e スクリーニング手順とデータ分析の概要。 HEK-293T 細胞を 96 ウェルマイクロプレートで増殖させ、Tluc 融合プラスミドと Nluc プラスミドで同時トランスフェクトしました。 細胞培養物を遠心分離し、細胞ペレットおよび馴化培地中の Tluc 活性を測定しました。 Nluc 活性は馴化培地でのみ定量されました。 c, e BioRender.com で作成されました。 ソース データはソース データ ファイルとして提供されます。 SEC サイズ排除クロマトグラフィー。
EV への候補の管腔負荷能力を評価するために、ルシフェラーゼ レポーター ThermoLuc (Tluc; 60.5 kDa) に基づくアッセイを開発しました。18。 簡単に言うと、通常、N 末端がシグナルペプチドと翻訳後修飾の部位であることを念頭に置き、Tluc をすべての候補の C 末端に融合させました。 融合タンパク質をコードするプラスミドを HEK-293T 細胞にトランスフェクトしました。 48 時間後、馴化培地を収集し、生物発光測定の前にさらに処理しました。 最初に、このアッセイの実現可能性を評価するために、Tluc 単独および CD63-Tluc を発現する細胞の馴化培地を分析しました。 両方をサイズ排除クロマトグラフィー (SEC) カラムで分画し、遊離タンパク質から小胞を分離しました (図 XNUMX)。 1b)35。 画分をPBSで処理して可溶性/表面結合Tlucを測定するか、界面活性剤Triton X-100で処理して総分泌Tlucを検出しました(図XNUMX)。 1c)。 Tluc 単独と比較して、CD63 との融合により、EV 画分への Tluc の顕著なシフトが生じました (図 XNUMX)。 1b)。 注目すべきことに、EV画分のTluc活性は膜溶解時にのみ検出され、Tluc基質がEV膜を通過して管腔ルシフェラーゼと反応できないことを示した。 これは、管腔タンパク質の定量には SEC 分画が不要であることを意味します。 これは、CD63-Tluc発現細胞の未分画培地と分画培地の比較によってさらに裏付けられ、小胞内Tlucのパーセンテージに有意差がないことが明らかになりました(図XNUMX)。 1d)。 まとめると、これらのデータは、このアッセイをハイスループット形式で使用して、潜在的な EV 搭載足場を特定できることを示しています。
今後、244 名の候補者全員を審査する原則は上記と同じです。 下流の分析では、タンパク質は主に、膜溶解の有無で検出されたTlucシグナルの差から得られる小胞内Tlucの絶対量、またはその相対パーセンテージに基づいて評価されました(図XNUMX)。 1e)。 融合タンパク質の発現に関する情報は、EV 産生細胞内の Tluc を測定することによって得られました。 さらに、指定された場合、データはトランスフェクションの変動を考慮して、トランスフェクション混合物に添加された NanoLuc (Nluc) ルシフェラーゼをコードするプラスミドの形でトランスフェクション コントロールに対して正規化されました。
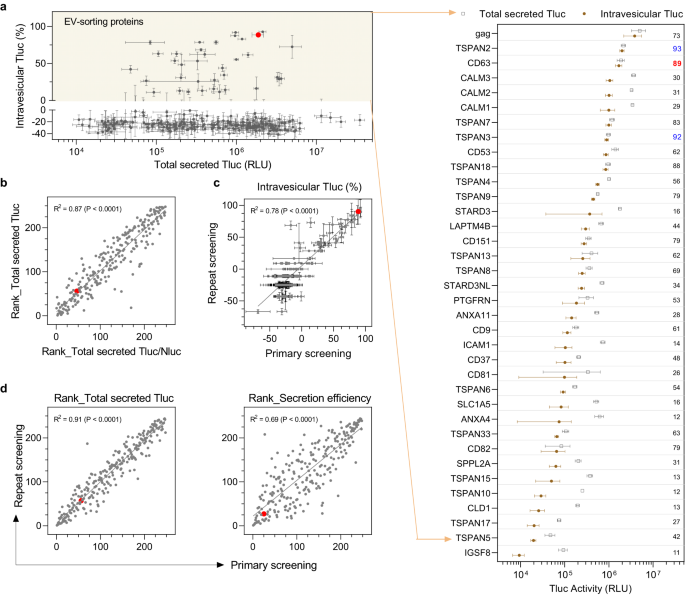
スクリーニングにより数十のEVソーティングタンパク質が特定される
HEK-244T細胞で293個の候補をスクリーニングしたところ、小胞内Tlucと細胞または総分泌Tlucとの間に明らかな相関関係は見られませんでした(補足図XNUMX)。 1a、b)、細胞発現も全体的な分泌もEV選別能力を完全には予測できないことを示しています。 ほとんどの候補について、小胞内 Tluc の割合はゼロ未満でした。これは予想外ですが、界面活性剤 Triton の存在下での酵素活性および/または光子の寿命の低下に起因する可能性があります。 それにもかかわらず、EV ソーティング能力を持つタンパク質に対して合理的かつ実用的なカットオフが提供されました。 この定義によれば、HEK-36T 細胞では合計 293 種類のタンパク質が EV 選別能力を示すことがわかりました(図 XNUMX)。 2a)。 これらの中には、9 つの EV マーカー (CD63、CD81、CDXNUMX) と最近同定された XNUMX つのタンパク質 (PTGFRN) を含む XNUMX つの既知の EV 選別タンパク質が含まれます。32、およびウイルス糖タンパク質 gag を分析し、それによって我々のスクリーニング プロトコールの有効性を実証しました。 私たちの知る限り、残りの 31 種類のタンパク質が EV 内腔に貨物を積み込むことができると報告されたのはこれが初めてです。
a 総分泌 Tluc と小胞内 Tluc の割合をプロットした 244 個の候補すべての概要。 EV ソーティングタンパク質は、小胞内 Tluc のパーセンテージがゼロ (黄色の領域) を超えるように定義されており、グループ化されたドット プロットに示されています。 この値は、小胞内 Tluc のパーセンテージを指します。 タンパク質には遺伝子名が付けられています。 b 総分泌Tlucに関する順位と総分泌Tluc/Nluc比に関する順位との相関関係。 c 一次スクリーニングと再スクリーニングから得られた小胞内 Tluc のパーセンテージの相関関係。 d 一次スクリーニングと再スクリーニングの間の、分泌されたTlucまたは分泌効率に関するランクの相関関係。 結果は (a, b)一次スクリーニングからのものであり、63つの生物学的複製の平均±標準偏差として示されています。 反復スクリーニングからのデータは、XNUMX つの生物学的複製の平均 ± 標準偏差として示されます。 散布図では、各点は XNUMX つの候補を示し、赤い点はベンチマーク CDXNUMX を示します。 相関度は線形回帰で分析され、適合度 (R2) と非ゼロの傾き (P) の重要性。 ソース データはソース データ ファイルとして提供されます。
既知の 63 つの非ウイルス性 EV 選別タンパク質のうち、CD89 は小胞内 Tluc の割合が最も高く、総分泌 Tluc の 2% が EV 内部に局在していました。 特に、TSPAN63は、相対的な胞内Tluc(93%対89%)だけでなく、絶対量(2.0e6対1.7e6、詳細情報についてはソースデータファイルを参照)の点でもCD1を上回りました。 それとは別に、2 つのカルモジュリンタンパク質 (CALM3、CALM29、CALM31) はかなりの量の Tluc を EV に選別しましたが、小胞内 Tluc の割合は中程度 (XNUMX ~ XNUMX%) でした。
望ましくない因子が Tluc 分泌を妨げることを排除するために、適切な品質管理が実施されました。 まず、総分泌 Tluc および総分泌 Tluc と Nluc の比に従って、すべての候補をランク付けしました。 Nluc シグナルに対する正規化は Tluc 分泌に影響を与えませんでした (図 XNUMX)。 2b)、それにより、トランスフェクション手順の混乱を招く役割が無視されます。 第二に、スクリーニングを繰り返すと、小胞内 Tluc の割合について一貫した結果が明らかになりました (図 XNUMX)。 2c)、総分泌Tlucと分泌効率のランクも表示されます(図XNUMX)。 2d)。 最後に、総分泌 Tluc と分泌効率のランクは、0.75 つの異なるプラスミド用量間で高度の線形相関を示しました (1 μg/mL 対 XNUMX μg/mL; 補足図)。 1c)。 総合すると、これらの結果は、我々のスクリーニング方法で得られた所見の信頼性を裏付けています。
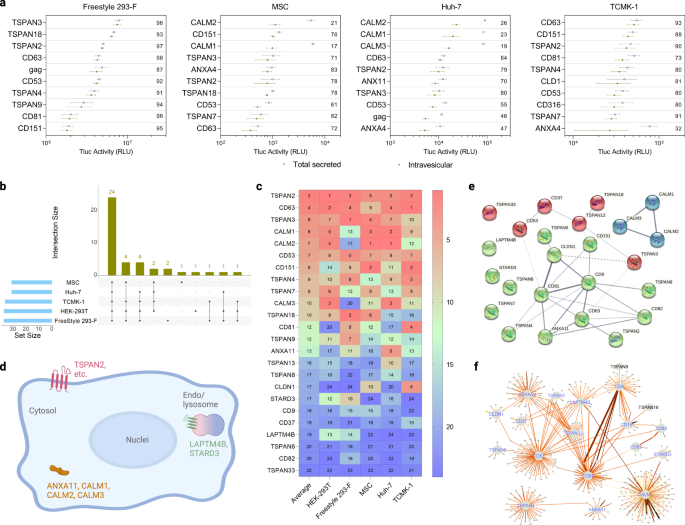
EV ソーティングタンパク質は、さまざまな細胞タイプにわたって大部分が保存されています
HEK-293T 以外にも、他の細胞タイプが EV ソースとして定期的に使用されているため、(1) 懸濁液に適応した HEK 細胞 (Freestyle 293-F)、(2) ヒト臍帯血由来の候補の EV 選別能力をスクリーニングすることが求められています。間葉系幹細胞 (MSC)、(3) ヒト肝細胞由来癌細胞 (Huh-7)、および (4) マウス腎臓上皮細胞 (TCMK-1)。 この目的のために、小胞内 Tluc の割合、総分泌 Tluc、分泌効率 (詳細についてはソース データ ファイルを参照) のいずれかのカテゴリーで、最初のスクリーニングで有望性を示した 95 個の候補が上記のようにスクリーニングされました。
Freestyle 293-F では、小胞内 Tluc の割合に関して最も高い EV 選別能力を持つタンパク質は TSPAN3 でした。 MSCとHuh-7ではCALM2が最高位を占め、TCMK-1ではCD63が占めた(図XNUMX)。 3a)。 トランスフェクション手順は、テストしたすべての接着細胞で Tluc 分泌に実質的な影響を与えることはわかりませんでしたが、Freestyle 293-F は変動しやすいようです(補足図 2)。 EVソーティング能力(ゼロを超える小胞内Tlucの割合)を持つ30〜37個のタンパク質が、各細胞タイプで同定されました(図XNUMX)。 3b)。 これらのうち、24 個のタンパク質が XNUMX つの細胞型すべてにわたって保存されており、さまざまな細胞状況における強力な選別能力を示しています (完全なリストについてはソース データ ファイルを参照してください)。 保存されたサブセット内のタンパク質は、絶対的な小胞内 Tluc 活性に従ってランク付けされました (図 XNUMX)。 3c)。 平均して、TSPAN2、CD63、および TSPAN3 は、さまざまな細胞タイプにわたって最高の選別能力を示しました。
a さまざまなプロデューサー細胞タイプの小胞内 Tluc に関するトップ XNUMX の足場タンパク質。 プロット内の値は、小胞内 Tluc のパーセンテージを示します。 結果は、XNUMX つの生物学的複製の平均 ± 標準偏差として示されます。 b 各プロデューサー細胞タイプで特定された EV ソーティングタンパク質の数と細胞タイプ間の重複。 c 各細胞タイプの小胞内 Tluc に関する 24 個の保存された EV ソーティング タンパク質のランク。 この値は、各セルタイプのランクとその平均を示します。 d 24 個の保存された EV ソーティングタンパク質のトポロジーと細胞内位置。 BioRender.com で作成されました。 (ef) STRING から取得した 24 個の保存された EV ソーティングタンパク質の相互作用ネットワーク (e) およびインタクト (f) データベース。 パネル内の線の太さ (e, f) はデータの裏付けの強さを示し、太い線はより強力な証拠を示します。 タンパク質には遺伝子名が付けられています。 ソース データはソース データ ファイルとして提供されます。
保存されたサブセットのEV選別能力を支配する潜在的なメカニズムをより深く理解するために、バイオインフォマティクス研究が実施されました。 UniProtKB で利用可能な注釈によると、11 つのカルモジュリンタンパク質と ANXAXNUMX のみがサイトゾルにあり、残りのタンパク質はすべてテトラスパニン スーパーファミリーのメンバーであり、血漿またはエンドソーム/リソソーム膜のいずれかに位置しています (図 XNUMX)。 3d)。 次に、24 個の EV ソーティングタンパク質間の相互作用の可能性を評価しました。 STRINGデータベースから入手可能な実験的および予測されたインタラクトームは、TSPAN2/TSPAN3とCD63の相互作用の弱い証拠を示しており、カルモジュリンタンパク質は残りのタンパク質とは無関係に機能するようです(図XNUMX)。 3e)。 同様に、直接的相互作用と間接的相互作用の両方を含む IntAct データベースからの結果は、TSPAN2 のインタラクトームが、よく特徴付けられている 9 つのテトラスパニン CD63/CD81/CDXNUMX のインタラクトームとあまり重複していないことを示唆しました (図 XNUMX)。 3f)。 これらの予測は、TSPAN2 と TSPAN3 が互いに、また他のテトラスパニンとはほぼ独立して動作することを示しています。
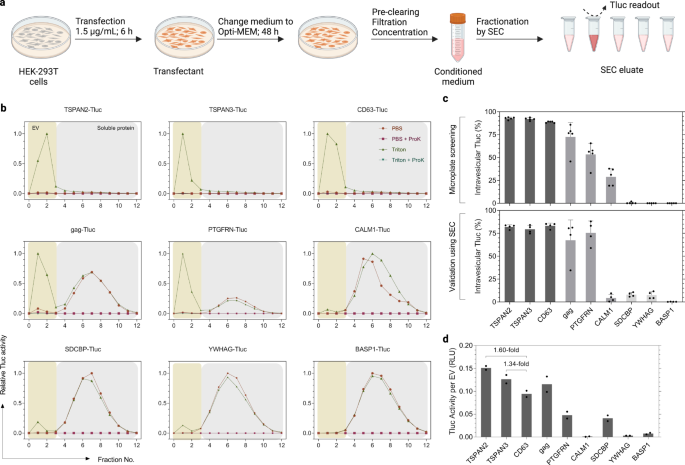
標準化されたEV生産の中でEV選別候補が堅調であることが判明
スクリーニングでは、より高いスループットを目的として、HEK-293T 細胞を 96 ウェルマイクロプレートで増殖およびトランスフェクトしました。 しかし、そのような規模は、開発されたEVを大量に生産しようとする将来の用途には現実的ではありません。 さらに、スクリーニングにおける馴化培地は、定義された分離技術を一切使用せずに、遠心分離の直後に分析されました。 ここでは、多くの疾患における治療の可能性があるため、小型EV(sEV、≤ 200 nm)に特に興味を持っていました。36,37。 このことを念頭に置き、当社グループが最近策定した標準化プロトコルに従ってEVを生産しました。38。 最初のスクリーニングプロトコルとの主な違いは、(1) プラスミドの用量が高く、トランスフェクション時間が短いこと、(2) その後の Opti-MEM でのメンテナンス、および (3) 200 nm メンブレンによる馴化培地の濾過とその後の濃縮です。ステップ(図 4a)。 さらに、Tluc活性と小胞数を測定する前に、sEVをSECによって可溶性タンパク質から分離しました(図XNUMX)。 4b)。 注目すべきことに、溶出液中のTlucはプロテイナーゼKによって完全に失活され、耐性タンパク質凝集体は問題ではないことが示されました(図XNUMX)。 4b).
a EV の生産と SEC 分別プロトコルのワークフロー。 BioRender.com で作成されました。 b トランスフェクトされた HEK-293T 細胞からの馴化培地の SEC 溶出プロファイル。 EV と可溶性タンパク質は、それぞれフラクション 0 ~ 3 と 4 ~ 12 で回収されました。 各画分における Tluc 活性を Triton および ProK の有無にかかわらず測定し、最も高いシグナルを示す画分に正規化しました。 c スクリーニング(上のパネル; XNUMX つの生物学的複製)および標準化(下のパネル; XNUMX つの生物学的複製)プロトコルを使用した小胞内 Tluc の割合。 平均±標準偏差。 d 精製されたEV調製物についての小胞あたりの計算されたTluc活性。 結果は XNUMX つの生物学的複製の平均として示されます。 タンパク質には遺伝子名が付けられています。 ソース データはソース データ ファイルとして提供されます。 SEC サイズ排除クロマトグラフィー。
sEV 選別能力についての洞察を得るために、スクリーニングでの成績に基づいて XNUMX つの代表的な候補が選択されました (図 XNUMX)。 4c)。 小胞内 Tluc の割合は一般にスクリーニングと一致し、sEV 選別能力が高い (>80%; TSPAN2、TSPAN3、および CD63) および低い (<15%; SDCBP、YWHAG、BASP1) ことを示しました (図 XNUMX)。 4c)。 興味深いことに、CALM1 はスクリーニングでは 3.7% であったのに対し、CALM28.9 は XNUMX% のみの Tluc を sEV に選別しました (P < 0.01、両面スチューデントの t テスト)。 小胞数を考慮すると、TSPAN2 と TSPAN3 は EV あたりの Tluc 活性の点で CD63 より優れていることが観察されました (それぞれ 1.60 倍と 1.34 倍)。 4d)。 全体として、これらの結果は、標準化された sEV 生成プロトコルに従った場合でも、これら XNUMX つの候補の選別能力がほとんど変わらないことを示しています。
EV 仕分け候補者はさまざまな貨物に多用途であることが証明されています
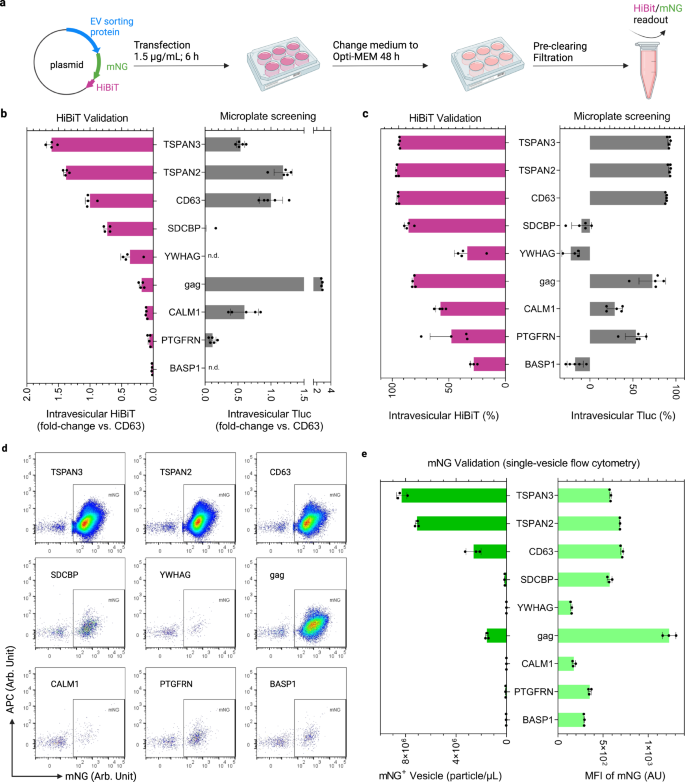
ルシフェラーゼは、操作された EV を大量に定量化するための容易なレポーターです。 ただし、操作された EV の数と EV あたりのカーゴタンパク質の存在量に関する詳細情報を取得するには、単一小胞イメージング フローサイトメトリーが最適な方法です。39,40。 したがって、上記で検討した 26.6 つの候補タンパク質については、Tluc を HiBiT に融合した蛍光タンパク質 mNeonGreen (mNG; XNUMX kDa) からなるハイブリッド レポーターに置き換えました。41、スプリット Nluc ルシフェラーゼからの 11 mer ペプチド (図 5a).
a EVの生産と分析のワークフロー。 BioRender.com で作成されました。 b ベンチマーク CD63 と比較した小胞内 HiBiT。 検出されませんでした。 c 膀胱内 HiBiT の割合。 の b, c、結果は、293 つの生物学的複製の平均 ± 標準偏差として示されています。 HEK-XNUMXT 細胞のスクリーニング結果を参考のために再グラフ化しました。 d mNG-HiBiT 標識 EV の単一小胞フローサイトメトリー ドット プロット。 e mNG 陽性 EV の濃度と平均蛍光強度 (MFI)。 結果は、XNUMX つの生物学的複製の平均 ± 標準偏差として示されます。 タンパク質には遺伝子名が付けられています。 ソース データはソース データ ファイルとして提供されます。
HiBiT と Tluc の小胞内ルシフェラーゼ活性を比較すると、TSPAN3、TSPAN2、CD63 の量の点で同等の工学効率が明らかになりました (図 XNUMX)。 5b) とパーセンテージ (図 5c)。 mNG を使用して単一小胞レベルを調べると、TSPAN3 と TSPAN2 は最も多くの操作された EV を生成し、CD63 を約 XNUMX 倍上回り、操作された EV あたりの mNG レベルは同様のレベルに達しました (図 XNUMX)。 5d、e)。 さらに、抗体染色後、mNGがEV上のそれぞれの選別タンパク質と共局在することを示しました。これは、無傷の融合タンパク質を示しています(補足図)。 3)。 驚くべきことに、HiBiT ベースの測定と Tluc ベースの測定は、ギャグに関して大きく異なりました (図 XNUMX)。 5b、c); しかし、その mNG レベルにはそのような矛盾は見られませんでした (図 XNUMX)。 5d、e)。 このことから、gag-mNG-HiBiT の立体配置により、HiBiT がパートナーのサブユニットと複合体を形成して機能的なルシフェラーゼを形成することが妨げられているとの仮説が導かれました。 さらに、CALM1 は、SEC 検証実験で CALM1-Tluc で観察された傾向と一致して、低レベルの小胞 HiBiT および mNG を示しました (図 XNUMX)。 4c)。 これらの結果は、CALM1が濾過ステップ中に除去されるより大きな小胞(>200 nm)に優先的に分類されることを示唆しています(補足図)。 4).
さらに、これらの選択したタンパク質のパフォーマンスを Freestyle 293-F 細胞で評価しました。Freestyle 3-F 細胞は、増殖手順がそれほど手間ではないため、EV 産生の顕著な供給源です。 繰り返しになりますが、TSPAN2とTSPAN63は、小胞内HiBiTの点で、それぞれCD82を50%とXNUMX%上回りました(補足図)。 5a)。 単一小胞レベルでは、最高濃度の mNG 陽性小胞は、TSPAN3 および TSPAN2 操作フリースタイル 293-F 細胞によって生成されました(補足図)。 5b)。 総合すると、mNG-HiBiT および Tluc レポーターに基づく一致した結果は、スクリーニングプロトコルの信頼性を強化し、さまざまな貨物に対する候補タンパク質の強力な EV 選別能力を強調します。
テトラスパニンで設計された EV 間の明確な分子の特徴
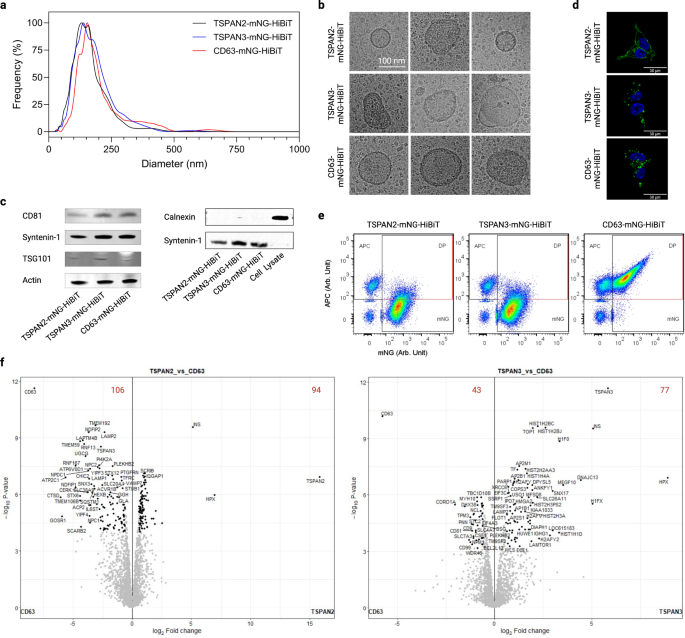
すべての実験を通じて、TSPAN2 と TSPAN3 は最も優れた EV ソーティングタンパク質の 63 つであり、十分に特徴付けられているテトラスパニン CD2 よりも優れたパフォーマンスを示しているようです。 注目すべきことに、TSPAN3およびTSPAN293の異なるスプライスアイソフォームは、HEKXNUMX-T細胞においてEVソーティング能力を保持できませんでした(補足図)。 6)。 私たちが知る限り、これは EV の内因性遺伝子操作のためのこれらのタンパク質の最初の報告であるため、CD2 遺伝子操作 EV と関連して TSPAN3 および TSPAN63 遺伝子操作 EV の物理化学的特徴をより詳細に特徴付けました。
トランスフェクトされたHEK-293T細胞からのEV調製物のナノ粒子追跡分析により、流体力学的直径の中央値が約120 nmという狭いサイズ分布が明らかになりました(図XNUMX)。 6a)。 また、それらの形態学的外観は、膜の構造とサイズによって例示されるように、EVに典型的でした(図XNUMX)。 6b)。 さらに、CD81、シンテニン-1、TSG101などの一般的なEVマーカーがEVから検出されましたが、ネガティブマーカーであるカルネキシンは検出されませんでした(図XNUMX)。 6c)。 それとは別に、EV の生合成についての洞察を得るために、トランスフェクトされた細胞における 2 つのテトラスパニン タンパク質の位置を調べました。 TSPAN3はプロデューサー細胞の原形質膜とサイトゾルの両方に局在していましたが、TSPAN63とCDXNUMXは主に細胞内の点状シグナルとして検出されました(図XNUMX)。 6d)。 さらに、すべてのタイプの操作された EV の産生はセラミドの阻害に耐性がありました(補足図)。 7a)、これは認識されているエクソソーム産生経路のドライバーです1,42.
a トランスフェクトされた HEK-293T 細胞からの EV のサイズ分布。 b EV の代表的なクライオ電子顕微鏡画像。 c EV の陽性および陰性マーカーのウェスタンブロット。 d トランスフェクトされた HEK-293T 細胞におけるテトラスパニンの細胞内位置。 e APC結合CD9/CD63/CD81テトラスパニン抗体で染色した後のEVの単一小胞フローサイトメトリードットプロット。 f EV 内で異なる濃縮タンパク質を示す火山プロット。 赤い数字は、異なる濃縮タンパク質の数を示します。 結果は 043840 つの生物学的複製から得られました。 ソース データはソース データ ファイルとして提供されます。 質量分析プロテオミクス データは、データセット識別子 PXDXNUMX で PRIDE パートナー リポジトリ経由で ProteomeXchange コンソーシアムに寄託されています。
タンパク質の特徴を理解するために、EV を古典的なパン表面マーカー CD9/CD63/CD81 で染色し、単一小胞レベルで分析しました。 テトラスパニンの過剰発現は、総EVの収量に異なる影響を与えました(すべての蛍光イベントとして定義されます、補足図。 7b) および設計された EV (mNG として定義)+ イベント、補足図。 7c)。 さらに興味深いことに、TSPAN2 および TSPAN3 で設計された EV のほんの一部だけが、表面に XNUMX つの古典的な EV マーカーを表示しました (図 XNUMX)。 6e)。 さらに、マルチプレックスビーズベースのフローサイトメトリーによる 39 種類のタンパク質の EV 表面発現解析43 TSPAN2陽性EVの表面エピトープ組成がCD9 / CD63 / CD81陽性EVの表面エピトープ組成とは異なることを明らかにしました(補足図)。 7d)。 表面タンパク質に加えて、EV の詳細なプロテオーム解析により、CD2 操作 EV と比較して、TSPAN106 (94 個が脱濃縮、3 個が濃縮) および TSPAN43 (77 個が脱濃縮、63 個が濃縮) について、差次的に濃縮されたタンパク質が大量に存在することが示されました。 CD9/CD63/CD81 は、TSPAN2/TSPAN3 操作 EV で有意に下方制御されたタンパク質の 293 つであり、これは単一小胞およびビーズベースのフローサイトメトリーから得られた結果と一致しています。 遺伝子オントロジー分析に基づくと、HEK63T 細胞由来の野生型 EV と比較して、2 種類の遺伝子操作された EV (CD3、TSPAN10、および TSPAN10) はすべて、代謝産物相互変換酵素、タンパク質修飾酵素、および RNA 代謝タンパク質が豊富 (>XNUMX%) でした。 、しかし細胞外マトリックスタンパク質は枯渇(>XNUMX%)しています(補足図。 8)。 次に、全体のタンパク質組成を主クラスタリング分析ツールで比較し、操作された EV が野生型 EV とは異なること、そして程度は低いですが互いに異なることを観察しました(補足図)。 7e)。 興味深いことに、WT EVと比較して、TSPAN2の過剰発現はCD63およびTSPAN3レベルに悪影響を及ぼし、これは競合関係を示す可能性があります。 一方、TSPAN3の過剰発現はCD63レベルのわずかな増加を引き起こし、正の制御を示唆しています(補足図)。 7f)。 全体として、これらの発見は、TSPAN2/TSPAN3ベースのエンジニアリングがCD63とは異なるEV亜集団を生じさせることを示しています。
配送手段としての TSPAN2 および TSPAN3 設計の EV
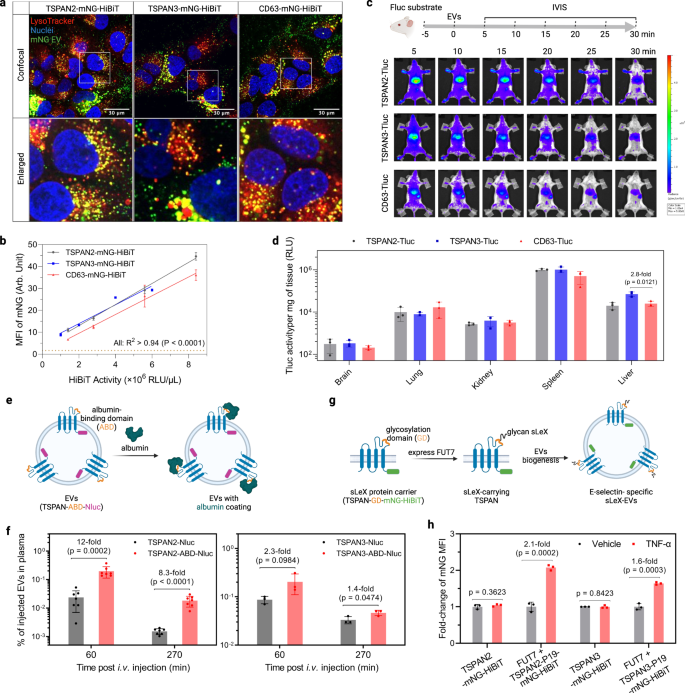
TSPAN2/TSPAN3改変EVが細胞送達に適しているかどうかを調べるために、in vitroおよびin vivoでの送達の可能性を調査しました。 まず、Huh-7 細胞を mNG 標識 EV で処理して、レシピエント細胞内の細胞内位置を調べました。 強い点状の黄色のシグナルは、リソソームへの効率的な内部移行と輸送を明らかに示していました(図XNUMX)。 7a)。 フローサイトメトリーを使用した細胞MFIの定量化により、CD2遺伝子組み換えEVと比較して、TSPAN3/TSPAN63遺伝子組み換えEVの取り込み効率がわずかに優れていることが明らかになりました(図XNUMX)。 7b)。 マウスでのEV分布研究では、等量の操作されたEV(Tluc活性に基づく)が静脈内投与され、生体内イメージングシステムでリアルタイムで追跡されました(補足図)。 9a と図。 7c)。 5 種類の操作された EV のすべてについて、XNUMX 分以内に肝臓と脾臓への急速な分布が観察されました (図 XNUMX)。 7c)、30分にわたる全身活動の顕著な低下(補足図。 9c, P = 0.0006、クラスカル・ウォリス検定)。 TSPAN2 および TSPAN3 で設計された EV は、CD63 で設計された EV よりもわずかに高い全身保持力を与えるようでした(補足図)。 9b)。 その後の ex vivo 測定の結果は、操作された EV の主な肝臓および脾臓蓄積を裏付けました (図 XNUMX)。 7d)。 まとめると、CD63 で改変された EV と同様に、TSPAN2 および TSPAN3 で改変された EV は、in vitro および in vivo で細胞に効率的に取り込まれます。
a Huh-7 細胞を EV で 4 時間処理し、LysoTracker で染色してリソソームを視覚化しました。 ウェル全体の代表的な領域の共焦点顕微鏡画像が表示されます。 実験は XNUMX 回実行されました。 b Huh-7 細胞を EV で 8 時間処理しました。 細胞の mNG MFI は、フローサイトメトリーを使用して定量されました。 データは、XNUMX つの生物学的複製の平均 ± 標準偏差として示されています。 相関度は線形回帰で分析され、適合度 (R2) と非ゼロの傾き (P) の重要性。 c マウスにおけるEVの生体内分布。 NMRI マウスに腹腔内注射した。 d-ルシフェリン基質。 XNUMX分後、同量の遺伝子操作されたEV(Tluc活性に基づく)をマウスに静脈内注射し、IVISで画像化した。 続いて、生体外生物発光測定のために主要な臓器が収集されました。 代表的な IVIS 画像を示します。 N = 3。 d IVIS後の生体外臓器におけるTluc活性。 結果は、XNUMX匹のマウスの平均±標準偏差として示されています。 e アルブミン結合EVの生成スキーム。 融合タンパク質を安定して発現する HEK-293T 細胞から EV を収集しました。 f アルブミン結合 EV を静脈内に注射し、血漿中のそれらの濃度を測定しました。 データは平均値 ± 標準偏差として表示されます。 N = 7 (TSPAN2 関連の場合) または 3 (TSPAN3 関連の場合)。 g EVにsLeXを表示する仕組み。 EVは、成分を安定して発現するHEK-293T細胞から収集されました。 h HUVEC 細胞を TNF-α によって 2 時間活性化し、EV で 6 時間処理しました。 細胞の mNG MFI はフローサイトメトリーを使用して定量され、非活性化細胞に対する倍率変化として示されます。 c, e, g BioRender.com で作成されました。 データは、XNUMX つの生物学的複製の平均 ± 標準偏差として示されています。 両面学生の t テスト。 ソース データはソース データ ファイルとして提供されます。
内腔貨物に対する TSPAN2 および TSPAN3 の積載および配送能力を幅広く紹介したので、次に、EV 表面ディスプレイ アプリケーションにおける可能性を調査しました。 一部のテトラスパニンの大きな細胞外ループ (LEL) は、そのような用途にすでに活用されており、テトラスパニンタンパク質のトポロジー的類似性を考慮して、TSPAN2 および TSPAN3 の LEL を操作することを試みました。 CD63、CD9、CD81 の LEL へのアルブミン結合ドメイン (ABD) の挿入は、EV の血漿循環時間を大幅に延長することが示されています。44。 同じ戦略を使用して、定量化のために C 末端に Nluc を備えた ABD を TSPAN2 および TSPAN3 の LEL にクローニングしました (図 XNUMX)。 7e)。 EVは、TSPAN-ABD-Nluc融合タンパク質を安定して発現するHEK-293T細胞から収集されました(補足図)。 9c) を評価し、アルブミン結合能力を評価しました。 予想どおり、ABD を表示する EV のみがアルブミンに結合しました(補足図 9d)。 次に、これらの EV をマウスに静脈内注射し、さまざまな時点で Nluc に基づいて血漿中の EV 濃度を測定しました。 野生型テトラスパニン改変EVと比較して、ABDを提示するEVは、特に足場タンパク質としてTSPAN2を使用した場合、血漿中濃度が著しく高かった(図XNUMX)。 7f).
別の例では、グリカンリガンドシアリルルイス X (sLeX) の表面提示を通じて活性化された内皮細胞特異的ターゲティングを達成することを目指しました。45。 したがって、19 mer の sLeX ペプチド キャリア (P19) を、C 末端に mNG-HiBiT を持つ各テトラスパニン タンパク質の LEL に挿入しました。 フコシルトランスフェラーゼ VII (FUT7) の存在下では、P19 がグリコシル化されて sLeX が表示されます (図 XNUMX)。 7g)。 この理論的根拠に基づいて、sLeX-EVは、FUT293およびTSPAN-P7-mNG-HiBiTを安定的に発現するHEK-19T細胞から生成されました(補足図)。 9c)。 それらの取り込みは、sLeX の主要な受容体である E-セレクチンを発現する TNF-α 活性化内皮細胞で評価されました。 野生型テトラスパニン改変EVは、非活性化内皮細胞および活性化内皮細胞に同様に取り込まれましたが、TSPAN2またはTSPAN3を足場として使用したsLeX-EVは、活性化内皮細胞による好ましい取り込みを示しました(図XNUMX)。 7h)。 全体として、これは、表面ディスプレイ用のLELと管腔カーゴローディング用のC末端の同時操作という観点からTSPAN2とTSPAN3の実現可能性を実証しており、したがって治療用途へのそれらの可能性を強調している。
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 自動車/EV、 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- ブロックオフセット。 環境オフセット所有権の近代化。 こちらからアクセスしてください。
- 情報源: https://www.nature.com/articles/s41467-023-40453-0