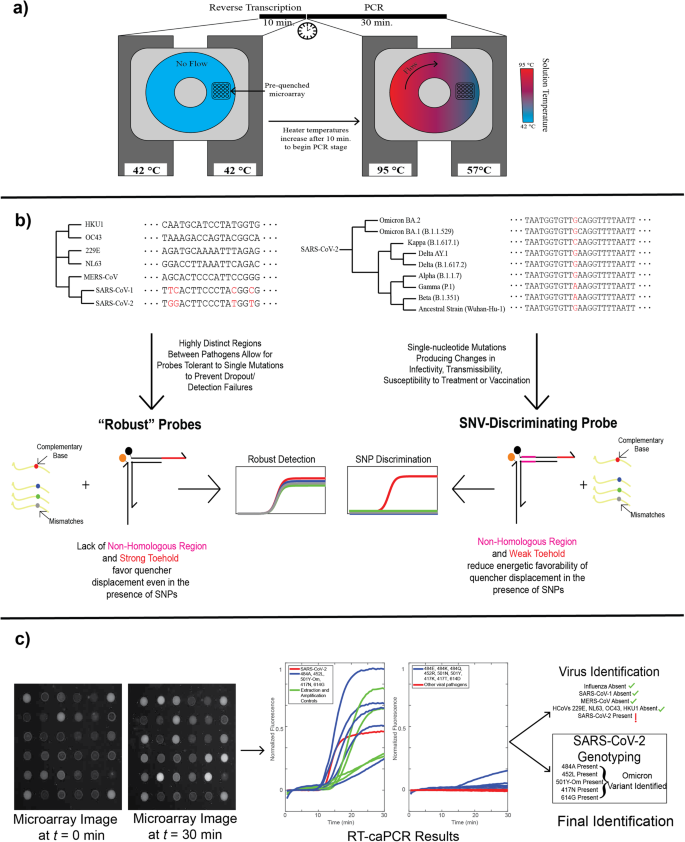
caPCR への逆転写の統合
まず、標準的な caPCR アッセイに RT ステップを導入しました。 caPCR は、PCR 反応混合物で満たされたトロイダル チャンバーを含むカートリッジのどちらかの面にクランプする 4 つのヒーターのセットを使用して実行されます。4。 チャンバーの片側のヒーターを PCR アニーリング温度に設定し、もう一方の側を変性温度に設定することにより、勾配が確立され、それによって PCR 増幅を促進する受動的対流が生成されます。 事前にクエンチされたトーホールド プローブ アレイはカートリッジの表面に固定されており、特異的な PCR 製品が合成されると TMSD を通じて応答します。 最初の逆転写ステップに対応するために、cDNA 合成のために 42 分間 10 °C の一定温度を維持するようにヒーターをプログラムしました。その後、対流を開始するためにヒーターをそれぞれ 57 °C と 95 °C に調整しました (図 XNUMX)。 2a)。 ワンポット RT-PCR アプローチは、ワークフローにおける手動処理ステップの数を減らすために使用されます。 caPCR プラットフォーム上の Toehold プローブを介した検出は、非対称 PCR 条件下で最適に機能します。クエンチャーを置換する鎖を生成する過剰なプライマーは、1:1 のフォワードプライマー対リバースプライマー比よりも強いシグナルを蛍光プローブアレイ上に生成します。 (イチジク。 S1)。 逆転写段階と PCR 段階で別個のプライマーを導入する必要性を回避するために、この同じプライマーが RNA ターゲットからの cDNA 合成も媒介することを確認しました。
a caPCR ワークフローは、逆転写酵素の追加による逆転写ステップ (RT-caPCR)、およびすべてのデバイスのヒーターが RT 温度 (42 °C) に設定された専用の RT ステージを含むように拡張できます。 次に、ヒーター温度を変性 (95 °C) およびアニーリング (57 °C) のために異なる温度に上げ、対流と cDNA テンプレートの PCR 増幅を誘導します。 b DNA 結合熱力学に基づくプローブのエネルギー設計スキームは、感染症診断における XNUMX つのニーズに対処するために使用できます。 I) ウイルス病原体の検出は、新しい変異体が発生した場合のドロップアウトを防ぐために、ヌクレオチド配列の小さな変化に対して堅牢である必要があります。 II) バリアントの識別には単一ヌクレオチドの解決が必要です。 トーホールド、ドメイン、および非相同領域 (NHR) エネルギーの変化を使用して、これらの要件の両方を満たすことができます。 c ドーナツ RT-caPCR 実行からのデータ出力の例。 プローブアレイ画像は、30 分間の caPCR の間、30 秒ごとに取得されます。 蛍光痕跡が抽出および分析され、どの呼吸器病原体が存在するのか、また、該当する場合は SARS-CoV-2 のどの変異体が存在するのかが特定されます。
突然変異感受性から突然変異耐性に至るまで、プログラム可能な配列選択性を備えた調整可能なプローブを開発するために、トーホールド プローブに 2 セットのエネルギー基準を利用しました (図 XNUMX)。 2b)。 堅牢なプローブは、より強力なトーホールド領域と、それに対応してより弱いドメインを特徴としており、結合反応の開始とそれに続くクエンチャー アームの変位に対する単一の変異の全体的な影響を軽減します。 SNV を識別するには、トーホールドの長さを短縮し、ターゲットとの相補性を欠く非相同領域 (NHR) を導入します。 この組み合わせは、トーホールド結合およびクエンチャーアーム変位に対する全体的なエネルギー的有利性を低下させる働きをし、それによって標的配列内の単一のミスマッチに余分な重みを与えます。
私たちは、強力なプローブと SNV 識別プローブの両方を備えた RT-caPCR を呼吸器ウイルス検出に適用しました。 RT-caPCR システムからのプローブ アレイ画像は、カスタム MATLAB スクリプトを使用して処理され、蛍光トレースが生成され、その後解釈されて、存在するウイルス標的と、該当する場合は SARS-CoV-2 の変異体の両方が識別されます。 SARS-CoV-2 オミクロン変異体の例を図に示します。 2c。 したがって、当社のワンポット RT-caPCR アッセイは、強力なプローブによる高感度検出と、SNV 識別プローブによる単一ヌクレオチド分解の両方を同時に実行し、単一の反応で目的の RNA ターゲットを正確に同定できる能力を示しています。
堅牢なプローブと SNV 識別プローブ間のエネルギー学の微調整
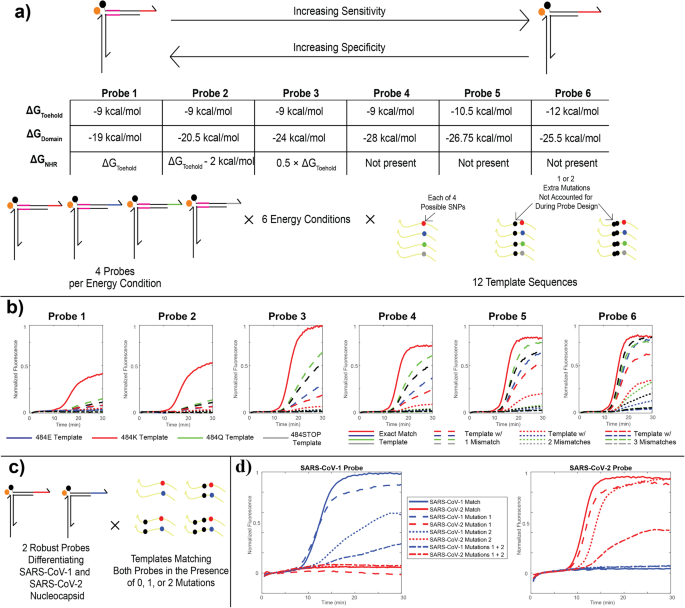
RT-caPCR アッセイで検出されるターゲットの多様性を高めるために、感度と特異性のトレードオフを調整するために、トーホールド結合と鎖置換のエネルギー学を最適化しました。 ケーススタディとして、エネルギー評価のテンプレートとして SARS-CoV-2 の「484E」遺伝子型を使用しました。 この部位の変異は宿主抗体の中和活性の低下に関連しています12、および 3 つの可能なヌクレオチド塩基 (アデニン、グアニン、シトシン) のうち 4 つが、自然に進化した SARS-CoV-2 変異体のコドンの最初の位置で見つかります。9。 この部位でのウラシル置換は終止コドンを生成するため、自然界では観察されませんが、厳密さを期すため、評価にチミン条件を含めました。 この遺伝子座で考えられる 4 つのヌクレオチドのそれぞれに対してプローブを設計し、結合エネルギー (ΔG) に基づいて 6 つの異なる熱力学的条件を確立しました。o)トーホールド プローブの 3 つの領域(NHR、ドメイン、およびトーホールド)の図。 3a、材料と方法を参照)。 これらのエネルギー条件は、NHR とトーホールドのエネルギーがほぼ等しい (約 -1 kcal/mol) という最も特異的な (プローブ 9) から、NHR とトーホールドが存在しない最も感度の高い (プローブ 6) までの範囲に及びます。トーホールドはわずかに強力です (-12 kcal/mol)。 すべての場合において、ドメイン結合エネルギーは、全体のプローブ結合エネルギーが約 -40 kcal/mol で一定に保たれるように調整されます。
a プローブのエネルギー特性評価のためのパラメータを設計します。 トーホールド、ドメイン、NHR 領域の結合エネルギーを変えることによって 484 つの異なるエネルギースキームを設計し、単一ヌクレオチドの特異性と突然変異に対する堅牢性の形での感度の間のトレードオフを可能にしました。 2 つのエネルギー設計のそれぞれに対して 12 つの異なるプローブが設計され、SARS-CoV-4 スパイクタンパク質の XNUMX 変異部位にある考えられる XNUMX つのコドンすべてをカバーし、そのうち XNUMX つは変異体で観察されています。 各プローブは、XNUMX つの固有の一塩基変異のみと、Omicron バリアントのさらに上流にある XNUMX つまたは XNUMX つの他の変異の存在下で、XNUMX の異なるプラスミド テンプレートを使用してテストされました。 b caPCR は 484 K シリーズのプローブから得られます。 赤い実線の曲線は、突然変異がない場合の目標どおりのパフォーマンスを示します。 破線、点線、二点鎖線は、それぞれプローブ配列に対して 1、2、または 3 つのミスマッチがあるテンプレートを示します。 色は 484 部位のコドン (E、K、Q、または STOP) を示します。 c 強力な SARS-CoV-1/2 識別をテストするためのスキーム。 エネルギースキームに従ってXNUMXつのプローブが設計されました 「プローブ5」 ある程度 a SARS-CoV-1 および SARS-CoV-2 のヌクレオカプシド遺伝子の領域について。 両方のプローブは、完全一致テンプレートおよび XNUMX つの上流ミスマッチの一方または両方を含むバリアントの存在下、ならびに完全一致テンプレートおよびもう一方のプローブのミスマッチバリアントの存在下でテストされました。 d に記載されているテストの結果 (c)。 実線、破線、点線、および一点鎖線は、SARS-CoV-1 (青) または SARS-CoV-2 (赤) ゲノムとの完全一致テンプレート、XNUMX つの SNV のいずれかを含むテンプレート、または両方の SNV を含むテンプレートを示します。
これらのプローブを 12 の異なる DNA テンプレートでテストしました。そのうちの 4 つは、4 コドン内の 484 つの可能な塩基のそれぞれに完全に一致するテンプレートを表します。 プローブのエネルギー学の調整可能性を実証するために、SARS-CoV-2 の進化の後期系統で生じた変異を取得し、それらをテンプレートに導入しました。デルタ AY 系統とオミクロン系統で見つかった T478K 変異と、オミクロンで見つかった S477N 変異です。系統(模式図) 3a)10。 24 個のプローブすべてが、12 個のテンプレートのそれぞれの増幅に応じて評価されました。 形 3b これらの結果のサブセット、特にベータおよびガンマ VOC に見られる 484 K 変異を標的とするように設計されたプローブを示します。10。 NHR の強度が低下し、トーホールドが増加すると、完全一致テンプレート (赤い実線) の検出は強力なままとなり、プローブは 1 (破線) と 2 (点線) の不一致を持つテンプレートに対する感度が高くなります。 これは、非常に特異的な標的結合結果を得るためにプローブのエネルギー学を設計する我々の能力を実証している。 これらの結果に基づいて、SNV 識別プローブにはエネルギー スキーム 2 を選択し、ロバスト プローブにはスキーム 5 を選択しました。
私たちは、SARS-CoV-2 および SARS-CoV-1 のヌクレオカプシド遺伝子配列を標的とする 2 つの強力なプローブを設計しました。 これらの病原体配列を、変異に対する耐性を維持しながら強力なプローブを使用して確実に区別できるようにするために、ミスマッチを含まないか、8 つのミスマッチのうち 1 つを含むか、または両方のミスマッチを一緒に含む 2 つのテンプレートを考案しました(図 XNUMX)。 3c、材料と方法を参照)。 SARS-CoV-1 および SARS-CoV-2 の検出用に選択された領域は、2 つの標的配列間で 8 つの変異によって異なります。そのため、テンプレート内のミスマッチはこれらの違いに基づいて選択されました。 そのため、2 つのミスマッチを持つ SARS-CoV-2 テンプレートには、SARS-CoV-6 配列と比較して 1 つの相違点しかなく、したがって、感度と特異性のプローブの正確な調整の重要性が実際に応用されることが強調されています。 形 3d にこれらのテストの結果を示します。 すべてのケースにおいて、SARS-CoV-1 と SARS-CoV-2 のプローブとテンプレートの間に交差反応性は観察されませんでした。SARS-CoV-1 RNA は SARS-CoV-1 プローブによってのみ検出され、SARS-CoV-2 は検出されました。 RNA は SARS-CoV-2 プローブによってのみ検出されました。 2 つの変異のいずれかを含むテンプレートも、それぞれの適切なプローブによって明確に検出できます。1 つの変異のうち 2 つは、他の変異よりも明らかにパフォーマンスに影響します。 同様に、両方の変異を併せ持つテンプレートも引き続き検出されますが、クエンチャー アームの置換におけるエネルギー的な有利性が低いため、パフォーマンスはわずかに低下します。
プローブのエネルギー学の対象を絞った研究を通じて、感度と特異性の望ましいトレードオフが得られるようにプローブを正確に設計できる能力を実証しました。 SNV 識別プローブは、クエンチャー アームの変位の正確な一致を必要とするエネルギー特性を備えていますが、堅牢なプローブは、ターゲットの結合においてより無差別であり、最大 1 つの変異を含むアンプリコンを検出できます。 私たちが調査したエネルギー範囲を適用して、エネルギー スキーム 6 からエネルギー スキーム XNUMX まで必要に応じてプローブを調整することで、プローブ配列からの所望の数のミスマッチを持つターゲットの検出が可能になります。
堅牢な SNV 識別プローブのパフォーマンス
高度に調整可能なプローブ設計の概念実証を実証するために、堅牢なプローブと SNV 識別プローブの両方の完全なパネルを作成しました。 私たちのパネルは、ヒトに感染することが知られている7つのコロナウイルスすべて(HCoV 229E、HKU1、NL63、OC43、MERS-CoV、SARS-CoV-1、SARS-CoV-2)およびインフルエンザをスクリーニングすることにより、強力なプローブの有用性を強調しています。 AとB8。 さらに、私たちのパネルは、SARS-CoV-14 スパイク遺伝子内の 3 つの共通変異部位をカバーする 5 個のプローブと 2 個のアンプリコンを使用して、懸念される変異体 (417、452、484、501、および614;図。 S2)9,10,11.
高感度ターゲット検出のための当社の RT-caPCR アッセイにおける堅牢なプローブの性能を評価するために、さまざまな患者層をカバーするコロナウイルス陰性ウイルス輸送媒体 (VTM) サンプルを使用して 65 件の RT-caPCR テストを実施しました (表) S1–S4) 7 種類のヒト コロナウイルスのそれぞれに由来する合成 RNA をスパイクしたもので、Twist Bioscience から購入したか、遺伝子断片からのインビトロ転写 (IVT) を使用して社内で合成したものです (表 S5)。 ビーズベースの抽出法を使用して、これらの人工的な臨床サンプルから RNA を分離および精製しました。13 SARS-CoV-2 診断ワークフローでは、RNA 抽出にそのような方法論を使用することが優先されているため14 システムへの入力として使用されました。 このアッセイには、抽出コントロール (精製前に人工サンプルにスパイクされた MS2 バクテリオファージからの RNA) と増幅コントロール (RT-caPCR 反応混合物にスパイクされた内部ポジティブコントロール (IPC) RNA) の両方も含まれていました。 特に指定のない限り、ここでの実験では約 10 回の実験が行われました。6 MS2 RNA のコピーと 107 ウイルスRNAのコピー。 RT-caPCR 反応は、40 分子の IPC コントロール RNA、抽出されたサンプル RNA、およびすべてのターゲットとコントロールをカバーする 5,000 個のプライマー ペアを使用して 11 分で実行されました。
RT-caPCR データを分析して、各サンプルに存在するウイルス標的を特定し、SARS-CoV-2 の場合はどの特定の変異体が存在するかを特定しました(図 4) 図 4a SARS-CoV-2 Omicron バリアントを RNA ターゲットとして使用した代表的な実行を示しています。 ウイルス識別のためのすべての強力なプローブは赤色で示され、SNV 識別プローブは青色で示されます。 抽出および増幅のコントロールは緑色で表示されます。 ポジティブおよびネガティブのプローブスポットは、プライマーもテンプレートも含まれていない配列を使用した完全に消光されていないプローブまたは完全に消光されたプローブに対応し、灰色で表示されます。 このタイプのデータは、図に示すように圧縮されたプロットに要約できます。 4b: 予想されるすべての陽性曲線が左側のプロットに示され、予想されるすべての陰性曲線が右側のプロットに表示されます。 一部の SNV 特異的プローブには低レベルのオフターゲット活性がありますが、オンターゲット SNV 特異的プローブ曲線 (484 A、452 L、501Y-Om、417 N、および 614 G) を他の SNV プローブと比較すると、特異的プローブは、目視および蛍光誘導体ベースの SNV 識別アルゴリズムによる評価で、オンターゲット プローブがすべてのケースで最も強く反応することを確認します (「材料と方法」および「補足方法」を参照)。 Omicron 変異体は他の変異体と比べて突然変異負荷が高いため、11検出を向上させるために、この変異体に見られる S484N および T477K 変異も含まれるように 478 A プローブの配列を設計しました。10。 同様に、独自の 501Y-Om プローブには、Omicron バリアントに特に見られる Q493R、G496S、および Q498R 変異が含まれています。 Omicron 系統の BA.2 サブバリアント (501Y-Om2) に特異的なプローブは、後に導入されました。 このプローブは 501Y-Om 配列と同一ですが、G496S 変異がありません。10.
a 例は、懸念される SARS-CoV-2 Omicron 変異体を検出する RT-caPCR 実行の結果です。 強力なウイルス検出プローブは赤色、SNV 識別プローブは青色、抽出および増幅コントロールは緑色、ポジティブおよびネガティブコントロールは灰色です。 各曲線は、取得した 60 枚の画像にわたる各時点での対応するプローブ アレイ スポットの強度を表し、アレイ内の最も明るいスポットに正規化されています。 b 実行に対応する集計結果 a。 予想されるすべての陽性プローブ (抽出および増幅コントロール、オンターゲット ウイルス同定、およびすべてのオンターゲット SNV 識別プローブ) が左側のプロットに示されているのに対し、すべての予想される陰性プローブ (すべての他のウイルスおよび SNV 識別プローブ) は左側のプロットに示されています。ネガティブコントロールも同様)を右側のプロットに示します。 c ヒトコロナウイルス 229E、中東呼吸器症候群コロナウイルス (MERS-CoV)、および SARS-CoV-1 のウイルス検出結果 ( に記載されている形式)b). d。 SNV 識別は、上記で指定された形式の SARS-CoV-2 Delta バリアント テンプレートから得られます。
フィギュア 4c 図は、ヒトコロナウイルス 3E、MERS-CoV、および SARS-CoV-3 の 229 つの異なるウイルス病原体テンプレートに対する 1 回の実行からの圧縮された代表的な結果を示しています。 3 つのサンプルはすべて、強力な病原体同定プローブによるウイルス RNA ターゲットの明確な検出を示し、オフターゲットのウイルス同定プローブ活性はなく、すべてのコントロールの存在を示しています。
表 1 すべての有効な試験からのウイルス同定結果を要約しています。 PCR 反応リソース (ポリメラーゼ、dNTP など) の競合により、コピー数の低いターゲットの増幅が抑制される可能性があるため、ウイルス病原体が検出され、1 つの対照 (MS2 および IPC) のうち少なくとも 2 つが検出された場合、アッセイの実行は有効であるとみなされました。 、またはウイルス病原体は検出されなかったが、両方のコントロールが検出されました。 サンプルのうち 11 個はネガティブ コントロールであり、MS2 および IPC コントロール RNA のみが含まれていました。 これら 11 個のサンプルすべてで、IPC と MS2 の両方が検出されました (100%)。 SARS-CoV-36 ヌクレオカプシド プローブの検出による評価により、36 個の SARS-CoV-2 サンプルのうち 100 個(2%)が特定されました。 残りのヒト コロナウイルス (229E、NL63、OC43、HKU1)、SARS-CoV-1 および MERS-CoV ターゲットも高い感度を示し、すべてのターゲットが 100% 検出されます。 プライマー結合のプロセスとアンプリコンを介したプローブのクエンチャー置換の両方がパネルの特異性に寄与しており、すべてのターゲットにわたって 100% でした。 ここで、特異性は正しく検出された真陰性の割合として計算されます。 つまり、特別に設計されたプローブ以外の堅牢なプローブでは、テンプレートは検出を引き起こしませんでした。
フィギュア 4d 図は、SARS-CoV-2 デルタ変異体の病原体同定と同時にウイルス変異体検出を示すことで、RNA 標的を同定するだけでなく、一塩基分解能を提供する当社の RT-caPCR アッセイの能力を強調する代表的な実行を示しています。 452 L プローブは顕著なオフターゲット活性を示しますが、その検出効率はオンターゲット 452 R プローブよりも明らかに低くなります (左側のプロットで最高強度を示す青い曲線)。 したがって、SNV 識別プローブを使用すると、いくつかの単一変異だけが異なる SARS-CoV-2 変異体を明確に区別できます。
表 2 2 件の試験にわたる SARS-CoV-36 変異体に対する SNV 特異的プローブのパフォーマンスを要約しています。 予想される検出数は、その変異を表示するテンプレートが含まれていたランの数に等しく、一方、予想される陰性の数は、対応するテンプレートが含まれていなかったランの数です。 真陽性は、対象のプローブがその変異部位に対する優勢な SNV 特異的プローブである場合の実行 (アルゴリズム的に評価)、真陰性はそうではなかった場合の実行です。 ある実行では、614 G プローブが異物 (塵) によって隠されていることがわかりました。そのため、これらのターゲットの合計は 35 ではなく 36 になります。484E を除いて、すべてのプローブは少なくとも 90% の感度を示します。 484E プローブのパフォーマンスが低いことは、デルタ変異体のアンプリコンに SNV (T478K 変異) が存在することによって部分的に説明できます。 他のすべてのプローブは 100% の特異性を示します。これは、オンターゲットのエネルギーが等しいと仮定すると、アンプリコンは常に変異のあるものよりも対応するクエンチャーを優先的に置換するためです。
まとめると、これらのデータは、ロバストなプローブと SNV 識別プローブが連携して機能し、(ロバストなプローブを使用して) 存在する RNA ターゲットを迅速に特定し、(SNV 識別プローブを使用して) 単一ヌクレオチドの分解能を提供する能力を強調しています。
RT-caPCR の検出限界の評価
次に、RT-caPCR アッセイの検出限界を決定するために一連の実験を実行しました。 図のこれまでのすべてのテストでは、 4、ウイルス入力 107 オミクロンおよびデルタ患者のピークウイルス量の推定と同様に、抽出前に分子を VTM にスパイクしました。15,16。 ここでは、ウイルス RNA の入力コピー数を変更し、コントロール コピーを同じに保つことにより、アッセイの LOD を定量しました。 Twist Bioscience から入手した精製 RNA、または IVT を介して遺伝子断片から社内で合成した精製 RNA を使用して、1,000 つのコロナウイルスすべてに対して 7 分子の LOD を達成しました。 代表的な結果を図に示します。 S3。 どちらの図でも S3a & S3b両方のコントロールを使用して、単一の標的について反応あたり 1,000 個の分子まで正常に検出できることがわかりました (HCoV 229E; 図 XNUMX)。 S3a)および両方の対照を含む SARS-CoV-2 変異体(Omicron; 図 S3b)、精製 RNA を使用する場合、VTM テストに使用される量より 3 桁低い量です。 図のように、単一のターゲットの存在のみが変化する場合。 S3aの場合、このターゲットのみで、しきい値時間に桁ごとに明らかな遅延が見られますが、2 つのコントロールは実行全体で一貫しています。 SARS-CoV-2 ではこの傾向はあまり明確ではありませんが、このターゲットでは 4 つのアンプリコンと 2 つのコントロールの同時増幅が必要であることを考えると、これは予想されることです。 酵素リソースと dNTP をめぐる競争は、単一アンプリコン標的で観察される明確な傾向を混乱させるようです。 図では、 S3cでは、Omicron バリアントの抽出パイプラインへの入力 RNA の量を変化させることで、一連の希釈を実行しました。 ここでも、テストされた最低値までの検出が見られます(RNA 抽出ステップに 10,000 分子が入力され、抽出中の損失と反応で 1,000 µL の溶出量全体が使用されなかったため、約 25 分子が RT ステップに送られます)。入力濃度の関数としての増幅の予想遅延。
単一サンプル内の複数のターゲットの検出
SNV 識別プローブ (SARS-CoV-2 変異体) を備えた単一ヌクレオチド特異性を備えた強力なプローブ (各ウイルス) を使用して RNA ターゲットを特定する、調整可能なプローブ RT-caPCR アッセイの成功を実証したので、次に、次の場合に私たちのアッセイがどのように実行されるかを調査しました。複数の RNA ターゲットを含む同時感染サンプルをシミュレートすることで、より複雑な入力を評価します。 ここでは、入力量を 10 とします。5 各テンプレートの分子は、VTM 抽出ステップを行わずに、RT-caPCR 反応に直接スパイクされました。 また、インフルエンザ A および B をテストするための 3 つの追加のプライマー セットと 4 つのプローブ (2 つはインフルエンザ A の M1 マトリックス タンパク質遺伝子を標的とする) を含めることで、より多くの RNA ターゲットをテストできるように RT-caPCR アッセイを拡張しました。17 および 2 つは、B 型インフルエンザの山形およびビクトリア系統における非構造タンパク質 1 (nsp1) を標的としています。18)。 この 14 プレックス アッセイは、その有効性を確認するために 4 つの新しいターゲットすべてについてテストされました (図 XNUMX)。 S4).
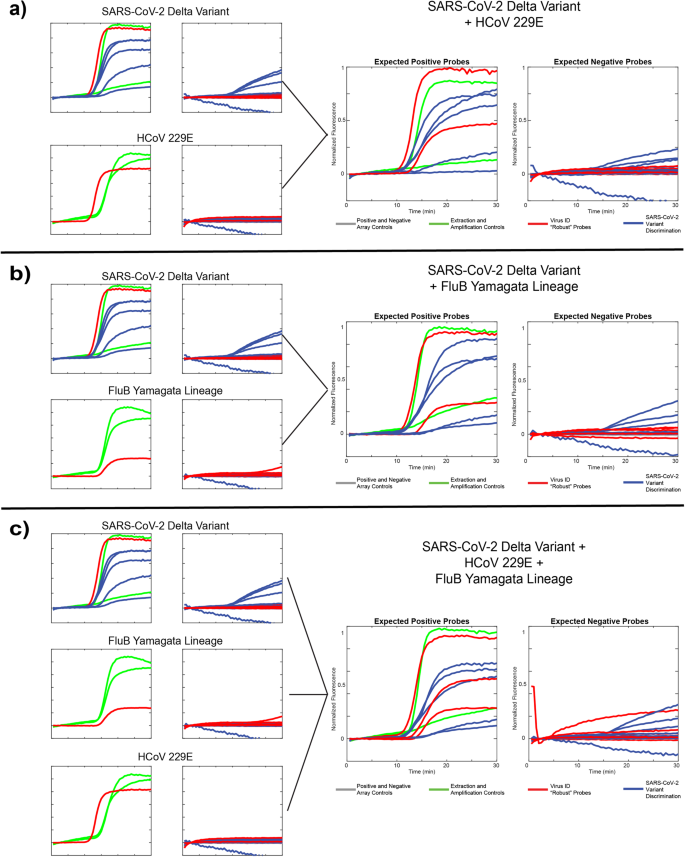
私たちは、3 つの異なるウイルス テンプレートのそれぞれを単独で、および 3 つの異なる組み合わせで評価しました: SARS-CoV-2 デルタ変異体 + HCoV229E (図 XNUMX)。 5a)、SARS-CoV-2 デルタ変異体 + FluB 山形系統(図 5b)、SARS-CoV-2 + HCoV229E + FluB 山形系統(図 5c)。 データは、上で説明したように、圧縮された蛍光トレース画像として表示され、左側のパネルには予想される陽性プローブが、右側のパネルには予想される陰性プローブが示されています。 すべての実行において、予想される動作が観察されました。堅牢な (ウイルス識別) プローブは、含まれるすべての病原体テンプレートの存在を報告し、SNV 識別プローブ (変異体識別) は、すべての実行において低レベルのオフターゲット プローブ活性を持つ Delta 変異体を正確に識別します。 5つのSNVサイト。 484E プローブは最もパフォーマンスが低く、これはおそらくこのプローブのドメイン領域における前述の不一致のためです。 さらに、一部の実験では、2 つの異なるアンプリコン間のリソースの競合により、MS8 抽出制御のパフォーマンスが低下しました。 また、これらの実行には、図の 1 つではなく、MS2 および IPC コントロールのそれぞれの複製が 2 つだけ含まれていることにも注意してください。 4、これは 501Y-Om2 プローブを含む更新されたパネルであるためです。 これらのデータは、対象となる複数の RNA ターゲットを含むより複雑なサンプルを正確に評価する当社の技術の能力を実証し、アッセイの多用途性を示しています。
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- プラトンヘルス。 バイオテクノロジーと臨床試験のインテリジェンス。 こちらからアクセスしてください。
- 情報源: https://www.nature.com/articles/s42003-023-05346-4