KI in der Arzneimittelforschung auf einen Blick
Der anhaltende Aufstieg der künstlichen Intelligenz (KI) wirkt sich erheblich auf verschiedene Branchen aus, wobei die Pharma- und Biotechbranche keine Ausnahme bildet. Es ist kaum überraschend, dass sowohl große als auch kleine Pharmaunternehmen zunehmend KI-Plattformen für die Arzneimittelforschung einsetzen, um Forschungs- und Entwicklungsprozesse zu rationalisieren, Forschungszeiten und -kosten zu verkürzen und die Gesamteffizienz zu steigern.
Führende Pharmaunternehmen wie J&J, GSK, AstraZeneca, Novartis, Pfizer, Sanofi und Eli Lilly und andere haben erhebliche Investitionen in KI für die Arzneimittelforschung getätigt. Zu diesen Investitionen gehören Kapitalbeteiligungen, Akquisitionen oder Partnerschaften mit KI-fokussierten Unternehmen, die Entwicklung interner Fähigkeiten oder eine Kombination dieser Strategien.
Gleichzeitig gibt es einen Aufschwung bei der Entdeckung neuartiger Arzneimittel und Biotechnologieunternehmen, die oft von Anfang an als KI-zentrierte Organisationen etabliert sind. Diese Unternehmen wurden größtenteils im letzten Jahrzehnt gegründet und haben bereits spezielle KI-gesteuerte Arzneimittelforschungsplattformen entwickelt und getestet. Diese Plattformen umfassen häufig zahlreiche Modelle des maschinellen Lernens und bieten mittlerweile erhebliche Vorteile hinsichtlich der schnellen und kostengünstigen Zielerkennung und der Möglichkeiten zur Arzneimittelentwicklung. Infolgedessen produzieren sie in beschleunigtem Tempo präklinische und klinische Arzneimittelkandidaten. In den folgenden Abschnitten werden wir eine Auswahl von KI-entwickelten Arzneimittelkandidaten untersuchen, darunter kleine Moleküle, Biologika und andere Modalitäten, die bereits in klinische Studien eingetreten sind oder kurz davor stehen.
Darüber hinaus haben bestimmte KI-Unternehmen Fortschritte bei der Modellierung der Biologie mithilfe komplexer multimodaler Daten in Größenordnungen erzielt, die noch vor zwei Jahrzehnten unvorstellbar waren. Eine andere Unternehmensgruppe hat KI-gesteuerte Plattformen entwickelt, um die betriebliche Effizienz und das Versuchsdesign in klinischen Studien oder bei der Analyse realer Daten wie der Pharmakovigilanz zu verbessern.
Große Technologiekonzerne wie Alphabet, Microsoft, Amazon, IBM und Tencent verfügen über Fachwissen in den Bereichen KI und Big-Data-Technologien und wagen sich auch in die Arzneimittelforschung vor. Ihr Engagement umfasst Investitionen, die Gründung von Startups, Partnerschaften mit Life-Science-Unternehmen, Experimente und Innovationen.
Schließlich wurden auch bei anderen fortschrittlichen Technologien wie Quantencomputing, Kryo-EM und DNA-kodierten Bibliotheken erhebliche Fortschritte erzielt. Diese Technologien konvergieren mit dem KI-Trend und führen nicht nur zu neuartigen Tools, Produkten und Dienstleistungen, sondern auch zu einer Welle innovativer Start-ups und sogar neuartiger Geschäftsmodelle.
Was ist KI und wie wird sie in der Arzneimittelforschung eingesetzt?
Künstliche Intelligenz ist ein relativ altes Konzept, das 1956 auf einer berühmten Konferenz des Dartmouth College formalisiert wurde. Die KI-Technologien in der Arzneimittelforschung haben sich aus früheren Konzepten und Ansätzen des maschinellen Lernens (ML), der Cheminformatik und der Bioinformatik entwickelt. Beispielsweise hat die Anwendung maschinellen Lernens zur Entwicklung quantitativer Struktur-Aktivitäts-Beziehungsmodelle (QSAR) und Expertensystemen zur Toxizitätsvorhersage eine lange Geschichte.
Das schnelle (in manchen Fällen „exponentielle“) Aufkommen von Big Data, fortschrittlicher Analyse, Minimierung der Rechenkosten, GPU-Beschleunigung, Cloud Computing, Algorithmenentwicklung (z. B. tiefe neuronale Netze und große Sprachmodelle) usw „Demokratisierung“ der KI-Technologie – All dies führte zu einem synergetischen „Boom“ bei der Kommerzialisierung und Industrialisierung künstlicher Intelligenz, insbesondere in der Pharma- und Biotechindustrie.
In diesem Whitepaper verwenden wir den Sammelbegriff „künstliche Intelligenz“, um alle hochentwickelten Rechen- und Modellierungssysteme zu bezeichnen, die automatisch Erkenntnisse gewinnen und praktische Vorschläge aus „Big Data“, strukturierten und unstrukturierten Daten sowie multimodalen Daten ableiten können.
Während es keine Begrenzung für eine bestimmte Familie von Algorithmen gibt, die wir als „künstliche Intelligenz“ bezeichnen, meinen wir in den meisten Fällen verschiedene Varianten von Systemen, die auf maschinellem Lernen basieren (hauptsächlich tiefe neuronale Netze) und umfangreiche Verarbeitung natürlicher Sprache (NLP). Modelle. Moderne KI-Systeme können lernen, ohne explizite Anweisungen zu erhalten (im Gegensatz zu herkömmlicher Cheminformatik-Software innerhalb der „Wenn-Dann“-Logik), sie können die Genauigkeit nach neuen Lernzyklen und wenn mehr Daten in das System eingespeist werden, verbessern, und – was am bemerkenswertesten ist – sie können Verarbeiten Sie hochdimensionale multimodale Daten von enormer Größe. All diese Eigenschaften unterscheiden moderne Systeme der künstlichen Intelligenz erheblich von älteren Softwarepaketen für Cheminformatik und Bioinformatik. Solche Fähigkeiten stehen im Mittelpunkt der anhaltenden Begeisterung (und des Hypes) um KI.
Während einige Komponenten dessen, was wir „künstliche Intelligenz“ nennen – z. B. Werkzeuge für maschinelles Lernen und Sprachmodelle – von nahezu jedem pharmazeutischen Unternehmen und akademischen Labor verwendet werden, ist es einigen Unternehmen gelungen, anspruchsvolle Rechen- und Modellierungspipelines aufzubauen und „KI-Plattformen“ zu erforschen. Dazu gehören automatisierte Arbeitsabläufe über Dutzende oder sogar Hunderte verschiedener Modelle und Systeme (Deep Learning, Sprachmodelle) und Hunderte verschiedener öffentlicher und proprietärer Datenquellen.
Die hohe Ausgereiftheit und Automatisierung einiger KI-Plattformen führte zu ihrer „Kommerzialisierung“ bis zu dem Punkt, an dem sie Handelsnamen als Markenzeichen trugen. Gleichzeitig werden einige davon auch anderen Unternehmen als Software-as-a-Service angeboten. Beispiele hierfür sind mRNA DESIGN STUDIO™ von Moderna, Centaur Chemist® von Exscientia, Guardian Angel™ von AI Therapeutics, ConVERGE™ von Verge Genomics, Taxonomy3® von C4X Discovery und viele andere.
Nachfolgend finden Sie ein Beispiel für Pharma.AI von Insilico Medicine, ein modulares System für die End-to-End-Arzneimittelentwicklung, das Hunderte verschiedener Subsysteme und Modelle für maschinelles Lernen umfasst – insgesamt gesteuert durch noch andere Algorithmen höherer Modellierungsabstraktion (über ein Prinzip). des „Ensemble-Lernens“).
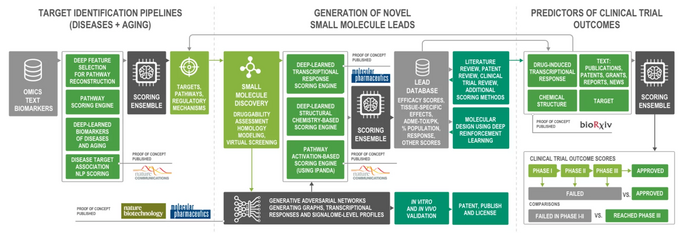
Ein Schema der End-to-End-Plattform Pharma.AI. Bildnachweis: https://insilico.com
Künstliche Intelligenz wird in nahezu allen Aspekten der pharmazeutischen Forschung eingesetzt, von der Datengewinnung über die biologische Modellierung und Zielerkennung bis hin zur Identifizierung von Leitmolekülen und der präklinischen und klinischen Forschung. Es wird auch für die Syntheseplanung, die intelligente Suche nach Reagenzien und Forschungsverbrauchsmaterialien sowie für Hilfsaufgaben wie intelligente Labornotizbücher und virtuelle Assistenten verwendet.

Quelle: https://www.biopharmatrend.com/m/companies/ai/
Das Life-Science-Ökosystem der KI-Anwender umfasst die folgenden Hauptkategorien von Akteuren:
|
Über 400 KI-gesteuerte Unternehmen (Startups/Scaleups) und bietet eine breite Palette von KI-gesteuerten Plattformen und Diensten an – vom klassischen Software-as-a-Service-Modell bis hin zu maßgeschneiderten Data-Science-Diensten, Arzneimittelforschung („Drug Candidate-as as Service“) und Unterstützung/Management klinischer Studien Ressourcen. |
|
Domainspezifische Softwareanbieter (z. B. KNIME, ChemAxon, Dotmatics, MolSoft und andere) konzentrieren sich hauptsächlich auf Cheminformatik-/Bioinformatik-Software, bieten aber auch auf maschinellem Lernen basierende Tools an. |
|
Führende Pharma- und Biotechunternehmen entwickeln im Rahmen ihrer F&E-Strategie interne KI-Expertise. Solche Akteure arbeiten oft mit externen KI-Anbietern und KI-gesteuerten Biotech-Start-ups zusammen, um Pilotprogramme in den Bereichen Arzneimittelentwicklung/Grundlagenbiologie/Analyse klinischer Studien zu erkunden. |
|
Spitzentechnologieunternehmen wie Google, Amazon und Tencent betreten den Pharmabereich und nutzen modernste KI-Technologien und Big-Data-Infrastrukturen. |
|
Auftragsforschungsorganisationen (CROs), die Fachwissen im Bereich KI entwickeln, um ihr Mehrwertangebot für Pharma-/Biotech-Kunden zu erweitern |
|
Akademische Labore im Pharma-/Biotechnologiebereich, die KI-Forschung betreiben und spezielle Frameworks und Tools entwickeln, die für die Branche relevant sind (normalerweise eine Wiege für zukünftige KI-Startups/Spin-outs) |
|
Nicht domänenspezifische Softwareanbieter, die AI-as-a-Service-Pakete und -Modelle entwickeln, die für den Einsatz in der Pharmaforschung geeignet sind (z. B. „out of the box AI“) |
|
Open-Source-Tools und Frameworks für maschinelles Lernen, die von Fachleuten der Biowissenschaften in ihren Forschungsprojekten umfassend genutzt werden |
Investitionslandschaft für die Entdeckung von KI-Arzneimitteln
Nach 2021, dem ungewöhnlich erfolgreichen Jahr für die Biotech-Branche im Hinblick auf die Anzahl der Risikokapitalgeschäfte, die Rekordzahl an Börsengängen, eine Fülle erfolgreicher Exits und ein insgesamt sehr positives Klima an der Börse, zeigte sich das Jahr 2022 deutliche Abkühlung der Finanzaktivitäten und völlig schlechte Entwicklung des Aktienmarktes.
Allerdings hat die künstliche Intelligenz im Bereich der Arzneimittelforschung zumindest im Bereich der Private-Equity-Transaktionen eine gewisse Widerstandsfähigkeit bewiesen, da mehrere Unternehmen Risikokapital in Höhe von Hunderten Millionen aufbrachten. Einige Beispiele sind MegaRobo Technologies mit Sitz in Peking (300 Millionen US-Dollar Serie C), ConcertAI mit Sitz in Massachusetts (150 Millionen US-Dollar Serie C) und Celsius Therapeutics (83 Millionen US-Dollar Serie A), Insilico Medicine mit Sitz in Hongkong (95 Millionen US-Dollar Serie D), Kalifornien- mit Sitz in BigHat Biosciences (75 Millionen US-Dollar Serie B) und DeepCell (73 Millionen US-Dollar Serie B) und mehreren anderen – lesen Sie „Große VC-Runden für KI-Unternehmen in der Arzneimittelforschung und Biotechnologie im Jahr 2022".
Die Fusions- und Übernahmelandschaft (M&A) war von einem kürzlich erfolgten bemerkenswerten Deal mit einem Biotech-Riesen geprägt Ginkgo Bioworks übernimmt Zymergen in einer Transaktion, die Zymergen mit 300 Millionen US-Dollar bewertet. Durch die Übernahme werden die Fähigkeiten von Zymergen im Bereich maschinelles Lernen und Datenwissenschaft mit der Plattform für synthetische Biologie von Ginkgo zusammengeführt.
Wichtige Beobachtungen und Trends der Branche
Das Aufkommen von KI und Datentechnologien sowie neuartige Rechenwerkzeuge und Infrastrukturlösungen (Datenbanken, Cloud-Dienste usw.) definieren die Arbeitsweise der Pharmaindustrie neu – auf Forschungs-, klinischer und geschäftlicher Ebene. Im Folgenden werfen wir einen Blick auf einige Trends und Beobachtungen im Bereich KI für die Arzneimittelforschung sowie beispielhafte Branchenentwicklungen im Jahr 2022.
KI-gestützte Biologiemodellierung und Zielerkennung
In der Arzneimittelforschung ist die Identifizierung neuer Wirkstoffziele von entscheidender Bedeutung für die Entwicklung neuartiger, erstklassiger therapeutischer Arzneimittel – potenzieller „Blockbuster“. In den letzten Jahrzehnten konzentrierten sich die Bemühungen zur Arzneimittelentdeckung traditionell darauf, spezifische Proteine mit geeigneten „Taschen“ anzusprechen, die von einem Ligandenmolekül (häufig einem kleinen Molekül) beeinflusst werden sollen. Aber von der Gesamtheit aller menschlichen Proteine (auch „Proteom“ genannt) wurde eine kleine Anzahl Proteine als Ziele erforscht. Derzeit gibt es 20,360 menschliche Proteine in Swiss-Prot, von denen laut OMIM-Datenbank etwa 4,600 bekanntermaßen an Krankheitsmechanismen beteiligt sind, was etwa 22 % der menschlichen Proteine mit einer Rolle bei Krankheiten ausmacht. Diese Proteine sind die offensichtliche Region des menschlichen Proteoms, die wahrscheinlich lebensfähige Angriffspunkte für Arzneimittel enthält. Jedoch, wie von 2017In den vorhandenen, von der FDA zugelassenen Arzneimitteln wurden tatsächlich nur etwa 890 menschliche und von Krankheitserregern stammende Biomoleküle (hauptsächlich Proteine) genutzt. Zu diesen Biomolekülen gehörten 667 aus dem menschlichen Genom stammende Proteine, auf die Medikamente gegen menschliche Krankheiten abzielen. Die Dinge sind heute nicht viel anders, daher gibt es in diesem Pool noch viel Raum für die Identifizierung neuer Ziele. Neuartige rechnerische Ansätze, die auf Technologien der künstlichen Intelligenz basieren, ermöglichen die Identifizierung neuer medikamentöser Proteintaschen im großen Maßstab und ermöglichen manchmal proteomweite virtuelle Screenings.
Aber was noch spannender ist: Fortschrittliche Modellierungswerkzeuge helfen dabei, neuartige Arten von Zielen zu identifizieren und zu modulieren, wie etwa Protein-Protein-Wechselwirkungen, Ziele mit großen Kontaktflächen, Protein-Nukleinsäure-Wechselwirkungen und Ziele der nächsten Generation, wie etwa die Nutzung des Proteins der Zelle Abbaumaschinen.
Viele KI-gesteuerte Unternehmen konzentrieren sich auf die Modellierung der Biologie, die Entdeckung und Validierung neuartiger Ziele und bieten anderen Organisationen „Krankheitsmodell als Dienstleistung“ oder „Zielerkennung als Dienstleistung“ an. Die Nachfrage nach solchen Auftragsforschungsdienstleistungen steigt, was sich in der wachsenden Zahl von Target-Discovery-Partnerschaften widerspiegelt.
Beispielsweise kündigte CytoReason, ein in Israel ansässiges Biologiemodellierungsunternehmen, im September 2022 eine erweiterte Zusammenarbeit mit Pfizer im Wert von 110 Millionen US-Dollar an. Die beiden Unternehmen begannen 2019 zusammenzuarbeiten, als Pfizer damit begann, die biologischen Modelle von CytoReason in der Forschung zu nutzen, die auf die Entwicklung neuer Medikamente für immunvermittelte Krankheiten und Krebsimmuntherapien abzielte.
Im Mai 2022 gab AstraZeneca bekannt, dass es aus seiner Zusammenarbeit mit BenevolentAI, einem in Großbritannien ansässigen Marktführer in der KI-gesteuerten Arzneimittelforschung, ein zweites Lungenfibrose-Target gesammelt hat. Der Meilenstein markierte ein drittes neuartiges Ziel, das BenevolentAI für AstraZeneca seit Beginn der Zusammenarbeit im Jahr 2019 entdeckte. Nur wenige Monate später, im Oktober 2022, gelang es BenevolentAI, zwei weitere KI-generierte Ziele für das F&E-Portfolio von AstraZeneca bereitzustellen, die auf chronische Nierenerkrankungen und idiopathische Erkrankungen abzielen Lungenfibrose.
Im November 2022 unterzeichnete das in Hongkong ansässige Unternehmen Insilico Medicine einen potenziell 1.2-Milliarden-Dollar-Vertrag mit Sanofi über die Entdeckung von bis zu sechs neuen Zielmolekülen unter Nutzung der „Pharma.AI“-Plattform von Insilico Medicine.
Während hochmoderne Algorithmen wie tiefe neuronale Netze große Datenmengen benötigen, um die Biologie richtig zu modellieren, gibt es Ziele, für die nur wenige Datenmengen verfügbar sind. Ein in Kanada ansässiges Unternehmen Cyclica hat eine KI-gesteuerte Plattform für Polypharmakologie und proteomweites Screening entwickelt, die in der Lage ist, mit „Low-Data“-Zielen zu arbeiten. Im November 2022 erhielt Cyclica von der Bill & Melinda Gates Foundation einen Zuschuss in Höhe von 1.8 Millionen US-Dollar, um seine KI-gestützte Arzneimittelforschungsplattform zur Entdeckung neuer nicht-hormoneller Wirkstoffe einzusetzen und dabei mehrere biologische Ziele mit wenigen Daten zu nutzen.
Gemäß der BiopharmaTrend-Bericht, gibt es mindestens 182 weitere KI-Unternehmen im Bereich der Zielforschung, darunter führende, gut finanzierte Unternehmen mit hochmodernen Forschungs- und Entwicklungsplattformen wie Insitro, Relay Therapeutics, Valo Health und andere.
Im Bereich der Biologiemodellierung entstehen ständig neue „KI-native“ Startups. Zum Beispiel CardiaTec Biosciences, WhiteLab Genomics, Degron Therapeutics, um nur einige zu nennen.
ZUGEHÖRIG: 11 KI-gestützte Arzneimittelforschungs-Startups, gegründet im Jahr 2021
Alles in allem tragen fortschrittliche, auf künstlicher Intelligenz basierende Modellierungsmethoden dazu bei, die Definition biologischer Ziele neu zu definieren, da wir versuchen, die Arzneimittelreaktion mit genetischer Variation zu verknüpfen, geschichtete klinische Wirksamkeit und Sicherheit zu verstehen, die Unterschiede zwischen Arzneimitteln derselben therapeutischen Klasse zu rationalisieren und Vorhersagen zu treffen Arzneimittelnutzen in Patientenuntergruppen.
Strukturbiologie mit KI knacken
Eines der am meisten diskutierten KI-bezogenen Themen in der Life-Sciences-Community in diesem Jahr war der jüngste Erfolg der in Großbritannien ansässigen Alphabet-Tochtergesellschaft DeepMind, über den viel berichtet wurde sein Erfolg bei der Lösung des Proteinfaltungsproblems, ein ein halbes Jahrhundert altes biologisches Problem.
Im Juli 2022 erscheint die Deep-Learning-Software AlphaFold von DeepMind vorhergesagt und öffentlich geteilt Proteinstrukturen von über 200 Millionen Proteinen und hat die erstaunliche Fähigkeit seines KI-Systems unter Beweis gestellt, 3D-Strukturen allein aus seiner 1D-Aminosäuresequenz genau vorherzusagen. Während einige argumentieren, dass diese Entdeckung möglicherweise (noch) keine so transformative Rolle in der Arzneimittelentwicklung spielt, wie man annehmen könnte, und dass AlphaFold schnitt bei der Vorhersage der Wechselwirkungen zwischen Bakterienprotein und antibakteriellen Verbindungen nicht viel besser ab als der ZufallDie Entdeckung ist sicherlich ein Paradigmenwechsel sowohl für die Strukturbiologie als auch für die Veranschaulichung des Potenzials der KI in der biologischen Grundlagenforschung.
Im November 2022 wurde der bahnbrechende Erfolg von DeepMind bei der Modellierung des Proteoms von Forschern bei Meta (ehemals Facebook, mit Hauptsitz in Menlo Park, Kalifornien) konkurriert. Es nutzte KI, um die Strukturen von etwa 600 Millionen Proteinen von Bakterien, Viren und anderen Mikroorganismen vorherzusagen, die noch nicht charakterisiert wurden.
Die Wissenschaftler von Meta verwendeten eine völlig unterschiedlicher KI-Ansatz – mithilfe eines „großen Sprachmodells“, einer Art KI, die Text aus nur wenigen Buchstaben oder Wörtern vorhersagen kann. Modelle natürlicher Sprache (NLPs) werden normalerweise auf großen Textmengen trainiert. Da es sich bei 1D-Proteinsequenzen jedoch im Wesentlichen um Buchstabenfolgen handelt, können NLPs auf solche Probleme ähnlich wie bei der Arbeit mit menschlichen Sprachen angewendet werden.
Interessanterweise könnten sich solche großen Technologiesprünge in der Proteinfaltung als nützlicher erweisen De-novo-Proteindesign, als einfach Strukturen bestehender Proteine für die Arzneimittelentwicklung zu modellieren. Die Zeit wird zeigen, wo die Auswirkungen am größten sein werden, aber die oben genannten Erfolge von DeepMind und Meta sind nicht die einzige aufregende Entwicklung für Strukturbiologen im Jahr 2022.
Vor kurzem haben die rasanten Fortschritte in der Kryo-EM in Verbindung mit KI-Technologien eine Entwicklung hervorgebracht neue Welle von Biotech-Startups wie Gandeeva Therapeutics, Septerna und MOMA Therapeutics. Der Kryo-EM-Bereich nimmt Fahrt auf, da Biotech-Start-ups die Aufmerksamkeit einer breiten Palette von Investoren auf sich ziehen, von kleineren Venture-Organisationen bis hin zum Eigentümer von TikTok und dem Internet-Tech-Riesen ByteDance, die in Shuimu BioSciences investieren. Das Interesse wird nicht nur durch die revolutionäre, mit dem Nobelpreis ausgezeichnete Technologie geweckt, sondern auch durch die aktive Einbindung von KI in den Prozess. Die aktuelle Veröffentlichung „Eine KI-gestützte Kryo-EM-Pipeline für Strukturstudien von Zellextrakten“ betonte die unersetzliche Rolle der KI in komplexen Kryo-EM-Pipelines, einschließlich der KI-gesteuerten Atommodellvorhersage zur schnellen und gleichzeitigen Untersuchung der Struktur mehrerer Mitglieder der Proteingemeinschaft de novo. Maschinelles Lernen hilft nicht nur, die Kryo-EM-Pipeline zu beschleunigen und zu optimieren, sondern auch, Fallstricke durch Benutzervoreingenommenheit zu vermeiden.
Gandeeva Therapeutics, gegründet im Jahr 2021, hat Anfang dieses Jahres 40 Millionen US-Dollar gesammelt, um neuartige Therapien zu entwickeln, die auf der präzisen Bildgebung von Protein-Arzneimittel-Wechselwirkungen basieren. Ihre Target-Selection Engine kann zusammen mit der Cryo-EM Engine dazu beitragen, „Sackgassen bei der Entdeckung zu vermeiden“, wie das Unternehmen erklärte. Gleichzeitig sammelte das im Jahr 2020 eingeführte Kryo-EM-Biotechnologieunternehmen MOMA Therapeutics in nur zwei Jahren satte 236 Millionen US-Dollar ein und hatte das ehrgeizige Ziel, neuartige Präzisionsmedikamente gegen Krebs in die Klinik zu bringen. MOMA konzentriert sich auf eine einzigartige Klasse biologischer Ziele – „molekulare Maschinen“.
Mit KI kleine Moleküle entwickeln
Nach der Modellierung von Krankheiten und der Entdeckung von Zielmolekülen ist die Entwicklung chemischer oder biologischer Moleküle der zweithäufigste Anwendungsfall für den Einsatz künstlicher Intelligenz in der Arzneimittelforschung. Mehr als 130 von 384 Unternehmen im BiopharmaTrend AI Report, die auf künstlicher Intelligenz basieren, nutzen künstliche Intelligenz unter anderem für die Entwicklung von Medikamentenkandidaten.
KI-gesteuertes Arzneimitteldesign lässt sich hauptsächlich in drei Hauptkategorien einteilen: De-novo-Arzneimitteldesign (z. B. generatives Design), virtuelles Screening vorhandener Datenbanken und Neuverwendung von Arzneimitteln.
Das De-novo-Arzneimitteldesign wird meist durch Deep-Learning-Modelle wie generative kontradiktorische neuronale Netze (GANs) ermöglicht. Einige Beispiele für generative KI-Plattformen sind die Software Chemistry42 von Insilico Medicine, Makya von Iktos und De Novo Platform von Ro5. Weitere Anbieter in dieser Kategorie sind Recursion Pharmaceuticals, Deep Cure, Standigm und andere.
Die Anwendung eines durch künstliche Intelligenz ermöglichten ultragroßen virtuellen Screenings, bei dem Milliarden von Molekülen durchsucht werden, um erfolgreiche Treffer zu finden. Im August 2022 schloss Sanofi mit Atomwise einen Deal zur Medikamentenentwicklung im Wert von potenziell bis zu 1.2 Milliarden US-Dollar ab. Der Deal, bei dem Sanofi eine Vorauszahlung von 20 Millionen US-Dollar vorsieht, konzentriert sich auf die Nutzung der AtomNet-Plattform des US-Unternehmens zur Erforschung kleiner Moleküle für bis zu fünf von Sanofi ausgewählte Wirkstoffziele. Ein auf einem Faltungs-Neuronalen Netzwerk basierendes AtomNet zeichnet sich durch strukturbasiertes Arzneimitteldesign aus und ermöglicht „die schnelle, KI-gestützte Suche in der proprietären Bibliothek von Atomwise mit mehr als 3 Billionen synthetisierbaren Verbindungen“, so das Ankündigung.
Anfang 2019 arbeitete Atomwise mit dem in der Ukraine ansässigen Chemieführer Enamine zusammen, um das „weltweit erste und größte virtuelle Screening mit 10 Milliarden Verbindungen“ durchzuführen, mit dem Ziel, Treffer für die pädiatrische Onkologie zu identifizieren.
Schließlich nutzen eine Reihe von Unternehmen Umnutzungsstrategien für die KI-gestützte Arzneimittelforschung. Unternehmen dieser Kategorie, darunter Healx, BenevolentAI und BioXcel Therapeutics, nutzen größtenteils NLP-Modelle (Natural Language Processing) und maschinelles Lernen und analysieren riesige Mengen unstrukturierter Textdaten – Forschungsartikel und Patente, elektronische Gesundheitsakten (EHRs) usw sowie andere Datentypen – um „Wissensdiagramme“ zu erstellen und zu durchsuchen. Solche KI-gestützten durchsuchbaren Ontologien ermöglichen die Auswahl neuer Indikationen oder Patientenpopulationen für bereits bekannte Arzneimittelkandidaten oder sogar zugelassene Arzneimittel.
Lantern Pharma beispielsweise, ein in den USA ansässiges Biotechnologieunternehmen im klinischen Stadium, konzentrierte sich auf die Innovation des Entwicklungsprozesses von Krebsmedikamenten durch den Einsatz fortschrittlicher Genomik, maschinellem Lernen und künstlicher Intelligenz.
Die KI-Plattform des Unternehmens, RADR®️, umfasst derzeit mehr als 25 Milliarden Datenpunkte und nutzt Big-Data-Analysen und maschinelles Lernen, um schnell biologisch relevante genomische Signaturen aufzudecken, die mit der Arzneimittelreaktion zusammenhängen, und dann relevante Untergruppen von Krebspatienten zu identifizieren, die von Lanterns Arzneimittelkandidaten profitieren . RADR®️ wird von Lantern und seinen Mitarbeitern auch zur Entwicklung und Positionierung neuer Arzneimittel sowie zur Umwidmung von Arzneimitteln eingesetzt.
ZUGEHÖRIG: Enthüllung der Erfolgsgeschichte von Lantern Pharma in der KI-gestützten Präzisionsonkologie
KI trifft auf DNA-kodierte Bibliotheken
Ein etwas einzigartiger Ansatz für das Arzneimitteldesign besteht darin, DNA-kodierte Bibliotheken (DELs) als Quelle für neue Moleküle zu verwenden, die durchsucht werden müssen. Da die DEL-Technologie Zugang zum praktisch größten verfügbaren Chemieraum auf dem Markt bietet, ist diese Big-Data-Technologie eine natürliche Ergänzung für KI-basierte Tools.
Ein bemerkenswertes Deal fand im Jahr 2020 statt, als Insitro, einer der namhaftesten Akteure in der Anwendung von maschinellem Lernen für die Arzneimittelforschung, gegründet von Daphne Koller, Haystack Sciences erwarb. Die auf maschinellem Lernen basierende Plattform von Haystack kombinierte mehrere Elemente ihrer DEL-Technologie, darunter die Fähigkeit, breite, vielfältige Sammlungen kleiner Moleküle zu synthetisieren, die Fähigkeit, iterative Nachverfolgungen durchzuführen, und eine proprietäre semiquantitative Screening-Technologie namens nDexer™, die generiert Datensätze mit höherer Auflösung.
ZebiAI wiederum wurde im Jahr 2021 von einem anderen namhaften Entwickler einer auf künstlicher Intelligenz basierenden Arzneimittelforschungsplattform übernommen, einem Biotech-Unternehmen im klinischen Stadium, Relay Therapeutics, wo Relay 85 Millionen US-Dollar im Voraus bezahlte. Diese Übernahme ermöglichte es Relay, die auf maschinellem Lernen basierende DEL-Technologie von ZebiAI in seine Protein-Targeting-Plattform Dynamo zu integrieren.
ZUGEHÖRIG: Ein Marktüberblick über DNA-kodierte Bibliothekstechnologie in der Arzneimittelforschung
Im Oktober 2021 erwarb X-Chem Glamorous AI, einen Entwickler einer modularen, vielfältigen künstlichen Intelligenzlösung für die Arzneimittelforschung RosalindAI, einschließlich Funktionen für Datentechnik und Featurisierung, prädiktive Analysen, Hochleistungsrechnen und De-novo-Arzneimitteldesign.
KI-gesteuertes Arzneimitteldesign über kleine Moleküle hinaus
Wenn man bedenkt, dass moderne Werkzeuge der künstlichen Intelligenz, die für die Arzneimittelforschung eingesetzt werden, tiefe historische Wurzeln in der Cheminformatik und den frühen, auf maschinellem Lernen basierenden QSAR-Modellen des vergangenen Jahrhunderts haben, ist es nicht verwunderlich, dass sich die überwältigende Mehrheit der KI-Startups in der Arzneimittelforschung auf kleine Moleküle konzentriert .
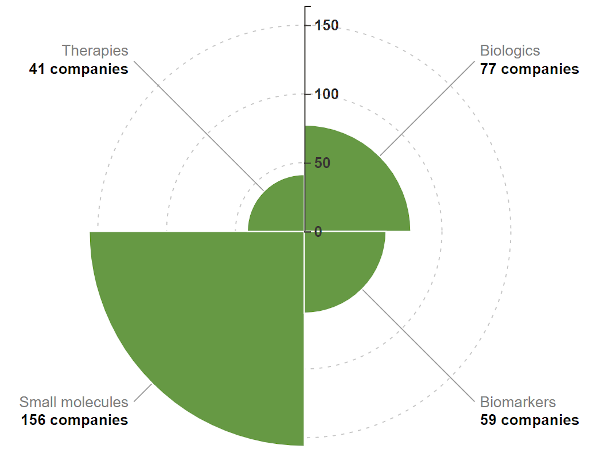
Verteilung der KI-Wirkstoffforschungsunternehmen nach Produktkategorie. Quelle: BiopharmaTrend AI-Bericht.
Biomolekulare Arzneimittel (auch „Biologika“ genannt) und neuartige chemische Modalitäten sind jedoch im pharmazeutischen Bereich immer häufiger anzutreffen, ebenso wie die neuen Biotech-Unternehmen, die KI-basierte Methoden anwenden, um diese zu entdecken. Nachdem Wissenschaftler im Jahr 2003 das menschliche Genom geknackt hatten, entwickelte sich der Bereich der Arzneimittelverfügbarkeit und Entwicklungsfähigkeit rasch weiter. Im vergangenen Jahrhundert diente Lipinskis Fünferregel (Ro5) als „Leitfaden“ für das Design arzneimittelähnlicher Moleküle für die orale Verabreichung im „traditionellen“ medikamentösen Zielraum.
Im Gegensatz dazu treiben neuartige Arten von Zielen, wie Protein-Protein-Wechselwirkungen, Ziele mit großen Kontaktflächen, Protein-Nukleinsäure-Wechselwirkungen und Ziele der nächsten Generation, wie etwa die Nutzung der Proteinabbaumaschinerie der Zelle, das Aufkommen einer Vielzahl neuer Ziele voran molekulare Modalitäten, insbesondere über Ro5 (bRo5) hinaus kleine Moleküle (wie Protein-Protein-Interaktionsmodulatoren, proteinzielgerichtete Chimären (PROTACs), monoklonale Antikörper (mAbs), Peptide und Peptidomimetika sowie nukleinsäurebasierte Modalitäten (RNA- und DNA- basierend) sind zu einem zentralen Schwerpunkt in der Arzneimittelforschung geworden.
ZUGEHÖRIG: Die „Explosion“ therapeutischer Modalitäten: kleine Moleküle, Biologika und alles dazwischen,
Beispielsweise nutzen immer mehr Unternehmen KI-Methoden, um neuartige monoklonale Antikörper zu entdecken – die bislang kommerziell erfolgreichste Biologika-Methode. Insbesondere kündigte das in Israel ansässige Unternehmen Biolojic Design im April 2022 seinen ersten rechnerisch entwickelten Antikörper an nahm an der klinischen Studie teil. Das Unternehmen nutzt eine strukturbasierte Designstrategie. Sein KI-Modell wird auf Millionen von Antikörper-Antigen-Paaren trainiert, um aus vorhandenen menschlichen Antikörpern einen Template-Antikörper gegen das gewünschte Ziel zu identifizieren. Ein zusätzliches maschinelles Lernmodell wird verwendet, um Mutationen vorherzusagen und die Optimierung der Vorlage zur Verbesserung ihrer Eigenschaften zu steuern.
Im November 2022 gab das in Kanada ansässige Unternehmen AbCellera Biologics bekannt, dass Regeneron beschlossen hat, von seinem Recht Gebrauch zu machen, den ersten therapeutischen Antikörperkandidaten von AbCellera, der auf einen nicht genannten G-Protein-gekoppelten Rezeptor (GPCR) abzielt, in die weitere präklinische Entwicklung voranzutreiben. Die Partnerschaft, die im März 2020 begann und vier von Regeneron ausgewählte Forschungsprogramme ermöglicht, nutzt die KI-basierte Antikörper-Entdeckungsmaschine von AbCellera und die VelocImmune®-Mäuse von Regeneron, um neuartige therapeutische Antikörper zu identifizieren.
Zwei Dutzend andere Unternehmen, die Antikörper entdecken, nutzen KI, darunter AbSci, BigHat Biosciences, Totient, Nabla Bio und Generate Biomedicine mit Sitz in den USA; Deep Biologics mit Sitz in Kanada; NeoX mit Sitz in China; EU-basiertes Deep CDR, Natural Antibody und MabSilico usw.
Das in den USA ansässige Unternehmen mit dem eingängigen Namen Creyon Bio wendet einen technischen Ansatz zur Entwicklung neuer Oligonukleotid-basierter Arzneimittel (OBMs) an. Das Unternehmen wurde 2019 gegründet und sammelte im März 40 2022 Millionen US-Dollar an Finanzmitteln. Envisagenics wurde 2014 als Spin-out des Cold Spring Harbor Laboratory gegründet und ist ein in New York ansässiges Unternehmen, das sich auf die Entdeckung von RNA-Therapeutika konzentriert. Gemäß ihrer erklärten Mission wollen sie die Komplexität biomedizinischer Daten mithilfe von KI/ML-Technologien reduzieren. Erst kürzlich, im August 2022, erhielten sie einen Zuschuss vom National Cancer Institute, was zu einer Gesamtfinanzierung von 27.1 Millionen US-Dollar führte.
Die KI-gesteuerte Technologie von Envisagenics, SpliceCore, ist eine cloudbasierte Plattform, die experimentell validiert wurde, um Wirkstoffziele und Biomarker durch Splicing-Entdeckung aus RNA-Sequenzierungsdaten vorherzusagen. Nach Angaben des Unternehmens gewährleistet es eine höhere Präzision und Geschwindigkeit im Vergleich zu herkömmlichen Methoden.
Die KI-gesteuerte Strategie von Innophore zur Entwicklung neuartiger therapeutischer Enzyme wird durch die Kopplung der patentierten Catalophore™-Technologie mit modernsten konventionellen Bioinformatik-Ansätzen und künstlicher Intelligenz umgesetzt. Innophore kann Struktur- und Sequenzdatenbanken mithilfe dreidimensionaler (3D) Suchvorlagen durchsuchen, die als „Katalophore“ (d. h. Träger der katalytischen Funktion) bezeichnet werden und durch Punktwolken physikalisch-chemischer Merkmale definiert sind. Mit dieser Technik identifizierte neuartige Enzyme haben nicht unbedingt eine gemeinsame Struktur oder Sequenzbasis mit ihren verwendeten Gegenstücken. Daher weisen sie möglicherweise veränderte Proteineigenschaften wie Thermostabilität, Robustheit, Substratspektrum, Selektivität und Spezifität auf.
Neben der Entwicklung neuartiger Enzyme kann die Technologie von Innophore potenziell bahnbrechend für epidemiologische Anwendungen sein und potenziell gefährliche Mutationen in Viren schützen. Im Jahr 2021 startete Innophore in Zusammenarbeit mit der AWS Diagnostic Development Initiative das Projekt virus.watch. Ziel dieses Projekts war die Implementierung eines Überwachungs- und Bewertungssystems für neu auftretende arzneimittel- und krankheitsrelevante Varianten des Coronavirus (SARS-CoV-2). Das erste gemeinsame Papier, veröffentlicht in Nature im August 2022 beschreibt eine bioinformatische Analyse von SARS-CoV-2-Varianten, die eine höhere hACE2-Rezeptorbindungsaffinität für Omicron B.1.1.529 Spike RBD im Vergleich zu einer Wildtyp-Referenz zeigt.

Die Verfolgung des sich entwickelnden Virus im Laufe der Zeit mithilfe der Innophore-Technologie und AWS zeigt eine hohe Mutationsrate bei der Omicron-Variante. Kugeln stellen Alpha-C-Atome des entsprechenden Aminosäurerests dar. Sowohl Farbe als auch Größe korrelieren mit der Anzahl der Mutationen an jeder Position.
Evaxion Biotech mit Sitz in Dänemark wurde 2008 gegründet und ist ein KI-gesteuertes Unternehmen, das sich der Entwicklung von Impfstoffen gegen Krebs und Infektionskrankheiten widmet. Sie besitzen eine Plattform für KI-Immunologie im klinischen Stadium, die KI-Technologie mit ihrem technischen Fachwissen kombiniert, um Vorhersagemodelle zu erstellen und so bei der Identifizierung einzigartiger Immuntherapien für Patienten zu helfen. Evaxion Biotech sammelte insgesamt 57 Millionen US-Dollar und nahm im Juni 2022 an der Post-IPO-Eigenkapitalfinanzierungsrunde im Wert von 40 Millionen US-Dollar teil, die von einem einzigen Investor, dem Lincoln Park Capital Fund, angeführt wurde.
ZUGEHÖRIG: 10 Unternehmen, die KI für die Entwicklung von Biologika einsetzen
Einige KI-Unternehmen aus dem „Club der chemischen Modalitäten“ wie Exscientia expandieren jetzt in die Entdeckung biologischer Arzneimittel. Im November 2022 kündigte das Unternehmen an, dass seine KI-Plattform die Entwicklung menschlicher Antikörper umfassen würde. Exscientia richtet außerdem in Oxford ein automatisiertes Biologika-Labor ein, um intern neuartige Antikörper zu generieren und zu profilieren.
Ein wachsender Trend besteht darin, das Proteinabbausystem menschlicher Zellen auszunutzen, um bösartige Proteine zu beseitigen und Krankheiten zu heilen. Eine Modalität, die hier immer beliebter wird, ist die Proteolysis Targeting Chimera (PROTAC), die 2001 eingeführt wurde und aus zwei Liganden besteht, die durch einen flexiblen Linker verbunden sind. Die primäre chemische Architektur moderner PROTACs ist dieselbe: Ein Ligand zielt auf das E3-Enzym ab, eine Komponente, die veraltete Proteine an das Proteasom sendet, und ein anderer Ligand zielt auf ein Protein of Interest (POI), das abgebaut werden muss. Ein PROTAC bindet E3 und POI und bringt sie näher zusammen, um einen induzierten Proximity-Komplex zu bilden. In einigen Fällen wird der POI ubiquitiniert, wenn sich die Proteine richtig ausrichten, was ihn für den Abbau durch das Proteasom markiert.
Ein weiterer umfassender Ansatz zum Proteinabbau umfasst sogenannte „molekulare Klebstoffe“, ein aktiv wachsendes Forschungsgebiet. Im Gegensatz zu PROTACs, bei denen es sich um relativ große bifunktionale kleine Moleküle mit zwei aktiven Zentren und einem Linker handelt, handelt es sich bei molekularen Klebern um kleinere und eher wirkstoffähnliche Moleküle. Letztere binden an eine aggregierte Proteintasche, die aus der Annäherung zweier separater Proteine durch die Wirkung des molekularen Klebermoleküls entsteht.
Es gibt eine Welle von Unternehmen im Bereich des Proteinabbaus (und allgemeiner der Modulation), darunter Arvinas, Nurix Therapeutika, Kymera Therapeutika, C4 Therapeutics, Roivant Discovery, Cedilla Therapeutics und Lycia Therapeutics, um nur einige zu nennen.
Einige Unternehmen wenden hochmoderne KI-Algorithmen an, um Verbindungen zu entwickeln, die Nähe erzeugen. Beispielsweise hat das in Österreich und den USA ansässige Unternehmen Celeris Therapeutics die Celeris One-Plattform entwickelt, die drei Arbeitsbereichssysteme umfasst: Xanthos, Hephaistos und Hades. Die Systeme umfassen graphische neuronale Netze zur Vorhersage von Wechselwirkungen und generative Modelle zur Schaffung neuer chemischer Materie, wie z. B. Linker- und Mehrzieloptimierung zur Verbesserung molekularer Eigenschaften, molekularer Dynamik und Berechnungen der freien Energie. Der Workflow nutzt außerdem geometrische Deep-Learning- und durch maschinelles Lernen gesteuerte Retrosynthesefunktionen. Celeris Therapeutics betreibt ein automatisiertes Labor zur Generierung biologischer Daten und zur Durchführung maßgeschneiderter chemischer Synthesen.

Der Trockenlabor-Workflow der KI-gesteuerten Plattform Xanthos von Celeris Therapeutics.
Wir haben kürzlich in einem Beitrag einen umfassenden Überblick über den Markt für Proteinabbau veröffentlicht Proteinabbauer erobern die Industrie im Sturm, einschließlich mehrerer Fallstudien mit einem technischen Überblick über die beteiligten Rechenplattformen.
Die erste Welle von KI-entwickelten Medikamentenkandidaten wird klinisch getestet
Während es wahrscheinlich noch zu früh ist, zu sagen, dass die Einführung von KI in der Pharmaindustrie die Arzneimittelforschung insgesamt revolutioniert hat, gelang es mehreren „KI-nativen“ Unternehmen, beim schnellen Aufbau ihrer therapeutischen Pipelines bemerkenswerte Effizienz zu erzielen. Was ist ein gemeinsames Merkmal solcher Unternehmen? Jeder baute eine spezialisierte, hochintegrierte KI-Plattform auf, die viele Modelle und Datenquellen umfasste. Einige Plattformen stehen auch externen F&E-Partnern wie Chemistry42 als Software-as-a-Service zur Verfügung.
Eines der anschaulichsten Beispiele dafür, wie die Branche von einer „Digital-First“-Strategie profitiert, ist Moderna Therapeutics, dem es nicht nur gelungen ist, modernste KI-Analysen in seine Forschung zu integrieren, sondern auch jeden Aspekt seines F&E-Workflows zu digitalisieren und zu integrieren Produktion und Vertrieb. Als die COVID-19-Pandemie Anfang 2020 die Welt erfasste, gehörte Moderna zu den ersten Unternehmen, denen es gelang, innerhalb von nur 2 Tagen (!) einen effizienten mRNA-basierten Impfstoff zu entwickeln und diesen innerhalb eines Jahres auf den Markt zu bringen .
Eine Welle von Erfolgen bei der Entdeckung von Therapeutika, die durch KI ermöglicht wurden, zeigt die Fähigkeit von KI-nativen Unternehmen, Arzneimittelkandidaten schneller zu entwickeln, als dies normalerweise für ähnliche Programme der Fall war.

Anzeigen „Die von KI entworfene Roadmap für Arzneimittelkandidaten“
Der monoklonale Antikörper LY-CoV555 von AbCellera wurde innerhalb von drei Monaten entwickelt und erhielt von der FDA eine Notfallzulassung.
Der Knowledge Graph von BenevolentAI half dem Unternehmen, Baricitinib innerhalb weniger Tage als wirksames antivirales Mittel gegen COVID-19 zu identifizieren (jetzt von der FDA zur Verwendung zugelassen). Ein weiteres kleines Molekül, BEN-8744, ein neuartiger Inhibitor zur Behandlung von Colitis ulcerosa und Dermatitis, wurde innerhalb von weniger als 24 Monaten in die späten präklinischen Studien gebracht.
Der niedermolekulare Inhibitor EXS-21546 von Exscientia war das erste von KI entwickelte Molekül für die Immunonkologie, das in klinische Studien am Menschen ging (jetzt in Phase I) und wurde in nur acht Monaten entdeckt. Das Unternehmen hat mehrere andere Moleküle in klinischen Studien.
Der niedermolekulare Inhibitor ISM001-055 von Insilico Medicine zur Behandlung der idiopathischen Lungenfibrose wurde de novo entwickelt und innerhalb von 18 Monaten in späte präklinische Studien überführt (jetzt in Phase I).
Das in New York ansässige Unternehmen Schrodinger hat innerhalb von zehn Monaten ein kleines Molekül SGR-1505 zur Behandlung von B-Zell-Lymphomen entwickelt und befindet sich derzeit in der IND-Anwendung.
Das in Salt Lake City ansässige Unternehmen Recursion Pharmaceuticals entwickelte innerhalb von 18 Monaten einen Medikamentenkandidaten für eine nicht näher bezeichnete seltene Krankheit. Das Unternehmen verfügt über ein großes und vielfältiges Portfolio an präklinischen und klinischen Arzneimittelkandidaten, die mithilfe seiner digitalen Biologieplattform entwickelt wurden.
Das in Toronto ansässige Unternehmen Deep Genomics nutzte seine AI Workbench-Plattform, um ein neuartiges genetisches Ziel und einen entsprechenden Oligonukleotid-Medikamentenkandidaten DG12P1 zur Behandlung eines seltenen vererbten Morbus Wilson zu entwickeln.
Um den Überblick über die führenden KI-entwickelten klinischen Arzneimittelkandidaten zu behalten, haben wir erstellt „Die von KI entworfene Roadmap für Arzneimittelkandidaten“ welches regelmäßig aktualisiert wird.
Es sollte beachtet werden, dass die anhaltende Aufmerksamkeit der Medien für die KI in der Arzneimittelforschung mit Vorsicht betrachtet werden sollte. Beispielsweise erlitt der Plan von BenevolentAI, seinen Medikamentenkandidaten gegen atopische Dermatitis, BEN-2293, auszulizenzieren, einen Rückschlag, da der KI-fähige pan-Trk-Inhibitor in einer Phase-2a-Studie weder Ekzemsymptome noch Juckreiz lindern konnte. Das Unternehmen hatte zuvor Tropomyosin-Rezeptorkinasen (Trk) als Vermittler von Juckreiz und Entzündungen bei atopischer Dermatitis identifiziert, was zur Entwicklung von Trk-Inhibitoren führte. Obwohl BEN-2293 in einer Phase-1b-Studie einen Trend zu einer klinisch bedeutsamen Wirkung zeigte, zeigte die Phase-2a-Studie, dass es bei der Verbesserung der Ekzemschwere oder des Juckreizes nicht besser war als ein Placebo. Das Ergebnis wirft Fragen zur KI-gestützten Plattform auf, die den Ansatz vorgeschlagen hat. Trotz des Rückschlags hat BenevolentAI den Medikamentenkandidaten nicht aufgegeben und verweist auf Beweise dafür, dass die Behandlung bei Patienten mit einem größeren Krankheitsausmaß zu Studienbeginn eine bessere Wirkung zeigte. Das Unternehmen prüft derzeit die Daten, bevor es die nächsten Schritte festlegt.
Die zwanzig „produktivsten“ KI-Unternehmen im Bereich der Arzneimittelforschung
Nachdem wir im BiopharmaTrend AI Report rund 130 Unternehmen aus mehr als 380 KI-Unternehmen in die engere Wahl gezogen haben, haben wir weitere 20 Unternehmen ausgewählt – mithilfe einer einfachen, aber robusten Bewertungsformel, die klinische und präklinische Pipelines von Unternehmen, die Fähigkeit zur Zielerkennung und die Zeit berücksichtigt im Geschäft. Die 20 ausgewählten Unternehmen bildeten die BPT20: Produktivitätsindex für künstliche Intelligenz in der Arzneimittelforschung – der erste Anlaufpunkt der Branche, der Unternehmen hervorhebt, die sich für die Anwendung von KI für die Entwicklung von De-novo-Arzneimitteln, das virtuelle Screening oder die Wiederverwendung von Arzneimitteln einsetzen.

KI und robotisierte Labore der Zukunft
Deep-Learning-Modelle (z. B. basierend auf tiefen neuronalen Netzen) sind äußerst „datenhungrig“, was bedeutet, dass die Qualität und Größe der Daten für aussagekräftige Forschungsvorhersagen gleichermaßen wichtig sind, egal wie gut die KI ist. Der effizienteste Weg, qualitativ hochwertige biologische Daten zu generieren, ist der Einsatz von Robotik. Wenn wir die moderne KI-gesteuerte Transformation der Arzneimittelforschung als einen schrittweisen Prozess betrachten, der weithin verfügbar und relativ kosteneffizient istObotics-as-a-Service wäre der letzte und entscheidende Teil der KI-gestützten Entwicklung Industrialisierung der Pharma- und Biotech-Forschung. In einem Bericht von Arctoris heißt es: „Robotik ist der Schlüssel dazu, das Paradigma der Closed-Loop-Entdeckung Wirklichkeit werden zu lassen – ein spannender Bereich, den es in den kommenden Jahren zu beobachten gilt.“
Einige Unternehmen bauen standardisierte, hochautomatisierte, skalierbare und zunehmend kompatible Laboreinrichtungen auf, die auf KI-basierten Experimentkontrollsystemen basieren und durch KI-gesteuerte Data-Mining- und Analysefunktionen ergänzt werden. Solche Laboreinrichtungen der „nächsten Generation“ stehen Forschern in der präklinischen Arzneimittelforschung aus der Ferne zur Verfügung, wodurch präklinische Experimente zu einer skalierbareren und standardisierten Routine werden. Die führenden Fernlaboranbieter auf der Liste sind Automata Labs, Strateos, Emerald Labs und Culture Biosciences, um nur einige zu nennen.
Der Raum zieht Risikokapitalgeber und Kunden an. Beispielsweise sammelte das in Großbritannien ansässige Unternehmen Automata Labs im Februar 2022 50 Millionen US-Dollar, um den Laborforschungsprozess zu automatisieren. Im Juli 2021 sammelte Strateos 56 Millionen US-Dollar für die weitere Verbesserung seiner SmartLab-Plattform und seiner ferngesteuerten, automatisierten Technologie, die präklinischen Forschern auf der ganzen Welt zur Verfügung steht. Culture Biosciences hat insgesamt mehr als 100 Millionen US-Dollar eingesammelt, wobei die letzte Serie B im Wert von 80 Millionen US-Dollar im November 2021 angekündigt wurde. Emerald Cloud Labs (ECL) mit Sitz in San Francisco hat im Laufe der Jahre mehr als 90 Millionen US-Dollar eingesammelt. Frühe Benutzer der ECL-Roboterplattform entfernen berichteten über Verbesserungen von 300 bis 700 % in der Forschungsproduktivität. Im Juni 2022 sammelte das in Peking ansässige Unternehmen MegaRobo 300 Millionen US-Dollar, um sein vielfältiges Angebot an automatisierten, KI-gesteuerten Fernlabordiensten und robotisierten Einrichtungen zu erweitern.
Der Aufstieg ferngesteuerter Roboterlabore ist ein langfristiger Branchentrend, eine neue Möglichkeit, Auftragsforschungsdienstleistungen anzubieten, die für die langfristige Einführung datenzentrierter „AI-first“-Forschungsstrategien äußerst vorteilhaft wäre.
Mehrere KI-gesteuerte Arzneimittelforschungsunternehmen wie Arctoris, Recursion Pharmaceuticals, Insitro und Generative Bio gehen diesen Trend mit einem anderen Geschäftsmodell an: Sie haben interne robotisierte Laboreinrichtungen aufgebaut, um ihre internen Datengenerierungskapazitäten für die Schulung ihrer Mitarbeiter zu verbessern KI-Modelle und Aufbau von Pipelines für therapeutische Arzneimittelkandidaten.
Beispielsweise baute das 2016 gegründete Unternehmen Arctoris mit Sitz in Oxford ein vollautomatisches Nasslabor auf, das qualitativ hochwertige Daten in großem Maßstab generiert, in den Datensee von Arctoris einspeist und die KI-gesteuerte Entscheidungsplattform Ulysses des Unternehmens antreibt, die die Forschung des Unternehmens vorantreibt Ziel zu treffen, zu führen und in die IND-Anwendungsphase zu bringen.
Die Pipeline von Arctoris umfasst mittlerweile mehrere präklinische Programme in den Bereichen Onkologie und Neurologie. Arctoris hat in mehreren Runden von Investoren, darunter Future Planet Capital, RT Ventures und Formic Ventures, insgesamt 10.3 Millionen US-Dollar eingesammelt.
Einige führende Unternehmen der KI-Medikamentenforschung, wie Exscientia und Insilico Medicine, bauen jetzt auch interne Roboterlabore auf, um ihre „Muskeln“ für die interne Datengenerierung aufzubauen.
Das in Salt Lake City ansässige Unternehmen Recursion Pharmaceuticals gehört zu den führenden Unternehmen im Bereich robotisierter biologischer Experimente. Die KI-gesteuerte Infrastruktur des Unternehmens, Recursion Operation System genannt, ist ein integriertes Closed-Loop-System, das proprietäre interne Datengenerierung und fortschrittliche Rechentools kombiniert, um neue Erkenntnisse für die Initiierung oder Beschleunigung therapeutischer Programme zu generieren. Das Unternehmen automatisiert präklinische biologische Experimente in großem Maßstab. Zellmikroskopische Bilder erfassen beispielsweise zusammengesetzte Veränderungen in der Zellmorphologie und werden von den KI-gestützten Computer-Vision-Systemen des Unternehmens verarbeitet. Seit 2017 hat Recursion Pharmaceuticals die Kapazität der Phenomics-Plattform jedes Jahr etwa verdoppelt und die Anzahl der durchgeführten phänomischen Experimente auf bis zu 2.2 Millionen pro Woche skaliert, was zu etwa 19 Petabyte proprietärer hochdimensionaler Daten führt.
Bewältigung von Engpässen bei klinischen Studien mit KI
Die klinische Studie ist eine kritische Phase des Arzneimittelentwicklungsablaufs mit einer geschätzten durchschnittlichen Erfolgsquote von etwa XNUMX % 11% für Arzneimittelkandidaten, die von Phase 1 in Richtung Zulassung übergehen. Selbst wenn der Arzneimittelkandidat sicher und wirksam ist, könnten klinische Studien daran scheitern unzureichende Finanzierung, unzureichende Einschreibung oder schlechtes Studiendesign.
Künstliche Intelligenz (KI) ist zunehmend als Chance wahrgenommen um die betriebliche Effizienz klinischer Studien zu verbessern und die klinischen Entwicklungskosten zu minimieren. Typischerweise bieten KI-Anbieter ihre Dienste und ihr Fachwissen in drei Hauptbereichen an. KI-Start-ups im ersten Bereich helfen dabei, Informationen aus unterschiedlichen Datenquellen wie wissenschaftlichen Arbeiten, Krankenakten, Krankheitsregistern und sogar medizinischen Ansprüchen zu erschließen, indem sie Natural Language Processing (NLP) anwenden. Dies kann die Patientenrekrutierung und -stratifizierung sowie die Standortauswahl unterstützen und das Design klinischer Studien sowie das Verständnis der Krankheitsmechanismen verbessern. Beispielsweise scheitern etwa 18 % der klinischen Studien aufgrund unzureichender Rekrutierung, wie z a 2015 Studie gemeldet.
Ein weiterer Aspekt für den Erfolg klinischer Studien ist eine verbesserte Patientenstratifizierung. Da Studienpatienten teuer sind, betrugen die durchschnittlichen Kosten für die Aufnahme eines Patienten $ 15,700-26,000 Im Jahr 2017 ist es wichtig, vorhersagen zu können, welcher Patient einen größeren Nutzen oder ein größeres Risiko aus der Behandlung ziehen wird. KI-gesteuerte Unternehmen arbeiten mit mehreren Datentypen, wie z. B. elektronischen Gesundheitsakten (EHR), Omics und Bilddaten, um die Heterogenität der Bevölkerung zu verringern und die Aussagekraft klinischer Studien zu erhöhen. Anbieter könnten Sprachbiomarker verwenden, um das Fortschreiten neurologischer Erkrankungen zu identifizieren, bildgebende Analysen, um den Behandlungsverlauf zu verfolgen, oder genetische Biomarker, um Patienten mit schwerwiegenderen Symptomen zu identifizieren.
KI rationalisiert auch die betrieblichen Prozesse klinischer Studien. KI-Anbieter helfen dabei, die Gesundheit der Patienten von zu Hause aus zu verfolgen, das Ansprechen auf die Behandlung zu überwachen und die Einhaltung der Studienabläufe durch die Patienten zu überwachen. Dadurch verringern KI-Unternehmen das Risiko von Patientenabbrüchen, die dafür verantwortlich sind 30% im Durchschnitt. Normalerweise ist die Phase der klinischen Studie der Phase 3 erforderlich 1000-3000 Teilnehmer, ein Teil von ihnen nahm ein Placebo ein. Deshalb ist die Entwicklung von synthetische Querlenker – KI-Modelle, die die Placebo-Kontrollgruppen von Einzelpersonen ersetzen und so die Anzahl der für klinische Studien erforderlichen Personen reduzieren könnten – könnten zu einem neuen Trend werden.
Laut BiopharmaTrend AI Report gibt es in allen drei Kategorien mehr als 80 Unternehmen, darunter Owkin, PathAI, GNS Healthcare, Neurcuit, AICure und Unlearn.ai.
ZUGEHÖRIG: 8 namhafte KI-Unternehmen in der klinischen Forschung, die man im Jahr 2022 im Auge behalten sollte
Die Nachfrage nach KI-gestützten Plattformen für klinische Studien ist hoch, ebenso wie die Investitionen in diesem Bereich, trotz des insgesamt kalten Investitionsklimas in der Biotechnologie.
Im März 2022 erhielt ConcertAI eine Bewertung von 1.9 Milliarden US-Dollar, nachdem es eine Serie-C-Runde über 150 Millionen US-Dollar zur Skalierung seiner Software- und Real-World-Data-Lösungen (RWD) für die Krebsforschung abgeschlossen hatte.
Saama ist ein im Silicon Valley ansässiges Unternehmen, das 1997 gegründet wurde, aber sein erstes Risikokapital im Jahr 2015 aufnahm. Das Unternehmen hat mehr als 500 Millionen US-Dollar an Risikokapital eingesammelt, einschließlich der letzten Mega-Runde von 430 Millionen US-Dollar im August 2022 – von Carlyle und Risikofonds von Merck, Pfizer, Amgen, McKesson und anderen.
Saama ist einer der führenden Akteure im Bereich der KI-gesteuerten Analyse klinischer Studien und bietet ein vielfältiges Lösungspaket: beschleunigte klinische Studien über zentralisierte Datenanalysen und ein Kontrollzentrum, einschließlich Echtzeit-Datenverarbeitungsfunktionen; automatisierte Datenqualitätsfunktionen; Optimierte Funktionen für die Einreichung behördlicher Auflagen, einschließlich Pharmakovigilanz-Analysen und -Einreichungen.
Im April 2022 sammelte Unlearn.AI, ein Startup, das einen „Digital Twin“-Dienst für klinische Studien entwickelt, 50 Millionen US-Dollar ein.
Im Juni 2022, Bristol Myers Squib investierte 80 Millionen US-Dollar in OWKIN – um das Design kardiovaskulärer Arzneimittelstudien zu verbessern, mit Verbesserungen bei Endpunktdefinitionen, der Identifizierung von Patientenuntergruppen und der Abschätzung von Behandlungseffekten. Das in Paris und New York ansässige „Einhorn“ OWKIN nutzt unseren hochwertigen multimodalen Datenzugriff und modernstes maschinelles Lernen, um verschiedene Behandlungseffekte auf Patientensubpopulationen genau vorherzusagen und so das Design und die Ergebnisse von klinischen Studienexperimenten zu verbessern. OWKIN nutzt seine KI-Plattform auch für die Arzneimittelforschung.
Im August 2022 kündigte Bristol Myers Squibb außerdem eine mehrjährige erweiterte Kooperationsvereinbarung mit dem KI-Pathologiespezialisten PathAI an. Die ersten Arbeiten im Rahmen dieser erweiterten Vereinbarung werden sich auf wichtige translationale Forschungen in den Bereichen Onkologie, Fibrose und Immunologie konzentrieren, mit dem übergeordneten Ziel, diese in klinische Studien weiterzuleiten. Zwei Monate zuvor ging PathAI eine strategische mehrjährige Partnerschaft mit GlaxoSmithKline ein, um die wissenschaftliche Forschung und Arzneimittelentwicklungsprogramme in den Bereichen Onkologie und nichtalkoholische Steatohepatitis (NASH) durch die Nutzung der Technologien von PathAI in der digitalen Pathologie, einschließlich der Verwendung des AIM-NASH-Tools von PathAI, zu beschleunigen.
Insbesondere Akkure Genomics aus Dublin soeben angekündigt Innerhalb einer Woche hat das Unternehmen 1 Million Euro per Crowdfunding finanziert, um klinische Studien über seine KI-Plattform zu unterstützen, die Menschen dabei hilft, auf der Grundlage von Daten über sich selbst und ihren Zustand an den relevantesten klinischen Studien teilzunehmen.
KI in der Auftragsforschungsbranche
Das Aufkommen neuartiger KI-nativer Auftragsforschungsunternehmen im präklinischen und klinischen Bereich stellt den Status quo der großen etablierten Auftragsforschungsorganisationen (CROs) in Frage. Sie reagieren darauf, indem sie KI in ihr Dienstleistungsangebot für Pharmaunternehmen integrieren oder mit KI-Unternehmen zusammenarbeiten, um ihre Forschungskapazitäten zu ergänzen.
ZUGEHÖRIG: Die sich entwickelnde Pharma-F&E-Outsourcing-Branche: Eine Vogelperspektive.
Beispielsweise taucht Charles River Labs, ein in den USA ansässiges Auftragsforschungsunternehmen für Frühphasenforschung, tiefer in die KI ein, indem es ein Unternehmen gründet mehrjährige Partnerschaft mit Valo Health. Charles River fügt die Opal-Technologie von Valo hinzu, die aktiv lernt, während Programme entwickelt werden. Charles River hofft, dass der Einsatz der Deep-Learning-Plattform Opal zu einem schnelleren und effektiveren Prozess vom De-novo-Moleküldesign bis zur Leitstrukturoptimierung führen wird. Letztes Jahr gründete Charles River ein strategische Partnerschaft mit Valence Discovery, das den Kunden des CRO Zugang zur künstlichen Intelligenzplattform von Valence für die Vorhersage molekularer Eigenschaften, generative Chemie und Multiparameteroptimierung verschaffte.
IQVIA investiert seit Jahren in KI-Fähigkeiten, um den klinischen Studien und kommerziellen Aktivitäten, die es seinen Kunden anbietet, einen Mehrwert zu verleihen. Zur Verbesserung klinischer Studien, zum Beispiel IQVIA ins Leben gerufen Avacare Clinical Research Network™ im Jahr 2020, das es den Standorten ermöglichte, Patienten schneller und effizienter für die Studien zusammenzubringen. Die Plattform basiert auf KI-Algorithmen und kann in 19 Krankheitsbereichen eingesetzt werden. Zuvor gewann eine weitere IQVIA-Plattform Linguamatics Natural Language Processing (NLP) die Fierce Innovation Awards 2019 von Questex. Die Plattform kann vielfältige Anwendungen im Gesundheitswesen und in den Biowissenschaften haben, darunter Zielidentifizierung, Genkartierung, Vorhersage von Patientenergebnissen usw.
Ein bedeutender Trend in der klinischen Forschungsbranche ist im Gange virtuelle klinische Studien, ein Markt im Wert von 8 Milliarden US-Dollar. Die COVID-19-Pandemie zwang Pharmaunternehmen dazu, auf Fernüberwachung, eine verbesserte Patientenregistrierung, Apps zur Verfolgung des Patientenengagements, Telemedizin, Dezentralisierung und andere Maßnahmen umzusteigen, um die Studien am Laufen zu halten. Da die Nachfrage nach solchen Lösungen erheblich wuchs, beeilten sich CROs, ihr Serviceangebot um virtuelle und dezentrale Funktionen zu erweitern. Die KI-Technologie erwies sich bei der Erstellung und Durchführung solcher Projekte als unschätzbar wertvoll, um Daten zu synthetisieren und die Prozesse klinischer Studien zu beschleunigen.
Technologiegiganten streben nach Arzneimittelentdeckung und Biotechnologie
Die zuvor erwähnten Erfolge von DeepMind und Meta des Alphabets bei der Lösung grundlegender biologischer Forschungsrätsel, wie der Vorhersage von Proteinstrukturen im großen Maßstab mithilfe von Deep Learning und Sprachmodellen, sind nur die Spitze des Eisbergs: Fast jeder führende Technologieriese ist mittlerweile im Life-Science-Geschäft tätig , irgendwie.
Alphabet (eine Muttergesellschaft von Google) hat Dutzende von Investitionen in Life-Science-Projekte getätigt, darunter die KI-basierte Reagenziensuchmaschine BenchSci, das in China ansässige KI- und Quantenphysik-Unternehmen XtalPi für die Arzneimittelforschung, das Personal-Genomics-Unternehmen 23andMe und die KI-gesteuerte Arzneimittelentwicklung Einhorn OWKIN, um nur einige zu nennen. Im Jahr 2021 gründete Alphabet zusammen mit DeepMind Isomorphic Labs, um sich auf die Anwendung künstlicher Intelligenz zur Erforschung grundlegender Biologie und Arzneimittelforschung zu konzentrieren.
Neben zahlreichen anderen Projekten und Aktivitäten in der pharmazeutischen Forschung und Biotechnologie verfügt Alphabet über eine vollwertige Einheit, Verily, die sich den Biowissenschaften und der Medizintechnik widmet.
Microsoft, ein globaler Softwareentwickler, verfügt über eine starke Präsenz in den Biowissenschaften mit Dutzenden von Forschungskooperationen mit großen Pharmakonzernen und stellt seine Infrastrukturen für die Verarbeitung großer Datenmengen mithilfe groß angelegter Modelle für maschinelles Lernen bereit. Zu den neuesten Microsoft-Initiativen gehört MoLeR-Modell, ein neues Werkzeug, das vom Team für generative Chemie des Unternehmens in Zusammenarbeit mit Novartis entwickelt wird. Das MoLeR-Modell nutzt – im Gegensatz zu anderen generativen Werkzeugen – Deep Learning, um neue Strukturen auf der Grundlage eines vorgegebenen Gerüsts zu entwickeln, das als Ausgangsbasis für den generativen Prozess dient. Ein weiteres Beispiel ist AI4Science, ein neues Microsoft-Unternehmen, das Computerchemie, Quantenphysik, maschinelles Lernen, Molekularbiologie, Fluiddynamik und Softwareentwicklung kombiniert, um eine Vision des sogenannten „fünften Paradigmas“ der Wissenschaft zu verwirklichen.
Ein besonders aktives Unternehmen in diesem Zusammenhang ist NVIDIA, ein Hardwarehersteller für die Gaming-Industrie und Personalcomputer. Dieses Technologieunternehmen hat Clara Discovery auf den Markt gebracht, eine Sammlung von Frameworks, Anwendungen und KI-Modellen, die eine GPU-beschleunigte Arzneimittelforschung ermöglichen und die Forschung in den Bereichen Genomik, Proteomik, Mikroskopie, virtuelles Screening, Computerchemie, Visualisierung, klinische Bildgebung usw. unterstützen Verarbeitung natürlicher Sprache (NLP). Und im März 2022 stellte das Unternehmen Clara Holoscan MGX™ vor, eine Plattform für die Medizingeräteindustrie zur Entwicklung und Bereitstellung von Echtzeit-KI-Anwendungen am Edge, die speziell auf die Einhaltung erforderlicher regulatorischer Standards ausgelegt ist. Clara Holoscan strebt eine umfassende Referenzarchitektur in medizinischer Qualität sowie einen langfristigen Software-Support an, um Innovationen in der Medizingerätebranche zu beschleunigen.
Die Zukunft der KI in der Arzneimittelforschung: alles, was mit „Quanten“ zu tun hat
Die meisten Softwaretools für die Arzneimittelentwicklung und Biologieforschung basieren auf der molekularen Mechanik – einer vereinfachten Darstellung von Molekülen, die sie im Wesentlichen auf „Kugeln und Stäbchen“ reduziert: Atome und Bindungen zwischen ihnen. Auf diese Weise ist die Berechnung einfacher, die Genauigkeit leidet jedoch erheblich. Um eine ausreichende Genauigkeit zu erreichen, muss man das elektronische Verhalten von Atomen und Molekülen berücksichtigen, also subatomare Teilchen – Elektronen und Protonen – berücksichtigen. Darum geht es bei quantenmechanischen (QM) Methoden – und die Theorie ist nicht neu, da sie bis in die frühen Jahrzehnte des 20. Jahrhunderts zurückreicht.
Allerdings sind Quantenmethoden außerordentlich rechenintensiv – und bis vor wenigen Jahrzehnten war dies ein Hindernis für die Einflussnahme der Quantentheorie auf die praktische Seite der Dinge. Aufgrund des exponentiellen Wachstums der verfügbaren Rechenleistung werden Quantenmethoden endlich zu wertvollen Werkzeugen in den Händen von Wissenschaftlern.
Mehrere Unternehmen kombinieren maschinelles Lernen und Quantentheorie, um die Modellierungsfähigkeiten ihrer Arzneimittelforschungssysteme erheblich zu verbessern. Beispielsweise haben Wissenschaftler von XtalPi, einem in China und den USA ansässigen Technologieunternehmen, das von Sequoia China, Tencent und Google unterstützt wird, ihre ID4-Plattform (Intelligent Digital Drug Discovery and Development) aufgebaut, die Quantenmechanik, künstliche Intelligenz und Hochleistung vereint Cloud-Computing-Algorithmen. ID4 ermöglicht die hochpräzise Vorhersage der physiochemischen und pharmazeutischen Eigenschaften niedermolekularer Arzneimittelkandidaten sowie ihrer Kristallstrukturen – entscheidende Elemente in der Arzneimittelforschung und -entwicklung.
Ein weiteres Unternehmen, das diesen Bereich vorantreibt, ist Aqemia mit Sitz in Paris. Das Unternehmen konzentriert sich auf das strukturbasierte De-novo-Design bleiähnlicher Moleküle durch die Kombination von Quanten- und künstlicher Intelligenz (KI). Ein einzigartiger quanteninspirierter statistischer Mechanik-Algorithmus, der die Affinität zwischen einer Verbindung und einem therapeutischen Ziel präzise und 10,000-mal schneller als die Konkurrenz vorhersagt. Die KI von Aqemia kann Verbindungen mit zunehmender Genauigkeit generieren, indem sie Feedback vom Affinitätsprädiktor erhält.
Schließlich gibt es noch das in Barcelona ansässige Unternehmen Pharmacelera, ein Computerunternehmen, das die Quantentheorie anwendet, um die Arzneimittelentwicklung über seine beiden primären Softwarepakete voranzutreiben: PharmScreen und PharmQSAR. Das erste Tool ermöglicht ein genaues ligandenbasiertes virtuelles Screening mithilfe eines hochpräzisen 3D-Ligandenausrichtungsalgorithmus basierend auf den Wechselwirkungsfeldern. Es kann eine höhere Diversitätsrate bei Leads generieren als klassische Methoden und Tools. Das zweite Tool – PharmQSAR – ist ein 3D-Tool zur quantitativen Struktur-Aktivitäts-Beziehung (QSAR), das eine Kombination mehrerer Interaktionsfelder zur Durchführung von CoMFA/CoMSIA-Studien ermöglicht.
ZUGEHÖRIG: 12 Unternehmen nutzen die Quantentheorie, um die Entdeckung von Arzneimitteln zu beschleunigen
Ein weiterer – eher futuristischer – Technologietrend, der sich die Quantentheorie zunutze macht, beschäftigt sich mit der Entwicklung eines Quantencomputers. Mit jahrzehntelangen Fortschritten in der Quantentheorie und gleichzeitigen Fortschritten in mehreren Software- und Hardwarebereichen treten wir endlich in die Ära ein, in der Quantencomputer praktisch realisierbar werden.
Während wir uns noch in den Anfängen des Quantencomputings befinden, integrieren mehrere Unternehmen bereits Elemente des Quantencomputings in die computergestützte Arzneimittelforschung.
POLARISqb ist beispielsweise ein in Großbritannien ansässiger Entwickler der weltweit ersten Arzneimittelforschungssoftware für Quantencomputer, die künstliche Intelligenz und einen Quantenansatz kombiniert. Das Herzstück der POLARISqb-Technologie ist die Arzneimitteldesignplattform Tachyon, die für die Ausführung verteilter molekularer Designarbeiten in der Cloud verwendet wird und von einem automatisierten Prozess verwaltet wird, der die Durchsuchung großer chemischer Bibliotheken bei gleichzeitiger Ausführung mehrerer Projekte ermöglicht. Durch die Entwicklung proprietärer Software für Quantensysteme kann das Unternehmen nach eigenen Angaben die Medikamentenentwicklung erheblich beschleunigen und qualitativ hochwertigere Hinweise erhalten. Aufgrund des inhärenten „Agnostizismus“ des Tachyon-Systems kann es bei mehreren Krankheiten und Indikationen wirken.
Menten AI ist ein 2018 gegründetes kanadisches Start-up, das eine Softwareplattform für Proteindesign entwickelt, die auf maschinellem Lernen und Quantencomputing basiert. Das Unternehmen verwendet proprietäre Quantenoptimierungsalgorithmen, von denen es glaubt, dass sie die Genauigkeit der Arzneimittelentwicklung erheblich verbessern und gleichzeitig Kosten und Entwicklungszeit reduzieren können.
Um diesen Beitrag zusammenzufassen, beziehen wir uns auf eine Vorhersage von Dr. Christopher Savoie, Mitbegründer und CEO von Zapata Computing, einem amerikanischen Quantensoftwareunternehmen, zur Spitzenforschung in diesem Bereich, die er in geäußert hat Ein Interview für BiopharmaTrend:
„Quantum wird in Zukunft Teil jedes oder fast jedes Datenwissenschafts- und maschinellen Lernworkflows in der Biopharmazeutik sein. Ich bin davon überzeugt, dass es ein integraler Bestandteil davon sein wird. Wenn Sie mithilfe der Quantentechnologie ein genaueres Modell erhalten können – warum sollten Sie das schließlich nicht tun?“
Große Sprachmodelle machen Fortschritte bei der Wirkstoffforschung
Große Sprachmodelle (LLMs) wie ChatGPT von OpenAI werden von Biotech-Unternehmen wie verwendet Insilico Medizin, Unschuld und Exscientia, um die Entdeckung von Arzneimitteln zu unterstützen.
ChatGPT hilft Wissenschaftlern bei der Interaktion mit KI und maschinellen Lerntools und macht Daten leichter zugänglich. Beispielsweise nutzt Insilico Medicine ChatGPT, um mit seiner Zielerkennungsplattform PandaOmics zu interagieren, während Ainnocence der Gründer ist Lurong P. stellt sich spezielle Versionen wie Bio ChatGPT oder Med ChatGPT vor. Exscientia nutzt LLMs, um strukturierte, mechanistische Aussagen für ihre Wissensgraphen zu generieren.
LLMs dienen auch als fortgeschrittene Suchmaschinen in der Biowissenschaft. Google und DeepMindDer Med-PaLM-Chatbot von bietet Antworten auf medizinische Fragen WohlwollendeAI scheint von der Abruf-Plugin-Funktion von ChatGPT begeistert zu sein, die dabei helfen könnte, die Chat-Funktion basierend auf ihren eigenen Daten anzupassen.
Trotz des Potenzials von LLMs in der Arzneimittelforschung mögen einige Unternehmen BioXcel Therapeutics, Inc. und Enterom bleiben bei der Einführung der Technologie vorsichtig und verweisen auf Bedenken hinsichtlich der Genauigkeit und des Datenschutzes.
Es ist klar, dass der Aufstieg von ChatGPT und anderen generativen KI-Modellen wie DeepMinds AlphaFold das Bewusstsein für ihre potenziellen Anwendungen in der Biotechnologie gestärkt hat und Unternehmen dazu ermutigt, ihre Vorteile bei der Entdeckung und Entwicklung von Arzneimitteln zu erkunden.
Themen: Branchentrends
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Automobil / Elektrofahrzeuge, Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- BlockOffsets. Modernisierung des Eigentums an Umweltkompensationen. Hier zugreifen.
- Quelle: https://www.biopharmatrend.com/post/615-pharmaceutical-artificial-intelligence-key-developments-in-2022/



