NMPA utfärdade "Utkast till riktlinjer för modifieringsregistrering av in vitro diagnostiskt reagens" den 31 maj 2023 för feedback. Återkopplingar måste lämnas in senast den 30 juni 2023.
Flödesschema för beslutsfattande
Ändringar i IVD-reagenser bör kontrolleras genom kvalitetsledningssystemet, och om ändringarna sker i registreringsbeviset för medicintekniska produkter och dess bilagor krävs ändringsregistrering eller ändringsregistrering.
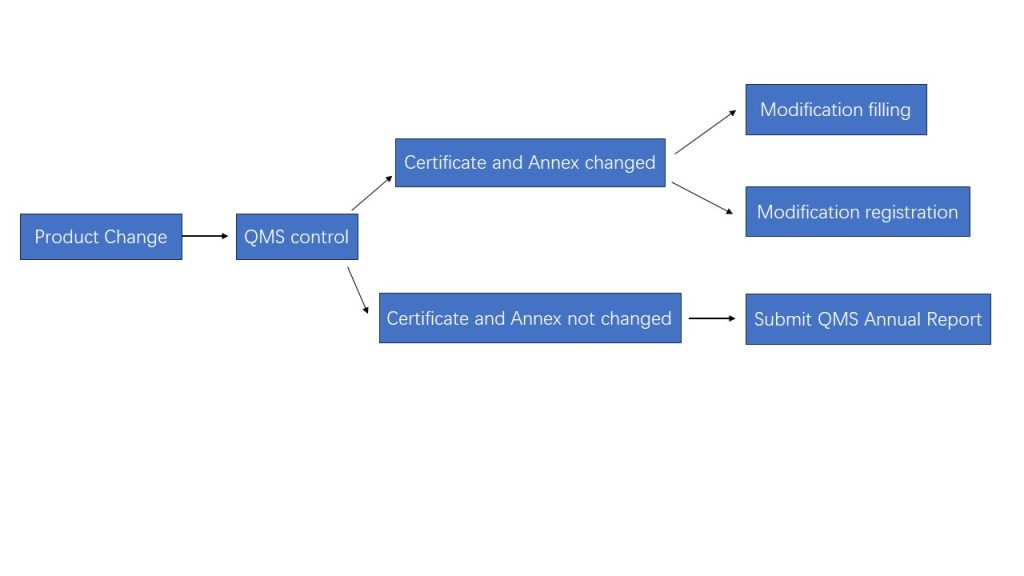
Ändringar i namn och adress kan tillämpas genom ändringsanmälan, och andra innehållsändringar ska tillämpas genom ändringsregistrering.
Hänsyn ska tas
Följande situationer måste beaktas i processen för riskkontroll och teknisk utvärdering. För mer information, vänligen maila info@ChinaMedDevice.com.
Omständigheter som inte ökar riskerna:
- Textförändringar i produktnamn.
- Ändringar i förpackningsspecifikationer som inte påverkar prestanda eller stabilitet: minimiförpackningen av produktsammansättningen förblir oförändrad, endast antalet förpackningar ändras.
- Lägg till varningsinformation till manualen.
- Ta bort den tillämpliga modellen.
- Textändringen av produktionsadressen för importerade IVD-reagenser.
- Andra ändringar som inte påverkar produktens prestanda.
Omständigheter där det finns potentiell risk:
- Förpackningsspecifikationer ändras
- Ändringar i produktens lagringsförhållanden och utgångsdatum
- Tillämpliga instrumentändringar
- Positivt bedömningsvärde eller förändring av referensintervall
- Förändringar i råmaterial av klass III IVD-reagenser
- Förändringar i produktionsprocessen av klass III IVD-reagenser
- Förändringar i reaktionssystemet
- Ändring av produktionsadress för importerade IVD-reagenser
- Tillämplig provtypsändring
- Förändringar i tillämplig population och kliniska indikationer
- Ändringar i produkttekniska krav och instruktioner
Omständigheter som krävs för att lämna in en ny ansökan.
Modifieringsexempel
Utkastet till riktlinje tar exemplen nedan för att demonstrera ändringsansökan, ur perspektivet av ändringsbeskrivning, icke-klinisk och klinisk prövning:
- Ändringar av tillämpliga instrument
- Förändringar i råmaterial för klass III IVD-reagens
- Förändringar i råmaterial för klass III IVD-reagens
- Förändringar i reaktionssystemet
- Förändringar av kliniska indikationer
- Ändringar av andra produkter som används tillsammans med reagenset
- Ändringar av referensintervall
- Ändringar av provtyper och kliniska indikationer
- Lägg till kalibratorer
För den engelska versionen av utkastet till riktlinjer, vänligen maila oss på info@ChinaMedDevice.com. Vi tar ut nominella avgifter för översättningen.
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoAiStream. Web3 Data Intelligence. Kunskap förstärkt. Tillgång här.
- Minting the Future med Adryenn Ashley. Tillgång här.
- Köp och sälj aktier i PRE-IPO-företag med PREIPO®. Tillgång här.
- Källa: https://chinameddevice.com/modification-registration-ivd/



