FDA släppte ett nytt utkast till 510k predikatvalsvägledning den 7 september, men utkastet till vägledning föreslår kontroversiella tillägg.

Den 7 september 2023 a utkast till vägledning för val av predikat dokumentet släpptes av FDA. Normalt förväntas släppandet av ett nytt utkast till FDA-vägledningsdokument och det finns ett uppenbart behov av utkastet. Detta nya utkast verkar dock innehålla några kontroversiella tillägg som jag anser bör tas bort från vägledningen. Denna specifika vägledning har utvecklats för att hjälpa insändare att använda bästa praxis för att välja ett predikat. Det finns några användbara råd angående behovet av att granska FDA-databasen för bevis på användningsrelaterade och designrelaterade säkerhetsproblem förknippade med ett potentiellt predikat som övervägs. Tyvärr föreslår det sista avsnittet i vägledningen några kontroversiella rekommendationer som jag inte håller med om.
Avsnitt 1 – Introduktion till vägledningen
FDA indikerar att detta nya utkast till vägledningsdokument för predikatval skapades för att ge rekommendationer för att implementera fyra (4) bästa praxis vid val av en predikatenhet för att stödja en 510k-inlämning. Detta första mål är något som vår konsultfirma rekommenderade i en utbildningswebinarium. Vägledningen indikerar att vägledningen också skapades av FDA i ett försök att förbättra förutsägbarheten, konsekvensen och transparensen i 510 XNUMX granskningsprocessen före marknaden. Detta andra mål uppnås inte av utkastet till vägledning och måste ändras innan vägledningen släpps som en slutlig vägledning.
Avsnitt 2 – Bakgrund
Detta avsnitt av vägledningen är uppdelat i två delar: A) 510k-processen och B) 510k-modernisering.
S. 510k-processen
FDA släppte en Vägledningsdokument för väsentlig likvärdighet som förklarar hur man påvisar väsentlig likvärdighet. Vägledningsdokumentet innehåller ett nytt beslutsträd som sammanfattar var och en av de sex frågor som 510 510 granskare måste besvara i processen för att utvärdera din 510 XNUMX inlämning för väsentlig likvärdighet. Bevisen på väsentlig likvärdighet måste sammanfattas i avsnittet Predicates and Substantial Equivalence i FDA eSTAR-mallen i din XNUMXk-inlämning, och vägledningsdokumentet granskar innehållet som bör tillhandahållas.
Väsentlig ekvivalens utvärderas mot en predikatenhet eller flera predikat. För att anses vara väsentligen likvärdig måste den aktuella enheten i din 510k-inlämning ha samma avsedda användning AND samma tekniska egenskaper som predikatanordningen. Därför kan du inte använda två olika predikat om ett predikat har samma avsedda användning (men olika tekniska egenskaper), och det andra predikatet har samma tekniska egenskaper (men en annan avsedd användning). Det kallas ett "delat predikat", och den termen definieras i vägledningen. Detta förbjuder dig inte från att använda ett sekundärt predikat, men du måste uppfylla kraven i detta vägledningsdokument för att få 510k godkännande. Vägledningsdokumentet granskar fem exempel på att flera predikat används på rätt sätt för att påvisa väsentlig likvärdighet.
B. 510k Modernisering
Den andra delen av detta avsnitt hänvisar till FDA:s Handlingsplan för säkerhet utfärdat i april 2018. Tillkännagivandet av Safety Action Plan är kopplat till FDA:s tillkännagivande om åtgärder för att även modernisera 510k-processen. Målen för FDA Safety Action Plan består av:
- Etablera ett robust patientskyddsnät för medicinsk utrustning i USA
- Utforska regulatoriska alternativ för att effektivisera och modernisera snabb implementering av begränsningar efter marknaden
- Stimulera innovation mot säkrare medicinsk utrustning
- Förbättra cybersäkerhet för medicinsk utrustning
- Integrera Center for Devices and Radiological Healths (CDRH:s) kontor och aktiviteter för förmarknad och postmarknad för att främja användningen av en TPLC-metod för enhetssäkerhet
Exempel på moderniseringsinsatser inkluderar följande:
- Konvertering av de återstående klass 3-enheterna som var avsedda för 510k clearance-vägen till PMA-godkännandeprocessen istället
- Användning av objektiva prestandastandarder när ny teknik släpps ut på marknaden
- Användning av modernare predikatenheter (dvs. < 10 år gamla)
I detta utkast till vägledning för val av predikat anger FDA att feedback som lämnats till protokollet 2019 har övertalat FDA att erkänna att fokusering endast på moderna predikatenheter kanske inte leder till optimal säkerhet och effektivitet. Därför föreslår FDA nu ett tillvägagångssätt för att uppmuntra bästa praxis vid val av predikat. Dessutom föreslår utkastet till vägledning ökad transparens genom att identifiera egenskaperna hos tekniska egenskaper som används för att stödja en 510k-inlämning.
Avsnitt 3 – Omfattningen av vägledningen för val av predikat
Utkastet till vägledning för val av predikat indikerar att omfattningen av vägledningen ska användas i samband med FDA:s 510k programvägledning. Omfattningen är inte heller avsedd att ändras till tillämpliga lagstadgade eller regulatoriska standarder.
Avsnitt 4 – Hur man använder FDA:s vägledning för val av predikat
FDA:s avsedda användning av vägledningen för val av predikat är att ge insändare ett verktyg för att hjälpa dem under urvalsprocessen för predikat. Denna vägledning föreslår en specifik process för predikatval. Först bör avsändaren identifiera alla möjliga lagligt marknadsförda produkter som också har liknande indikationer för användning. För det andra bör insändaren utesluta alla enheter med olika tekniska egenskaper om skillnaderna ger upphov till nya eller andra risker. Den återstående undergruppen hänvisas till i vägledningen som "giltiga predikatenheter." Det tredje och sista steget i urvalsprocessen är att använda de fyra (4) bästa metoderna för predikaturval som föreslås i vägledningen. Diagrammet nedan ger en visuell skildring av den terminologi som introduceras i denna vägledning.

Avsnitt 5 – Bästa metoder (för val av predikat)
FDA:s vägledning för val av predikat har fyra (4) bästa praxis som rekommenderas för insändare att använda när de begränsar sin lista över giltiga predikatenheter till ett eller flera potentiella predikat(er). Innan du använder dessa bästa metoder måste du skapa en lista över lagligt marknadsförda enheter som kan vara potentiella predikat. Följande FDA-databaser är de vanligaste källorna för att skapa en lista över lagligt marknadsförda enheter:
- Registrerings- och noteringsdatabas
- Handelsnamn för liknande enheter (dvs. proprietärt namn)
- Tillverkare av liknande enheter (dvs ägarens operatörsnamn)
- 510k databas
- 510k antal liknande enheter
- Sökandens namn (dvs. ägarens operatörsnamn) för liknande enheter
- Enhetsnamn (dvs. handelsnamn) för liknande enhet
- Databas för enhetsklassificering
- Enhetsklassificeringsnamn för liknande enheter
- Produktkod för liknande enheter
- Regler Antal liknande enheter
Vårt team använder vanligtvis Basil Systems Regulatory Database för att utföra våra sökningar. Basil Systems använder data som laddas ner direkt från FDA, men programvaran ger oss fyra fördelar jämfört med FDA:s offentliga databaser:
- Sökmotorn använder en naturligt språkalgoritm snarare än en boolesk sökning.
- Databasen är mycket snabbare än FDA-databaser.
- Resultaten inkluderar analyser angående granskningstidslinjerna och ett "predikatträd".
- Basil Systems har också en databas för övervakning efter marknaden som inkluderar alla FDA-biverkningar och återkallelsedata, men den inkluderar också tillgång till data från Health Canada och australiensiska TGA.
A. Predikatenheter rensade med väletablerade metoder
Vissa 510 510 inlämningar använder samma metoder som används av en predikatenhet som användes för deras betydande ekvivalensjämförelse, medan andra enheter använder väletablerade metoder. Anledningen till detta kan ha varit att XNUMXk-inlämningen föregick utgivningen av ett FDA-produktspecifikt, specialkontrolldokument. I andra fall kan det hända att FDA inte har erkänt en internationell standard för enhetsklassificeringen. Du kan söka efter erkända internationella standarder för en specifik enhetsklassificering genom att använda FDA:s erkänd databas med konsensusstandarder. Ett exempel ges nedan.
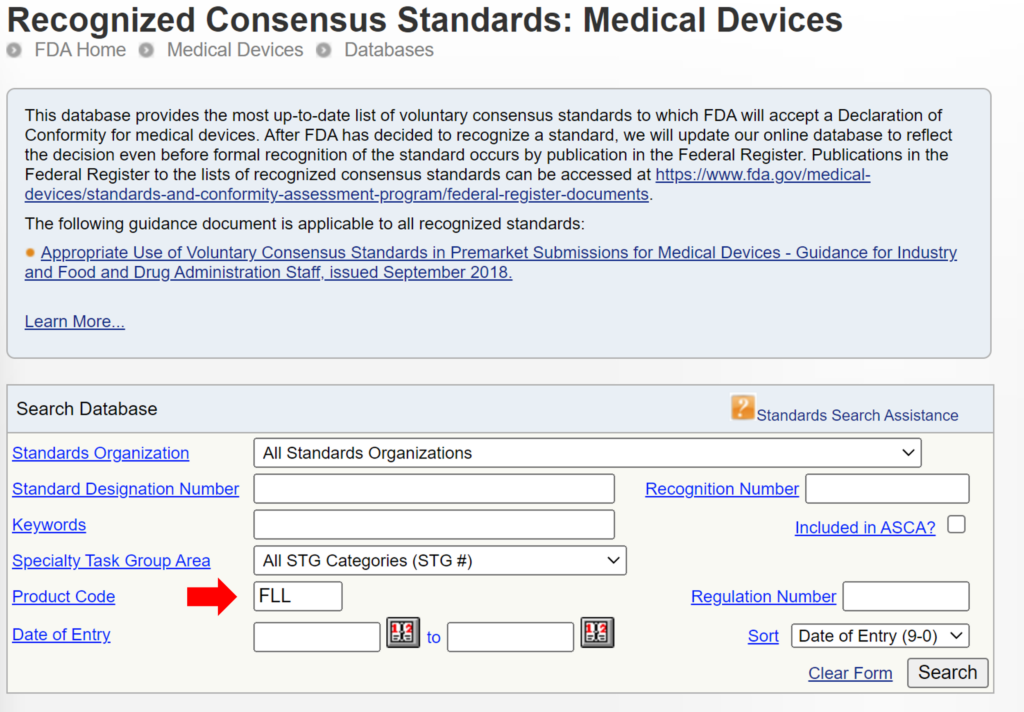
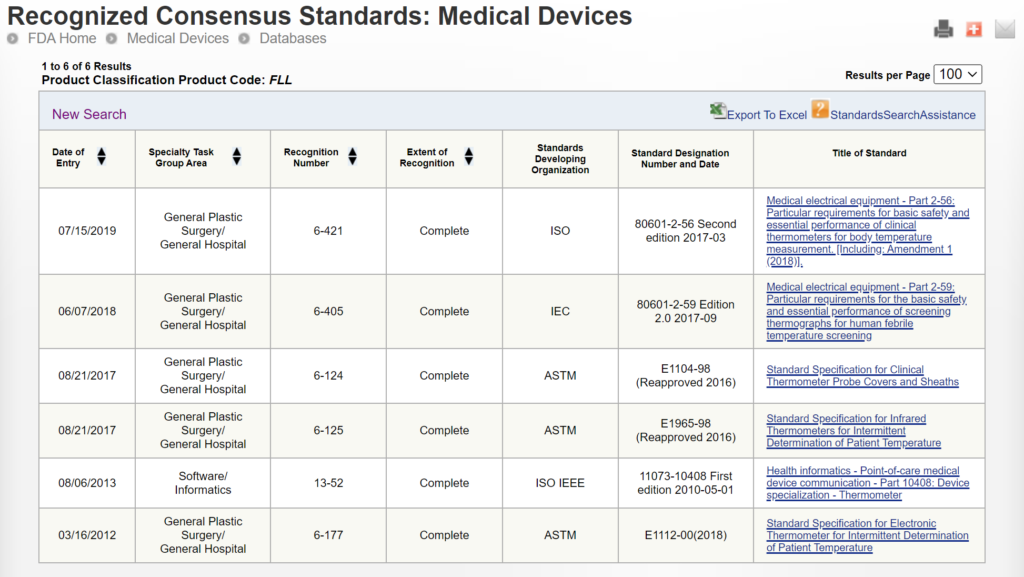
Nya 510 510-inlämningar bör alltid använda metoderna som identifieras i FDA-vägledningsdokument och hänvisa till erkända internationella standarder istället för att kopiera metoderna som används för att stödja äldre XNUMX XNUMX-inlämningar som föregår nuvarande FDA-riktlinjer eller erkända standarder. Problemet med FDA:s föreslagna tillvägagångssätt är att FDA antyder att en enhet som inte testats enligt nuvarande FDA-riktlinjer eller erkända standarder inte är lika säker eller effektiv som en annan enhet som testades enligt nuvarande FDA-riktlinjer eller erkända standarder. Denna slutsats kanske inte är sann. Därför, även om detta kan vara ett övervägande, är det inte lämpligt att kräva att tillverkarna ska inkludera detta som ett urvalskriterium för predikat. FDA tar redan hänsyn till detta genom att kräva att företag följer de nuvarande FDA-riktlinjerna och erkända standarder för enhetsbeskrivning, märkning, icke-klinisk prestandatestning och andra prestandatester. Ett exempel på hur FDA PreSTAR automatiskt meddelar dig om lämplig FDA-riktlinje för särskilda kontroller för en produktklassificering finns nedan.

B. Predikatenheter uppfyller eller överträffar förväntad säkerhet och prestanda
Denna bästa praxis som identifieras i FDA:s vägledning för val av predikat rekommenderar att du söker igenom tre olika FDA-databaser för att identifiera eventuella rapporterade skador, dödsfall eller fel på predikatenheten. Dessa tre databaser är:
Alla dessa databaser är användbara, men det finns också problem med varje databas. I allmänhet är biverkningar underrapporterade, och en mer grundlig granskning av granskning efter marknadsövervakning behövs för att korrekt bedöma säkerheten och prestandan för alla enheter. MAUDE-data representerar rapporter om biverkningar som involverar medicinsk utrustning och den uppdateras varje vecka. Uppgifterna består av alla frivilliga rapporter sedan juni 1993, rapporter från användaranläggningar sedan 1991, rapporter från distributörer sedan 1993 och tillverkarrapporter sedan augusti 1996. MDR-data uppdateras inte längre, men MDR-databasen låter dig söka i CDRH-databasens information om medicinsk utrustning som kan ha fungerat felaktigt eller orsakat dödsfall eller allvarlig skada under åren 1992 till 1996. Medical Product Safety Network (MedSun) är ett rapporteringsprogram för biverkningar som lanserades 2002 av CDRH. Det primära målet för MedSun är att samarbeta med det kliniska samhället för att identifiera, förstå och lösa problem med användningen av medicinsk utrustning. FDA:s predikatvalsvägledning nämner dock inte Databas för total produktlivscykel (TPLC). vilket är ett mer effektivt sätt att söka i alla FDA:s databaser – inklusive återkallelsesdatabasen och 510k-databasen.
Det största problemet med denna bästa praxis som grund för att välja ett predikat är att antalet biverkningar beror på antalet enheter som används varje år. För en liten tillverkare kommer antalet biverkningar att vara mycket litet eftersom det är väldigt få enheter som används. För en större tillverkare kommer antalet biverkningar att vara större – även om det kan representera mindre än 0.1 % av försäljningen. Slutligen rapporterar inte alla företag negativa händelser när de är skyldiga, medan vissa företag kan överrapportera negativa händelser. Ingen av dessa möjligheter beaktas i FDA:s utkast till vägledning för val av predikat.
C. Predikatenheter utan obegränsade användningsrelaterade eller designrelaterade säkerhetsproblem
För den tredje bästa praxis, rekommenderar FDA predikat urval vägledning att insändare söker Säkerhetsdatabas för medicinsk utrustning och CBER Safety & Availability (Biologics) databas för att identifiera eventuella "uppkommande signaler" som kan indikera ett nytt orsakssamband mellan en enhet och en eller flera negativa händelser. Som med alla FDA-databassökningar är denna information användbar som en input till designprocessen, eftersom den hjälper till att identifiera kända faror förknippade med liknande enheter. Det behövs dock en mer grundlig granskning av granskning efter marknadsövervakning för att exakt bedöma säkerheten och prestandan för alla enheter – inklusive sökning i databaser från andra länder där liknande enheter marknadsförs.
D. Predikatenheter utan en tillhörande designrelaterad återkallelse
För den fjärde bästa praxisen rekommenderar FDA:s vägledning för val av predikat att insändare söker FDA återkallar databasen. Som nämnts ovan innehåller TPLC-databasen denna information för varje produktklassificering. Av de fyra bästa praxis som rekommenderas av FDA är det osannolikt att någon predikatenhet som skulle återkallas genom design kommer att accepteras av FDA som en lämplig predikatenhet. Därför bör denna sökning utföras under designplaneringsfasen eller medan designinsatser identifieras. Om du inte kan identifiera en annan predikatenhet som inte var föremål för en designrelaterad återkallelse, bör du begära ett förhandsmöte med FDA och ge en motivering för användningen av den predikatenhet som återkallades. Din motivering måste innehålla en förklaring av de riskkontroller som implementerades för att förhindra liknande fel eller användningsfel med din enhet. Återkallelser beror ofta på kvalitetsproblem i samband med en leverantör som inte har tillverkat en produkt enligt specifikationerna eller någon annan bristande överensstämmelse i samband med montering, test, förpackning eller märkning av en enhet. Inget av dessa problem bör automatiskt utesluta användningen av ett predikat eftersom de inte är specifika för designen.
Avsnitt 6 – Förbättring av transparens
Det här avsnittet av FDA:s vägledning för val av predikat innehåller de mest kontroversiella rekommendationerna. FDA föreslår att 510k-sammanfattningen i 510k-inlämningar ska innehålla en berättelse som förklarar deras val av predikatenhet(er) som används för att stödja 510k-avslutet. Detta skulle vara ett nytt krav för slutförandet av en 510k sammanfattning eftersom den informationen för närvarande inte ingår i 510k sammanfattningar. Den nya FDA eSTAR har möjligheten att automatiskt generera en sammanfattning på 510 510 som en del av inlämningen (se exemplet nedan), men XNUMX XNUMX sammanfattningen som genereras av eSTAR innehåller inte ett avsnitt för att inkludera en berättelse som förklarar skälen till val av predikat.

FDA lade till det här avsnittet i utkastet till vägledning med målen att förbättra förutsägbarheten, konsekvensen och transparensen i 510 510 granskningsprocesser före marknaden. Det föreslagna tillägget av en berättelse som förklarar skälen till predikatval är dock inte det bästa sättet att uppnå dessa mål. Transparens uppnås bäst genom att eliminera alternativet med en 21k-sats (dvs. 807.93 CFR 510). För närvarande tillåter 510k-processen för insändare att tillhandahålla ett 510k-utdrag eller en 510k-sammanfattning. 510k uttalandet förhindrar allmänheten från att få tillgång till någon av informationen som skulle tillhandahållas i en 510k sammanfattning. Därför, om berättelsen som förklarar skälen till predikatvalet kommer att krävas i en 510k-inlämning, bör det nya kravet läggas till i sektionen för väsentlig ekvivalens i eSTAR istället för att bara inkludera det i 510k-sammanfattningen. Om 510k-satsen elimineras som ett alternativ för insändare, kommer alla insändare att behöva tillhandahålla en XNUMXk-sammanfattning och förklaringen till predikatvalet kan kopieras från en textruta i avsnittet om väsentlig ekvivalens.
FDA eSTAR säkerställer konsekvens i 510k-inlämningsinnehållet och -formatet, och spårning av FDA-prestanda har förbättrat konsekvensen i FDA 510k granskningsprocessen. Att lägga till en förklaring för val av predikat kommer inte att påverka något av dessa mål för att förbättra 510k-processen. Dessutom väljer företag inte predikat endast av de skäl som anges i denna vägledning för val av predikat från FDA. En av de vanligaste anledningarna till att välja ett predikat är kostnaden för att köpa prover av predikatenheter för prestandatestning sida vid sida. Detta avser endast kostnad, inte säkerhet eller prestanda, och att tvinga företag att köpa dyrare enheter för testning skulle inte överensstämma med det minst betungande tillvägagångssättet. En annan brist i denna föreslagna ytterligare information som ska inkluderas i 510k-sammanfattningen är att det finns en enorm variation i antalet predikat som kan väljas för olika produktklassificeringar. Till exempel har 319 enheter godkänts under de senaste 10 åren för FLL-produktklassificeringen (dvs. klinisk elektronisk termometer), medan 35 enheter godkändes under de senaste 10 åren för LCX-produktklassificeringen (dvs. graviditetstest). Därför skulle tillvägagångssättet för att välja ett predikat för dessa två produktklassificeringar vara väsentligt olika på grund av antalet giltiga predikat att välja mellan. Detta gör det mycket svårt att skapa en förutsägbar eller konsekvent process för predikatval över alla produktklassificeringar. Det kan också finnas konfidentiella, strategiska skäl för val av predikat som inte skulle vara lämpliga för en sammanfattning på 510k.
Avsnitt 7 – Exempel
FDA:s vägledning för val av predikat ger tre exempel. I varje exempel föreslår FDA att insändaren ska tillhandahålla en tabell som listar de giltiga predikatenheterna och jämföra dessa enheter i en tabell med de fyra bästa metoderna som kriterier för det slutliga urvalet. FDA positionerar detta som att ge mer insyn för allmänheten, men denna information som presenteras på det sätt som FDA presenterar den skulle inte vara användbar för allmänheten. Detta skapar mer dokumentation för företag att lämna in till FDA utan att göra enheter säkrare eller förbättra effektiviteten. Detta tillvägagångssätt skulle innebära en förändring av det erforderliga innehållet i en sammanfattning på 510 510 och introducera data efter marknaden som kriterium för XNUMX XNUMX clearance. Detta är en betydande avvikelse från den nuvarande FDA-policyn.
Exempel 1 från vägledning för predikatval
I det här exemplet inkluderade avsändaren en tabell i sin 510k-inlämning, tillsammans med sin motivering för att välja ett av de fyra potentiella predikaten som den predikatenhet som används för att stödja deras 510k-inlämning. Det här exemplet är det mest oroande eftersom sammanfattningen inte har några detaljer om försäljningsvolymen för de potentiella predikaten som utvärderas. Antalet negativa händelser och återkallelser är vanligtvis korrelerade med försäljningsvolymen. Den föreslagna tabellen tar inte hänsyn till denna information.
Exempelvis 2 från vägledning för predikatval
I det här exemplet kunde insändaren bara identifiera en potentiell, giltig predikatenhet. Avsändaren tillhandahöll en tabell som visar att predikatet inte gav några problem för tre av de fyra bästa praxis, men predikatet var föremål för en designrelaterad återkallelse. Insändaren förklarade också de åtgärder som vidtagits för att minska risken för dessa säkerhetsproblem i den aktuella enheten. Som nämnts ovan är det inte nödvändigtvis lämpligt att använda förekomsten av ett återkallande som grund för att utesluta ett predikat. De flesta återkallelser initieras på grund av andra skäl än designen. Därför måste du se till att orsaken till återkallelsen är designrelaterad snarare än ett problem med efterlevnad av kvalitetssystem eller ett problem med leverantörskvalitet.
Exempelvis 3 från vägledning för predikatval
I detta exempel identifierade avsändaren två potentiella, giltiga predikatenheter. Inga säkerhetsproblem identifierades med någon av de fyra bästa metoderna, men de två potentiella enheterna har olika marknadshistorik. En enhet har 15 års historia och den andra enheten har tre års historia. Insändaren valde enheten med 15 års historia eftersom den aktuella enheten hade en längre regulatorisk historia. Problemet med detta tillvägagångssätt är att år sedan godkännande inte är en indikation på regulatorisk historia. En enhet kan godkännas 2008, men den kanske inte kommer att lanseras kommersiellt förrän flera år senare. Dessutom kan antalet enheter som används vara ganska litet för ett litet företag. Däremot, om produkten med tre år sedan 510k-tillståndet distribueras av ett stort företag inom medicinteknik, kan det finnas tusentals enheter som används varje år.
Medical Device Academys rekommendationer för predikatval
Följande information består av rekommendationer som vårt konsultföretag ger till kunder angående val av predikat.
Försök att bara använda ett predikat (dvs ett primärt predikat)
När du väl har begränsat en lista med predikat rekommenderar vi generellt att du endast använder ett av alternativen som ett primärt predikat och undviker användningen av ett andra predikat om det inte är absolut nödvändigt. Om du är osäker på om ett andra predikat eller referensenhet behövs, är detta en utmärkt fråga att ställa till FDA under en telekonferens före inlämning under ämnet "regulatorisk strategi" (se bilden nedan). I din PreSTAR du kan ställa följande fråga: "[Ditt företagsnamn] föreslår att använda [primärt predikat] som ett primärt predikat. A) Har FDA några problem med valet av predikat? B) Anser FDA att ett sekundärt predikat eller referensenhet behövs?"
När och hur man använder flera predikat
Nyligen frågade en klient mig om användningen av ett sekundärt predikat i en 510k-inlämning som jag förberedde. De hade intrycket att endast ett predikat var tillåtet för en 510 510 inlämning eftersom FDA anser att de två predikatenheterna är ett "delat predikat." Videon ovan förklarar definitionen av ett "delat predikat", och definitionen hänvisar till mer än användningen av två predikat. För många av de 510 XNUMX inlämningarna förberedde vi och fick godkännande för använda sekundära predikat. En ännu vanligare strategi är att använda en andra enhet som referensenhet. Den andra enheten kanske bara har tekniska egenskaper gemensamma med den aktuella enheten, men metoderna för säkerhet och prestandatestning som används kan användas som objektiva prestandastandarder för din XNUMXk-inlämning.
När du försöker använda flera predikatenheter för att visa väsentlig likvärdighet med din ämnesenhet i en 510k-inlämning, har du tre alternativ för korrekt användning av flera predikatenheter:
- Två predikat med olika tekniska egenskaper, men samma avsedda användning.
- En anordning med mer än en avsedd användning.
- En anordning med mer än en indikation under samma avsedda användning.
Om du använder "alternativ 1" måste din ämnesenhet ha de tekniska egenskaperna hos båda predikatenheterna. Till exempel har din enhet Bluetooth-kapacitet, och den använder infraröd teknik för att mäta temperatur, medan ett av de två predikaten har Bluetooth men använder en termistor, och det andra predikatet använder infraröd mätning men inte har Bluetooth.
Om du använder "alternativ 2" kombinerar du funktionerna hos två olika enheter till en enhet. Till exempel används en predikatanordning för att mäta temperatur, och den andra predikatanordningen används för att mäta blodtryck. Din enhet kan dock utföra båda funktionerna. Du kanske har valt en annan multiparametermonitor på marknaden som ditt predikat, men du kanske inte kan göra det om ingen av multiparametermonitorerna har samma kombination av avsedda användningsområden och tekniska egenskaper. Detta scenario är ganska vanligt när en ny teknik introduceras för övervakning och ingen av multiparametermonitorerna använder den nya tekniken ännu.
Om du använder "alternativ 3" måste du vara försiktig så att den aktuella enhetens förmåga att användas för en andra indikation inte äventyrar enhetens prestanda för den första indikeringen. Till exempel är benfixeringsplattor designade för fixering av benfrakturer. Om den första indikationen är för långa ben, och den andra indikationen är för små ben i handleden, kanske storleken och styrkan på benfixeringsplattan inte är tillräcklig för långa ben, eller så kan enheten vara för stor för handleden.
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Fordon / elbilar, Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- PlatoHealth. Biotech och kliniska prövningar Intelligence. Tillgång här.
- ChartPrime. Höj ditt handelsspel med ChartPrime. Tillgång här.
- BlockOffsets. Modernisera miljökompensation ägande. Tillgång här.
- Källa: https://medicaldeviceacademy.com/predicate-selection-guidance/



