Preparação de NPs Mel-PLGA
O método de nanoprecipitação-volatilização de solvente em uma etapa foi utilizado para a síntese de NPs de Mel-PLGA26. Vinte mg de PLGA (P2191, lactido:glicólido (50:50), peso molecular 30,000-60,000, Sigma Aldrich, EUA) foram dissolvidos em acetona (um ml); e dois mg de Mel (73-31-4, peso molecular 232.28, Sigma Aldrich, EUA) foram adicionados seguidos de meia hora de centrifugação para formar a fase orgânica [2% (p/v)]. A fase orgânica formada foi injetada em HXNUMX destilado2O com agitação contínua por meia hora; seguido de evaporação da acetona (a 37°C sob vácuo).
Caracterização de NPs Mel-PLGA
Os NPs de Mel-PLGA produzidos foram obtidos por liofilização e armazenados a 4°C. A forma das nanopartículas preparadas foi observada por microscópio eletrônico de transmissão (TEM). Malvern.
O dispositivo Zetasizer foi utilizado para determinar o tamanho e o potencial zeta das nanopartículas.
Eficiência de encapsulamento (EE%) e carga de medicamento (DL%) de NPs de Mel-PLGA26
A quantidade de Mel em NPs de Mel-PLGA foi determinada por cromatografia líquida de alta eficiência (HPLC). Onde, NPs de Mel-PLGA foram dissolvidos em acetona seguido de ultrassom para liberar o Mel encapsulado. A solução foi centrifugada a 3000 rpm durante vinte minutos para precipitar o PLGA. O Mel dissolvido no sobrenadante representou a massa encapsulada em NPs. A libertação de Mel de NPs de Mel-PLGA foi determinada diluindo um ml de NPs com nove ml de solução salina tamponada com fosfato (PBS, pH 7.4); seguido de incubação a 37°C em shaker. Nos tempos 0, 20, 40, 60, 80 e 100 h, 300 µl da solução foram removidos (substituídos pelo mesmo volume por PBS) e centrifugados a 3000 rpm por 30 min. O EE% e DL% foram calculados pelas seguintes equações:
$${texto{EE}}% = esquerda( {{text{massa}};{texto{de}};{texto{Mel}};{texto{in}};{texto{Mel}} – {texto {PLGA}};{texto{NPs}}/{texto{total}};{texto{massa}};{texto{de}};{texto{Mel}}} certo) vezes {1}00.$$
$${texto{DL}}% = esquerda( {{texto{massa}};{texto{de}};{texto{Mel}};{texto{in}};{texto{Mel}} – {texto {PLGA }};{texto{NPs}}/{texto{total}};{texto{massa}};{texto{de}};{texto{Mel}} – {texto{PLGA}};{texto{ NPs}}} certo) vezes {1}00.$$
Efeitos in vitro de NPs de Mel-PLGA
Efeito antioxidante in vitro de NPs de Mel-PLGA 27
A capacidade antioxidante dos NPs de Mel-PLGA preparados foi avaliada a partir de seus efeitos de eliminação de radicais livres via 1, 1-difenil-2-picril hidrazil [DPPH (281,689, Sigma Aldrich, EUA)]. Simplesmente, diferentes concentrações de NPs (de 3.9 a 1000 μg/ml) foram misturadas com um ml de solução de DPPH/etanol (0.1 mM), agitadas e deixadas em repouso por 30 min a 25°C. A absorvância foi medida a 517 nm utilizando ácido ascórbico como substância de referência. Atividade de eliminação de DPPH% = [(A0-UMA1)/UMA0]× 100. A absorbância da amostra foi A1, enquanto a absorbância da reação de controle foi A0.
Efeito de citotoxicidade in vitro de NPs de Mel-PLGA
A segurança do uso de NPs de Mel-PLGA foi examinada, in vitro, antes de ser utilizada in vivo. Células Caco2 (Sigma Aldrich, EUA) foram cultivadas, a 37 °C em 5% de CO2 e umidade relativa de 95%, em meio Eagle modificado por Dulbecco (DMEM) suplementado com NaHCO3 (2.2 g/l), d-glicose (4.5 g/l), 1% de aminoácidos não essenciais, 10% de soro fetal bovino, 100 UI/ml de penicilina e 0.1 mg/ml de estreptomicina (todos os materiais utilizados no processo de cultura foram adquiridos da Sigma Aldrich, EUA). Os ensaios de citotoxicidade in vitro foram realizados de acordo com Alaa et al.28. 100 µl/poço de 105 As células Caco2 em placas de cultura de tecidos foram incubadas a 37 ° C durante 24 h para permitir o desenvolvimento de monocamadas celulares. Após decantação do meio, utilizou-se um meio de lavagem para lavar as monocamadas. Concentrações graduadas de NPs de Mel-PLGA foram produzidas combinando NPs com meio RPMI. A diluição de NPs produzida foi diluída para 0.1 ml, adicionada aos poços e depois deixada em repouso por mais 24 horas. Os poços receberam 20 µl de MTT (brometo de 3-(4,5-dimetiltiazol-2-il)-2-5-difeniltetrazólio) na concentração de 5 mg/ml. As placas foram agitadas durante cinco minutos para garantir a mistura do MTT e depois incubadas durante quatro horas a 37°C com 5% de CO2. Para dissolver o formazan desenvolvido, 200 µl de dimetilsulfóxido (DMSO) foram aplicados nas placas. A 560 nm, foi medida a absorvância (que estava directamente ligada ao formazan).
Efeito de coagulação in vitro de NPs de Mel-PLGA29
A atividade de coagulação dos NPs de Mel-PLGA preparados foi testada para prever o seu efeito quando administrado in vivo. A atividade anticoagulante dos NPs de Mel-PLGA foi avaliada medindo o tempo de coagulação em segundos a 37°C, com heparina servindo como controle. De acordo com as recomendações do fabricante, foram utilizados reagentes de tempo de protrombina (TP) e tempo de tromboplastina parcial (PTT) (pré-incubados a 37°C por 5 min). Resumidamente, foram combinados plasma de rato (900 μl) e várias concentrações de NPs de Mel-PLGA (100 μl) ou heparina dissolvida em solução salina. O teste foi concluído três vezes e o tempo de coagulação foi registrado.
Efeito antiinflamatório in vitro (inibição da hemólise) de NPs de Mel-PLGA
O efeito antiinflamatório das NPs de Mel-PLGA foi determinado pelo teste de inibição da hemólise de acordo com Anosike et al.30. Sangue heparinizado de rato fresco (5 ml) foi centrifugado a 2500 rpm durante 15 min; depois disso, o pellet resultante foi dissolvido com tampão isotônico (que equivalia ao volume do sobrenadante). Diferentes doses de NPs de Mel-PLGA (de 100 a 1000 μg/ml) foram combinadas com 5 ml de água destilada para criar uma solução hipotônica. As mesmas dosagens de NPs foram combinadas com solução isotônica (5 ml); e indometacina foi empregada como controle. As soluções NPs e controle receberam 0.1 ml da suspensão de eritrócitos produzida, que foi então incubada por uma hora a 37 ° C antes de ser centrifugada por três minutos a 1500 rpm. Um espectrofotômetro foi utilizado para quantificar a hemoglobina liberada no sobrenadante a 540 nm, e a porcentagem de inibição da hemólise foi estimada usando a fórmula: inibição da hemólise (%) = 1−[(ODb−ODa)/(ODc−ODa)]× 100. DEa significava absorbância da amostra em uma solução isotônica, ODb para absorbância da amostra em solução hipotônica e ODc para controle de absorbância em solução hipotônica.
Animais e desenho experimental
Ratos Sprague Dawley machos, pesando 200 g e oito semanas de idade, foram adquiridos no biotério da Organização Nacional para Controle e Pesquisa de Drogas (Cairo, Egito). Todos os procedimentos experimentais foram realizados de acordo com as diretrizes internacionais para o cuidado e uso de animais de laboratório e cumpriram as diretrizes da ARRIVE. Duas doses de NPs de Mel-PLGA (5 e 10 mg/kg) foram examinadas in vivo para testar a eficácia das NPs no tratamento de lesão hepática induzida por CCL4; e também, para encontrar a dose terapêutica necessária. Além disso, duas doses de Mel livre (5 e 10 mg/kg) foram utilizadas nos subgrupos experimentais e comparadas aos subgrupos administrados de NPs de Mel-PLGA para comprovar o sucesso dos NPs de Mel-PLGA preparados na redução da quantidade de Mel administrado. Subgrupos de controle saudáveis foram concebidos como subgrupos com lesão hepática induzida por CCL4 para obter uma comparação crítica e análise estatística. Para tanto, os animais foram divididos em dois grupos, hígidos (H) e com lesão hepática CCL4 (I); cada grupo foi dividido em cinco subgrupos (cinco ratos/subgrupo):
-
Grupo saudável (H):
H controle GI: ratos de controle saudáveis negativos.
H Mel (5 mg/kg) GII: ratos controle saudáveis que receberam 5 mg/kg de Mel.
H Mel (10 mg/kg) GIII: ratos controle saudáveis que receberam 10 mg/kg de Mel.
NPs de H Mel-PLGA (5 mg/kg) GIV: ratos controle saudáveis que receberam 5 mg/kg de NPs de Mel-PLGA.
NPs de H Mel-PLGA (10 mg/kg) GV: ratos controle saudáveis que receberam 10 mg/kg de NPs de Mel-PLGA.
-
Grupo CCL4 com lesão hepática (I):
Eu controlo o GI não tratado: ratos não tratados com lesão hepática induzida por CCL4 (controle positivo).
I Mel (5 mg/kg) GII: ratos com lesão hepática induzida por CCL4 tratados com 5 mg/kg de Mel.
I Mel (10 mg/kg) GIII: ratos com lesão hepática induzida por CCL4 tratados com 10 mg/kg de Mel.
I Mel-PLGA NPs (5 mg/kg) GIV: ratos com lesão hepática induzida por CCL4 tratados com 5 mg/kg de NPs de Mel-PLGA.
I Mel-PLGA NPs (10 mg/kg) GV: ratos com lesão hepática induzida por CCL4 tratados com 10 mg/kg de NPs de Mel-PLGA.
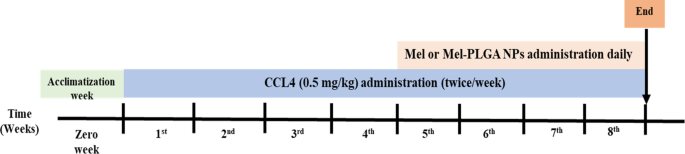
Além do grupo veículo (GV) composto por ratos saudáveis que receberam 0.1 ml de azeite por injeção intraperitoneal (ip) duas vezes/semana durante todo o período experimental. O CCL4 foi dissolvido em azeite e administrado na dose de 0.5 mg/kg por via ip duas vezes/semana durante quatro semanas sucessivas. Após a indução da lesão hepática, os NPs Mel ou Mel-PLGA foram administrados por via ip diariamente durante mais quatro semanas (nota: os ratos continuaram a receber doses de CCL4 durante o tratamento) (Fig. 1).
Ao final do experimento, os ratos foram anestesiados terminalmente com 50 mg/kg de pentobarbital sódico31. Amostras de sangue foram coletadas por punção cardíaca. Após permitir a coagulação do sangue em temperatura ambiente, o soro foi coletado após centrifugação a 1500 rpm por 15 min e dividido em alíquotas para serem mantidas a -20°C. Ratos, de todos os grupos experimentais, foram dissecados para coleta de órgãos (fígado). Resumidamente, o rato foi colocado de costas na bandeja de dissecação e seus membros foram fixados com o auxílio de uma fita adesiva. A pele do rato foi cortada para expor os músculos subjacentes. A parede abdominal foi removida e o fígado foi removido cuidadosamente. Amostras de fígado (um g), de todos os grupos experimentais, foram homogeneizadas usando tampão Tris-HCl frio para preparar homogeneizado de fígado (10%).
Análise bioquímica em amostras de soro
Os parâmetros da função hepática foram medidos para avaliar o efeito hepatoprotetor dos NPs de Mel-PLGA. Os níveis de aspartato aminotransferase (AST), alanina transaminase (ALT), albumina (ab234579, ab263883, ab108789, abcam, EUA) e bilirrubina total (MBS9389057, MyBiosource, EUA) foram medidos por kits ELISA de ratos de acordo com Farid et al.27.
Marcadores de estresse oxidativo em homogeneizados de tecido hepático:
O efeito antioxidante das NPs preparadas foi determinado, in vivo, pela medição do marcador de peroxidação lipídica malondialdeído (MDA) e das enzimas antioxidantes. Os níveis de MDA (MBS268427, MyBioSource, EUA), GPx (MBS744364, MyBioSource, EUA), SOD (ab285310, EUA) e CAT (P04762, CUSABIO, EUA) foram medidos por kits ELISA de rato de acordo com Farid et al.32 e Amr et al.33.
Níveis de citocinas em homogeneizados de tecido hepático
O efeito antiinflamatório dos NPs de Mel-PLGA foi determinado medindo o nível de citocinas pró-inflamatórias (TNF-α, IL-1β e IL-6) e a citocina antiinflamatória (IL-10). Os níveis de citocinas foram medidos no fígado de ratos por IL-1β (MBS825017, MyBioSource, EUA), TNF-α (ab100785, abcam, Reino Unido), IL-6 (P20607, CUSABIO, EUA) e IL-10 (P29456, CUSABIO, EUA). EUA) kits ELISA para ratos de acordo com Farid et al.34.
Níveis de metaloproteinases de matriz em homogeneizados de tecido hepático:
O efeito dos NPs Mel-PLGA na remodelação do tecido hepático foi avaliado medindo MMP9 e TIMP1 por kits ELISA de rato (MBS722532 e MBS2502910, respectivamente; MyBioSource, EUA).
Técnica de citometria de fluxo
A técnica de citometria de fluxo foi utilizada para encontrar o efeito dos NPs preparados na apoptose e nos níveis de proteínas apoptóticas intracelulares. As culturas de células de hepatócitos foram produzidas sob condições esterilizadas. A veia porta de ratos sob anestesia foi perfundida com tampão de colagenase. O fígado foi dissecado após a perfusão, as células foram separadas, suspensas em meio completo de William, filtradas em filtro de náilon (100 μm) e depois cultivadas. O nível de apoptose nas células do fígado foi examinado utilizando o kit de detecção de apoptose Anexina-V-FITC / PI (ab14085, abcam, EUA). As células hepáticas foram permeabilizadas por saponina (pH 7.4); e a proteína anti-apoptótica Bcl2 (11-6992-42) e proteínas pró-apoptóticas [Bax (MA5-14,003), p53 (ab90363), caspase 3 (C92-605) e 8 (ab32125)] foram medidas por citometria de fluxo .
Exame histopatológico e imunohistoquímico:
As secções do fígado foram examinadas pelo método comum de coloração com hematoxilina e eosina para avaliar as diferentes alterações histopatológicas entre os grupos experimentais. A coloração imuno-histoquímica foi utilizada para avaliar o efeito antiinflamatório dos NPs de Mel-PLGA. As amostras de fígado foram desidratadas com níveis crescentes de álcool: álcool 70% por 1.5 h, álcool 90% por 1.5 h e álcool absoluto por 3 h. O fígado foi então clarificado durante 4 h em xileno. Após a limpeza, as amostras de fígado são submetidas ao procedimento de infiltração, onde são impregnadas com parafina pura e macia em três graus distintos (cada um com duração de uma hora) a 56 °C. Os corpos de prova foram então dispostos em blocos e imersos em parafina a 58 °C. Para análise histológica foram cortadas fatias de parafina de 4 mícrons de espessura, coradas com hematoxilina e eosina, montadas em dibutilftalato poliestireno xileno e depois cobertas33,35. Para exame imuno-histoquímico28, H2O2 (3%) [seguido de lavagem com PBS e bloqueio de 60 minutos com albumina de soro bovino (BSA, 5%)] foi utilizado para inibir a atividade da peroxidase endógena. As secções de fígado foram lavadas em PBS, após uma incubação de 30 minutos com o anticorpo primário [anticorpo anti-fator nuclear-kappa beta (NF-кB) p65 (ab86299, abcam, EUA) ou anticorpo anti-proteína C reativa (C1688 , Sigma Aldrich, EUA)]. O anticorpo secundário IgG anti-rato de coelho peroxidase de rábano (HRP) (ab6734, abcam, EUA) foi aplicado em secções de fígado e incubado durante 60 min. 3-diaminobenzidina (DAB) foi utilizada para o desenvolvimento da cor, com a cor marrom significando um resultado positivo. As secções de fígado foram lavadas e depois contrastadas com hematoxilina (3%).
Análise estatística
Os dados foram expressos como média ± DP e investigados por análise de variância unidirecional (ANOVA) utilizando SPSS versão 20.0 (SPSS Inc., Chicago, EUA). As diferenças entre as médias foram examinadas pelo teste post hoc de Tukey. Quando P < 0.05, valores foram considerados significativos.
Aprovação ética
Todos os procedimentos experimentais e manutenção dos animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais.
- Conteúdo com tecnologia de SEO e distribuição de relações públicas. Seja amplificado hoje.
- PlatoData.Network Gerativa Vertical Ai. Capacite-se. Acesse aqui.
- PlatoAiStream. Inteligência Web3. Conhecimento Amplificado. Acesse aqui.
- PlatãoESG. Carbono Tecnologia Limpa, Energia, Ambiente, Solar, Gestão de resíduos. Acesse aqui.
- PlatoHealth. Inteligência em Biotecnologia e Ensaios Clínicos. Acesse aqui.
- Fonte: https://www.nature.com/articles/s41598-023-43546-4