Dierlijke voorbereiding
Alle dierprocedures werden beoordeeld en goedgekeurd door het Institutional Animal Care and Use Committee van de Washington University in St. Louis in overeenstemming met de National Institutes of Health Guidelines for animal research. Dit onderzoek is gerapporteerd in overeenstemming met de ARRIVE-richtlijnen. Er werden in totaal 15 muizen (Zwitsers, 6-8 weken oud, vrouwelijk, Charles River Laboratory, Wilmington, MA) gebruikt. Deze muizen werden willekeurig verdeeld in drie groepen om de uitkomst van FUS-BBBO te vergelijken onder de drie koppelingscondities: "olie + haren" (n = 5), "echografiegel + geen haar" (n = 5) en "echografiegel + haren” (n = 5).
FUS-BBBO experimentele opstelling
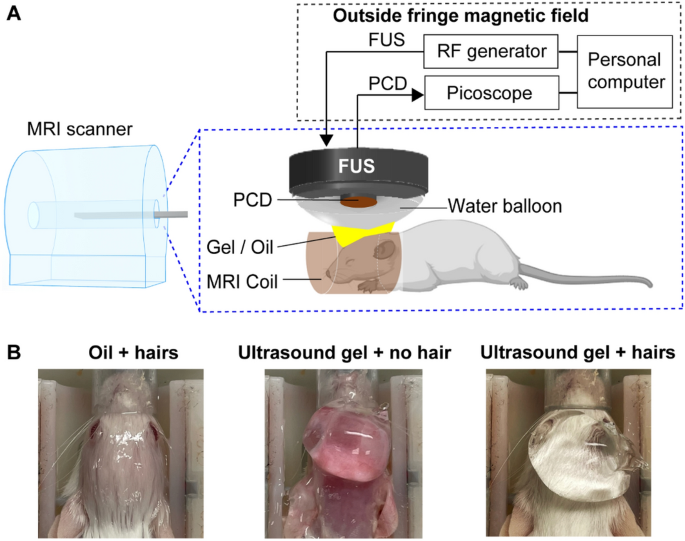
Een MR-geleid FUS-systeem (Image Guided Therapy, Pessac, Frankrijk) werd gebruikt om de FUS-BBBO-procedure bij muizen uit te voeren. Een schematisch diagram van het experimentele systeem wordt getoond in Fig. 1A. Dit systeem werd gebruikt in onze eerdere MR-geleide FUS-BBBO-onderzoeken10,20. Het systeem bestond uit een MRI-compatibele FUS-transducer (Imasonic, Voray-sur-l'Ognon, Frankrijk) gemaakt van een ringvormige reeks van zeven elementen met een middenfrequentie van 1.5 MHz, een opening van 25 mm en een kromtestraal. van 20mm. Het systeem werd geïntegreerd in een 9.4 T MRI-scanner voor kleine dieren (Bruker, Billerica, MA, VS). De transducer was verbonden met een MRI-compatibele piëzo-elektrische motor, waardoor de positie van de transducer mechanisch in laterale richtingen kon worden aangepast (langs de x- en y-as, Fig. 1A). De axiale en laterale volledige breedte bij halve maxima van de FUS-transducer waren respectievelijk 5.5 mm en 1.2 mm. De akoestische druk die in deze studie werd gerapporteerd, werd gecorrigeerd voor 18% verlies van insertie van de schedel van de muis10,20. Een passieve cavitatiedetectie (PCD) -sensor geïntegreerd in het midden van de FUS-transducer had een middenfrequentie van 1.6 MHz en een -6 dB bandbreedte van 754 kHz. De signalen die met de PCD-sensor werden gedetecteerd, werden verkregen via de PicoScope (5244B, Pico Technology, Cambridgeshire, VK) om cavitatiegebeurtenissen te bewaken. De transducerset (FUS-transducer en PCD) was verbonden met een waterballon gevuld met gedeïoniseerd en ontgast water.
FUS-BBBO experimentele opstelling in muizen. (A) De experimentele opstelling bestond uit een 9.4 T MRI-scanner voor kleine dieren en een commercieel FUS-systeem. (B) Voor elke groep muizen werden verschillende koppelingsmethoden gebruikt: "olie + haren", "ultrasone gel + geen haar" en "ultrasone gel + haren".
Akoestische koppelingsmethoden
De waterballon van de transducer werd met behulp van verschillende koppelingsmethoden aan de muiskop gekoppeld, zoals getoond in Fig. 1A en B.
Voor de groep "olie + haren" werd eerst minerale olie (Walgreen Company, Deerfield, IL) in een kom van weegpapier gegoten en gedurende ten minste 5 minuten gewacht om vastzittende luchtbellen, als die er waren, te laten drijven en uit de kom te laten verdwijnen. olie. Een deel van de minerale olie werd vervolgens in een injectiespuit geladen. De rest werd gebruikt om wattenstaafjes te weken. Druppels olie werden vervolgens met een injectiespuit op de kop van de muis aangebracht en de olie werd voorzichtig verspreid en geborsteld met in olie gedrenkte wattenstaafjes. Vervolgens werd met een injectiespuit 1-2 ml olie bovenop de haren toegevoegd. De hoogte van de FUS-transducer werd vervolgens zodanig aangepast dat het transducermembraan in contact was met de olie.
Voor de groep "ultrasone gel + geen haar" werden de haren verwijderd met behulp van Nair (Church & Dwight Co., Princeton, NJ, VS) en werd de hoofdhuid grondig gereinigd met behulp van alcoholdoekjes. Daarna werd ontgaste ultrasone gel (Aquasonic, Parker Laboratories, Inc., Fairfield, NJ, VS) aangebracht en werd de FUS-transducer gepositioneerd om te koppelen met de ultrasone gel.
Bij de groep “ultrasone gel + haren” werden de haren eerst grondig gereinigd met behulp van alcoholdoekjes. Ontgast water werd aan de haren toegevoegd en ultrageluidgel werd op de bevochtigde haren aangebracht. De FUS-transducer werd vervolgens gekoppeld aan de ultrasone gel.
FUS-BBBO-procedure
Na de voltooiing van akoestische koppeling, T2-gewogen MRI-scans (TR/TE: 2200/35; plakdikte: 0.5 mm; resolutie in het vlak: 0.125 mm; matrixgrootte: 256 × 256) werden uitgevoerd om de relatieve locatie van de FUS-transducer ten opzichte van de hersenen te verkrijgen. Het linker striatum werd gekozen als de beoogde hersenlocatie (FUS +) en de contralaterale zijde werd gekozen als de niet-sonische controle (FUS-). De transducerset (FUS-transducer en PCD) werd ingeschakeld en tijdens ultrasoonapparaat door elke FUS-puls werd akoestische emissie van microbellen geregistreerd door de PCD. De akoestische parameters werden bij alle drie de groepen hetzelfde gehouden (0.6 MPa piek negatieve druk in situ, 5 Hz pulsherhalingsfrequentie, 10,000 cycli, 3.3% duty cycle en 3 min sonicatieduur). Dertig seconden na het begin van FUS-sonicatie werden commerciële microbellen (Definity, Lantheus Medical Imaging, North Billerica, MA, VS) intraveneus toegediend in een concentratie van (8 keer {10}^{8}) bubbels/ml en een totaal volume van 30 µL, gevolgd door een spoeling met zoutoplossing. Onmiddellijk na de FUS-behandeling werd 4% Evans-blauw intraveneus toegediend als modelgeneesmiddel.
PCD-signaalverwerking
Vergelijkbaar met onze eerdere publicatie10, werd een aangepast MATLAB-script geschreven om de verkregen PCD-gegevens te verwerken voor de evaluatie van stabiele cavitatiedoses. In het kort werden basislijn-PCD-gegevens verkregen tijdens de eerste 30 s sonicatie vóór injectie van microbellen. Nadat microbellen waren geïnjecteerd, werden PCD-gegevens verkregen totdat de sonicatie eindigde. De stabiele cavitatiedosis werd berekend met de volgende stappen: (1) Het gemiddelde van het pre-microbellen injectie stabiele cavitatie (SC) niveau werd berekend door het gemiddelde te nemen van de SC niveaus waargenomen vóór microbellen injectie. Het SC-niveau werd beoordeeld in het frequentiedomein door de amplitude bij de tweede harmonische (3.0 MHz) op te tellen binnen een bandbreedte van ± 0.02 MHz. (2) Het SC-niveau na microbelleninjectie werd bepaald door het gemiddelde van het SC-niveau vóór microbellen af te trekken van het op elk tijdstip berekende SC-niveau. (3) De stabiele cavitatiedosis werd vervolgens gekwantificeerd door de SC-niveaus op te tellen tussen de tijd na injectie van microbellen en het einde van de sonicatie. Deze stappen zorgden ervoor dat rekening werd gehouden met de variaties in het baseline SC-niveau voor individuele muizen.
MRI-evaluatie van de akoestische koppelingskwaliteit
T2-gewogen MRI-scan (TR/TE, 4228/35; plakdikte: 0.5 mm; resolutie in het vlak: 0.125 mm; matrixgrootte: 256 × 256) werd uitgevoerd aan de bovenkant van de muiskop om de kwaliteit van de akoestische koppelen. Als kwantitatieve beoordeling berekenden we het aantal luchtbellen dat vastzat in het koppelingsmedium binnen een interessegebied (ROI) op het grensvlak tussen het koppelingsmedium en het haar/de huid van de muizen. De grootte van de ROI (40 × 24 pixels, pixelbreedte van 0.125 mm) werd in alle objecten consistent gehouden. De locatie van ROI was gefixeerd op het achterste gedeelte van het huid/haarkoppelingsmedium-interfacegebied, dat verscheen als het grijze gebied in de T2-gewogen MRI-beelden. De luchtbellen in de ROI werden vervolgens geëxtraheerd door nabewerking met behulp van ImageJ21.
FUS-BBBO uitkomstbeoordeling
De FUS-BBBO-uitkomst werd in vivo beoordeeld met behulp van contrastversterkte T1-gewogen MRI en ex vivo door fluorescentiebeeldvorming van hersenplakjes.
In vivo, contrastversterkte T1-gewogen MRI-scan (TR/TE: 20/5; plakdikte: 0.13 mm; resolutie in het vlak: 0.13 mm; matrixgrootte: 120 × 240; draaihoek: 20°) werd uitgevoerd om de uitkomst van FUS-BBBO te evalueren gebaseerd op de extravasatie van het MRI-contrastmiddel gadobenaat dimeglumin (Gd-BOPTA; MultiHance, Bracco Diagnostics Inc., Monrow Township, NJ) uit de bloedcirculatie in hersenweefsel. Het BBBO-volume werd berekend door het contrastversterkte volume in de T1-gewogen afbeeldingen aan de FUS + en FUS-zijden met behulp van een aangepast MATLAB-script dat in onze eerdere publicaties is vermeld10,20,22. Kort gezegd werd het contrastversterkte volume voor elke muis berekend door de som van voxels in de FUS+-zijde met een intensiteit boven het gemiddelde plus driemaal de standaarddeviatie van de FUS-zijde voor elk afzonderlijk scansegment.
Alle muizen werden opgeofferd onder verdampte isofluraan-anesthesie ongeveer 30 minuten na FUS-sonicatie door transcardiale perfusie met 30 ml 1 x PBS gedurende 5 minuten. Hersenen werden geoogst en gefixeerd in 4% paraformaldehyde gedurende ten minste 24 uur. De hersenen werden vervolgens transversaal in plakjes van 1 mm gesneden met behulp van een hersenmatrix (RBM-4000C, ASI Instruments Inc., MI, VS) en afgebeeld met behulp van het Pearl Trilogy Image System (LI-COR, Lincoln, NE, VS). De uitkomst van de levering van Evans Blue werd gekwantificeerd met behulp van de ingebouwde software van het systeem (Image Studio Lite, LI-COR, Lincoln, NE, VS). De fluorescentie-intensiteit binnen de FUS+-zijde werd opgeteld en genormaliseerd door de som van de fluorescentie-intensiteit van de contralaterale zijde van het striatum voor elk afzonderlijk hersenplakje.
statistische analyse
Statistische analyses werden uitgevoerd met behulp van GraphPad Prism (versie 9.0, La Jolla, CA, VS). Verschillen tussen meerdere groepen werden bepaald met behulp van gewone eenrichtings-ANOVA met groepsgewijze vergelijkingen. A p waarde < 0.05 werd gebruikt om de statistische significantie te bepalen.
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. Automotive / EV's, carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- ChartPrime. Verhoog uw handelsspel met ChartPrime. Toegang hier.
- BlockOffsets. Eigendom voor milieucompensatie moderniseren. Toegang hier.
- Bron: https://www.nature.com/articles/s41598-023-40598-4