F16BP-microdeeltjes bevinden zich in het fagocytoseerbare bereik
Om de kracht van een dergelijke strategie aan te tonen, werd PFK15 (blokken − 6-Phosphofructo-2-Kinase Fructose-2,6-Biphosphatase 3-PFKFB3) gekozen om de glycolyse te blokkeren, omdat dit een van de snelheidsbeperkende stappen in de glycolyse is.20. Bovendien werd fructose-1,6-bifosfaat (F16BP), dat wordt gegenereerd door fosfofructokinase (PFK), een stap stroomafwaarts van PFKFB3, gekozen als de metaboliet om fagocytoseerbare deeltjes te genereren.21. Op F16BP gebaseerde microdeeltjes werden gegenereerd met behulp van calciumfosfaatchemie. Dynamische lichtverstrooiing toonde aan dat de grootte van deze deeltjes 2.3 ± 0.4 µm was (Fig. 1b) en scanning-elektronenmicrofoto's toonden aan dat deze deeltjes een gladde sferische morfologie hadden (Fig. 1c). Met behulp van 1H NMR en EDX-mapping werd bepaald dat het F16BP in deze microdeeltjes was opgenomen (Fig. 1c; S1) en de deeltjes hadden een verhouding van calcium tot fosfor (Ca:P) van 2 ± 0.14 (Fig. 1c).
F16BP-microdeeltjes worden gefagocyteerd door DC's
Om te testen of F16BP-MP's F16BP konden afgeven, werd de afgiftekinetiek in fosfaatgebufferde zoutoplossing uitgevoerd. Er werd waargenomen dat F16BP-parlementsleden F16BP gedurende 6 uur op een aanhoudende manier konden vrijgeven (Fig. S2). Deze gegevens toonden aan dat de gegenereerde MP's F16BP bevatten, zich in het fagocytoseerbare bereik van DC's bevinden en F16BP kunnen vrijgeven om mogelijk de glycolyse vooruit te laten gaan. Naast F16BP werden ook deeltjes van andere controlemetabolieten zoals ribulose 5-fosfaat (R5P), fosfoenolpyrodruivenzuur (PEP) en fructose-6-fosfaat (F6P) gegenereerd (Fig. S3). In deze studie werd PBS gekozen om de in vivo fysiologische omstandigheden van fosfaten na te bootsen, en de afgifte van F16BP in dit medium werd bepaald22. Omdat wordt verwacht dat geactiveerde DC's na fagocytose in vivo 1-3 dagen zullen overleven, is bovendien de kortetermijnactiviteit of stabiliteit van de F16BP-parlementsleden wenselijk.23.
Om te testen of deze deeltjes door DC's kunnen worden gefagocyteerd, werd confocale beeldvorming uitgevoerd. Concreet werden F16BP-MP's gegenereerd met FITC geïntercaleerd in de deeltjes. Van beenmerg afkomstige DC's (DC's) werden vervolgens gedurende 60 minuten met deze deeltjes geïncubeerd en gekleurd op actine en kernen, en er werd fluorescente beeldvorming uitgevoerd. Cytochalasine D in aanwezigheid van F16BP-FITC-MP's werd als controle gebruikt. Er werd waargenomen dat DC's effectief met de deeltjes konden associëren, en de confocale plakjes in de z-richting toonden aan dat de deeltjes geïnternaliseerd waren (Fig. S4).
F16BP-microdeeltjes redden de glycolyse in DC's in vitro
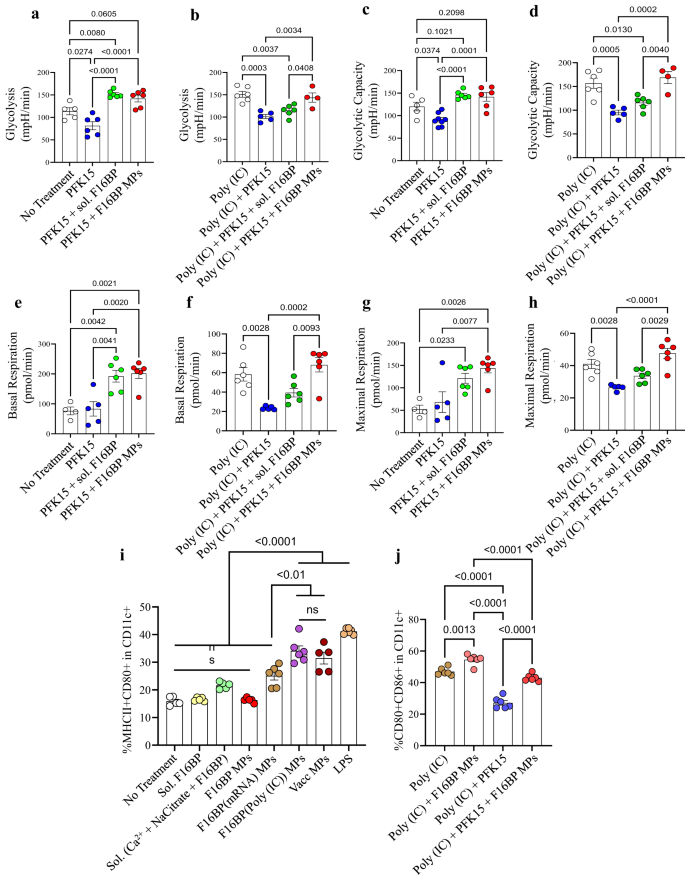
Vervolgens werd het vermogen van de F16BP-parlementsleden om glycolyse in DC's te redden in aanwezigheid van glycolytische remmer PFK15 getest met behulp van extracellulaire fluxtesten. DC's werden gekweekt met PFK15, F16BP MP's, oplosbaar fructose-6-fosfaat (F6P-stroomopwaarts van PFKFB3) of PFK15 + F16BP MP's, of individuele componenten van de F16BP MP's gedurende 2 uur, en extracellulaire verzuringssnelheid (ECAR – de snelheid van glycolyse) metingen werden verkregen. Er werd waargenomen dat PFK15 de glycolyse en glycolytische capaciteit bracht (y-axis-ECAR) lager dan de controle zonder behandeling (Fig. 2a-d; S5). Belangrijk is dat de glycolyse en de glycolytische capaciteit significant hoger waren in F16BP-MPs, zelfs in de aanwezigheid van de PFK15, vergeleken met de PFK15-controle alleen (Fig. 2a-d). Ook in aanwezigheid van poly(IC) (een activeringsmiddel voor DC's)24PFK15 verminderde de glycolyse en de glycolytische capaciteit, en de F16BP-parlementsleden waren in staat deze afname te redden, zelfs in de aanwezigheid van PFK15 (Fig. 2e-u). Over het geheel genomen suggereren deze gegevens dat de fagocytoseerbare F16BP-MP's in staat waren de glycolyse in DC's te redden, zelfs in de aanwezigheid van glycolytische remmer PFK15, en dus kunnen worden gebruikt voor immuuntherapieën waarbij de glycolyseroute van kankercellen is gericht. Dit is belangrijk omdat DC's onder omstandigheden van ontsteking verhoogde niveaus van glycolyse moeten uitvoeren om de productie van inflammatoire eiwitten te ondersteunen11,25.
a-d DC's behandeld met F16BP-MP's redden de glycolyse en glycolytische capaciteit van glycolytische remming (PFK15), in vitro (n = 6; One-way ANOVA Tukey's test), e-h DC's behandeld met F16BP MP's versnellen de basale en maximale ademhaling, zelfs onder glycolytische remming (PFK15), in vitro (n = 6; One-way ANOVA Tukey-test). i Vaccindeeltjes induceerden een significant hogere frequentie van MHCII + CD86+ in CD11c+ DCs in vergelijking met de individuele componentcontroles van de MPs (n = 6; One-way ANOVA Tukey-test). j F16BP-parlementsleden waren in staat de activering van DC’s te redden, zelfs in de aanwezigheid van PFK15 (PFK15-conc. = 25 µM) (n = 6; One-way ANOVA Tukey-test). Gegevens weergegeven als gemiddelde ± std-fout.
F16BP-microdeeltjes redden de activering van DC's in vitro
Om te testen of F16BP-MP’s de functie van DC’s kunnen moduleren, werden op mRNA en peptiden gebaseerde vaccin-F16BP-MP’s geformuleerd. Deze vaccins werden gegenereerd door het intercaleren van gedifosforyleerd melanoompeptide-antigeen Tyrosine-gerelateerd eiwit 2 (pTRP2), en poly(IC) en mRNA afgeleid van melanoomcellen, die verschillende fosfaatgroepen in hun ruggengraat bevatten (Fig. S6). Omdat pTRP2p en poly(IC) fosfaatgroepen hebben, kunnen deze moleculen in de F16BP-MP's worden opgenomen met behulp van de calciumfosfaatchemie. Er werd bepaald dat de hoeveelheid pTRp2 en poly(IC) die in de F16BP-MP's was opgenomen respectievelijk 78 ± 3.4 en 50.9 ± 7.9 µg was. Vervolgens werden F16BP-MP's geïntercaleerd met poly (IC) en pTRP2 overnacht geïncubeerd met DC's, en flowcytometrie werd gebruikt om te testen of deze deeltjes DC's konden activeren (Fig. 2i, j). Er werd waargenomen dat de vaccindeeltjes een significant hogere frequentie van MHCII + CD86+ in CD11c+ DCs induceerden in vergelijking met de individuele componentcontroles van de MPs (Fig. 2i). Bovendien werd waargenomen dat PFK15 de activering van DC's (CD80 + CD86+ in CD11c + ) kon verminderen, zelfs in de aanwezigheid van poly(IC), en dat F16BP-parlementsleden de activering van DC's konden redden, zelfs in de aanwezigheid van PFK15. (Afb. 2j). Ook leidden calciumionen in de concentratie die aan de DCs werden toegevoegd als de F16BP MPs, niet tot veranderingen in het activeringsprofiel (MHCII + CD80+ in CD11c + ) van DCs (Fig. S5). Deze gegevens geven aan dat de op F16BP gebaseerde vaccin-parlementsleden DC-activatie kunnen redden, zelfs in de aanwezigheid van PFK15, wat belangrijk is als in vivo kankervaccinreacties moeten worden gegenereerd in de aanwezigheid van glycolyse-remming.
Om verder te analyseren of DC's behandeld met F16BP MP-formuleringen de T-celreacties moduleren, werd een syngene gemengde lymfocytreactie (MLR) uitgevoerd. C57BL/6j-beenmerg-afgeleide DC's werden onder verschillende omstandigheden behandeld (Fig. S7) gedurende 2 uur en vervolgens gedurende 57 uur gekweekt met T-cellen geïsoleerd uit C6BL/60j-muizen. De cellen werden vervolgens gekleurd tegen CD4, CD8, CD44, Tbet, RORɣT, GATA3, CD25 en Foxp3 en geanalyseerd met behulp van flowcytometrie. Er werd waargenomen dat de F16BP-parlementsleden, F16BP(pTRP2), F16BP(poly(IC), F16BP(pTRP2+poly(IC)), PFK15 + F16BP-parlementsleden en PFK15 + F16BP(pTRP2+poly(IC)) allemaal aanzienlijk werden opgereguleerd de frequentie van geactiveerde Th1-, geactiveerde Th17- en geactiveerde Tc1-cellen, terwijl tegelijkertijd de frequentie van Th2, Tregs en geactiveerde Th2 wordt verlaagd (Fig. S7). Interessant genoeg werd waargenomen dat de behandeling van DC's met F16BP-MP's leidde tot de grootste veranderingen in de polarisatie en activering van T-cellen. Deze waargenomen verandering was zelfs aanwezig in de aanwezigheid van adjuvans poly(IC) of het antigeen pTRP2. Bovendien induceerden oplosbaar F16BP en de componenten ervan toegevoegd aan de DC's een aanzienlijk lagere frequentie van geactiveerde Th1, Tc1 en Th17 in vergelijking met F16BP MP's in alle mogelijke combinaties. Deze gegevens suggereren dat de aanwezigheid van deeltjes belangrijk was voor het scheeftrekken van pro-inflammatoire T-celfrequenties in een MLR-reactie.
F16BP-vaccins met glycolytische remmers genereren robuuste antitumorreacties
Om te testen of de immunometabolisme-modulerende aanpak van het redden van glycolyse in de aanwezigheid van glycolytische remmers en het genereren van immuuntherapieën tegen kankervaccins werd gekozen, werden zeer agressieve vormen van melanoommuismodellen gekozen. Specifiek werden vaccin-MP's subcutaan geïnjecteerd in muizen die YUMM1.1 bevatten (muizen BRAFv600e mutatie vergelijkbaar met mensen) melanoomtumoren, en hun vermogen om de tumorgroei te verminderen en aangeboren en adaptieve immuunresponsen te moduleren werd getest.
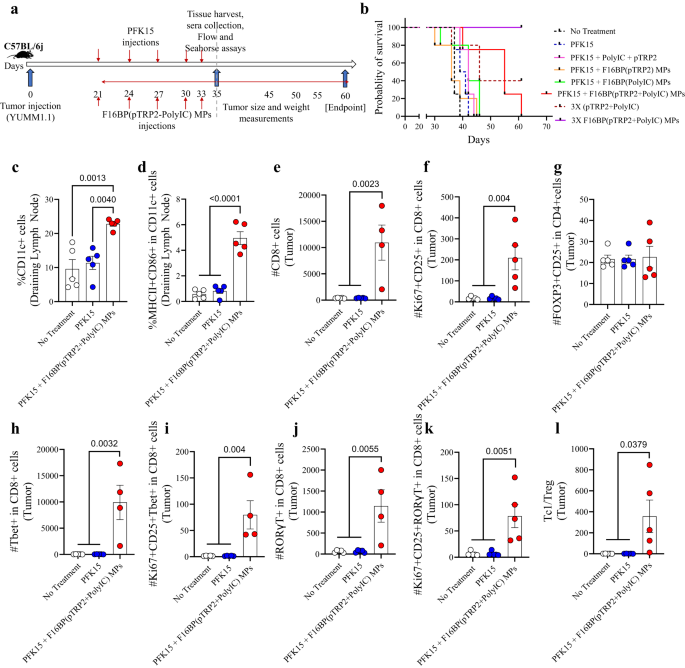
In dit melanoommodel 0.75 × 106 YUMM1.1-cellen werden subcutaan geïnjecteerd in C57BL/6j-immuuncompetente muizen, en PFK15 werd elke andere dag geïnjecteerd gedurende de duur van het onderzoek. Bovendien werd F16BP(pTRP2+poly(IC)) subcutaan geïnjecteerd op dezelfde dagen als de PFK15-injecties (Fig. 3a). In vitro werd vastgesteld dat PFK15 effectief was bij het voorkomen van de proliferatie van YUMM1.1-kankercellen (Fig. S8). Er werd waargenomen dat de behandelingsgroep met PFK15 + vaccin-MP’s leidde tot een significant verhoogde overleving van muizen (dag 60 – eindpunt) en langzamere tumorgroei in vergelijking met alle verschillende controles (Fig. 3b; S9). Deze toename in overleving bij de vaccin-MP’s ging gepaard met een toename van de DC-populatie en geactiveerde DC-populatie in de drainerende inguinale lymfeklieren op dag 35, wat suggereert dat de vaccin-MP’s in staat waren de aangeboren immuunresponsen te moduleren (Fig. 3c, d). F16BP was essentieel bij het genereren van antitumorreacties bij muizen, omdat muizen zonder F16BP niet langer dan dag 45 overleefden. Bovendien was driemaal de dosering van F3BP (pTPR16+ poly IC) parlementsleden zonder PFK2 in staat bestaande tumoren teniet te doen, die pas werden gedetecteerd dag 15 (afb. 3b; S9). Bovendien werd ook gevonden dat het poly(IC) en pTRP2 moesten worden opgenomen in de F16BP-MP's, en dat de injecties van F16BP-MP's met oplosbaar (poly(IC) + pTRP2) de tumorgroei bij muizen niet verminderden (Fig. S9). F16BP-MP’s zouden op zichzelf de glycolyse in verschillende cellen van muizen kunnen versnellen, zoals in vitro werd waargenomen in DC’s. Deze versnelling van de glycolyse zou er vervolgens voor kunnen zorgen dat de immuunrespons zich richt op antitumorreacties. Deze controle werd echter niet getest bij muizen en is een beperking van deze studie. Binnen de tumor werden geen significante verschillen waargenomen in het aantal CD4+ T-cellen van verschillende behandelingsgroepen; er was echter een significante toename in de prolifererende en geactiveerde CD4+-cellen bij muizen behandeld met vaccin-MP's in vergelijking met de andere behandelingsgroepen (Fig. S10a). Bovendien werden er geen significante verschillen waargenomen in het aantal T-helper type 1 (Th1) en geactiveerde en prolifererende Th1-cellen; een significante toename van T-helper type 17 (Th17) en geactiveerde en prolifererende Th17-cellen werd waargenomen bij muizen behandeld met vaccin-MP's in vergelijking met andere behandelingsgroepen (Fig. S10a). Er werd ook waargenomen dat wanneer muizen werden behandeld met PFK15 en met oplosbaar pTRP2 en oplosbaar poly (IC) zonder F16BP, dit leidde tot verhoogde niveaus van geactiveerde DC's, vergeleken met een controle zonder behandeling. DC's werden echter niet gemoduleerd in andere gevallen. organen (afb. S10b). Bovendien moduleerde de formulering zonder F16BP geen pro-inflammatoire T-celreacties in vergelijking met de controle zonder behandeling (Fig. S10c). Deze gegevens suggereren dat F16BP nodig was in de formulering om pro-inflammatoire T-celreacties te genereren. Bovendien was er binnen de tumor een significante toename van het aantal CD8+ T-cellen en prolifererende en geactiveerde CD8+ T-cellen bij muizen behandeld met vaccin-MP’s, vergeleken met andere behandelingsgroepen, wat wijst op een afname van de tumorgroeikinetiek bij muizen behandeld met vaccin-MP’s. Reacties van vaccin-parlementsleden (Fig. 3e, f). Er werden geen significante verschillen waargenomen in regulerende T-cellen in de verschillende behandelingsgroepen (Fig. 3g). Bovendien was er een significante toename in het aantal Tc1-, Tc17- en prolifererende en geactiveerde Tc1- en Tc17-cellen bij muizen behandeld met vaccin-MP's in vergelijking met andere behandelingsgroepen (Fig. 3u – k). Ook werd een significante toename van de Tc1/Treg-verhouding waargenomen bij muizen die werden behandeld met vaccin-MP's in vergelijking met andere behandelingsgroepen (Fig. 3l). Deze gegevens tonen aan dat de vaccin-parlementsleden in staat waren robuuste pro-inflammatoire adaptieve immuunreacties in de tumor te genereren.
a Schematische weergave van subcutane injectie van Vacc-parlementsleden, in vivo, b Kaplan-Meir-curve die een significant hogere overleving aantoont van muizen behandeld met Vacc-parlementsleden, c, d Muizen behandeld met Vacc-MP's hadden een significant hoger percentage van het totaal, evenals geactiveerde DC's in de drainerende lymfe (n = 5; One-way ANOVA Tukey-test), e, f Muizen behandeld met Vacc-MP's hadden een significant hoger aantal Tc en geactiveerde en prolifererende Tc in vergelijking met andere behandelingsgroepen (n = 4 of 5; One-way ANOVA Tukey-test), g Er werden geen significante verschillen in het aantal Tregs waargenomen tussen de behandelingsgroepen (n = 5; One-way ANOVA Tukey-test), h-k Muizen behandeld met Vacc-MP's hadden een significant hoger aantal Tc-, Tc1-, geactiveerde en prolifererende Tc1- en Tc17-cellen (n = 4; One-way ANOVA Tukey-test), l Een significant hogere Tc1/Treg-ratio werd waargenomen bij muizen behandeld met Vacc-MP's in vergelijking met de controlegroepen (n = 4; One-way ANOVA Tukey-test). Gegevens weergegeven als gemiddelde ± std-fout.
F16BP-vaccins behouden de metabolische functie van DC- en T-cellen in vivo
Om te testen of de DC's of T-cellen hun metabolische functie na behandeling behouden, werden muizen met tumoren geëuthanaseerd en werden de cellen uit tumoren, milt en inguinale LN's geïsoleerd. Deze cellen werden vervolgens gekweekt met 2NBDG en de stroom werd gebruikt om de opname van 2NBDG te bepalen die het niveau van glycolyse vertegenwoordigde. Er werd waargenomen dat in de tumor de gMFI van 2NBDG in CD80+ DCs en macrofagen significant hoger was in PFK15 + F16BP(polyIC) MPs in vergelijking met alleen PFK15 condities, maar deze waren niet significant verschillend van de controle zonder behandeling (Fig. S11a-g). In de milt was de gMFI van 2NBDG in DCs, CD80+ DCs, maar niet in CD206+ DCs, significant hoger in met PFK15 + F16BP(polyIC) MPs behandelde muizen in vergelijking met alle controles (Fig. S11h-j). Deze trends waren omgekeerd in macrofagen geïsoleerd uit de milt van met PFK15 + F16BP (polyIC) MPs behandelde muizen in vergelijking met alle controles (Fig. S11k–m). Deze gegevens suggereren dat de MP's systemisch de glycolyse van DC's en macrofagen differentieel moduleerden. In de inguinale LNs werd gMFI van 2NBDG ook opgereguleerd in geactiveerde CD80+ DCs en CD206+ DCs (Fig. S11n-s). De 2NBDG-test toonde dus aan dat de DC- en macrofaagglycolyse nog steeds gehandhaafd bleef in een tumor, milt en in drainerende inguinale LN's. Een soortgelijk onderzoek werd uitgevoerd voor adaptieve T-cellen om de glycolytische plasticiteit in deze cellen te begrijpen. Er werd met name waargenomen dat uit de tumor geïsoleerde CD45-cellen een significant lagere 2NBDG gMFI hadden in met PFK15, PFK15+ oplosbare F16BP + oplosbare poly(IC) en PFK15 + F16BP(polyIC) MP's behandelde muizen vergeleken met de controlegroep van muizen zonder behandeling. (Afb. S12a). Deze gegevens suggereren dat de MP's of oplosbare delen van de MP's niet in staat waren om de glycolyse van niet-immuuncellen substantieel te moduleren of dat deze cellen een hoger niveau van metabolische plasticiteit hebben in vergelijking met immuuncellen. Bovendien was gMFI van 2NBDG in T-helpercellen in de tumor niet significant verschillend in PFK15 + F16BP (polyIC) MPs in vergelijking met de controle zonder behandeling, en deze twee omstandigheden waren significant hoger dan de andere controles (Fig. S12b). De gMFI van 2NBDG in CD8+ T-cellen in de tumor was niet significant verschillend in PFK15+F16BP(polyIC) MPs in vergelijking met de controle zonder behandeling (Fig. S12c), maar was hoger dan de toestand van PFK15+ oplosbaar F16BP + oplosbaar poly(IC). In de milt werden geen significante verschillen waargenomen in CD4+ T-cellen, maar CD8+ T-cellen hadden hogere 2NBDG gMFI vergeleken met de controles in met PFK15 + F16BP(polyIC) MPs behandelde muizen, maar niet anders dan de controle zonder behandeling. (Afb. S12d, bijv). Ook hadden in de inguinale lymfeklieren met PFK15 + F16BP (polyIC) MPs behandelde muizen de 2NBDG gMFI verlaagd in vergelijking met de controle zonder behandeling (Fig. S12f, gr). De T-cel 2NBDG-test suggereert dat in de tumor zowel CD4+ als CD8+ T-cellen hun glycolyse behouden, zelfs na ex vivo kweek, en dus in vivo antitumorreacties kunnen ondersteunen. Over het geheel genomen toonden deze gegevens aan dat de vaccin-parlementariërs die F16BP afleveren en DC’s kunnen redden, in staat waren robuuste immuunreacties te genereren tegen een agressieve vorm van melanoomtumoren.
F16BP redt adoptief overgedragen DC-metabolisme bij muizen
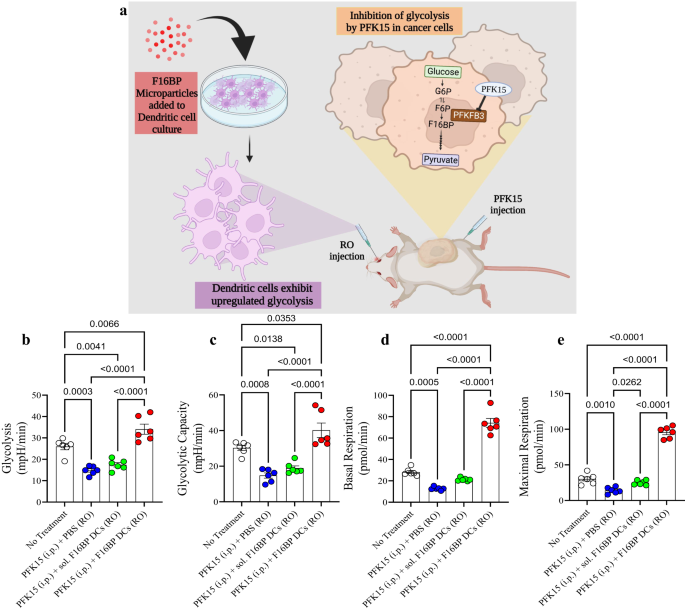
Naast de subcutane vaccinstrategie is adoptieve overdracht van DC's getest in klinieken voor de behandeling van prostaatkanker26,27,28. Deze strategieën zijn in klinieken echter niet erg succesvol geweest, deels vanwege hun lage werkzaamheid bij het verbeteren van de overleving. Om de veelzijdigheid van het F16BP-PFK15-systeem te testen, werd een ander agressief B16F10-melanoommodel gekozen en werd het vermogen van adoptieve overdracht van DC's geladen met de MP's gebruikt als behandelingsmodaliteit (Fig. 4a). In dit model werden DC's geladen met F16BP-MP's geïntercaleerd met mRNA geïsoleerd uit B16F10-kankercellen en poly (IC) (Vacc DC's) en adoptief overgebracht in muizen die B16F10-tumoren bevatten. Het vermogen van deze cellulaire therapie om adaptieve immuunreacties te moduleren, de tumorgroei te verminderen en de overleving te verbeteren, werd gemeten.
a Schematische weergave van het gebruikte adoptieve cellulaire therapiemodel. b, c Muizen geïnjecteerd met adoptief overgedragen DC's samen met F16BP-MP's waren in vivo in staat om de glycolyse en glycolytische capaciteit te redden van glycolytische remming (PFK15).n = 6; One-way ANOVA Tukey-test), d, e Muizen geïnjecteerd met adoptief overgedragen DC's samen met F16BP-MP's versnelden de basale en maximale ademhaling, zelfs onder glycolytische remming (PFK15), in vivo (n = 6; One-way ANOVA Tukey-test). Gegevens weergegeven als gemiddelde ± std-fout.
Om te testen of de F16BP-MP's (zonder poly(IC) of mRNA) DC's in vivo kunnen redden, werden F16BP-MP's eerst in DC's geladen door deze deeltjes gedurende 2 uur met DC's te incuberen. Vervolgens werden deze DC's adoptief intraveneus overgebracht in muizen en werd PFK15 intraperitoneaal geïnjecteerd. DC's werden uit de milt geïsoleerd en op deze cellen werden extracellulaire fluxtesten uitgevoerd. Er wordt verwacht dat deze uit de milt geïsoleerde DC's een mengsel zullen zijn van zowel endogene milt-DC's als adoptief overgedragen DC's. Er werd waargenomen dat de F16BP-MP’s in staat waren de glycolyse en de glycolytische capaciteit van DC’s te redden, zoals waargenomen door de verhoogde ECAR-waarden in de aanwezigheid van PFK15 in vergelijking met de controles (Fig. 4b, c). Bovendien waren F16BP-parlementsleden ook in staat om de basale en maximale ademhaling van DCs te redden in de aanwezigheid van PFK15, vergeleken met de controles (Fig. 4d, e). Deze gegevens toonden aan dat deze deeltjes niet alleen de glycolyse en de mitochondriale ademhaling in deze cellen in vitro maar ook in vivo kunnen redden, en dus mogelijk functionele immunotherapeutische reacties kunnen genereren.
Metabolische redding van DC's genereert robuuste adoptieve celimmunotherapie
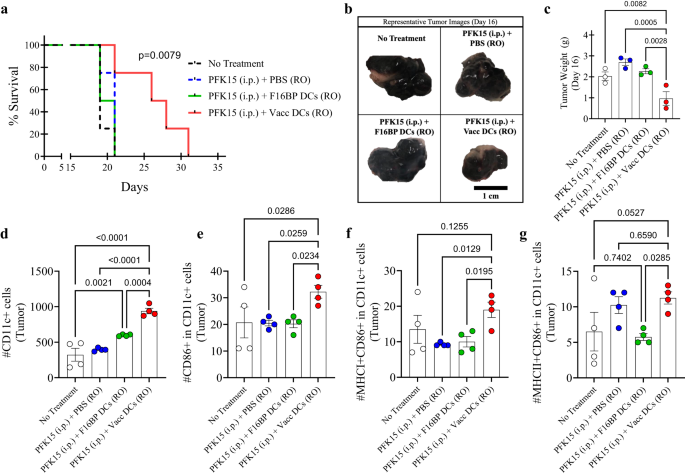
Om te testen of de metabolische redding in DC’s kan worden toegepast op adoptieve celtherapie, werd de adoptieve overdracht van DC-vaccins getest bij muizen (Fig. S13). Ten eerste werd in vitro vastgesteld dat PFK15 effectief was bij het voorkomen van de proliferatie van B16F10-kankercellen (Fig. S14). Concreet: 0.75 × 106 B16F10-cellen werden geïnjecteerd in C57BL/6j-immuuncompetente muizen, en PFK15 werd elke andere dag geïnjecteerd gedurende de duur van het onderzoek (Fig. S13). Bovendien werden ex vivo DC's geladen met F16BP (mRNA + poly (IC)) (Vacc DC's) of DC's geladen met F16BP MP's adoptief overgebracht met behulp van retro-orbitale injecties (RO) op dagen 6 en 19 (Fig. S13). Er werd waargenomen dat de overleving van muizen die Vacc DCs + PFK15 kregen dramatisch toenam in vergelijking met alle controles, en dat de tumor langzamer groeide bij muizen die Vacc DCs kregen in vergelijking met de controles (Fig. 5a; S15). Deze gegevens werden verder bevestigd door tumorgewichten en beelden die werden verkregen halverwege het onderzoek op dag 16 (Fig. 5b, c). Deze gegevens geven aan dat er na slechts twee injecties met Vacc DC's een robuuste reactie tegen de tumor was, die vervolgens de tumorgroei bij muizen verminderde.
a Kaplan-Meir-curve die een significant hogere overleving aantoont van muizen die werden behandeld met adoptief overgedragen Vacc-parlementsleden (n = 10, p <0.001), b Representatieve tumorbeelden van verschillende behandelingsgroepen op dag 16. c Muizen behandeld met adoptief overgedragen Vacc DCs hadden significant lagere tumorgewichten in vergelijking met andere behandelingsgroepen, in vivo (n = 3; One-way ANOVA Tukey-test). d, e Er werden significant hogere totale, evenals geactiveerde DC’s waargenomen bij muizen die werden behandeld met adoptief overgedragen Vacc DC’s in vergelijking met andere behandelingsgroepen, in vivo (n = 4; One-way ANOVA Tukey-test). f Er werden significant hogere MHCI+ geactiveerde DC’s waargenomen bij muizen die werden behandeld met adoptief overgedragen Vacc DC’s in vergelijking met andere behandelingsgroepen, in vivo (n = 4; One-way ANOVA Tukey-test). g Er werden significant hogere door MHCII+ geactiveerde DC’s waargenomen bij muizen die werden behandeld met adoptief overgedragen Vacc DC’s in vergelijking met F16BP DC’s, in vivo (n = 4; One-way ANOVA Tukey-test). Gegevens weergegeven als gemiddelde ± std-fout.
Om vervolgens te testen of de Vacc DC's de immuunresponsen na hun toediening konden moduleren, werden op dag 16 de milt, lymfeklieren en tumoren geïsoleerd uit verschillende omstandigheden en gekleurd op het activeringsprofiel van DC's en T-cellen. Er werd waargenomen dat het totale aantal DC's en geactiveerde DC's in tumoren voor Vacc DC's significant hoger was in vergelijking met alle controles (Fig. 5d, e). Bovendien hebben Vacc DC's ook het aantal DC's die MHCI + CD86 + CD11c+ waren in de tumor opgereguleerd in vergelijking met andere behandelingsgroepen, wat suggereert dat de Vacc DC's de activering van DC's in vivo ondersteunen (Fig. 5f). Ook verhoogden Vacc DC's het aantal DC's die MHCII + CD86 + CD11c+ waren in de tumor in vergelijking met adoptief overgedragen F16BP DC's, wat suggereert dat de Vacc DC's in vivo naar MHCII-geassocieerde reacties neigen (Fig. 5g). Deze gegevens geven aan dat glycolyse nodig kan zijn voor potentiële infiltratie van de DC's in de milt en de tumor, en F16BP MP's bieden DC's de mogelijkheid om glycolyse te laten plaatsvinden.
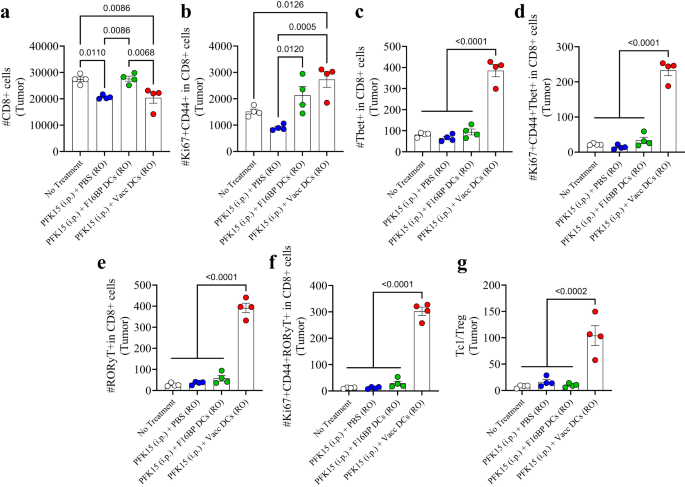
De adaptieve T-celreacties in de tumor waren scheef in de richting van pro-inflammatoire reacties (Fig. 6a-g; S16). Er werd waargenomen dat behandeling met PFK15 alleen het totale aantal CD8+ T-cellen in de tumor significant verminderde, en dat DCs geladen met F16BP in staat waren dit aantal gelijk te brengen aan de controle zonder behandeling (Fig. 6a). Binnen deze aantallen CD8+ T-cellen werd waargenomen dat er een 2-3-voudige toename was in geactiveerde en prolifererende (Ki67+CD44+ in CD8+) T-cellen in de tumor in de Vacc DC-groep in vergelijking met de controlegroepen (Fig. 6b). Bovendien was er een viervoudige significante toename van cytotoxisch Tbet+ in CD4+ T-cellen (Tc8) in de Vacc DCs-groep vergeleken met alle andere groepen (Fig. 6c). Bovendien was het aantal geactiveerde en prolifererende Tc1-cellen> 10 maal hoger in de Vacc DCs-groep in vergelijking met alle andere behandelingsomstandigheden (Fig. 6d). Op vergelijkbare wijze was het aantal Tc17-cellen (RORγt+ in CD8+) en geactiveerde en prolifererende Tc17 (RORγt+Ki67+CD44+ in CD8+), die naar voren komen als belangrijke pro-inflammatoire celtypen die kankerceldood veroorzaken, ook >10- aanzienlijk hoger vouwen dan de controles in de tumoren (Fig. 6e, f). Naast de Tc-populaties leidden Vacc DC's ook tot een afname van het aantal T-helpercellen (Th), geactiveerde en prolifererende Th-cellen, Th1 (Tbet+ in CD4+), Th2 (GATA3+ in CD4+), geactiveerde en prolifererende Th1 (Tbet+CD44+Ki67+ in CD4+), en geactiveerde en prolifererende Th2-cellen (GATA3+CD44+Ki67+ in CD4+) nummers in de Vacc DC-groep (Fig. S16). Er was een significante afname in het aantal Treg (CD25+Foxp3+ in CD4+) in de tumor bij muizen behandeld met Vacc DCs vergeleken met onbehandelde muizen (Fig. S16). Bovendien was er een significante toename van de Th17- (RORγt+ in CD4+) en geactiveerde en prolifererende Th17-cellen (RORγt+Ki67+CD44+ in CD4+) in de tumor in de met Vacc DC behandelde muizen vergeleken met alle andere groepen (Fig. . S16). Bovendien was de verhouding tussen Tc1 en Treg-cellen 5-10 keer hoger in de tumor van de met Vacc DC behandelde muizen in vergelijking met de controles (Fig. 6g). Deze gegevens suggereren dat de Vacc DC's in staat waren een robuuste adaptieve immuunrespons tegen de tumoren te induceren, die voornamelijk zou kunnen worden veroorzaakt door toenames in Tc1- en Tc17-celpopulaties.
a, b Een significante modulatie van zowel de totale (CD8+) als de geactiveerde en prolifererende (Ki67+CD44+ in CD8+) cytotoxische T-cellen werd waargenomen bij muizen die werden behandeld met adoptief overgedragen Vacc DC’s, vergeleken met andere behandelingsgroepen, in vivo (n = 4; One-way ANOVA Tukey-test). c-f Aanzienlijk hogere totale Tc1 (Tbet+ in CD8+), geactiveerde en prolifererende Tc1 (Tbet+Ki67+CD44+ in CD8+), totale Tc17 (RORɣT+ in CD8+), geactiveerde en prolifererende Tc17 (RORɣT+Ki67+CD44+ in CD8+) werden waargenomen bij muizen behandeld met met adoptief overgedragen Vacc DC's in vergelijking met andere behandelingsgroepen, in vivo (n = 4; One-way ANOVA Tukey-test). g Een significant hogere verhouding van cytotoxische tot regulerende T-cellen (Tc1/Treg) werd waargenomen bij muizen die werden behandeld met adoptief overgedragen Vacc DC's in vergelijking met andere behandelingsgroepen, in vivo (n = 4; One-way ANOVA Tukey-test). Gegevens weergegeven als gemiddelde ± std-fout.
Omdat Vacc DC's systemisch worden toegediend, werden de milt- en cervicale lymfeklieren ook geanalyseerd op de veranderingen in aangeboren en adaptieve immuunresponsen (Fig. S17-S20). Met name de totale frequentie van DCs (CD11c+) en geactiveerde DCs (MHCII+CD86+ in CD11c+, MHCI+CD86+ in CD11c+, CD86+ in CD11c+, MHCI+ in CD11c+, MHCII+ in CD11c+) was significant hoger in de milt vergeleken met de controles; dit verschil werd echter niet waargenomen in de cervicale lymfeklieren (Fig. S17 en S18). Deze bevindingen suggereren dat de adoptieve overdracht van DC's voornamelijk immuunreacties genereert door de aangeboren immuunreacties in de milt te moduleren. In tegenstelling tot de tumor werd waargenomen dat er in de milt significante afnames waren in de Th17-frequentie in Vacc DC-groepen in vergelijking met alle controles (Fig. S19), significante stijgingen van de Th2-frequentie in vergelijking met alle bedieningselementen (Fig. S19), en een significante afname van de Tc17-frequentie in vergelijking met PFK15 alleen, en PFK15 + F16BP DCs-controles (Fig. S20). Deze bevindingen geven aan dat, hoewel de Vacc DC's systemisch werden toegediend, de pro-inflammatoire adaptieve immuunresponsen voornamelijk in de tumor werden aangetroffen en niet in de milt. Bovendien behielden de Vacc DC's geïsoleerd uit de milt van muizen ook hogere ECAR en OCR in vergelijking met de controles (Fig. S21). Om te testen of de F16BP-component van de formulering belangrijk is voor het genereren van aangeboren en adaptieve immuunreacties, werden DC's geladen met oplosbaar mRNA + oplosbaar poly (IC) retro-orbitaal in muizen geïnjecteerd en de aangeboren en adaptieve immuunreacties gegenereerd in iLN, milt en tumoren werden getest en vergeleken met de controlegroep zonder behandeling. Er werd waargenomen dat voor het verhogen van pro-inflammatoire zowel DC's als T-celreacties F16BP geladen in DC's essentieel was, omdat er geen significante verschillen werden waargenomen tussen controles zonder behandeling en DC's geladen met oplosbaar mRNA + oplosbaar poly (IC) in deze organen. (Afb. S22).
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. Automotive / EV's, carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- ChartPrime. Verhoog uw handelsspel met ChartPrime. Toegang hier.
- BlockOffsets. Eigendom voor milieucompensatie moderniseren. Toegang hier.
- Bron: https://www.nature.com/articles/s41467-023-41016-z