17 januari 2024
(Nanowerk Nieuws) Onderzoekers van het Nano Life Science Institute (WPI-NanoLSI), Kanazawa University rapporteren in Nano Letters ("Structurele dynamiek van E6AP E3 ligase HECT-domein en betrokkenheid van flexibele scharnierlus in ubiquitineketensynthesemechanisme") hoe de flexibiliteit van een eiwitscharnier een cruciale rol speelt bij de overdracht van eiwitten in belangrijke celprocessen.
Opvallend beeld: realtime observatie en simulatie van conformationele veranderingen van het E6AP HECT-domein.
Het HECT-domein herhaalt sferische en elliptische conformaties door het flexibele gebied. Uit computersimulatieresultaten blijkt dat de bolvorm overeenkomt met de katalytische structuur en de ovale vorm overeenkomt met de L-vormige structuur. De vormingsefficiëntie van het ubiquitinedimeer (Ub2) verandert aanzienlijk, afhankelijk van de conformationele toestand van het flexibele scharniergebied. Ubiquitinatie – de toevoeging van het eiwit ubiquitine – is een sleutelfase in veel celprocessen, zoals eiwitafbraak, DNA-reparaties en signaaltransductie. Met behulp van snelle atomaire krachtmicroscopie (HS-AFM) en moleculaire modellering hebben onderzoekers onder leiding van Hiroki Konno en Holger Flechsig van WPI-NanoLSI, Kanazawa University geïdentificeerd hoe de mobiliteit van een ubiquitinatie-gerelateerd enzymscharnier ubiquitinatie mogelijk maakt. Eerdere studies hebben een aantal enzymen geïdentificeerd die ubiquitinatie mogelijk maken, waaronder een enzym dat ubiquitine (E1) activeert, een enzym dat het conjugeert (E2) en een enzym dat de verbinding van ubiquitine-eiwit (d.w.z. een ligase, E3) met het doeleiwit katalyseert. Figuur 1).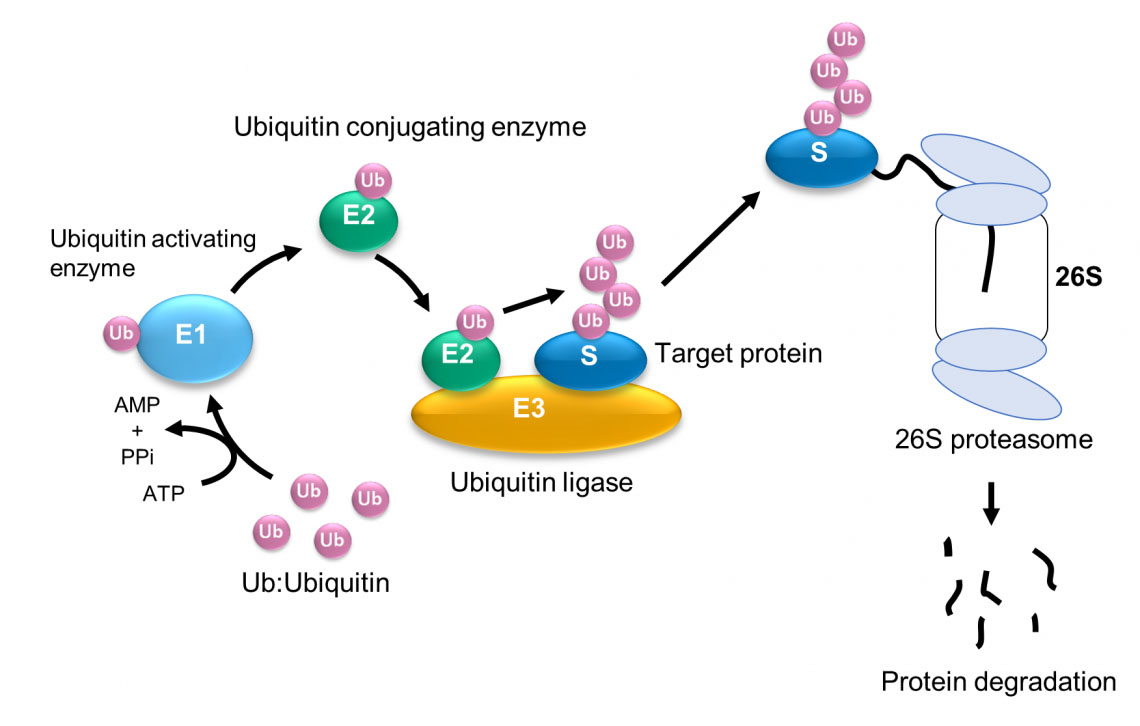 Fig. 1: Ubiquitinatie en afbraak van eiwitten door het ubiquitine-proteasoomsysteem. (© 2023 Takeda)
Het HECT-type E3-ligase wordt gekenmerkt door een HECT-domein dat een N-lob met de E2-bindingsplaats en een C-lob met een katalytisch Cys-residu omvat. Een flexibel scharnier verbindt de twee lobben, wat leidt tot de hypothese dat ubiquitinatie wordt vergemakkelijkt door de herschikking van het eiwit rond dit scharnier. Konno en hun medewerkers zetten hun supersnelle atoomkrachtmicroscoop in om op zoek te gaan naar bewijs dat dit het geval was.
De onderzoekers merkten op dat wanneer het HECT-domein werd gekristalliseerd met een type E2-enzym, het een L-vorm vormde, zodat de afstand tussen het katalytische Cys-residu van het HECT-domein en de katalytische Cys van het E2-enzym 41 Å was – te ver voor de overdracht van ubiquitine. In zijn katalytische conformatie heeft het HECT-domein echter een andere vorm, waarbij de afstand tussen de twee katalytische Cys-residuen veel kleiner is – slechts 8 Å – dus er wordt aangenomen dat dit een “katalytische conformatie” is.
Analyse van HS-AFM-beelden van een wildtype HECT-domein van E6AP onthulde twee conformaties – waarvan er één bolvormig leek en de andere ovaal (Fig. 2). Met behulp van AFM-simulaties schreven ze de ovale vormen toe aan de L-conformatie en bolvormige vormen zijn ofwel de katalytische conformatie of de zogenaamde omgekeerde T-conformatie, die was waargenomen in een ander type HECT-domein waar de afstand tussen de Cys-residuen 16 Å is ( Fig. 2). Om de spatio-temporele resolutiebeperkingen van beeldvorming te overwinnen, werden de experimenten aangevuld met moleculaire modellering om conformationele bewegingen van het HECT-domein op atomistisch niveau te visualiseren. Simulatie-AFM werd gebruikt om een overeenkomstige pseudo-AFM-film te genereren, die duidelijk de verandering van bolvormige naar ovale topografie liet zien (Fig. 2).
Fig. 1: Ubiquitinatie en afbraak van eiwitten door het ubiquitine-proteasoomsysteem. (© 2023 Takeda)
Het HECT-type E3-ligase wordt gekenmerkt door een HECT-domein dat een N-lob met de E2-bindingsplaats en een C-lob met een katalytisch Cys-residu omvat. Een flexibel scharnier verbindt de twee lobben, wat leidt tot de hypothese dat ubiquitinatie wordt vergemakkelijkt door de herschikking van het eiwit rond dit scharnier. Konno en hun medewerkers zetten hun supersnelle atoomkrachtmicroscoop in om op zoek te gaan naar bewijs dat dit het geval was.
De onderzoekers merkten op dat wanneer het HECT-domein werd gekristalliseerd met een type E2-enzym, het een L-vorm vormde, zodat de afstand tussen het katalytische Cys-residu van het HECT-domein en de katalytische Cys van het E2-enzym 41 Å was – te ver voor de overdracht van ubiquitine. In zijn katalytische conformatie heeft het HECT-domein echter een andere vorm, waarbij de afstand tussen de twee katalytische Cys-residuen veel kleiner is – slechts 8 Å – dus er wordt aangenomen dat dit een “katalytische conformatie” is.
Analyse van HS-AFM-beelden van een wildtype HECT-domein van E6AP onthulde twee conformaties – waarvan er één bolvormig leek en de andere ovaal (Fig. 2). Met behulp van AFM-simulaties schreven ze de ovale vormen toe aan de L-conformatie en bolvormige vormen zijn ofwel de katalytische conformatie of de zogenaamde omgekeerde T-conformatie, die was waargenomen in een ander type HECT-domein waar de afstand tussen de Cys-residuen 16 Å is ( Fig. 2). Om de spatio-temporele resolutiebeperkingen van beeldvorming te overwinnen, werden de experimenten aangevuld met moleculaire modellering om conformationele bewegingen van het HECT-domein op atomistisch niveau te visualiseren. Simulatie-AFM werd gebruikt om een overeenkomstige pseudo-AFM-film te genereren, die duidelijk de verandering van bolvormige naar ovale topografie liet zien (Fig. 2).
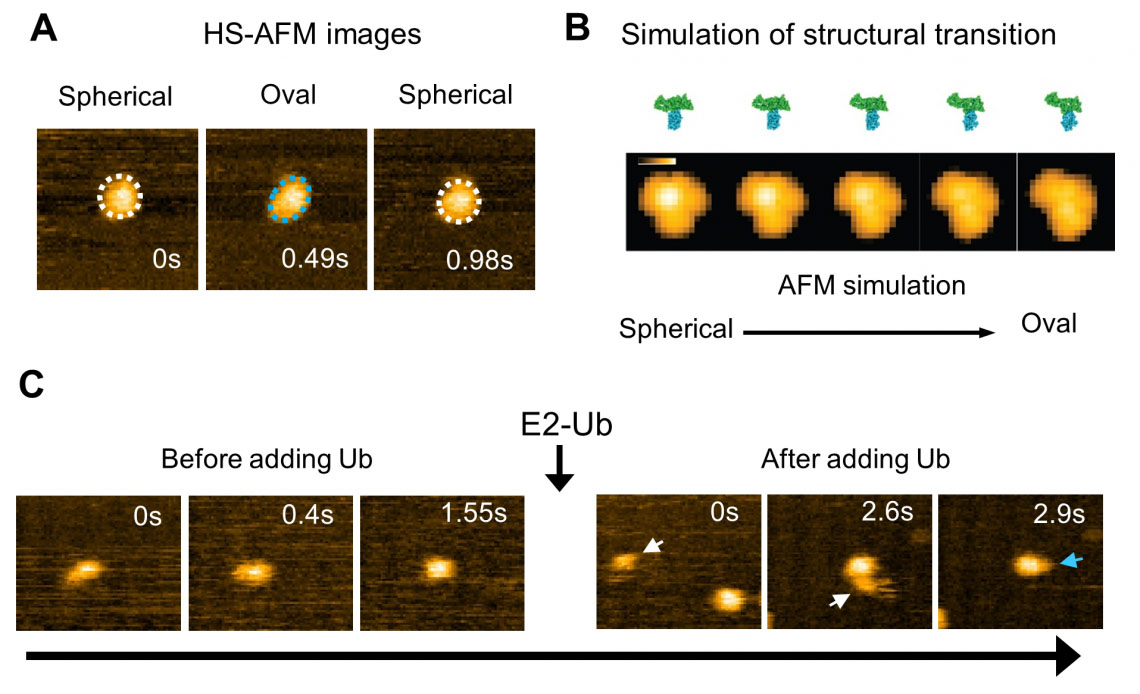 Fig. 2: Snelle AFM-observatie en simulatie van de structurele dynamiek van het HECT-domein van E6AP. (A) HS-AFM-afbeelding van het HECT-domein. Bolvormige (witte stippellijn) en ovale (blauwe stippellijn) conformationele toestanden werden waargenomen. (B) Gesimuleerd overgangsproces van de structurele toestand van het HECT-domein en zijn pseudo-AFM-beeld. (C) Ubiquitine (Ub) wordt overgebracht van E2 naar E3 (HECT-domein). Na de toevoeging van ubiquitine-bevattend E2 (E2-Ub), bindt E2-Ub (witte pijl) aan het HECT-domein, en nadat E2 dissocieert, wordt een klein deeltje (blauwe pijl) dat ubiquitine lijkt te zijn, toegevoegd aan het HECT-domein . (© 2023 Takeda)
“Hoewel experimentele beperkingen ons niet in staat stellen de tussenliggende conformaties op te lossen”, leggen de onderzoekers uit in hun rapport van het werk. “De uitgevoerde modellering levert bewijs dat de overgangen tussen sferische en ovale HECT-domeinvormen waargenomen onder HS-AFM overeenkomen met functionele conformationele bewegingen waaronder de C-lob roteert ten opzichte van de N-lob, waardoor de verandering tussen katalytische en L-vorm mogelijk is. HECT-conformaties.”
Verdere experimenten met mutante HECT-domeinen met minder flexibiliteit in het scharnier onthulden dat er niet tussen conformaties werd gewisseld - de mutante HECT-domeinen waren opgesloten in de katalytische conformatie. Ze ontdekten ook dat deze mutante HECT-domeinen twee ubiquitine-eiwitten efficiënter konden vormen die efficiënter met elkaar verbonden waren dan het wildtype.
E6AP, het HECT-type E3 in deze studie, interageert met E6-eiwit afkomstig van het humaan papillomavirus (HPV) en ubiquitineert p53, een tumorsuppressoreiwit. Het is ook bekend dat de ubiquitinatie van p53 door E6AP en E6 een belangrijke oorzaak is van baarmoederhalskanker. Het mechanisme van p53-ubiquitinatie door de interactie van E6AP- en E6-eiwitten blijft echter onduidelijk. In de toekomst zullen we de structurele dynamiek van E6AP/E6 en het E6AP/E6/p53-complex met HS-AFM ophelderen en verduidelijken hoe E6 de activiteit van p53-ubiquitinatie door E6AP verhoogt.
Fig. 2: Snelle AFM-observatie en simulatie van de structurele dynamiek van het HECT-domein van E6AP. (A) HS-AFM-afbeelding van het HECT-domein. Bolvormige (witte stippellijn) en ovale (blauwe stippellijn) conformationele toestanden werden waargenomen. (B) Gesimuleerd overgangsproces van de structurele toestand van het HECT-domein en zijn pseudo-AFM-beeld. (C) Ubiquitine (Ub) wordt overgebracht van E2 naar E3 (HECT-domein). Na de toevoeging van ubiquitine-bevattend E2 (E2-Ub), bindt E2-Ub (witte pijl) aan het HECT-domein, en nadat E2 dissocieert, wordt een klein deeltje (blauwe pijl) dat ubiquitine lijkt te zijn, toegevoegd aan het HECT-domein . (© 2023 Takeda)
“Hoewel experimentele beperkingen ons niet in staat stellen de tussenliggende conformaties op te lossen”, leggen de onderzoekers uit in hun rapport van het werk. “De uitgevoerde modellering levert bewijs dat de overgangen tussen sferische en ovale HECT-domeinvormen waargenomen onder HS-AFM overeenkomen met functionele conformationele bewegingen waaronder de C-lob roteert ten opzichte van de N-lob, waardoor de verandering tussen katalytische en L-vorm mogelijk is. HECT-conformaties.”
Verdere experimenten met mutante HECT-domeinen met minder flexibiliteit in het scharnier onthulden dat er niet tussen conformaties werd gewisseld - de mutante HECT-domeinen waren opgesloten in de katalytische conformatie. Ze ontdekten ook dat deze mutante HECT-domeinen twee ubiquitine-eiwitten efficiënter konden vormen die efficiënter met elkaar verbonden waren dan het wildtype.
E6AP, het HECT-type E3 in deze studie, interageert met E6-eiwit afkomstig van het humaan papillomavirus (HPV) en ubiquitineert p53, een tumorsuppressoreiwit. Het is ook bekend dat de ubiquitinatie van p53 door E6AP en E6 een belangrijke oorzaak is van baarmoederhalskanker. Het mechanisme van p53-ubiquitinatie door de interactie van E6AP- en E6-eiwitten blijft echter onduidelijk. In de toekomst zullen we de structurele dynamiek van E6AP/E6 en het E6AP/E6/p53-complex met HS-AFM ophelderen en verduidelijken hoe E6 de activiteit van p53-ubiquitinatie door E6AP verhoogt.
Het HECT-domein herhaalt sferische en elliptische conformaties door het flexibele gebied. Uit computersimulatieresultaten blijkt dat de bolvorm overeenkomt met de katalytische structuur en de ovale vorm overeenkomt met de L-vormige structuur. De vormingsefficiëntie van het ubiquitinedimeer (Ub2) verandert aanzienlijk, afhankelijk van de conformationele toestand van het flexibele scharniergebied. Ubiquitinatie – de toevoeging van het eiwit ubiquitine – is een sleutelfase in veel celprocessen, zoals eiwitafbraak, DNA-reparaties en signaaltransductie. Met behulp van snelle atomaire krachtmicroscopie (HS-AFM) en moleculaire modellering hebben onderzoekers onder leiding van Hiroki Konno en Holger Flechsig van WPI-NanoLSI, Kanazawa University geïdentificeerd hoe de mobiliteit van een ubiquitinatie-gerelateerd enzymscharnier ubiquitinatie mogelijk maakt. Eerdere studies hebben een aantal enzymen geïdentificeerd die ubiquitinatie mogelijk maken, waaronder een enzym dat ubiquitine (E1) activeert, een enzym dat het conjugeert (E2) en een enzym dat de verbinding van ubiquitine-eiwit (d.w.z. een ligase, E3) met het doeleiwit katalyseert. Figuur 1).
 Fig. 1: Ubiquitinatie en afbraak van eiwitten door het ubiquitine-proteasoomsysteem. (© 2023 Takeda)
Het HECT-type E3-ligase wordt gekenmerkt door een HECT-domein dat een N-lob met de E2-bindingsplaats en een C-lob met een katalytisch Cys-residu omvat. Een flexibel scharnier verbindt de twee lobben, wat leidt tot de hypothese dat ubiquitinatie wordt vergemakkelijkt door de herschikking van het eiwit rond dit scharnier. Konno en hun medewerkers zetten hun supersnelle atoomkrachtmicroscoop in om op zoek te gaan naar bewijs dat dit het geval was.
De onderzoekers merkten op dat wanneer het HECT-domein werd gekristalliseerd met een type E2-enzym, het een L-vorm vormde, zodat de afstand tussen het katalytische Cys-residu van het HECT-domein en de katalytische Cys van het E2-enzym 41 Å was – te ver voor de overdracht van ubiquitine. In zijn katalytische conformatie heeft het HECT-domein echter een andere vorm, waarbij de afstand tussen de twee katalytische Cys-residuen veel kleiner is – slechts 8 Å – dus er wordt aangenomen dat dit een “katalytische conformatie” is.
Analyse van HS-AFM-beelden van een wildtype HECT-domein van E6AP onthulde twee conformaties – waarvan er één bolvormig leek en de andere ovaal (Fig. 2). Met behulp van AFM-simulaties schreven ze de ovale vormen toe aan de L-conformatie en bolvormige vormen zijn ofwel de katalytische conformatie of de zogenaamde omgekeerde T-conformatie, die was waargenomen in een ander type HECT-domein waar de afstand tussen de Cys-residuen 16 Å is ( Fig. 2). Om de spatio-temporele resolutiebeperkingen van beeldvorming te overwinnen, werden de experimenten aangevuld met moleculaire modellering om conformationele bewegingen van het HECT-domein op atomistisch niveau te visualiseren. Simulatie-AFM werd gebruikt om een overeenkomstige pseudo-AFM-film te genereren, die duidelijk de verandering van bolvormige naar ovale topografie liet zien (Fig. 2).
Fig. 1: Ubiquitinatie en afbraak van eiwitten door het ubiquitine-proteasoomsysteem. (© 2023 Takeda)
Het HECT-type E3-ligase wordt gekenmerkt door een HECT-domein dat een N-lob met de E2-bindingsplaats en een C-lob met een katalytisch Cys-residu omvat. Een flexibel scharnier verbindt de twee lobben, wat leidt tot de hypothese dat ubiquitinatie wordt vergemakkelijkt door de herschikking van het eiwit rond dit scharnier. Konno en hun medewerkers zetten hun supersnelle atoomkrachtmicroscoop in om op zoek te gaan naar bewijs dat dit het geval was.
De onderzoekers merkten op dat wanneer het HECT-domein werd gekristalliseerd met een type E2-enzym, het een L-vorm vormde, zodat de afstand tussen het katalytische Cys-residu van het HECT-domein en de katalytische Cys van het E2-enzym 41 Å was – te ver voor de overdracht van ubiquitine. In zijn katalytische conformatie heeft het HECT-domein echter een andere vorm, waarbij de afstand tussen de twee katalytische Cys-residuen veel kleiner is – slechts 8 Å – dus er wordt aangenomen dat dit een “katalytische conformatie” is.
Analyse van HS-AFM-beelden van een wildtype HECT-domein van E6AP onthulde twee conformaties – waarvan er één bolvormig leek en de andere ovaal (Fig. 2). Met behulp van AFM-simulaties schreven ze de ovale vormen toe aan de L-conformatie en bolvormige vormen zijn ofwel de katalytische conformatie of de zogenaamde omgekeerde T-conformatie, die was waargenomen in een ander type HECT-domein waar de afstand tussen de Cys-residuen 16 Å is ( Fig. 2). Om de spatio-temporele resolutiebeperkingen van beeldvorming te overwinnen, werden de experimenten aangevuld met moleculaire modellering om conformationele bewegingen van het HECT-domein op atomistisch niveau te visualiseren. Simulatie-AFM werd gebruikt om een overeenkomstige pseudo-AFM-film te genereren, die duidelijk de verandering van bolvormige naar ovale topografie liet zien (Fig. 2).
 Fig. 2: Snelle AFM-observatie en simulatie van de structurele dynamiek van het HECT-domein van E6AP. (A) HS-AFM-afbeelding van het HECT-domein. Bolvormige (witte stippellijn) en ovale (blauwe stippellijn) conformationele toestanden werden waargenomen. (B) Gesimuleerd overgangsproces van de structurele toestand van het HECT-domein en zijn pseudo-AFM-beeld. (C) Ubiquitine (Ub) wordt overgebracht van E2 naar E3 (HECT-domein). Na de toevoeging van ubiquitine-bevattend E2 (E2-Ub), bindt E2-Ub (witte pijl) aan het HECT-domein, en nadat E2 dissocieert, wordt een klein deeltje (blauwe pijl) dat ubiquitine lijkt te zijn, toegevoegd aan het HECT-domein . (© 2023 Takeda)
“Hoewel experimentele beperkingen ons niet in staat stellen de tussenliggende conformaties op te lossen”, leggen de onderzoekers uit in hun rapport van het werk. “De uitgevoerde modellering levert bewijs dat de overgangen tussen sferische en ovale HECT-domeinvormen waargenomen onder HS-AFM overeenkomen met functionele conformationele bewegingen waaronder de C-lob roteert ten opzichte van de N-lob, waardoor de verandering tussen katalytische en L-vorm mogelijk is. HECT-conformaties.”
Verdere experimenten met mutante HECT-domeinen met minder flexibiliteit in het scharnier onthulden dat er niet tussen conformaties werd gewisseld - de mutante HECT-domeinen waren opgesloten in de katalytische conformatie. Ze ontdekten ook dat deze mutante HECT-domeinen twee ubiquitine-eiwitten efficiënter konden vormen die efficiënter met elkaar verbonden waren dan het wildtype.
E6AP, het HECT-type E3 in deze studie, interageert met E6-eiwit afkomstig van het humaan papillomavirus (HPV) en ubiquitineert p53, een tumorsuppressoreiwit. Het is ook bekend dat de ubiquitinatie van p53 door E6AP en E6 een belangrijke oorzaak is van baarmoederhalskanker. Het mechanisme van p53-ubiquitinatie door de interactie van E6AP- en E6-eiwitten blijft echter onduidelijk. In de toekomst zullen we de structurele dynamiek van E6AP/E6 en het E6AP/E6/p53-complex met HS-AFM ophelderen en verduidelijken hoe E6 de activiteit van p53-ubiquitinatie door E6AP verhoogt.
Fig. 2: Snelle AFM-observatie en simulatie van de structurele dynamiek van het HECT-domein van E6AP. (A) HS-AFM-afbeelding van het HECT-domein. Bolvormige (witte stippellijn) en ovale (blauwe stippellijn) conformationele toestanden werden waargenomen. (B) Gesimuleerd overgangsproces van de structurele toestand van het HECT-domein en zijn pseudo-AFM-beeld. (C) Ubiquitine (Ub) wordt overgebracht van E2 naar E3 (HECT-domein). Na de toevoeging van ubiquitine-bevattend E2 (E2-Ub), bindt E2-Ub (witte pijl) aan het HECT-domein, en nadat E2 dissocieert, wordt een klein deeltje (blauwe pijl) dat ubiquitine lijkt te zijn, toegevoegd aan het HECT-domein . (© 2023 Takeda)
“Hoewel experimentele beperkingen ons niet in staat stellen de tussenliggende conformaties op te lossen”, leggen de onderzoekers uit in hun rapport van het werk. “De uitgevoerde modellering levert bewijs dat de overgangen tussen sferische en ovale HECT-domeinvormen waargenomen onder HS-AFM overeenkomen met functionele conformationele bewegingen waaronder de C-lob roteert ten opzichte van de N-lob, waardoor de verandering tussen katalytische en L-vorm mogelijk is. HECT-conformaties.”
Verdere experimenten met mutante HECT-domeinen met minder flexibiliteit in het scharnier onthulden dat er niet tussen conformaties werd gewisseld - de mutante HECT-domeinen waren opgesloten in de katalytische conformatie. Ze ontdekten ook dat deze mutante HECT-domeinen twee ubiquitine-eiwitten efficiënter konden vormen die efficiënter met elkaar verbonden waren dan het wildtype.
E6AP, het HECT-type E3 in deze studie, interageert met E6-eiwit afkomstig van het humaan papillomavirus (HPV) en ubiquitineert p53, een tumorsuppressoreiwit. Het is ook bekend dat de ubiquitinatie van p53 door E6AP en E6 een belangrijke oorzaak is van baarmoederhalskanker. Het mechanisme van p53-ubiquitinatie door de interactie van E6AP- en E6-eiwitten blijft echter onduidelijk. In de toekomst zullen we de structurele dynamiek van E6AP/E6 en het E6AP/E6/p53-complex met HS-AFM ophelderen en verduidelijken hoe E6 de activiteit van p53-ubiquitinatie door E6AP verhoogt.
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://www.nanowerk.com/news2/biotech/newsid=64429.php



