Introductie
De ontdekking tijdens het Human Genome Project begin jaren 2000 dat wij mensen slechts ongeveer 20,000 eiwitcoderende genen hebben – ongeveer evenveel als de kleine in de bodem levende nematodenworm, en minder dan de helft zoveel als de rijstplant – kwam als een schok. . Die klap voor onze trots werd echter verzacht door het idee dat het menselijk genoom rijk is aan regulerende verbanden. Onze genen werken samen in een dicht netwerk, waarin stukjes DNA en de moleculen waarvoor ze coderen (RNA en eiwitten) de ‘expressie’ van andere genen controleren, en beïnvloeden of ze hun respectievelijke RNA en eiwitten maken. Om het menselijk genoom te begrijpen, moesten we dit proces van genregulatie begrijpen.
Die taak blijkt echter veel moeilijker te zijn dan het decoderen van de sequentie van het genoom.
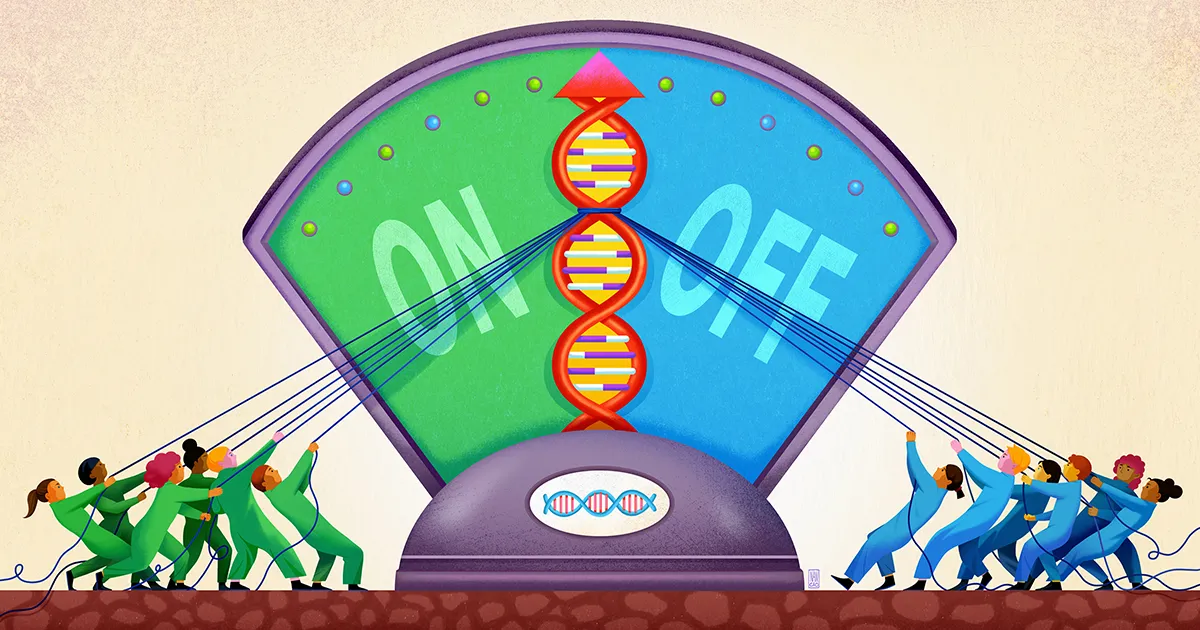
Aanvankelijk werd vermoed dat genregulatie eenvoudigweg een kwestie was van het ene genproduct dat op digitale wijze als aan/uit-schakelaar voor een ander gen fungeerde. In de jaren zestig brachten de Franse biologen François Jacob en Jacques Monod voor het eerst duidelijkheid een genregulerend proces in mechanistisch detail: In Escherichia coli bacteriën, wanneer een repressoreiwit zich aan een bepaald DNA-segment bindt, blokkeert het de transcriptie en translatie van een aangrenzende reeks genen die coderen voor enzymen voor het verteren van de suikerlactose. Dit regelcircuit, dat Monod en Jacob het ‘ meer operon, heeft een nette, transparante logica.
Maar genregulatie bij complexe metazoans – dieren zoals mensen, met complexe eukaryote cellen – lijkt over het algemeen niet op deze manier te werken. In plaats daarvan gaat het om een groep moleculen, waaronder eiwitten, RNA's en stukjes DNA uit het hele chromosoom, die op de een of andere manier samenwerken om de expressie van een gen te controleren.
Het is niet alleen zo dat dit regulerende proces bij eukaryoten meer spelers kent dan doorgaans wordt gezien bij bacteriën en andere eenvoudige, prokaryotische cellen; het lijkt een categorisch ander proces te zijn, en een waziger proces.
Een team van Stanford University, geleid door de biofysicus en bio-ingenieur Polly Fordyce, lijkt nu een onderdeel van deze vage vorm van genregulatie te hebben blootgelegd. Hun werk, afgelopen september gepubliceerd in Wetenschapsuggereert dat het DNA in de buurt van een gen fungeert als een soort ondiepe put waarin diverse regulerende moleculen worden gevangen, waardoor ze gereed blijven voor actie, zodat ze, wanneer dat nodig is, hun stem kunnen geven aan de beslissing over het al dan niet activeren van het gen.
Introductie
Deze regulerende putjes zijn gemaakt van beslist vreemde stukjes DNA. Ze bestaan uit sequenties waarin een kort stuk DNA, van één tot zes basenparen lang, zich vele malen herhaalt. Tientallen kopieën van deze ‘korte tandemherhalingen’ (STR’s) kunnen in deze reeksen aan elkaar worden geregen, als hetzelfde kleine ‘woord’ dat keer op keer wordt geschreven.
STR's zijn overvloedig aanwezig in het menselijk genoom: ze omvatten ongeveer 5% van al ons DNA. Ooit werd gedacht dat ze klassieke voorbeelden van ‘junk’-DNA waren, omdat een zich herhalende DNA-‘tekst’ die alleen uit STR’s bestaat, lang niet zoveel betekenisvolle informatie kan bevatten als bijvoorbeeld de onregelmatige opeenvolging van letters waaruit een zin bestaat. artikel.
En toch zijn STR's duidelijk niet onbelangrijk: ze zijn in verband gebracht met aandoeningen zoals de ziekte van Huntington, spinobulbaire spieratrofie, de ziekte van Crohn en sommige vormen van kanker. De afgelopen decennia is er steeds meer bewijsmateriaal ontstaan dat ze op de een of andere manier de genregulatie kunnen versterken of remmen. Het mysterie was hoe ze zo krachtig konden zijn met zo weinig informatie-inhoud.
Complexe controles voor complexe cellen
Laten we een stapje terug doen om te begrijpen hoe STR's in het grote plaatje van genregulatie passen. Genen worden routinematig geflankeerd door stukjes DNA die niet voor RNA of eiwit coderen, maar regulerende functies hebben. Bacteriële genen hebben ‘promotor’-gebieden waar polymerase-enzymen kunnen binden om de transcriptie van aangrenzend DNA naar RNA te beginnen. Ze hebben ook routinematig ‘operator’-gebieden, waar repressoreiwitten kunnen binden om transcriptie te blokkeren, waardoor een gen wordt uitgeschakeld, zoals in de meer operon.
Bij mensen en andere eukaryoten kunnen de regulerende sequenties talrijker, diverser en verwarrender zijn. Regio's die versterkers worden genoemd, beïnvloeden bijvoorbeeld de waarschijnlijkheid dat een gen wordt getranscribeerd. Enhancers zijn vaak het doelwit van eiwitten die transcriptiefactoren worden genoemd en die kunnen binden om genexpressie te stimuleren of te remmen. Vreemd genoeg zijn sommige versterkers tienduizenden basenparen verwijderd van de genen die ze reguleren, en worden ze alleen dichtbij gebracht door de fysieke herschikking van de DNA-lussen in een gepakt chromosoom.
Eukaryote genregulatie omvat doorgaans deze vele verschillende regulerende DNA-blokken, samen met een of meer transcriptiefactoren en andere moleculen, die zich allemaal rond een gen verzamelen, als een commissie die is bijeengeroepen om te beslissen wat het moet doen. Ze komen samen in een losse, dichte cluster.
Vaak lijken de moleculaire deelnemers ook geen interactie te hebben via de zeer selectieve “slot en sleutel”-combinaties die gebruikelijk zijn in de moleculaire biologie. In plaats daarvan zijn ze veel minder kieskeurig en gaan ze nogal zwak en niet-selectief met elkaar om, alsof ze ronddwalen en korte gesprekken met elkaar beginnen.
Hoe transcriptiefactoren zich binden aan DNA in eukaryoten is eigenlijk een mysterie. Er werd lang aangenomen dat een deel van een transcriptiefactor nauw moest overeenkomen met een bindende ‘motief’-sequentie in het DNA, zoals de stukjes van een legpuzzel. Maar hoewel sommige van dergelijke motieven zijn geïdentificeerd, correleert hun aanwezigheid niet altijd even goed met waar wetenschappers vinden dat transcriptiefactoren aan DNA in cellen blijven kleven. Soms blijven transcriptiefactoren hangen in gebieden zonder motieven, terwijl sommige motieven die transcriptiefactoren sterk zouden moeten binden leeg blijven.
"Traditioneel was het doel in de genomica om genomische sites op een [binaire] manier te classificeren als 'gebonden' of 'ongebonden'" door transcriptiefactoren, zei Fordyce. “Maar het beeld is veel genuanceerder dan dat.” De individuele leden van deze genregulerende “comités” lijken niet altijd aanwezig of afwezig te zijn op hun vergaderingen, maar hebben eerder verschillende kansen om daar wel of niet aanwezig te zijn.
De neiging van genregulatie bij eukaryoten om te vertrouwen op zoveel verschillende zwakke interacties tussen grote moleculaire complexen “is een van de dingen die het notoir moeilijk maken om er theoretisch grip op te krijgen”, aldus de biofysicus. Thomas Kuhlman van de Universiteit van Californië, Riverside, die schreef een commentaar op het papier van het Fordyce-lab voor Wetenschap. Het is een diepgaande puzzel hoe uit dit ogenschijnlijk chaotische proces precieze beslissingen over het in- en uitschakelen van genen voortkomen.
Naast de mysterieuze, vage logica van dat besluitvormingsproces, is er ook de vraag hoe alle commissieleden überhaupt de weg naar de juiste kamer vinden – en daar vervolgens blijven. Moleculen bewegen zich over het algemeen door de cel door diffusie, geteisterd door alle andere omringende moleculen, zoals water, en dwalen in willekeurige richtingen. We zouden kunnen verwachten dat deze losse commissies te snel uiteen zullen vallen om hun regelgevende werk te kunnen doen.
Fordyce en haar collega's denken dat dit is waar de STR's in het spel komen. STR's komen opvallend veel voor op versterkerplaatsen op DNA. In hun artikel beweren de onderzoekers dat de STR's fungeren als plakkerige plekken die transcriptiefactoren bijeenbrengen en voorkomen dat ze afdwalen.
De plakkerigheid verfijnen
De groep van Fordyce onderzocht systematisch hoe verschillen in STR-sequentie het plakken van transcriptiefactoren aan een bindingsmotief beïnvloeden. Ze keken naar twee factoren – één van gist, één van mensen – die vasthouden aan een bepaald motief van zes basen. De onderzoekers maten zowel de sterkte (of affiniteit) van die binding als de snelheid waarmee de transcriptiefactoren vast komen te zitten en loskomen (kinetiek) wanneer het motief wordt geflankeerd door een STR in plaats van een willekeurige reeks. Ter vergelijking keken ze naar hoe gemakkelijk de factoren binden aan de STR alleen en aan een geheel willekeurige DNA-sequentie.
“Een van de grootste uitdagingen op dit gebied is het ontwarren van de talloze variabelen die van invloed zijn op de binding van [transcriptiefactor] op een specifieke positie van het genoom”, zegt David Suter, een moleculair bioloog aan het Zwitserse Federale Instituut voor Technologie Lausanne in Zwitserland. DNA-vorm, nabijheid tot andere DNA-segmenten en fysieke spanning in de DNA-moleculen kunnen allemaal een rol spelen bij de binding van transcriptiefactoren. De waarden van deze parameters verschillen waarschijnlijk op elke positie in het genoom, en misschien ook tussen celtypen en binnen een enkele cel in de loop van de tijd op een bepaalde positie. "Dit is een enorme ruimte van onbekende variabelen die heel moeilijk te kwantificeren zijn", zei Suter.
Introductie
Daarom zijn goed gecontroleerde experimenten zoals die van het Stanford-team zo nuttig, voegde Kuhlman eraan toe. Wanneer onderzoekers dit soort zwakke interacties moeten meten, hebben ze meestal twee keuzes: ze kunnen een paar zeer gedetailleerde, extreem nauwkeurige metingen doen en daaruit generaliseren, of ze kunnen een groot aantal snelle en vuile metingen doen en wiskundig complexe metingen gebruiken. statistische methoden om resultaten af te leiden. Maar Fordyce en haar collega's, zei Kuhlman, gebruikten een geautomatiseerde, op microfluïdische chips gebaseerde procedure om nauwkeurige metingen uit te voeren tijdens experimenten met hoge doorvoer "om het beste van twee werelden te krijgen."
Het Stanford-team ontdekte dat verschillende STR-sequenties de bindingsaffiniteit van transcriptiefactoren aan DNA met maar liefst een factor 70 kunnen veranderen; ze hebben soms meer invloed op de binding van de transcriptiefactor dan het veranderen van de sequentie van het bindingsmotief zelf. En de effecten waren verschillend voor de twee verschillende transcriptiefactoren waar ze naar keken.
STR's lijken dus in staat om het vermogen van transcriptiefactoren om zich aan te melden op een DNA-site te verfijnen en zo een gen te reguleren. Maar hoe precies?
Een wachtkamer bij een Gene
De onderzoekers dachten dat het deel van een transcriptiefactor dat DNA bindt een zwakke interactie zou kunnen hebben met een STR, waarbij de exacte sterkte van die affiniteit afhangt van de STR-sequentie. Omdat een dergelijke binding zwak is, zal deze niet veel specificiteit hebben. Maar als een transcriptiefactor keer op keer losjes wordt vastgegrepen en vrijgegeven door een STR, is het cumulatieve effect dat de transcriptiefactor in de buurt van het gen blijft, zodat het waarschijnlijker is dat hij zich veilig aan het motiefgebied bindt als dat nodig is.
Fordyce en haar collega's voorspelden dat STR's dus fungeren als een 'lobby' of put waar transcriptiefactoren zich, hoe kortstondig ook, kunnen verzamelen in de buurt van een regulerende bindingsplaats. “De repetitieve aard van een STR versterkt het zwakke effect van elke afzonderlijke bindingsplaats waaruit deze is gemaakt”, zegt Connor Horton, de eerste auteur van het onderzoek, die nu een doctoraatsstudent is aan de Universiteit van Californië, Berkeley.
Omgekeerd, voegde hij eraan toe, kunnen sommige STR's ook transcriptiefactoren wegtrekken van regulerende sequenties, waardoor transcriptiefactoren elders als een spons worden opgezogen. Op deze manier kunnen ze genexpressie remmen.
Het werk, aldus Suter, “laat op overtuigende wijze zien dat STR’s een directe invloed hebben op de binding van transcriptiefactoren in vitro.” Bovendien gebruikte het Stanford-team een machine learning-algoritme om aan te tonen dat de effecten die in hun in vitro-experimenten werden waargenomen, ook in levende cellen (dat wil zeggen in vivo) lijken voor te komen.
Maar Robert Tjan, een biochemicus in Berkeley en een onderzoeker aan het Howard Hughes Medical Institute, denkt dat het misschien te vroeg is om zeker te weten welke invloed een bepaalde combinatie van STR-transcriptiefactoren heeft op genexpressie in echte cellen.
Tjian, Xavier Darzacq en hun collega's in het laboratorium dat ze samen runnen in Berkeley zijn het erover eens dat STR's een manier lijken te bieden om transcriptiefactoren te concentreren in de buurt van genregulerende sites. Maar zonder te weten hoe dicht de factoren bij elkaar moeten liggen om transcriptie te activeren, is het moeilijk om de functionele betekenis van dat resultaat te begrijpen. Tjian zei dat hij graag zou willen zien of het introduceren van een STR in een levende cel voorspelbaar de expressie van een doelgen beïnvloedt. Op dit moment, zei hij, is hij “er niet van overtuigd dat STR’s noodzakelijkerwijs een belangrijk aspect zullen zijn van [regelgevende] mechanismen in vivo.”
Een combinatorische grammatica
Een slepende puzzel is hoe een dergelijk mechanisme op betrouwbare wijze zorgt voor het soort precieze genregulatie dat cellen nodig hebben, aangezien zowel de sterkte als de selectiviteit van transcriptiefactorbinding binnen de STR-putjes zwak zijn. Fordyce denkt dat een dergelijke specificiteit van invloed uit vele bronnen kan komen – niet alleen uit verschillen in de STR-sequenties, maar ook uit coöperatieve interacties tussen transcriptiefactoren en andere eiwitten die betrokken zijn bij de regulatie.
Gezien dit alles, zegt Horton, is het niet duidelijk of het eenvoudig zal zijn om het effect van een bepaalde combinatie van STR-transcriptiefactoren op de expressie van een gen te voorspellen. De logica van het proces is inderdaad vaag. En de ‘grammatica’ van de invloed is waarschijnlijk combinatorisch, voegde Horton eraan toe: de uitkomst hangt af van verschillende combinaties van transcriptiefactoren en andere moleculen.
Het Stanford-team denkt dat misschien wel 90% van de transcriptiefactoren gevoelig zijn voor STRs, maar dat er veel meer typen transcriptiefactoren in het menselijk genoom voorkomen dan typen STRs. “Het muteren van een STR-sequentie kan de binding van twintig verschillende transcriptiefactoren in dat celtype beïnvloeden, wat kan leiden tot een algehele afname van de transcriptie van dat nabijgelegen gen zonder dat er een specifieke transcriptiefactor bij betrokken is”, aldus Horton.
Dus in feite is het Stanford-team het met Tjian eens dat genregulatie in levende cellen niet door één enkel eenvoudig mechanisme zal worden aangestuurd. In plaats daarvan kunnen transcriptiefactoren, hun DNA-bindingsplaatsen en andere regulerende moleculen samenkomen in dichte bijeenkomsten die gezamenlijk hun invloed uitoefenen.
“Er zijn nu meerdere voorbeelden die het idee ondersteunen dat DNA-elementen transcriptiefactoren kunnen verdringen tot het punt waarop ze condensaten vormen met cofactoren,” zei Richard Young, een celbioloog aan het Whitehead Institute van het Massachusetts Institute of Technology. Enhancers binden veel transcriptiefactoren om die crowding te veroorzaken. STR's kunnen een ingrediënt zijn dat helpt bij het verzamelen van transcriptiefactoren om zich dichtbij een gen te clusteren, maar ze zullen niet het hele verhaal zijn.
Waarom genen op deze ingewikkelde manier reguleren, in plaats van te vertrouwen op het soort sterke en specifieke interacties tussen regulerende eiwitten en DNA-plaatsen die domineren in prokaryoten? Het is mogelijk dat deze vaagheid grote, complexe metazoans überhaupt mogelijk heeft gemaakt.
Om levensvatbare soorten te zijn, moeten organismen kunnen evolueren en zich kunnen aanpassen aan veranderende omstandigheden. Als onze cellen zouden vertrouwen op een enorm, maar strak voorgeschreven netwerk van genregulerende interacties, zou het moeilijk zijn om er enige verandering in aan te brengen zonder het hele apparaat te verstoren, net zoals een Zwitsers horloge vastloopt als we een onderdeel ervan verwijderen (of zelfs maar een klein beetje verplaatsen). van zijn talloze tandwielen. Als de regulerende moleculaire interacties echter los en tamelijk onspecifiek zijn, is er sprake van nuttige speling in het systeem – net zoals een commissie doorgaans tot een goed besluit kan komen, zelfs als een van haar leden ziek is.
Fordyce merkt op dat het in prokaryoten zoals bacteriën relatief gemakkelijk kan zijn voor transcriptiefactoren om hun bindingsplaatsen te vinden, omdat het te doorzoeken genoom kleiner is. Maar dat wordt moeilijker naarmate het genoom groter wordt. In de grote genomen van eukaryoten “kun je het risico niet langer tolereren dat je tijdelijk vast komt te zitten op een ‘verkeerde’ bindingsplaats,” zei Fordyce, omdat dat het vermogen om snel te reageren op veranderende omgevingsomstandigheden in gevaar zou brengen.
Bovendien zijn STR's zelf zeer evolueerbaar. Een verlenging of verkorting van hun sequentie, of een verandering in de grootte en diepte van de ‘transcriptiefactorput’, kan gemakkelijk gebeuren door ongelukken in de DNA-replicatie of -reparatie, of door seksuele recombinatie van de chromosomen. Voor Fordyce suggereert het dat STRs “daarom kunnen dienen als grondstof voor het ontwikkelen van nieuwe regulerende elementen en het verfijnen van bestaande regulerende modules voor gevoelige transcriptionele programma’s”, zoals die welke de ontwikkeling van dieren en planten regelen.
De kracht van zwakke interacties
Dergelijke overwegingen zorgen ervoor dat moleculair biologen veel meer aandacht besteden aan zwakke en relatief niet-selectieve interacties in het genoom. Bij veel daarvan zijn eiwitten betrokken die, in plaats van een vaste en precieze structuur te hebben, los en slap zijn – ‘intrinsiek ongeordend’, zoals biochemici het uitdrukken. Als eiwitten alleen via rigide structurele domeinen zouden werken, legde Young uit, zou dit niet alleen een beperking vormen voor hoe goed regulerende systemen zouden kunnen evolueren, maar ook voor de soorten dynamische regulatie die we in het leven zien. “Je zult geen levend organisme – of zelfs maar een virus – vinden dat alleen functioneert met stabiele structurele elementen zoals die in een Zwitsers horloge,” zei Young.
Misschien stuitte de evolutie gewoon op STR's als onderdeel van zo'n complexe maar uiteindelijk effectievere oplossing voor genregulatie bij eukaryoten. STR's zelf kunnen op verschillende manieren ontstaan, bijvoorbeeld door fouten in de DNA-replicatie of de activiteit van DNA-segmenten die transponeerbare elementen worden genoemd en die kopieën van zichzelf door het hele genoom maken.
“Het gebeurde zo dat de resulterende zwakke interacties tussen eiwitten en de zich herhalende sequenties iets waren dat selectief voordeel kon opleveren voor de cellen waar het plaatsvond,” zei Kuhlman. Hij vermoedt dat deze vaagheid waarschijnlijk aan de eukaryoten werd opgedrongen, maar dat ‘zij deze vervolgens voor hun eigen voordeel konden exploiteren.’ Bacteriën en andere prokaryoten kunnen vertrouwen op goed gedefinieerde ‘digitale’ regulerende logica, omdat hun cellen doorgaans slechts in een paar eenvoudige, verschillende toestanden bestaan, zoals bewegen en repliceren.
Maar de verschillende celtoestanden voor metazoans zijn “veel complexer en soms bijna een continuüm”, zei Suter, dus ze zijn beter gediend met een vagere “analoge” regulatie.
“De genregulerende systemen bij bacteriën en eukaryoten lijken behoorlijk uiteen te lopen,” beaamde Tjian. Terwijl Monod ooit zou hebben opgemerkt dat ‘waar voor waar is E. coli geldt voor de olifant”, lijkt het erop dat dit niet altijd zo is.
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://www.quantamagazine.org/a-lobby-where-a-molecule-mob-tells-genes-what-to-do-20240214/



