새로 생성된 제품의 결정 및 격리
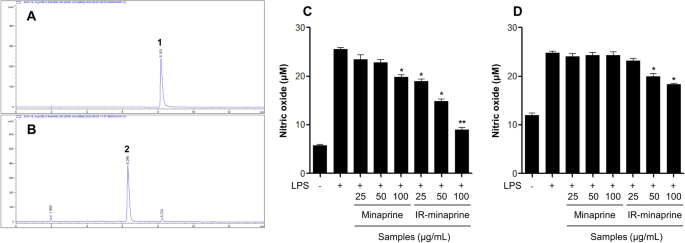
전리 방사선은 이전에 설명한대로 적용되었습니다. 순수한 미나프린(400 mg)을 메탄올(400 mL)에 녹인 시료용액에 감마선을 직접 조사하여 역상 HPLC 장치를 이용하여 형질전환 패턴을 분석하였다. 30kGy 선량으로 조사한 후, 미나프린(1)가 거의 감소했고 새로 생성된 피크는 tR 6.2분은 95%의 전환율에 해당합니다(그림. 1A,B ). 30 kGy의 선량으로 조사된 반응물은 순수 미나프린과 비교하여 LPS(lipopolysaccharide)로 자극된 RAW 264.7 및 DH82 대식세포에서 NO 생성에 대한 향상된 억제 효과를 보였다(도 XNUMXb). 1CD). 30 kGy 조사 반응물의 반복 컬럼 크로마토그래피 분리로 새로운 하이드로피리진 유도체의 분리 및 정제 2. 새로운 하이드록시알킬화 제품 2 minaprine의 aminopyridazine에 질소 부분이 있는 희귀한 작용기를 포함하는 것으로 밝혀졌습니다(그림 XNUMX). 2에이).
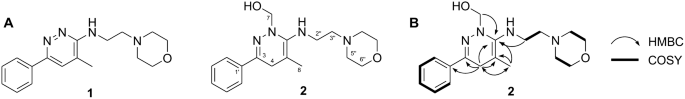
화합물 2 노란색 오일로 정제되었으며, UV 스펙트럼에서 219 및 284 nm에서의 흡수 최대값은 하이드로피리다진 골격의 존재를 시사했습니다.17. HRESIMS는 pseudomoelcular 이온 피크를 m / z 331.2126 [엠 + 에이치]+ 분자식 C에 해당18H27N4O2. 그만큼 1H NMR 스펙트럼(600MHz)의 2 CD에서3OD는 하나의 벤젠 고리 공명 신호를 δH 7.90(2시간, 일, J = 8.4, 1.8Hz, H-2', 6'), 7.51(1H, dd, J = 8.4, 1.8Hz, H-4') 및 7.49(2H, t, J = 8.4Hz, H-3', 5'), 6개의 메틸렌 양성자 신호 δH 3.73(4H, t, J = 4.2Hz, H-6″, 7″), 3.61(2H, t, J = 5.4Hz, H-2″), 2.77(2H, t, J = 5.4 Hz, H-3") 및 2.60(4H, br s, H-5", 8"), 이는 하나의 벤젠 및 알킬모르폴린 모이어티의 존재를 시사함18. 단일 단일 메틸기 δH 1.36 (3H, s, H-8) 및 메틸렌 양성자 δH 2.94(1H, d, J = 17.4Hz, H-4a) 및 2.88(1H, d, J = 17.4Hz, H-4b)가 관찰되었다. 또한, 1D NMR 및 HSQC 스펙트럼은 δH 3.80(1H, d, J = 11.4Hz, H-7a) 및 3.71(1H, d, J = 11.4Hz, H-7b) (표 1).
XNUMX개의 탄소 신호가 관찰되었습니다. 13C NMR 및 HSQC 스펙트럼은 9로 분류될 수 있습니다. sp2 탄소(8개의 방향족 고리와 XNUMX개의 올레핀에 할당됨), XNUMX개의 메틸렌 탄소 δC 67.9(C-6", 7"), 67.1(C-7), 56.6(C-3"), 54.1(C-5", 8"), 41.6(C-2") 및 30.8(C- 4), 및 XNUMX개의 메틸 신호 δC 19.9(C-8)(표 1). 위의 데이터는 하이드록시메틸 잔기가 있는 특이한 하이드로피리다진을 나타냅니다(그림 XNUMX). 2ㅏ). 의 구조 2 HMBC에서 추가로 확인했습니다. H-4에서 C-3, -5 및 -6으로, H-8에서 C-4 및 -6으로, H-1'에서 C-3으로, H-2"에서 C-로의 HMBC 관계 6, 확인 2 아미노피리다진 백본을 갖는다. H-4, -8 및 -2"에서 C-6까지의 교차 피크는 다음을 확인했습니다. 2 C-3에 모르폴린이 있는 8-벤즈닐-6-메틸-6-아미노피리다진입니다. 하이드록시메틸 작용기는 H-7과 C-6 사이의 주요 HMBC 상관관계에 의해 뒷받침되는 수화된 아미노피리다진 단위의 질소 위치에 위치했습니다(그림 XNUMX). 2비). 따라서 특이한 hydroaminopyridazine의 구조는 2 도 XNUMX에 나타낸 바와 같이, 신규 형질전환 산물인 미나프리놀로 완전히 지정되었다. 2A.
대기 존재 하에서 메탄올 조건의 방사선 분해는 하이드록시메틸과 같은 다양한 자유 라디칼을 생성합니다.·CH2OH), 하이드록실(•OH), 메톡시(CH3O·), 퍼옥실(HOO·), 이후 신약 후보 물질의 녹색 합성입니다.19,20. 우리의 결과는 하이드록시메틸(·CH2OH) 라디칼은 또한 화합물의 변형에 관여할 수 있습니다. 2 미나프린이 메탄올 용액에서 이온화 방사선에 노출되었을 때. 이것은 amionpyridazine 약물의 새로운 방사성 하이드록시메틸화의 첫 번째 예입니다.
LPS로 자극된 대식세포에서 항염증 억제 효과
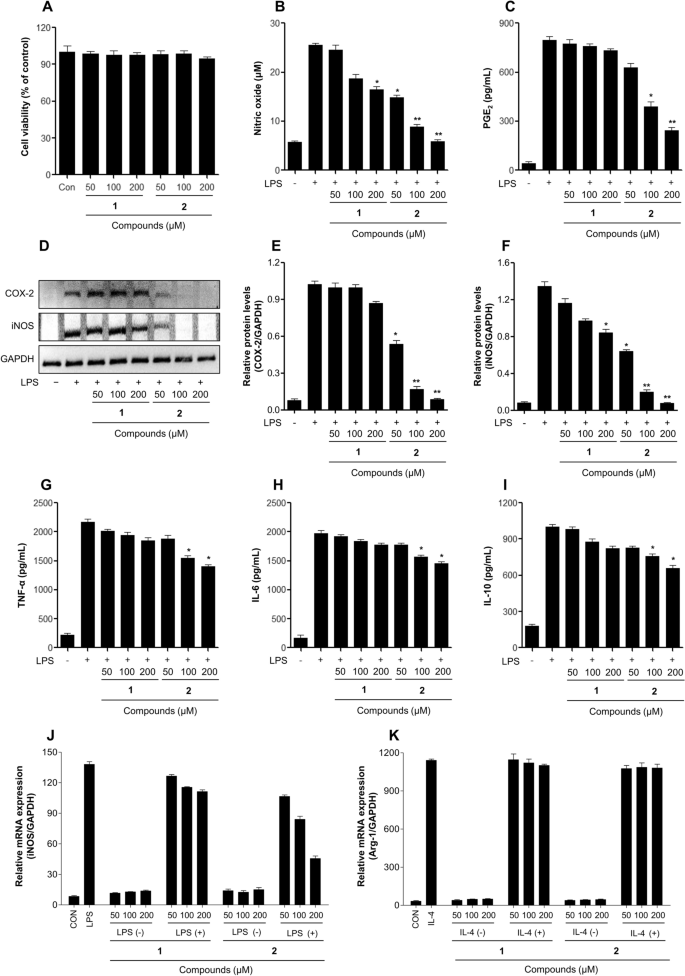
복합을 특징으로 하는 플래너 구조 2 RAW 264.7 및 DH82 대식세포 모두에서 항염증 활성을 결정하기 위해 평가되었습니다. 화합물 치료 1 과 2 264.7% 이하(최대 82μM)에서 RAW 5 및 DH200 세포의 생존력에 영향을 미치지 않았습니다(도 XNUMX 및 XNUMX). 3A 및 4ㅏ). 새로운 hydropyridazine 유도체인 minaprinol의 항염증 효과를 평가하였다.2) NO 및 PGE를 포함하는 전염증성 매개체의 생성을 검출함으로써2 LPS로 자극된 RAW 264.7 및 DH82 대식세포에서 3 과 4).
LPS로 자극된 RAW 264.7 대식세포에서 항염증 활성에 대한 아미노피리다진 제품의 효과. (A) 264.7시간 동안 샘플로 처리한 후 RAW 24 세포에서 MTT 검정에 의한 세포 생존율 검출. 세포를 2시간 동안 샘플로 처리한 후, LPS(0.1 μg/mL)로 24시간 동안 처리하였다. (B) 배양 배지의 아질산염 함량을 Griess 시약 검정으로 분석하였다. (C) PGE2 배양 배지의 생산 함량은 ELISA로 분석하였다. (D, E, F) COX-2의 발현(E) 및 iNOS(F) 264.7시간 동안 두 RAW 24 대식세포의 샘플 처리에 의해 유도됨. (G, H, I) 사이토카인 생성(G: TNF-α, H: IL-6, I: IL-10) 배양액의 ELISA로 측정하였다. (J, K) iNOS(J) 및 Arg-1(K) qPCR 분석에 의해 mRNA 발현을 결정하였다. GAPDH mRNA의 발현량을 이용하여 각 유전자의 상대적인 발현량을 정량하였다. 결과는 평균 ± SD(n = 3). *p <0.05; **p <0.01; vs. LPS 처리군. 1: 미나프린, 2: 미나프리놀.
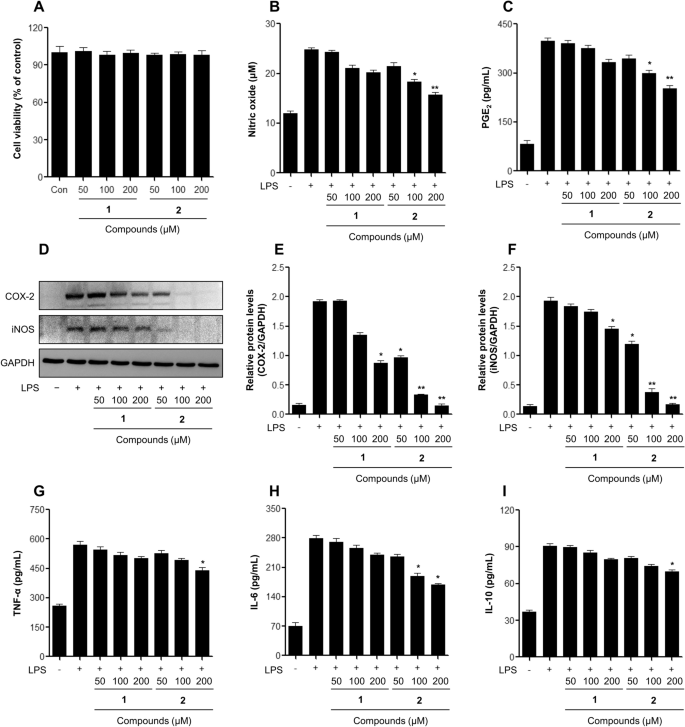
LPS로 자극된 DH82 대식세포에서 항염증 활성에 대한 아미노피리다진 제품의 효과. (A) 82시간 동안 샘플로 처리한 후 DH24 세포에서 MTT 분석에 의한 세포 생존력 검출. 세포를 2시간 동안 샘플로 처리한 후, LPS(1 μg/mL)로 24시간 동안 처리하였다. (B) 배양 배지의 아질산염 함량을 Griess 시약 검정으로 분석하였다. (C) PGE2 배양 배지의 생산 함량은 ELISA로 분석하였다. (D, E, F) COX-2의 발현(E) 및 iNOS(F) 82시간 동안 두 DH24 대식세포 세포의 샘플 처리에 의해 유도됨. (G, H, I) 사이토카인 생성(G: TNF-α, H: IL-6, I: IL-10) 배양액의 ELISA로 측정하였다. 결과는 평균 ± SD(n = 3). *p <0.05; **p <0.01; vs. LPS 처리군. 1: 미나프린, 2: 미나프리놀.
미나프리놀(2)는 하이드록시메틸 작용기를 가지며, 200 μM 농도에서 NO 및 PGE에 대해 강력하게 향상된 억제 활성을 나타냄2 LPS로 자극된 RAW 264.7 세포에서의 생산, 부모 minaprine에 비해 각각 약 10.6 μM 및 490.4 pg/mL의 감소(그림 XNUMX) 3기원전). DH82 세포에서 NO와 PGE의 현저한 억제2 관찰되었다(Fig. 4기원전). 염증이 있는 동안 효소 COX-2와 iNOS는 전염증성 매개체의 분비를 촉진합니다.21. 그러므로, 2 LPS로 유도된 대식세포에서 COX-2와 iNOS를 억제하는지 여부를 western blot analysis로 조사하였다. Fig. 3D 및 4D, 화합물 2 LPS로 유도된 COX-2 및 iNOS 단백질 발현을 용량 의존적으로 억제하여 NO 및 PGE와 같은 전 염증성 매개체 생성을 억제합니다.2.
LPS로 자극된 대식세포에 의한 TNF-α, IL-6 등의 전염증성 사이토카인과 IL-10과 같은 항염증성 사이토카인의 분비 변화를 측정하였다. 수치 3G-I 새로 생성된 제품의 억제 효과를 나타냅니다. 2 LPS로 자극된 RAW 6 세포에 의한 염증성 사이토카인 TNF-α, IL-10 및 IL-264.7의 분비에 대한 조사된 미나프린으로부터의 3). 미나프리놀(2) 또한 미나프린과 비교하여 전 염증성 및 항염증성 사이토카인 생성 억제가 증가한 것으로 나타났습니다(1) 송곳니의 DH82 세포에서(Fig. 4미군 병사). 새로 생성된 후보 2 는 RAW 1 대식세포에서 iNOS 및 Arg-264.7의 mRNA 발현 수준에 영향을 미치지 않았으며, 이는 대식세포 분극화에 관여하지 않았음을 시사합니다(그림 XNUMX). 3J, K). 흥미롭게도, 이온화 방사선에 의해 유도된 aminopyridazine의 하이드록시메틸화는 LPS로 자극된 대식세포의 항염증 특성을 향상시켰습니다. 최근 연구에서 크리신과 루테올린은 γ-선 조사에 의해 유도된 in vitro 및 in vivo에서 개선된 항염증 활성을 나타냈으며, 하이드록시알킬 치환 화합물의 화학구조를 규명하였다.12,21. 또한, 알칼로이드와 스테로이드의 방사선 분해 변환은 흑색종, 유방암, 간암 및 폐암에서 강력한 항암 효과를 나타냈습니다.11,22,23,24,25.
방사선 분해에 의한 미나프린의 항염증제의 색 변화 및 변형
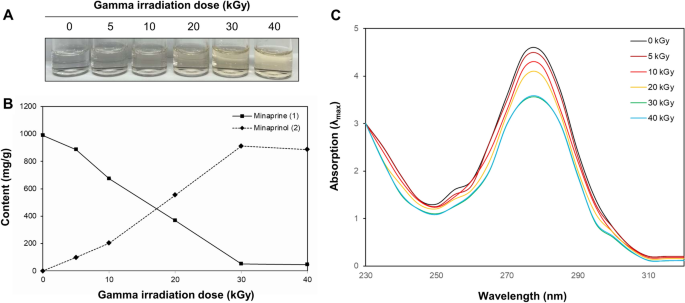
하이드로아미노피리다진의 가장 흔한 형태인 미나프린의 하이드록시메틸화에 의한 신규 화합물의 변색 및 변형에 대한 이온화 조사의 영향을 조사하였다. 미나프린의 흰색은 선량 의존적으로 점차 감소하였고 30 kGy 선량의 감마선 조사에서 효과적으로 변형되었다(도 XNUMX). 5에이).
5, 10, 20, 30, 40 kGy의 조사된 mianprine으로부터 분리된 화합물의 함량을 외부표준법을 이용하여 정량하였고 그 결과를 도 XNUMX에 나타내었다. 5B. XNUMX개의 집중 지점(n = 5)는 검량선 작성에 사용되었으며 표준 화합물의 순수한 용액의 검량선은 완전히 선형이었습니다(R2 > 0.999). 새로 형성된 미나프리놀의 머무름 시간(2, tR 6.3분) 및 미나프린(1, tR 8.2분)이 XNUMX개의 조사된 반응물에 대해 검출되었습니다. 정량분석 결과 가장 강력한 미나프리놀(2) 5, 10, 20, 30, 40 kGy 조사 시료에서 각각 98.6 ± 0.6, 202.7 ± 1.5, 554.6 ± 1.6, 912.0 ± 2.0, 886.0 ± 2.0 mg/g으로 개선에 따른다. 각 샘플의 대식세포 세포의 항염증 능력. 반대로, 미나프린의 감소(1) 함량을 이온화 조사하여 관찰하였다.
변형된 미나프린의 화학적 특성은 UV spectrometry로 확인하였다(Fig. 5씨). 280 nm에서의 흡광도는 minaprine의 pyridazine 결합에 기인한 것입니다(1). 대조적으로, 30kGy 조사된 샘플과 대조군(280kGy)에 비해 0nm에서 감소된 흡광도는 디하이드로피리다진 백본으로의 더 큰 변형을 제안했습니다. 이러한 결과는 미나프리놀(2) 미나프린의 주요 제품으로 전리방사선 선량을 30 kGy까지 증가시켰다. 우리의 결과는 minaprine에 이온화 방사선을 적용하여 유도된 hydroxymethylation이 반려 동물 대식세포에서 과도한 염증 생성을 억제하는 데 도움이 될 수 있음을 나타냅니다.
- SEO 기반 콘텐츠 및 PR 배포. 오늘 증폭하십시오.
- PlatoData.Network 수직 생성 Ai. 자신에게 권한을 부여하십시오. 여기에서 액세스하십시오.
- PlatoAiStream. 웹3 인텔리전스. 지식 증폭. 여기에서 액세스하십시오.
- 플라톤ESG. 자동차 / EV, 탄소, 클린테크, 에너지, 환경, 태양광, 폐기물 관리. 여기에서 액세스하십시오.
- BlockOffsets. 환경 오프셋 소유권 현대화. 여기에서 액세스하십시오.
- 출처: https://www.nature.com/articles/s41598-023-37812-8