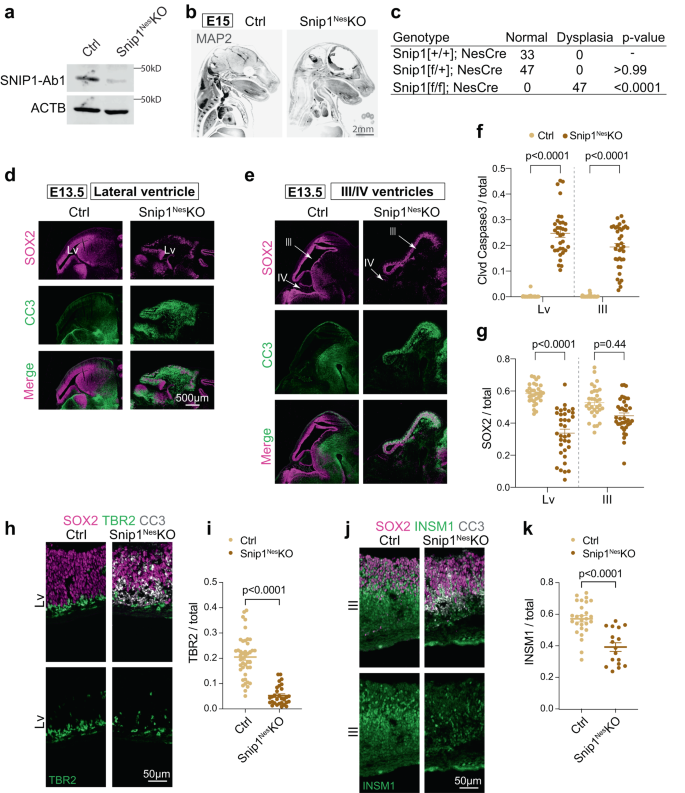
SNIP1はマウス胎児の脳におけるNPCの生存に必要である
まず、次の式を調べました。 スニップ1 RNAscopeによるマウス胎児の脳内40。 胎生日E11.5とE13.5では、 スニップ1 転写物はほぼすべての細胞で発現され、NPCが存在する心室の内側を裏打ちする神経上皮でも強力に発現されました(補足図)。 1b、c)。 マウス胎児の脳における SNIP1 を研究するために、私たちは以下を使用しました。 ネスチン (ネス)::::CRE NPCのSNIP1を条件付きで枯渇させること、以下、 スニップ1ネス–KO。 ネス::Cre は NPC で発現され、flox 部位を再結合し、エクソン 2 を切除します。 スニップ1 (イチジク。 1a、補足図 1D-F、補足図 2a–d)。 E15までに、 スニップ1ネス-KO 胚は、100% の浸透率で脳組織の重度の薄化と異形成を示しました (図 XNUMX)。 1b、c, p フィッシャーの直接確率検定による < 0.0001)。 脳異形成の細胞基盤を理解する スニップ1ネス–KO、私たちはNPCの細胞増殖とアポトーシスを調べました。 NPC は、神経幹細胞マーカー SRY-box 2 (SOX2) の発現によって同定されました。 in vivo で増殖細胞を特定するために、妊娠中の母動物に BrdU を注射し、および/または増殖マーカー Ki67 を検出しました。 神経上皮におけるこれらのマーカーの定量化では、兄弟対照における増殖性 NPC の有意差は明らかにされませんでした。 スニップ1ネス–KO 胚(補足図 2e–h).
a コントロールのWBと スニップ1ネス- E13.5でNPCをKOします。 コントロールを少なくとも 5 回繰り返し、 スニップ1ネス-KO NPC も同様の結果を示しました。 SNIP1-Ab1; ProteinTech の抗 SNIP1 抗体。 b 制御中のMAP2のIFと スニップ1ネス-E15 での KO 胚。 胚は iDISCO 法によって除去され、ライトシート顕微鏡で画像化されました。 IF を 2 回繰り返したところ、同様の結果が得られました。 バー、XNUMX mm。 c E13.5胚における脳異形成の浸透度。 脳異形成は、脳組織の薄化によって判断されました。 統計的有意性はフィッシャーの直接確率検定によって計算されました。 d-e E2 脳の矢状凍結切片における SOX3 および切断型カスパーゼ 3 (CC13.5) の IF。 側脳室(Lv、前脳)、第 500 脳室(中脳)、第 XNUMX 脳室(後脳)の周囲の胚帯を検査しました。 バー、XNUMXμm。 f, g 対照心室と心室の神経上皮内層における CC3 陽性細胞と SOX2 陽性細胞の定量 スニップ1ネス-E13.5のKO胚。 DAPI 染色を使用して細胞の総数を数えました。 各データ ポイントは 7 つの画像を表します。 対照胚 XNUMX 個と XNUMX 個 スニップ1ネス-KO胚を分析した。 の (f)、側心室の場合、 n = 38 枚の画像 (コントロール) と n = 34(スニップ1ネス-KO); 第三心室の場合、 n = 38 (コントロール) および n = 36(スニップ1ネス-KO)。 の (g)、側心室の場合、 n = 33 (コントロール) および n = 35(スニップ1ネス-KO); 第三心室の場合、 n = 32 (コントロール) および n = 37(スニップ1ネス-KO)。 データは平均±SEMとして表され、統計分析には二元配置分散分析が使用されました。 h-j E2 脳の神経系譜マーカー TBR3 および INSM2 と重ねられた SOX1 および CC13.5 の IF。 バー、50μm。 i, k 側脳室または第三脳室の神経上皮内層における TBR2 陽性または INSM1 陽性細胞の定量化。 各データ ポイントは 8 つの画像を表します。 3 ~ 7 個の対照胚と XNUMX ~ XNUMX 個 スニップ1ネス-KO胚を分析した。 の (i), n = 43 枚の画像 (コントロール) と n = 30(スニップ1ネス-KO); の (k), n = 27 (コントロール) および n = 17(スニップ1ネス-KO)。 データは平均±SEMとして表され、統計分析には二元配置分散分析が使用されました。 ソース データはソース データ ファイル (a, f, g, i, k).
次に、切断された (cl)-カスパーゼ 3 の IF によってアポトーシスを調べました。E13.5 では、すべての心室が スニップ1ネス–KO は、神経上皮の脳室下帯における cl-カスパーゼ 3 の強力な誘導を示しました(図 XNUMX)。 1D-F)。 cl-caspase 3 シグナルは、SOX2 陽性 NPC と TBR2 陽性中間前駆体と重複していました(補足図)。 2i–l)、顕著に減少した。 スニップ1ネス–KO 神経上皮 (図 XNUMX) 1d–i)。 INSM1 陽性の中間前駆細胞も同様に減少しました。 スニップ1ネス–中脳をKOする(図) 1j、k)。 これらのデータは、SNIP1 が NPC および発達中の脳の中間前駆細胞のアポトーシスを抑制することを示唆しています。
以前のイベントをキャプチャするには、 スニップ1ネス–KO 脳では、E3 胎児脳の cl-カスパーゼ 11.5 を調べました。 E11.5までに、cl-caspase 3シグナルが全領域で検出されました。 スニップ1ネス–KO脳(補足図) 3a–d)。 として ネス::CreはE10.5でオンになります41、SNIP1の枯渇は24時間以内にアポトーシスを誘導する可能性があります。 側脳室、第 2 脳室、第 11.5 脳室の SOXXNUMX 陽性細胞の定量化により、第 XNUMX 脳室の NPC のみが EXNUMX までに枯渇することが示されました(補足図)。 3e)。 今後、SNIP1によるアポトーシス制御を研究するために側脳室と第三脳室の分析に焦点を当てました。
SNIP1 の枯渇が観察されたアポトーシスを一貫して引き起こすことを確認するために、以下を使用しました。 エム×1::Creは背側終脳のNPCのSNIP1を条件付きで枯渇させる42を選択します。 スニップ1エム×1–KO 胚はまた、アポトーシスの強力な誘導、TBR2 陽性中間前駆細胞の喪失、および前脳の異形成を示しました(補足図)。 3f-k)。 これらの発見は、発生中のマウスの脳において、アポトーシスの誘導と形成異常が SNIP1 の枯渇に特異的であることを裏付けています。 これらのデータは、SNIP1 が NPC および中間前駆細胞における抗アポトーシスおよび生存促進機構に必要であるという我々の結論をさらに裏付けています。
SNIP1は内因性アポトーシスプログラムを抑制する
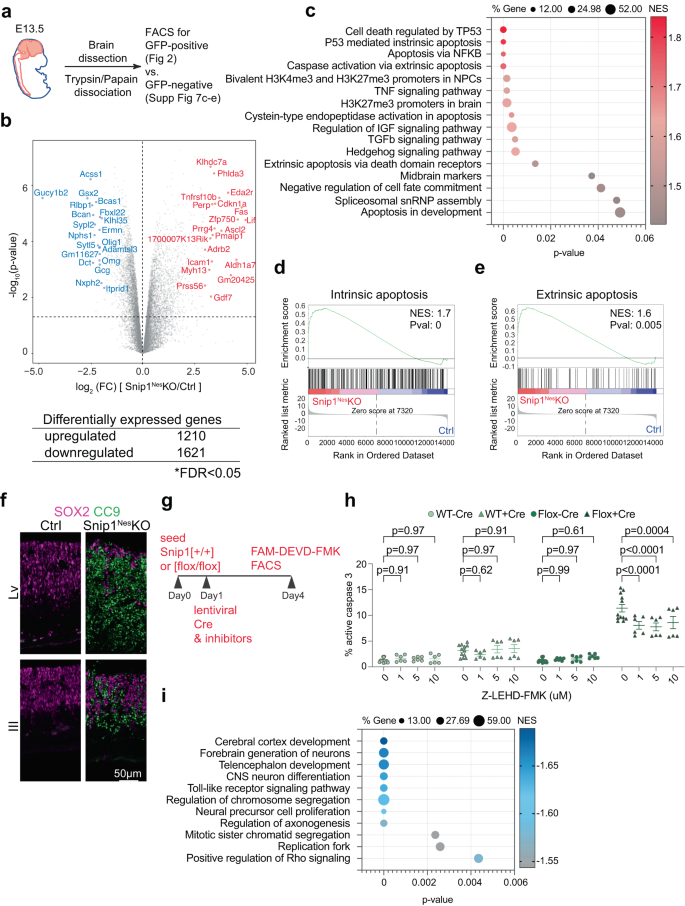
欠陥の分子基盤を明らかにする スニップ1ネス–KO NPC、E2 からソートされた SOX13.5 陽性 NPC の RNA シーケンス (RNA-seq) を実行しました。 スニップ1ネス–KO および兄弟コントロール (図 XNUMX) 2a、補足図 4a)。 コントロールまたはコントロールのいずれかで、1 万あたりのカウント (CPM) 値が XNUMX を超える遺伝子を分析しました。 スニップ1ネス–NPCをKOします。 誤検出率 (FDR) < 0.05 の基準を使用して、対照データセットと対照データセットの 4 つの複製データセットをそれぞれ比較します。 スニップ1ネス-KO NPC では、1210 個の上方制御遺伝子と 1621 個の下方制御遺伝子を特定しました。 スニップ1ネス-KO(図 2b、補足図 4b–d).
a 脳内NPCコレクションの概略図。 b ボルケーノプロットとコントロールとの間で差次的に発現された遺伝子の数 スニップ1ネス- NPCをKOします。 表は、FDR < 0.05 のカットオフを通過した遺伝子の数を示しています。 FDR は Benjamini & Hochberg 法によって計算されました。 P 値は両側 Voom-limma によって計算されました。 t テスト。 c, i 上方制御された遺伝子と下方制御された遺伝子の濃縮された遺伝子セットのバブル プロット スニップ1ネス-KO 対コントロール NPC。 差次的に発現される遺伝子は、まずその変化倍数によってランク付けされました。 p-値、および遺伝子セット強化分析 (GSEA) を実行する前の発現レベル。 P-値は、FDR 調整を使用した右側順列テストによって計算されました。 d, e 上方制御された遺伝子の代表的な GSEA スニップ1ネス-KO 対コントロール NPC。 上方制御された遺伝子は、内因性アポトーシスと外因性アポトーシスの両方に関連する遺伝子セットに富んでいました。 差次的に発現される遺伝子は、最初にその変化倍数によってランク付けされ、 p-GSEA が実行される前の値。 f E9 脳の矢状凍結切片における SOX9 を重ねた切断型カスパーゼ 2 (CC13.5) の IF。 バー、50μm。 g mCherry-Cre レンチウイルスによる形質導入と阻害剤による治療の概略図 スニップ1[+/+] と スニップ1【flox/フロックス】 NPC。 h FACSによって定量化された、活性なカスパーゼ3を有する細胞の割合。 カスパーゼ 9 阻害剤 (Z-LEHD-FMK) を、mCherry-Cre レンチウイルスとともにさまざまな濃度で添加しました。 FAM-FLICA (活性型カスパーゼ 3) 陽性集団 (全集団に対する) の割合が表示されます。 N = 12 (DMSO 制御の場合)、 n サンプルの残りの場合は = 6。 データは平均±SEMとして表され、統計分析には二元配置分散分析が使用されました。 ゲート戦略と代表的な FACS プロットを補足情報に示します (補足図)。 4e、補足図 14a)。 ソース データはソース データ ファイル (c, h, i).
遺伝子セット濃縮分析 (GSEA) により、以下の遺伝子が上方制御されていることが明らかになりました。 スニップ1ネス–KO NPCは、p53媒介アポトーシス、NPCと脳のH3K27me3または二価プロモーター、中脳マーカー、スプライソソーム核小リボ核タンパク質粒子、およびTNF、IGF、TGFβ、およびヘッジホッグが関与するシグナル伝達経路に関連する機能が豊富でした(図XNUMX)。 2c)。 内因性および外因性のアポトーシス シグネチャは、上方制御された遺伝子に豊富に含まれていたため、 スニップ1ネス–KO NPC (図 2d、e)、これら 8 つの経路の活性化を調べました。 IFは、外因性アポトーシス経路のエフェクターであるcl-カスパーゼXNUMXのシグナルをほとんど示さなかった43,44 (補足図 5a) しかし、内因性アポトーシス経路のエフェクターである cl-カスパーゼ 9 の強いシグナル45,46,47、心室の神経上皮全体に存在します(図。 2f)。 さらに、FAM-DEVD-FMK 染色の FACS による cl-caspase 3 の定量化48,49 カスパーゼ 8 の阻害はアポトーシスをわずかに変化させましたが、カスパーゼ 9 の阻害はアポトーシスを強力に減少させたことを示しています。 スニップ1ネス–KO NPC (図 2g、h、補足図 4e、補足図 5b)。 カスパーゼ 9 阻害剤である Z-LEHD-FMK は、9 μM でカスパーゼ 1 を効果的に阻害し、20 および 40 μM で細胞毒性を引き起こしました(図 XNUMX)。 2h、補足図 4f)。 アポトーシス増加の原因を特定するために、DNA損傷の増加は検出されませんでした(補足図)。 5c–f)しかし、SOX53陽性NPCではp2シグナルの強い増加が検出されました(補足図。 5g-i)。 これらのデータは、 スニップ1ネス–KO 胚は、NPC において p53 媒介の内因性アポトーシスの調節不全を示しました。 私たちは、SNIP1 が主に神経発達プログラムの一部として内因性アポトーシスを抑制すると提案します。
下方制御された遺伝子 スニップ1ネス–KO NPCは、前脳と皮質の発達、CNSニューロンの分化、染色体分離、NPC増殖、軸索形成、複製フォーク、およびTLRとRhoが関与するシグナル伝達経路に関連する機能が豊富でした(図XNUMX)。 2i)。 とはいえ、 スニップ1ネス–KO 前脳組織はアポトーシスの結果として重度の薄化を示し、前脳マーカー FOXG1 および中/後脳マーカー OTX2 が対照と後脳の間で同様に検出されました。 スニップ1ネス–KOの脳(補足図。 5j)。 これらのデータは、SNIP1 の枯渇によって前脳の仕様が変化しないことを示唆しています。
他の下方制御された遺伝子 スニップ1ネス–KO NPC は自己再生の制御に関与していました (図 XNUMX)。 2i)。 の特徴付け スニップ1ネス–インビトロでKOされたNPCは、対照NPCと比較して、培養 スニップ1ネス–KO NPCではSOX2発現が減少していました(補足図)。 6a、b)。 NPC が浮遊状態で連続継代を通じてニューロスフェアを形成できるようにすることで、ニューロスフェアの数と断面積が有意に減少することを観察しました。 スニップ1ネス–KOと対照との比較(補足図) 6c–e)。 ヒトSNIP1の過剰発現(マウスSNIP85と1%の同一性)は、培養細胞の自己複製をレスキューするのに十分であった スニップ1ネス–KO NPC (補足図) 6f、g)、ヒトとマウスの間でSNIP1の機能が保存されていることを示唆しています。 全体として、SNIP1は細胞の生存を促進してNPCの自己複製を維持すると結論付けています。
SNIP1はNPCの分化を抑制する
E13.5 では胎児の脳で神経新生が起こるため、未熟ニューロン マーカー TUJ1 を調べました。 TUJ1 陽性領域の相対的な厚さは、両者の間で有意な差はありませんでした。 スニップ1ネス–E13.5でのKOとコントロール(補足図。 7a、b)。 それを考えると スニップ1ネス–KO NPC は徐々に減少していきましたが、この差のなさは驚きでした。 したがって、我々は、NPC マーカー SOX1 の発現を失った分化中の神経細胞における SNIP2 の分子効果を調べました。 E2からソートされたSOX13.5:GFP陰性細胞のRNA配列を実行しました。 スニップ1ネス–KOと兄弟は脳を制御する(図XNUMX)。 2a、補足図 4a)。 フォールドチェンジ >2 の基準を使用し、 p < 0.05 で、コントロールとそれぞれの 2 つの複製データセットを比較します。 スニップ1ネス-KO、我々は658個の上方制御された遺伝子と150個の下方制御された遺伝子を特定しました。 スニップ1ネス-KO (補足図。 7c)。 GSEA は、次の遺伝子が上方制御されていることを明らかにしました。 スニップ1ネス–KO 細胞には、アポトーシス クリアランス、ニューロンの特定と分化、中脳マーカー、および NPC の二価マーク (H3K27me3 および H3K4me3) によって占められる既知の高 CpG 密度プロモーターに関連する機能が豊富でした。50 (補足図 7d)。 下方制御された遺伝子 スニップ1ネス–KO 細胞は、スプライセオソーム、翻訳とリボソーム、ヌクレオソームの組織化、および p21 を介したアポトーシスに関連する機能が豊富でしたが、p53 はそうではありませんでした(補足図)。 7e)。 これらの結果は、SNIP1 がアポトーシス、ニューロンの特定と分化、中脳の遺伝プログラム、および H3K27me3 が占有する遺伝子を抑制することを示唆しています。 E13.5では、上方制御されたアポトーシスは減少しますが、 スニップ1ネス–KO NPC と中間前駆細胞。その残骸は、ニューロンの仕様と分化を上方制御した細胞を生じさせます。 これらを組み合わせると、TUJ1陽性皮質の厚さには明らかな差が生じなくなる可能性が高い。 スニップ1ネス–KOしてコントロール。
次に、NPC の in vitro 分化を介して SNIP1 をアッセイしました。 形質導入により、1日目または1日目にSNIP5を枯渇させました。 スニップ1[flox/flox] 14日目のレンチウイルスコントロールまたはCreを持つNPCとプロファイリングされた遺伝子発現(補足図。 7f)。 定量的qPCRは、対照細胞と比較して、SNIP1枯渇細胞がニューロンマーカーおよびグリアマーカーを上方制御するが、NPCマーカーは上方制御しないことを示した(補足図)。 7g、h)。 SNIP1枯渇のタイミング(1日目と5日目)は、この遺伝子発現パターンに影響を与えませんでした(補足図)。 7g、h)。 これらの結果は、SNIP1 が NPC における神経新生を抑制することをさらに裏付けています。 ゼブラフィッシュ胚におけるSnip1のグローバルノックアウト(KO)により、GABA作動性ニューロンとグルタミン酸作動性ニューロンが減少する35我々は、SNIP1の枯渇がマウスのサブニューロン系統の仕様を変えるかどうかを尋ねた。 脳組織が大幅に失われるため、 スニップ1ネス–KO、E13.5以降の脳の発達をしっかりと分析することはできませんでした。 E13.5でのGABA作動性ニューロンマーカーの転写レベル ガド1 & Slc6a1 より低かった スニップ1ネス–KO、およびグルタミン酸作動性ニューロンマーカーには差はありませんでした。 スニップ1ネス–KOとコントロール(補足図) 7i、j)。 免疫蛍光の定量化により、GABA (GABA作動性ニューロンマーカー) 陽性細胞が有意に低下していることが示されました。 スニップ1ネス-KO (補足図。 7k、l)、サブニューロン系統の特定におけるSNIP1の関与が高次の種でも保存されている可能性があることを示唆しています。
SNIP1はH3K27修飾により遺伝子を直接調節する
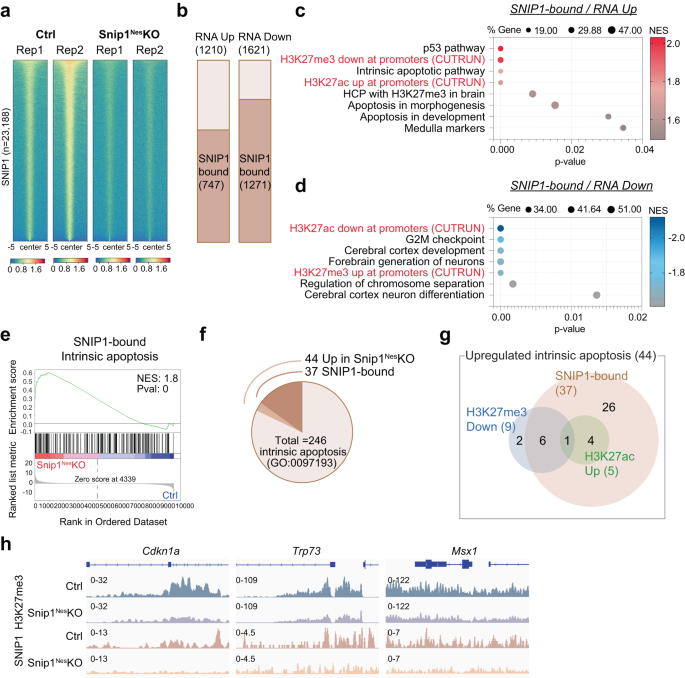
SNIP1タンパク質が遺伝子座に直接結合してその発現を調節しているかどうかを判断するために、CUT&RUNによってSNIP1のゲノム全体の分布をプロファイリングしました。51 in スニップ1ネス- NPCをKOしてコントロールします。 SICERの使用52 とMACS253 FDR < 0.05 で、対照とそれぞれの 2 つのデータセットを比較します。 スニップ1ネス–KO、我々は対照NPCでは23,188個のSNIP1結合領域を特定したが、対照NPCでは4187個の領域のみを特定した スニップ1ネス–KO NPC (補足図) 8a – c)。 4187 個の領域は対照領域の 18% であり、体内の残存 SNIP1 タンパク質の結果です。 スニップ1ネス–KO NPC (図 1a)。 ヒートマップは、SNIP1 CUT&RUN シグナルの大幅な減少を示しました。 スニップ1ネス-KO、NPCにおけるSNIP1 CUT&RUNの高い特異性を示唆しています(図XNUMX)。 3a)。 SNIP50 結合ピークの約 1% はプロモーター内 (転写開始部位の 2 kb 以内) にあり、7.4% はエクソンに、23.3% はイントロンに、0.7% は転写終結部位に、9.7% は 5' 遠位 (2-50) にありました。遺伝子からのkb)領域、3.4'遠位(遺伝子から3〜2 kb)領域で50%、遺伝子間(遺伝子から5.5 kbを超える)領域で50%(補足図)。 8d)。 SNIP18.6 結合ピークの 1% のみが遺伝子の遠位に位置していました (補足図)。 8d).
a コントロールおよびコントロールにおける SNIP2 CUT&RUN の 1 つの生物学的複製の結合強度を表すヒートマップ スニップ1ネス–NPCをKOします。 すべての 5 SNIP23,188 CUT&RUN ピークの両側の 1 kb の結合強度が表示されます。 青は強度が低いことを示し、赤は強度が高いことを示します。 b 上方制御および下方制御された遺伝子の数を表示する棒グラフ (スニップ1ネス–KO vs. コントロール、FDR < 0.05)、遺伝子本体で SNIP1 に結合されています。 c, d 上方制御された遺伝子および下方制御された遺伝子となったSNIP1結合遺伝子の濃縮された遺伝子セットのバブルプロット スニップ1ネス-KO 対コントロール NPC。 H3K27me3/ac CUT&RUN データを GSEA 遺伝子セットに追加すると、H3K27me3 および H3K27ac レベルはそれぞれ逆相関および遺伝子発現との相関を示しました。 ソース データはソース データ ファイルで提供されます。 e 上方制御された遺伝子の代表的な GSEA スニップ1ネス-KO NPC と、制御 NPC 内の SNIP1 によってバインドされている制御 NPC の比較。 内因性アポトーシス遺伝子はほとんどが SNIP1 に結合しており、上方制御される遺伝子が豊富でした。 スニップ1ネス- NPCをKOします。 差次的に発現される遺伝子は、最初にその変化倍数によってランク付けされ、 p-GSEA が実行される前の値。 f 上方制御される内因性アポトーシス遺伝子の割合を示す円グラフ。 スニップ1ネス- NPC を KO する、および/または SNIP1 によってバインドされる。 g 上方制御された内因性アポトーシス遺伝子の数を 3 つのカテゴリーで表示したベン図。 SNIP1、H3K27me3、および H3K27ac CUT&RUN データを使用して、44 個の遺伝子は、1) コントロール NPC の SNIP1 結合、2) コントロール NPC の H3K27me3 レベルの低下に分類されました。 スニップ1ネス-KO 対コントロール NPC (p < 0.05)、および/または 3) H3K27ac レベルの増加 スニップ1ネス-KO 対コントロール NPC (p <0.05)。 h H3K27me3 および SNIP1 CUT&RUN トラックは、上方制御された内因性アポトーシス遺伝子で Integrative Genomics Viewer (IGV) によって視覚化されました。 Cdkn1a、Ch17: 29,090,888 − 29,095,850。 TRP73、Ch4: 154,132,565 − 154,143,373。 msx1、Ch5: 37,818,429 − 37,828,924。
次に、SNIP1 占有率が遺伝子発現と相関するかどうかを調べました。 1210 個の上方制御遺伝子と 1621 個の下方制御遺伝子のうち、 スニップ1ネス-KO、対照NPCでは、それぞれ747人(62%)と1,271人(78%)がSNIP1標的であった(図XNUMX)。 3b)。 これらの重複は重要であり、 p 超幾何検定によると = 5.55e-25 および 2.24e-155 (合計 21,636 個の発現遺伝子が与えられた場合) であり、SNIP1 がこれらの遺伝子を占有して発現を制御していることが示唆されます。 GSEAは、SNIP1が上方制御されるようになった標的であることを示した。 スニップ1ネス–KO は、p53 経路、髄質/中脳、およびアポトーシスに富んでいました (図 XNUMX)。 3c)、一方、SNIP1 は下方制御されたターゲットをターゲットとします。 スニップ1ネス–KO では、G2/M チェックポイント、皮質発達、および染色体分離が豊富でした(図 XNUMX)。 3d)。 下方制御された1,621個の遺伝子のうち、 スニップ1ネス–KO、1,093はSNIP1結合(PRC2結合ではない)であり、G2-Mチェックポイント、有糸分裂紡錘体、神経発達の主要なシグナル伝達経路、およびアポトーシスの遺伝的プログラムが豊富でした(補足図。 8e)、SNIP1がそれらの発現を促進することを示唆しています。 内因性アポトーシス遺伝子は、上方制御される SNIP1 標的に富んでいました。 スニップ1ネス-KO(図 3e、f、補足図 8f、g)。 内因性アポトーシス遺伝子セットの 44 個の遺伝子のうち、37 個のプロモーターがコントロール NPC の SNIP1 に結合しました (p = 4.62e-5; イチジク。 3g)、SNIP1 がこれらの遺伝子を直接抑制することを示唆しています。 これらのデータは、SNIP1 がアポトーシスと細胞周期に重要な遺伝プログラムを直接制御していることを示唆しています。
上方制御された遺伝子 スニップ1ネス-KO には、1) 胎児マウスの脳で H3K27me3 が占有されている高 CpG 密度プロモーターを持つ遺伝子が豊富に含まれていました。50 または 2) マウス NPC の二価54 (補足図 9a、b)。 このことから、SNIP1 が H3K27 の改変を通じて遺伝プログラムを制御しているかどうかを精査するようになりました。 H3K27me3 と H3K27ac を CUT&RUN でプロファイリングしました。 スニップ1ネス-KOおよびコントロールSOX2陽性NPC(補足図) 9c–g)。 我々は、上方制御された遺伝子、低いH3K27me3占有率、およびより高いH3K27ac占有率の間に強い相関関係を観察したが、下方制御された遺伝子はより高いH3K27me3占有率とより低いH3K27ac占有率を有していた。 スニップ1ネス-KO(図 3c、d、補足図 9時間、私は)。 上方制御された 44 個の内因性アポトーシス遺伝子のうち、9 個の遺伝子が H3K27me3 占有率の減少を示し、5 個の遺伝子が H3K27ac 占有率の増加を示しました (p < 0.05、図。 3g、h、補足図 9j、k)。 これらのデータは、クロマチンの SNIP1 が H3K27 の修飾と遺伝子発現を制御していることを示唆しています。
TGFβおよびNFκBシグナル伝達経路はSNIP1のクロマチンへの局在を制御する
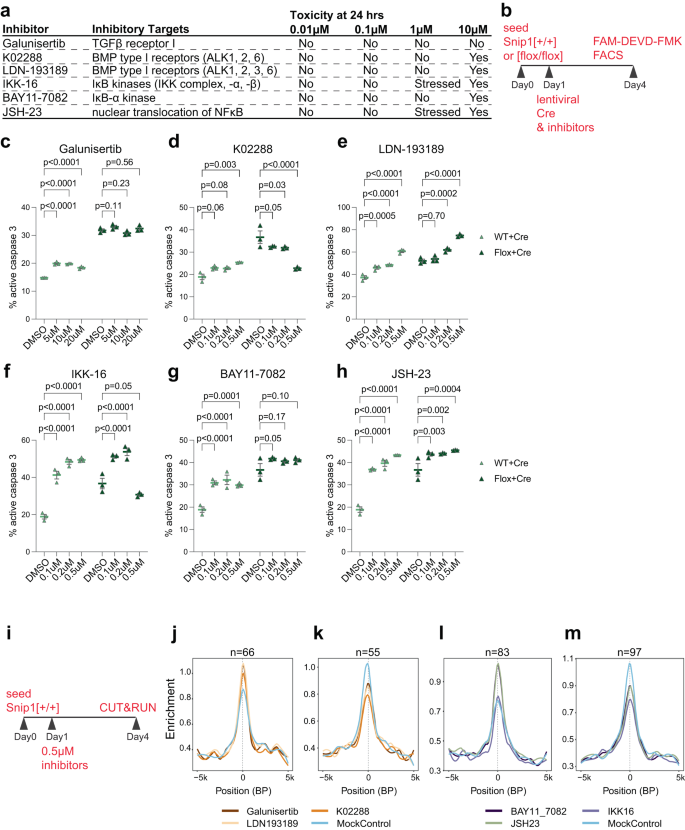
SNIP1はTGFβに参加するので22,23,24,25 およびNFκB26,27,28,29,30 私たちは、シグナル伝達経路の阻害が SNIP1 枯渇 NPC のアポトーシスに影響を与えるかどうかをテストすることを目的としました。 私たちは、TGFβ または NFκB シグナル伝達に対する 3 つの阻害剤の NPC に対する毒性をテストしました (図 XNUMX)。 4a、b)。 0.1 ~ 0.5 μM の濃度で、TGFβ を標的とする K02288 (Galunisertib や LDN-193189 ではない) は、SNIP1 枯渇 NPC のアポトーシスを一貫して減少させました (図 XNUMX)。 4c–e)。 対照的に、TGFβシグナル伝達に対する2つの阻害剤とNFκBシグナル伝達に対する3つの阻害剤は、NPCのアポトーシスを増加させました(図XNUMX)。 4f–h)。 したがって、6 つの阻害剤のいずれかが SNIP1 のクロマチンへの結合を変化させるかどうかをテストすることにしました。 NPCをDMSOまたは0.5μMの阻害剤で3日間処理し、CUT&RUNを実行してクロマチン上のSNIP1局在をアッセイしました(図XNUMX)。 4i)。 治療条件ごとに 2 つの複製 SNIP1 CUT&RUN データを分析し、 p < 0.05 は、阻害剤治療と対照治療の間の SNIP1 CUT&RUN シグナルの有意かつ一貫した差異を特定します。 K1治療によって誘発されるSNIP02288 CUT&RUN変化を特定しました(補足データ) 1)。 また、任意の 1 つの阻害剤治療で重複する SNIP1 結合遺伝子における SNIP2 CUT&RUN の重大な変化も特定しました(補足データ) 1)。 さまざまな阻害剤で処理したNPCのSNIP1結合プロモーターにおけるSNIP1 CUT&RUNシグナルの平均プロファイリングにより、TGFβに対する阻害が確認されました(図XNUMX)。 4j、k) と NFκB (図 XNUMX) 4リットル、メートル) シグナル伝達により、SNIP1 のプロモーターへの結合が大幅に変化しました。 これらのデータは、TGFβ および NFκB シグナル伝達経路が NPC の特定の遺伝子座への SNIP1 結合を制御していることを示唆しています。
a TGFβ および NFκB シグナル伝達経路の成分とその細胞毒性をさまざまな濃度で標的とする阻害剤。 b 阻害剤アッセイの概略図。 1日目、WTまたは スニップ1[flox/flox] NPC を阻害剤または DMSO で処理し、SNIP1 枯渇のためにレンチウイルス Cre を形質導入しました。 3日目にFACSによるcl-カスパーゼ4のアッセイにFAM-DEVD-FMKを使用しました。 c-h FACSによって定量化された、活性なカスパーゼ3を有する細胞の割合。 阻害剤を、mCherry-Cre レンチウイルスとともにさまざまな濃度で添加しました。 FAM-FLICA (活性型カスパーゼ 3)-/mCherry-ダブル陽性集団 (mCherry 陽性集団のうち) の割合を示します。 N = 治療ごとに 3。 データは平均±SEMとして表され、統計分析には二元配置分散分析が使用されました。 代表的な FACS プロットを補足図に示します。 14c、d。 ソース データはソース データ ファイルで提供されます。 i 阻害剤処理を行った SNIP1 CUT&RUN の概略図。 1日目に、NPCをDMSO対照または異なる阻害剤で処理した。 1 日目に 7 つの治療のそれぞれについて、反復 SNIP4 CUT&RUN を実行しました。 j–m 阻害剤対DMSO対照処理において有意に高いまたは低いSNIP1結合を有するSNIP1結合標的におけるNPCにおけるSNIP1の結合強度の中央値を比較するプロファイルプロット。 n はリージョン番号を示します。 SNIP1レベルが低下した場合、その領域は真のSNIP1ターゲットであるとみなされました。 スニップ1ネス-KO 対コントロール NPC p <0.05。
PRC2 はクロマチンへの局在化と H1K3me27 沈着に SNIP3 を必要とします
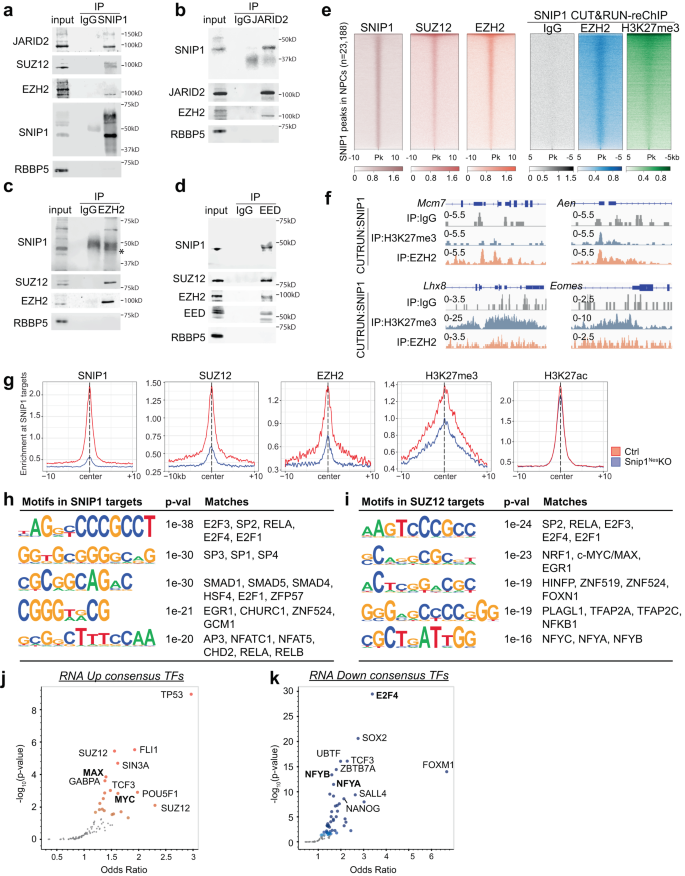
我々は、SNIP1、H3K27 メチルトランスフェラーゼ PRC2、ヒストン アセチルトランスフェラーゼ p300 および CBP の間の相互作用を調査しました。 抗SNIP1抗体は、既知のPRC2サブユニットJumonjiおよびAT-rich相互作用ドメイン含有2(JARID2)、ゼステ12サプレッサー(SUZ12)、およびEZH2と共免疫沈降しましたが、NPC核抽出物中のネガティブコントロールRBBP5とは共免疫沈降しませんでした(図XNUMX)。 5a)。 抗SNIP1抗体は、SNIP2枯渇NPCにおいてPRC1サブユニットと免疫共沈降しなかった(補足図)。 10a)、抗体の特異性を裏付けています。 抗 JARID2、EZH2、または EED 抗体は、NPC 核抽出物中の SNIP1 および他の PRC2 サブユニットを共免疫沈降しましたが、ネガティブ コントロール RBBP5 は共沈降しませんでした (図 XNUMX)。 5b–d)。 抗p300抗体またはCBP抗体はSNIP1を共免疫沈降できず、NPCではそれらの物理的相互作用が検出できないことを示唆しています(補足図。 10b、c)。 PRC2 と SNIP1 の結合は、PRC2 が SNIP1 を免疫共沈降させることを示した他のプロテオミクス研究によって裏付けられています。19,20.
広告 SNIP1とPRC2の間の相互作用を調べるための免疫共沈降とそれに続くWB。 (a) SNIP1、(b) JARID2、(c)EZH2、または(d) EED は NPC 核抽出物中で免疫沈降されました。 RBBP5はネガティブコントロールでした。 ソース データはソース データ ファイルとして提供されます。 e NPC の SNIP1、SUZ12、および EZH2 が豊富に含まれるクロマチン ピークを並べたヒートマップ。 IgG、EZH1、および H2K3me27 を使用した SNIP3 CUT&RUN–reChIP からのピークは、SNIP1 結合ピークと位置合わせされました。 5 個の SNIP10 結合ピークの両側の 23,188 kb または 1 kb の強度が表示されます。 暗い色は強度が高いことを示し、明るい色は強度が低いことを示します。 f IgG、EZH1、および H2K3me27 を使用した SNIP3 CUT&RUN–reChIP のトラックは、Integrative Genomics Viewer (IGV) によって視覚化されます。 Mcm7、Ch5: 138,169,717 − 138,173,621。 阿炎、Ch7: 78,894,526 − 78,898,271。 LHX8、Ch3: 154,325,066 − 154,334,835。 エオメス、Ch9: 118,474,178 − 118,480,775。 g SNIP1、PRC2、および H3K27me3/ac の結合強度の中央値を比較するプロファイル プロット スニップ1ネス- SNIP1 ターゲットでのコントロール NPC に対する KO。 SNIP1レベルが低下した場合、その領域は真のSNIP1ターゲットとみなされました。 スニップ1ネス-KO 対コントロール NPC p <0.05。 h, i SNIP1 および SUZ12 結合領域のモチーフ(レベルが大幅に低下) スニップ1ネス–フォールドチェンジ > 2 の NPC を KO し、 p < 0.05。 HOMER de novo 分析が実行され、最も低い XNUMX つのモチーフが得られました。 p-値と脊椎動物モチーフの一致がここにリストされています。 j, k 差次的に発現する遺伝子 (FDR < 0.05) への結合が報告されている転写因子のボルケーノ プロット。 Enrichr を使用して、ChIP-X データベースの ENCODE および ChEA コンセンサス TF に対して遺伝子を検索しました。56。 暗い色ほど小さく表示されます p-値と大きなポイントが渡されました p-値 < 0.05。 太字の転写因子は、図 5h の CUT&RUN モチーフ分析で見つかりました。
我々は、SNIP1 が PRC2 サブユニットの発現を変化させるかどうかをテストしました。 SNIP1枯渇は低下したが えず2 転写レベルは変化しませんでしたが、PRC2サブユニット、H3K27me3、またはH3K27acのタンパク質レベルは変化しませんでした(補足図)。 10D-G)。 次に、CUT&RUN を実行して SUZ12 と EZH2 のプロファイルを作成しました。 スニップ1ネス-KOおよびコントロールNPC(補足図) 10時間~XNUMX時間)。 免疫共沈降の結果と一致して、SUZ12 と EZH2 はゲノム全体で SNIP1 結合標的部位を共占します (図 XNUMX)。 5e)。 クロマチン上の PRC2-SNIP1 相互作用を分析するために、CUT&RUN-reChIP を実行しました。 このアッセイでは、SNIP1 CUT&RUN によって放出されたクロマチンが IgG、EZH2、または H3K27me3 によって免疫沈降されました。 代表的な遺伝子座 Mcm7, 阿炎, LHX8, エオメス SNIP1はEZH2およびH3K27me3と共占有していましたが、ネガティブコントロールIgGは共占していませんでした(図XNUMX)。 5f)。 ゲノムワイドの CUT&RUN-reChIP は、EZH2 および H3K27me3 が SNIP1 結合ピークで SNIP2 および PRC1 と高い重複を有することを示しました (図 XNUMX)。 5e).
PRC1クロマチン占有におけるSNIP2の役割を調べると、クロマチンにおけるSUZ12、EZH2、およびH3K27me3のレベルが有意に低下していることがわかりました。 スニップ1ネス-KO(図 5g、補足図。 10k, 11a)。 対照的に、H3K27ac レベルはあまり変化しませんでした。 スニップ1ネス-KO NPC (図 5g、補足図。 10k, 11a)。 次に、in vitro アッセイを使用して、PRC1 に対する SNIP2 枯渇の動態効果を分析しました。 対照レンチウイルスと比較して、レンチウイルスのCre形質導入は スニップ1[flox/flox] NPC は 1 日目と 70 日目にそれぞれ 99.9% と 2% SNIPXNUMX 転写物を枯渇させました。 これは、PRCXNUMXコンポーネントの転写レベルを変更しませんでした(補足図。 11b)。 EZH2およびSUZ12 CUT&RUNを使用して、SNIP2枯渇の1日目までにクロマチン上のPRCXNUMXの強力な減少が観察されました(補足図XNUMX)。 11c)。 これらのデータを総合すると、PRC2 がクロマチンに結合するには SNIP1 が必要であることが裏付けられます。
SNIP1-PRC2ターゲットを特徴付けるために、HOMERソフトウェアによるde novoモチーフ発見を実行しました。55。 フォールドチェンジ >2 の基準を使用し、 p < 0.05 対照 vs スニップ1ネス-KO、SNIP1 ターゲットには、E2F タンパク質、SP1/3/4、および EGR1 のモチーフが豊富にありました (図 XNUMX)。 5h)。 以前に報告されたSNIP1インタラクターであるSMADタンパク質およびRELAのモチーフも、SNIP1標的の中に見出された21,26。 結合が減少した SUZ12 結合ピークでは、 スニップ1ネス-KO モチーフには、SP2、RELA、E2F タンパク質、EGR1、HINFP、PLAGL1、および NF-Y サブユニットが豊富に含まれていました (図 XNUMX)。 5i)。 SNIP1 および SUZ12 結合モチーフの類似性は、SNIP1 および PRC2 とこれらの転写因子の一部との潜在的な相互作用を示しています。
次に、SNIP1結合モチーフまたはSUZ12結合モチーフが差次的に発現される遺伝子で過剰発現するかどうかを調べました。 エンリッチの使用56の遺伝子が上方制御されることを発見しました。 スニップ1ネス-KO は TP53、FLI1、SUZ12、MAX、および MYC の標的であったのに対し、下方制御された遺伝子は E2F4、SOX2、NFYB、および NFYA の標的でした (図 XNUMX)。 5j、k)。 E2F タンパク質はモチーフ解析と Enrichr 解析によって明らかになり、E2F4 ターゲットも明らかになりました Mcm7 & Anp32e 結合が減少したSNIP1およびPRC2ターゲットでした。 スニップ1ネス-KO(図 5k、補足図 11d)。 上方制御された遺伝子の中には、 スニップ1ネス-KO、MYC、および MAX ターゲットは、モチーフ分析と Enrichr 分析の両方によって同定されました (図 XNUMX)。 5j、補足図 11e)。 これらのデータは、E2F タンパク質、MYC、および MAX が遺伝子調節のための SNIP1-PRC2 活性に影響を与える可能性があることを示唆しています。
PRC2はSNIP1の非存在下でアポトーシスを促進する
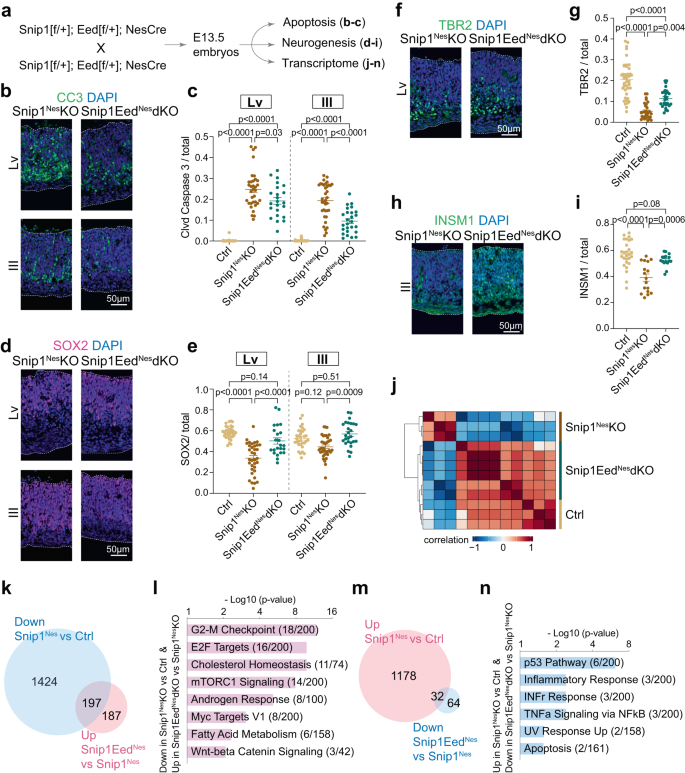
我々は、インビボでのNPC生存におけるPRC2の役割を試験した。 私たちが使用した ネス::Cre はエクソン 3 ~ 6 を切除します。 イード (PRC2 コア サブユニット) を生成する イードネス-KOと スニップ1ネス-イードネス-dKO (補足図。 12a、b)。 NPCのEED枯渇はアポトーシスを誘発しなかった イードネス-KO E13.5 脳 (補足図。 12c–g)。 他の研究者は対照群で EED を研究しており、 イードエム×1-背側終脳をKOし、結論を出した57 それは私たちの観察とは異なりました イードネス-KO E13.5の脳。 この違いは次の式で説明できます。 エム×1::クレと ネス::さまざまな発達段階と脳領域のCre。 アポトーシスは、制御されている他の脳領域でも観察され、 イードネス-KOの脳(補足図。 12c、d)。 EED は E14.5 では神経新生に影響を与えるが、E16.5 では影響しないことがすでに示されているため57、NPC 機能に対する EED/PRC2 の正確な影響は、発生段階と細胞の状況に依存します。 私たちの分析によると、 スニップ1ネス–KO、 スニップ1ネス-イードネス-dKO では、cl-カスパーゼ 3 陽性細胞が大幅に減少しました (図 XNUMX)。 6a – c)、SOX2 陽性の NPC が増加(図 6d、e)、およびさらに多くのTBR2またはINSM1陽性の中間前駆細胞(図XNUMX)。 6f-i)。 TUJ1陽性の未熟ニューロンは、SNIP1-PRC2の機能的相互作用によって顕著な影響を受けませんでした(補足図)。 12時間、私は)。 EED の枯渇 スニップ1ネス–KO 胚脳はアポトーシスを減少させ、NPC と中間前駆細胞を救出しました。 したがって、SNIP1 は PRC2 に対抗することによって、発達中の脳におけるアポトーシスを抑制します。
a 下流アッセイ用の SNIP1 と EED の両方を枯渇させる遺伝子交差の概略図。 b, c E3 脳の DAPI と重ね合わせた CC13.5 の IF 分析。 バー、50μm。 各データ ポイントは 7 つの画像を表します。 対照胚 XNUMX 個、XNUMX 個 スニップ1ネス-KO 胚、および 5 スニップ1ネス-イードネス-dKO胚を分析した。 側脳室の場合、 n = 38 画像 (コントロール)、 n = 34(スニップ1ネス-KO)、そして n = 23(スニップ1ネス-イードネス-dKO)。 第三脳室の場合は、 n = 38 (コントロール)、 n = 36(スニップ1ネス-KO)、そして n = 26(スニップ1ネス-イードネス-dKO)。 d-i NPC マーカー SOX2、中間前駆細胞マーカー TBR2 および INSM1 の IF を E13.5 脳の DAPI と重ね合わせたもの。 バー、50μm。 (の人口)e) SOX2 陽性、(g) TBR2 陽性、または (i) 側脳室および/または第三脳室の神経上皮内層における INSM1 陽性細胞を定量しました。 各データ ポイントは XNUMX つの画像を表します。 の (g), n = 43 画像 (コントロール)、 n = 30(スニップ1ネス-KO)、そして n = 29(スニップ1ネス-イードネス-dKO)。 の (i), n = 27 (コントロール)、 n = 17(スニップ1ネス-KO)、そして n = 16(スニップ1ネス-イードネス-dKO)。 パネル用 c, e, g, i、データは平均±SEMとして表され、統計分析には二元配置分散分析が使用されました。 j コントロールからの RNA-seq データの教師なしクラスタリング (n = 3)、 スニップ1ネス-KO (n = 3)、そして スニップ1ネス-イードネス-dKO (n = 6) E13.5 の脳。 前脳および中脳領域からの RNA の配列が決定され、下流の分析のために統合されました。 青は負の相関を示し、赤は正の相関を示します。 k, m FDR < 0.05 で発現差のある遺伝子の数を示すベン図。 下方制御された遺伝子のリスト スニップ1ネス- KO 対 対照および上方制御された遺伝子 スニップ1ネス-イードネス-dKO vs. スニップ1ネス-KO は (k)。 アップレギュレートされた遺伝子のリスト スニップ1ネス-KO 対 対照および下方制御された遺伝子 スニップ1ネス-イードネス-dKO vs. スニップ1ネス-KO は (m). l, n 図に対応するレスキューされた遺伝子の遺伝子オントロジー。 6k、メートル。 Enrichr を使用して、Molecular Signatures Database (MSigDB) Hallmark 2020 に対して遺伝子を検索しました。56。 ソース データはソース データ ファイル (c, e, g, i, l, n).
私たちはコントロールのトランスクリプトームをプロファイリングしました。 スニップ1ネス–KO、そして スニップ1ネス-イードネス-dKO 脳組織。 上位 3,000 個の最も差次的に発現された遺伝子 (変動中央値に基づく) に基づく教師なしクラスタリングは、対照と遺伝子の間のトランスクリプトームの類似性が高いことを示唆しています。 スニップ1ネス-イードネス-dKO との比較 スニップ1ネス–KO(図 6j)。 フォールドチェンジ>2を使用し、 p データセットを比較するには < 0.05 スニップ1ネス-KO & スニップ1ネス-イードネス-dKO、我々は184個の上方制御された遺伝子と994個の下方制御された遺伝子を同定した スニップ1ネス-イードネス-dKO (補足図。 13a).
NPCおよび中間前駆細胞の救出についての分子的説明の可能性を提供すること。 スニップ1ネス-イードネス-dKO、対照間で差次的に発現された遺伝子を分析しました。 スニップ1ネス-イードネス-dKO、および スニップ1ネス-KO。 私たちは、197 個の遺伝子が下方制御されていることを発見しました。 スニップ1ネス–KOは部分的に発現を回復した スニップ1ネス-イードネス-dKO (図 6k)。 これらの救出された遺伝子は、G2/M チェックポイント、E2F ターゲット、コレステロール恒常性、mTORC1 シグナル伝達、およびアンドロゲン応答に関与しています (図 XNUMX)。 6l)。 対照的に、32 個の遺伝子が上方制御され、 スニップ1ネス-KO でダウンレギュレートされた スニップ1ネス-イードネス-KO (イチジク。 6m)そして、p53経路、炎症反応およびインターフェロンガンマ反応、NFκBシグナル伝達、およびアポトーシスに関与しています(図XNUMX)。 6n)。 これら 32 個の遺伝子のうち、 Cdkn1a は、H3K27me3 レベルが著しく低い唯一の内因性アポトーシス遺伝子です。 スニップ1ネス-KO 対対照(FDR < 0.05;補足図) 13b)、SNIP1がPRC2とH3K27me3を直接促進することを示唆しています。 Cdkn1a 軌跡。 SNIP1-PRC2ゲノム占有率のプロファイリングは、SNIP1がE3F標的を含む遺伝子座でのH27K3me2沈着を阻害することを示唆しています(補足図)。 11d)しかし、アポトーシス遺伝子を含む他の遺伝子座での H3K27me3 沈着を促進します Cdkn1a、Nkx2-9、 Etv4, Pxdc1, タップ1 (補足図 13b、c)。 まとめると、SNIP1 は、発達中の脳における NPC 分裂、アポトーシス、分化のバランスをとるために、H3K27me3 の沈着と遺伝子発現を遺伝子座依存的に制御します。
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 自動車/EV、 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- ブロックオフセット。 環境オフセット所有権の近代化。 こちらからアクセスしてください。
- 情報源: https://www.nature.com/articles/s41467-023-40487-4