17 年 2024 月 XNUMX 日
(Nanowerkニュース)金沢大学ナノ生命科学研究所(WPI-NanoLSI)の研究者らが報告した。 ナノの手紙 (「E6AP E3リガーゼHECTドメインの構造動態とユビキチン鎖合成機構における柔軟なヒンジループの関与」)タンパク質ヒンジの柔軟性が、重要な細胞プロセスにおけるタンパク質の輸送においてどのように重要な役割を果たすか。
アイキャッチ画像:E6AP HECTドメインの立体構造変化のリアルタイム観察とシミュレーション。
HECT ドメインは、柔軟な領域を通じて球形と楕円形の立体構造を繰り返します。コンピューターシミュレーションの結果、球形が触媒構造に対応し、楕円形がL字型構造に対応することがわかりました。ユビキチン二量体(Ub2)の形成効率は、柔軟なヒンジ領域の構造状態に応じて大きく変化します。 ユビキチン化 (タンパク質のユビキチンの付加) は、タンパク質の分解、DNA 修復、シグナル伝達など、多くの細胞プロセスにおける重要な段階です。金沢大学WPI-NanoLSIの今野広樹氏とホルガー・フレヒシグ氏率いる研究者らは、高速原子間力顕微鏡(HS-AFM)と分子モデリングを用いて、ユビキチン化に関連する酵素ヒンジの可動性がどのようにしてユビキチン化の発生を可能にするのかを特定した。 これまでの研究では、ユビキチンを活性化する酵素(E1)、ユビキチンを結合させる酵素(E2)、ユビキチンタンパク質と標的タンパク質の結合を触媒する酵素(すなわちリガーゼ、E3)など、ユビキチン化を促進する酵素が多数同定されている(図1)。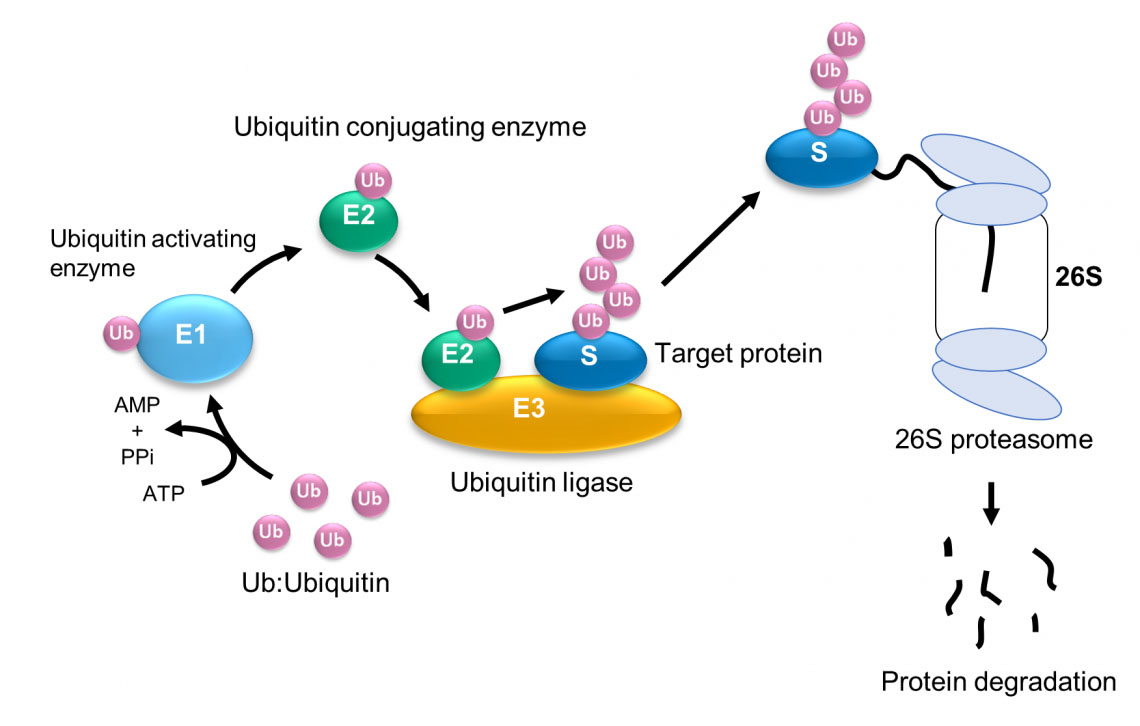 図 1: ユビキチン-プロテアソーム系によるタンパク質のユビキチン化と分解。 (© 2023 タケダ)
HECT 型 E3 リガーゼは、E2 結合部位を持つ N ローブと触媒作用のある Cys 残基を持つ C ローブで構成される HECT ドメインによって特徴付けられます。柔軟なヒンジが 2 つのローブを接続しており、ユビキチン化が促進されるという仮説につながります。このヒンジの周りのタンパク質の再配置。今野氏とその共同研究者らは、これが事実であるという証拠を探すために高速原子間力顕微鏡を導入した。
研究者らは、HECTドメインをある種のE2酵素で結晶化すると、HECTドメインの触媒作用を有するCys残基とE41酵素の触媒作用を有するCys残基との間の距離が8ÅとなるL字型を形成したことに注目した。ユビキチンの転移。しかし、HECT ドメインの触媒立体構造は異なる形状をしており、6 つの触媒 Cys 残基間の距離がわずか 2 Å と非常に近いため、これは「触媒立体構造」であると考えられています。
E16AP の野生型 HECT ドメインの HS-AFM 画像の分析により、2 つの立体構造が明らかになりました。2 つは球形、もう XNUMX つは楕円形に見えました (図 XNUMX)。 AFMシミュレーションを使用して、彼らは楕円形はL立体配座に起因し、球形は触媒立体配座またはいわゆる逆T型立体配座のいずれかであると考えました。これは、Cys残基間の距離がXNUMXÅである別のタイプのHECTドメインで観察されていました(図XNUMX)。イメージングの時空間分解能の限界を克服するために、実験は分子モデリングによって補完され、HECT ドメインの立体構造の動きを原子レベルで視覚化しました。シミュレーション AFM を使用して、対応する疑似 AFM ムービーを生成しました。このムービーでは、球形から楕円形のトポグラフィーへの変化が明確に示されています (図 XNUMX)。
図 1: ユビキチン-プロテアソーム系によるタンパク質のユビキチン化と分解。 (© 2023 タケダ)
HECT 型 E3 リガーゼは、E2 結合部位を持つ N ローブと触媒作用のある Cys 残基を持つ C ローブで構成される HECT ドメインによって特徴付けられます。柔軟なヒンジが 2 つのローブを接続しており、ユビキチン化が促進されるという仮説につながります。このヒンジの周りのタンパク質の再配置。今野氏とその共同研究者らは、これが事実であるという証拠を探すために高速原子間力顕微鏡を導入した。
研究者らは、HECTドメインをある種のE2酵素で結晶化すると、HECTドメインの触媒作用を有するCys残基とE41酵素の触媒作用を有するCys残基との間の距離が8ÅとなるL字型を形成したことに注目した。ユビキチンの転移。しかし、HECT ドメインの触媒立体構造は異なる形状をしており、6 つの触媒 Cys 残基間の距離がわずか 2 Å と非常に近いため、これは「触媒立体構造」であると考えられています。
E16AP の野生型 HECT ドメインの HS-AFM 画像の分析により、2 つの立体構造が明らかになりました。2 つは球形、もう XNUMX つは楕円形に見えました (図 XNUMX)。 AFMシミュレーションを使用して、彼らは楕円形はL立体配座に起因し、球形は触媒立体配座またはいわゆる逆T型立体配座のいずれかであると考えました。これは、Cys残基間の距離がXNUMXÅである別のタイプのHECTドメインで観察されていました(図XNUMX)。イメージングの時空間分解能の限界を克服するために、実験は分子モデリングによって補完され、HECT ドメインの立体構造の動きを原子レベルで視覚化しました。シミュレーション AFM を使用して、対応する疑似 AFM ムービーを生成しました。このムービーでは、球形から楕円形のトポグラフィーへの変化が明確に示されています (図 XNUMX)。
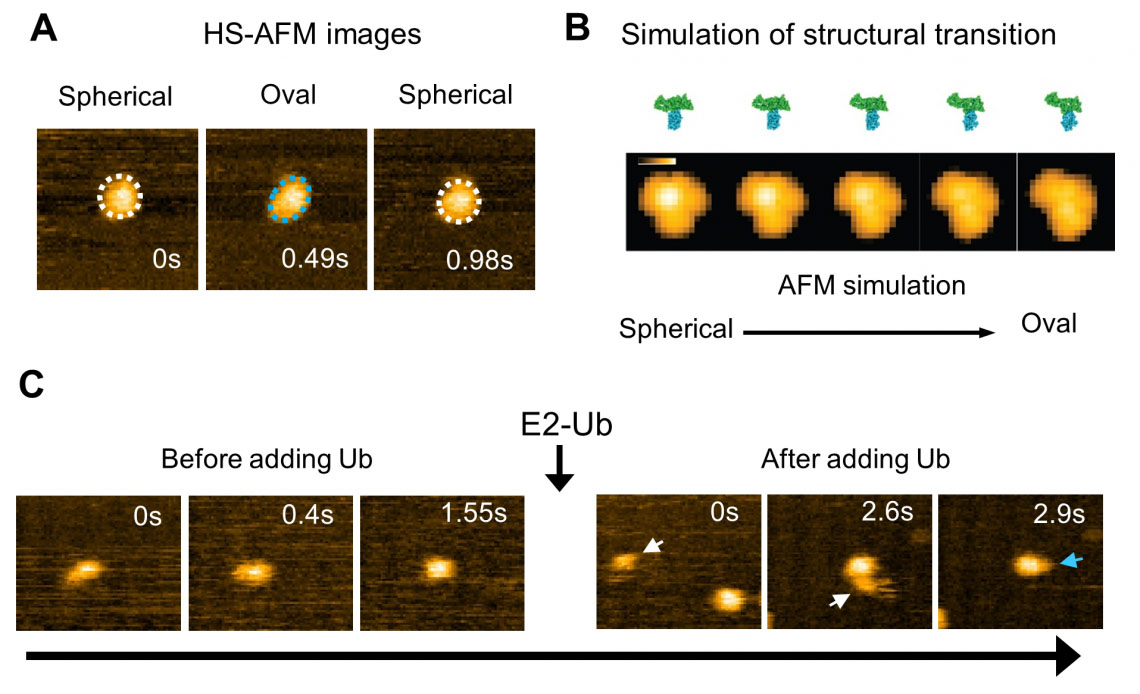 図2:E6APのHECTドメインの構造ダイナミクスの高速AFM観察とシミュレーション。 (A) HECT ドメインの HS-AFM 画像。球形(白い点線)と楕円形(青い点線)の立体配座状態が観察されました。 (B) HECT ドメインの構造状態の遷移過程のシミュレーションとその擬似 AFM 画像。 (C) ユビキチン (Ub) が E2 から E3 (HECT ドメイン) に転送されます。ユビキチンを含む E2 (E2-Ub) を付加すると、E2-Ub (白矢印) が HECT ドメインに結合し、E2 が解離した後、ユビキチンと思われる小さな粒子 (青矢印) が HECT ドメインに付加されます。 。 (© 2023 タケダ)
研究者らは研究報告の中で「実験上の限界により、中間構造を解明することはできない」と説明している。 「実行されたモデリングは、HS-AFM で観察された球形と楕円形の HECT ドメイン形状の間の遷移が、C ローブが N ローブに対して回転する機能的な立体配座運動に対応し、それによって触媒作用と L 字型の間の変化を可能にするという証拠を提供します。」 HECT 構造。」
ヒンジの柔軟性が低い変異型 HECT ドメインを用いたさらなる実験では、立体構造間で反転がないことが明らかになりました。変異型 HECT ドメインは触媒立体構造に固定されていました。彼らはまた、これらの変異型 HECT ドメインが野生型より効率的に結合した 6 つのユビキチンタンパク質を形成できることも発見しました。
この研究における HECT 型 E3 である E6AP は、ヒトパピローマウイルス (HPV) 由来の E53 タンパク質と相互作用し、腫瘍抑制タンパク質である p53 をユビキチン化します。 E6AP および E6 による p53 のユビキチン化が子宮頸がんの主な原因であることも知られています。しかし、E6AP と E6 タンパク質の相互作用による p6 ユビキチン化のメカニズムは不明のままです。今後は、E6AP/E6、HS-AFMによるE6AP/E53/p6複合体の構造動態を解明し、E53がどのようにしてE6APによるpXNUMXユビキチン化活性を高めるのかを明らかにする予定である。
図2:E6APのHECTドメインの構造ダイナミクスの高速AFM観察とシミュレーション。 (A) HECT ドメインの HS-AFM 画像。球形(白い点線)と楕円形(青い点線)の立体配座状態が観察されました。 (B) HECT ドメインの構造状態の遷移過程のシミュレーションとその擬似 AFM 画像。 (C) ユビキチン (Ub) が E2 から E3 (HECT ドメイン) に転送されます。ユビキチンを含む E2 (E2-Ub) を付加すると、E2-Ub (白矢印) が HECT ドメインに結合し、E2 が解離した後、ユビキチンと思われる小さな粒子 (青矢印) が HECT ドメインに付加されます。 。 (© 2023 タケダ)
研究者らは研究報告の中で「実験上の限界により、中間構造を解明することはできない」と説明している。 「実行されたモデリングは、HS-AFM で観察された球形と楕円形の HECT ドメイン形状の間の遷移が、C ローブが N ローブに対して回転する機能的な立体配座運動に対応し、それによって触媒作用と L 字型の間の変化を可能にするという証拠を提供します。」 HECT 構造。」
ヒンジの柔軟性が低い変異型 HECT ドメインを用いたさらなる実験では、立体構造間で反転がないことが明らかになりました。変異型 HECT ドメインは触媒立体構造に固定されていました。彼らはまた、これらの変異型 HECT ドメインが野生型より効率的に結合した 6 つのユビキチンタンパク質を形成できることも発見しました。
この研究における HECT 型 E3 である E6AP は、ヒトパピローマウイルス (HPV) 由来の E53 タンパク質と相互作用し、腫瘍抑制タンパク質である p53 をユビキチン化します。 E6AP および E6 による p53 のユビキチン化が子宮頸がんの主な原因であることも知られています。しかし、E6AP と E6 タンパク質の相互作用による p6 ユビキチン化のメカニズムは不明のままです。今後は、E6AP/E6、HS-AFMによるE6AP/E53/p6複合体の構造動態を解明し、E53がどのようにしてE6APによるpXNUMXユビキチン化活性を高めるのかを明らかにする予定である。
HECT ドメインは、柔軟な領域を通じて球形と楕円形の立体構造を繰り返します。コンピューターシミュレーションの結果、球形が触媒構造に対応し、楕円形がL字型構造に対応することがわかりました。ユビキチン二量体(Ub2)の形成効率は、柔軟なヒンジ領域の構造状態に応じて大きく変化します。 ユビキチン化 (タンパク質のユビキチンの付加) は、タンパク質の分解、DNA 修復、シグナル伝達など、多くの細胞プロセスにおける重要な段階です。金沢大学WPI-NanoLSIの今野広樹氏とホルガー・フレヒシグ氏率いる研究者らは、高速原子間力顕微鏡(HS-AFM)と分子モデリングを用いて、ユビキチン化に関連する酵素ヒンジの可動性がどのようにしてユビキチン化の発生を可能にするのかを特定した。 これまでの研究では、ユビキチンを活性化する酵素(E1)、ユビキチンを結合させる酵素(E2)、ユビキチンタンパク質と標的タンパク質の結合を触媒する酵素(すなわちリガーゼ、E3)など、ユビキチン化を促進する酵素が多数同定されている(図1)。
 図 1: ユビキチン-プロテアソーム系によるタンパク質のユビキチン化と分解。 (© 2023 タケダ)
HECT 型 E3 リガーゼは、E2 結合部位を持つ N ローブと触媒作用のある Cys 残基を持つ C ローブで構成される HECT ドメインによって特徴付けられます。柔軟なヒンジが 2 つのローブを接続しており、ユビキチン化が促進されるという仮説につながります。このヒンジの周りのタンパク質の再配置。今野氏とその共同研究者らは、これが事実であるという証拠を探すために高速原子間力顕微鏡を導入した。
研究者らは、HECTドメインをある種のE2酵素で結晶化すると、HECTドメインの触媒作用を有するCys残基とE41酵素の触媒作用を有するCys残基との間の距離が8ÅとなるL字型を形成したことに注目した。ユビキチンの転移。しかし、HECT ドメインの触媒立体構造は異なる形状をしており、6 つの触媒 Cys 残基間の距離がわずか 2 Å と非常に近いため、これは「触媒立体構造」であると考えられています。
E16AP の野生型 HECT ドメインの HS-AFM 画像の分析により、2 つの立体構造が明らかになりました。2 つは球形、もう XNUMX つは楕円形に見えました (図 XNUMX)。 AFMシミュレーションを使用して、彼らは楕円形はL立体配座に起因し、球形は触媒立体配座またはいわゆる逆T型立体配座のいずれかであると考えました。これは、Cys残基間の距離がXNUMXÅである別のタイプのHECTドメインで観察されていました(図XNUMX)。イメージングの時空間分解能の限界を克服するために、実験は分子モデリングによって補完され、HECT ドメインの立体構造の動きを原子レベルで視覚化しました。シミュレーション AFM を使用して、対応する疑似 AFM ムービーを生成しました。このムービーでは、球形から楕円形のトポグラフィーへの変化が明確に示されています (図 XNUMX)。
図 1: ユビキチン-プロテアソーム系によるタンパク質のユビキチン化と分解。 (© 2023 タケダ)
HECT 型 E3 リガーゼは、E2 結合部位を持つ N ローブと触媒作用のある Cys 残基を持つ C ローブで構成される HECT ドメインによって特徴付けられます。柔軟なヒンジが 2 つのローブを接続しており、ユビキチン化が促進されるという仮説につながります。このヒンジの周りのタンパク質の再配置。今野氏とその共同研究者らは、これが事実であるという証拠を探すために高速原子間力顕微鏡を導入した。
研究者らは、HECTドメインをある種のE2酵素で結晶化すると、HECTドメインの触媒作用を有するCys残基とE41酵素の触媒作用を有するCys残基との間の距離が8ÅとなるL字型を形成したことに注目した。ユビキチンの転移。しかし、HECT ドメインの触媒立体構造は異なる形状をしており、6 つの触媒 Cys 残基間の距離がわずか 2 Å と非常に近いため、これは「触媒立体構造」であると考えられています。
E16AP の野生型 HECT ドメインの HS-AFM 画像の分析により、2 つの立体構造が明らかになりました。2 つは球形、もう XNUMX つは楕円形に見えました (図 XNUMX)。 AFMシミュレーションを使用して、彼らは楕円形はL立体配座に起因し、球形は触媒立体配座またはいわゆる逆T型立体配座のいずれかであると考えました。これは、Cys残基間の距離がXNUMXÅである別のタイプのHECTドメインで観察されていました(図XNUMX)。イメージングの時空間分解能の限界を克服するために、実験は分子モデリングによって補完され、HECT ドメインの立体構造の動きを原子レベルで視覚化しました。シミュレーション AFM を使用して、対応する疑似 AFM ムービーを生成しました。このムービーでは、球形から楕円形のトポグラフィーへの変化が明確に示されています (図 XNUMX)。
 図2:E6APのHECTドメインの構造ダイナミクスの高速AFM観察とシミュレーション。 (A) HECT ドメインの HS-AFM 画像。球形(白い点線)と楕円形(青い点線)の立体配座状態が観察されました。 (B) HECT ドメインの構造状態の遷移過程のシミュレーションとその擬似 AFM 画像。 (C) ユビキチン (Ub) が E2 から E3 (HECT ドメイン) に転送されます。ユビキチンを含む E2 (E2-Ub) を付加すると、E2-Ub (白矢印) が HECT ドメインに結合し、E2 が解離した後、ユビキチンと思われる小さな粒子 (青矢印) が HECT ドメインに付加されます。 。 (© 2023 タケダ)
研究者らは研究報告の中で「実験上の限界により、中間構造を解明することはできない」と説明している。 「実行されたモデリングは、HS-AFM で観察された球形と楕円形の HECT ドメイン形状の間の遷移が、C ローブが N ローブに対して回転する機能的な立体配座運動に対応し、それによって触媒作用と L 字型の間の変化を可能にするという証拠を提供します。」 HECT 構造。」
ヒンジの柔軟性が低い変異型 HECT ドメインを用いたさらなる実験では、立体構造間で反転がないことが明らかになりました。変異型 HECT ドメインは触媒立体構造に固定されていました。彼らはまた、これらの変異型 HECT ドメインが野生型より効率的に結合した 6 つのユビキチンタンパク質を形成できることも発見しました。
この研究における HECT 型 E3 である E6AP は、ヒトパピローマウイルス (HPV) 由来の E53 タンパク質と相互作用し、腫瘍抑制タンパク質である p53 をユビキチン化します。 E6AP および E6 による p53 のユビキチン化が子宮頸がんの主な原因であることも知られています。しかし、E6AP と E6 タンパク質の相互作用による p6 ユビキチン化のメカニズムは不明のままです。今後は、E6AP/E6、HS-AFMによるE6AP/E53/p6複合体の構造動態を解明し、E53がどのようにしてE6APによるpXNUMXユビキチン化活性を高めるのかを明らかにする予定である。
図2:E6APのHECTドメインの構造ダイナミクスの高速AFM観察とシミュレーション。 (A) HECT ドメインの HS-AFM 画像。球形(白い点線)と楕円形(青い点線)の立体配座状態が観察されました。 (B) HECT ドメインの構造状態の遷移過程のシミュレーションとその擬似 AFM 画像。 (C) ユビキチン (Ub) が E2 から E3 (HECT ドメイン) に転送されます。ユビキチンを含む E2 (E2-Ub) を付加すると、E2-Ub (白矢印) が HECT ドメインに結合し、E2 が解離した後、ユビキチンと思われる小さな粒子 (青矢印) が HECT ドメインに付加されます。 。 (© 2023 タケダ)
研究者らは研究報告の中で「実験上の限界により、中間構造を解明することはできない」と説明している。 「実行されたモデリングは、HS-AFM で観察された球形と楕円形の HECT ドメイン形状の間の遷移が、C ローブが N ローブに対して回転する機能的な立体配座運動に対応し、それによって触媒作用と L 字型の間の変化を可能にするという証拠を提供します。」 HECT 構造。」
ヒンジの柔軟性が低い変異型 HECT ドメインを用いたさらなる実験では、立体構造間で反転がないことが明らかになりました。変異型 HECT ドメインは触媒立体構造に固定されていました。彼らはまた、これらの変異型 HECT ドメインが野生型より効率的に結合した 6 つのユビキチンタンパク質を形成できることも発見しました。
この研究における HECT 型 E3 である E6AP は、ヒトパピローマウイルス (HPV) 由来の E53 タンパク質と相互作用し、腫瘍抑制タンパク質である p53 をユビキチン化します。 E6AP および E6 による p53 のユビキチン化が子宮頸がんの主な原因であることも知られています。しかし、E6AP と E6 タンパク質の相互作用による p6 ユビキチン化のメカニズムは不明のままです。今後は、E6AP/E6、HS-AFMによるE6AP/E53/p6複合体の構造動態を解明し、E53がどのようにしてE6APによるpXNUMXユビキチン化活性を高めるのかを明らかにする予定である。
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- プラトンヘルス。 バイオテクノロジーと臨床試験のインテリジェンス。 こちらからアクセスしてください。
- 情報源: https://www.nanowerk.com/news2/biotech/newsid=64429.php



