編集者様へ,
皮脂腺 (SG) は皮膚表面の脂質生成の 90% に寄与しており、表皮バリアの維持、真皮免疫反応、全身の全身抗菌活性などの適切な皮膚機能の調節に重要な役割を果たしています。1 皮脂脂質の減少は、瘢痕性脱毛症、炎症、慢性かゆみ、皮膚の早期老化などのさまざまな皮膚疾患に関与していると考えられています。2 特に、深い火傷や大規模な皮膚欠損後の瘢痕修復は、付属器官の不可逆的な喪失につながることがよくあります。 SG が欠如しているため、再生された組織は正常な皮膚の構造的および機能的完全性を完全に再現することができません。 したがって、発生能力と脂質産生能力を備えた増殖可能な SG 細胞の生成は、病気、損傷、または老化した皮膚をより良い生活の質で治療するための有望なアプローチとなります。 最近、細胞型特異的転写因子 (TF) による維持が困難なヒト細胞を取得するために、直接的な細胞再プログラミングが広く使用されています。 小分子は、TF を介した細胞の再プログラミングを促進し、移植用のより安全なカスタマイズされた細胞を生成するプロセスを短縮するためにも使用されます。 しかし、ヒト体細胞の SG 細胞への変換はこれまで研究されていません。 ここでは、拡張可能で機能的にコンピテントなヒト SG 細胞の生成を可能にする段階的な再プログラミング戦略について説明しました。
成人の包皮から単離されたヒト表皮ケラチノサイト(HEK)は、qRT-PCRおよび免疫蛍光法でアッセイしたところ、SG細胞の汚染を示さなかった(補足図)。 S1a、b)。 HEK と初代 SG 細胞 (pSC) の比較トランスクリプトーム解析により、上方制御された差次的発現遺伝子 (DEG) が脂肪生成と脂質代謝に関連するいくつかの生物学的プロセスに大きく関与していることが明らかになりました (補足図 S2a)、PPARシグナル伝達経路はKEGG分析によって強化されました(図XNUMX)。 1a)。 したがって、PPARγは、SGの仕様およびパターン形成におけるその独特の役割により、潜在的なSG運命決定因子として選択された。3,4 SG 変換を誘導するために、レンチウイルスを使用して PPARγ を安定的に過剰発現する HEK (HEK-PPARγ) を生成しました。 pLV-CMV-PPARγ-P2A-EGFP ベクトル (補足図 S2b、c)。 KEGG分析は、上方制御されたDEGは主に脂質関連経路に富んでいて、PPARγの過剰発現後にPPARシグナル伝達経路が活性化されたことを示しました(補足図)。 S2d)。 次に、HEK-PPARγ を SG 器官形成分子 EGF、FGF7、および FGF10 を含む SG 誘導培地 (SGIM) に切り替えました。 SGIM で培養された HEK-PPARγ は、その後 HPSM と呼ばれます。 3 日間の曝露後、SG 細胞様形態を持つ HPSM が出現しました(補足図)。 2e)。 qRT-PCR により、以下を含むいくつかの重要な SG 遺伝子が示されました。 AR, ガタ6, CK7、SG 分化マーカーと同様に MUC1 & PLIN2、6日目に顕著に上方制御されました(図XNUMX)。 1b)。 さらに免疫蛍光により、MUC1、CK7、およびFASNを発現するHPSMの割合がそれぞれ29.2±3.2%、37.2±2.7%、および52.9±6.6%であることが示されました(補足図)。 S2f、g).
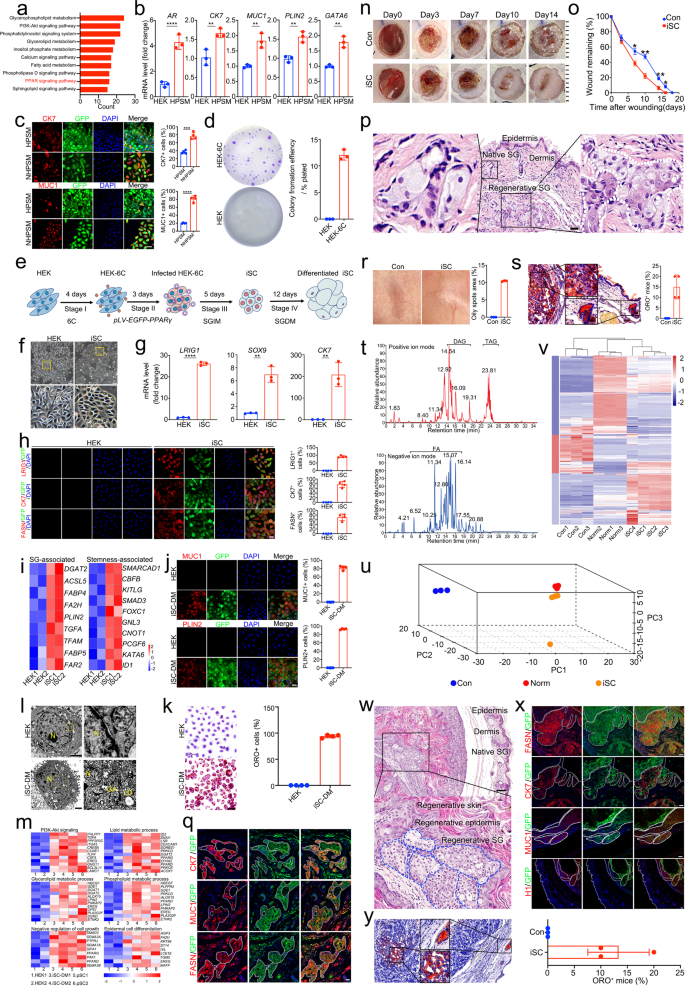
単一遺伝子による皮脂腺の再プログラミング、 パパルグ、および小分子。 a HEKと比較したpSCにおける上方制御された脂質関連遺伝子のKEGG分析。 pSC、初代SG細胞。 b の転写発現の qRT-PCR 分析 AR、CK7、MUC1、PLIN2, ガタ6 HEK と HPSM で。 データは平均値 ± SD として表されます。 n = 3. **p < 0.01; ****p < 0.0001。 HPSM、HEKはPPARγを安定して過剰発現し、SGIMで培養されました。 c HPSM および NHPSM における CK7 および MUC1 の代表的な免疫蛍光 (左) および CK7 の定量分析+ とMUC1+ HPSM と NHPSM のセル (右)。 NHPSM、PPARγを安定して過剰発現し、SGIMで培養された新生児HEK。 スケールバー = 50 μm。 定量化は、ランダムに選択された XNUMX つの個別の顕微鏡視野で行われました。 d HEK および HEK-6C のコロニー形成単位 (CFU) アッセイの代表的な画像 (左) とそれらのコロニー形成効率の定量化 (右)。 n = 3. HEK-6C、化学物質 616452 (6) および CHIR99021 (C) で処理された HEK。 e iSC 再プログラミング図の概略図。 6C (HEK-6C) で 4 日間処理した HEK に PPARγ を導入し、HEK 培地に播種しました。 次に、感染した HEK-6C 細胞を SGIM に移し、指定の日間培養しました。 iSC、誘導された皮脂腺細胞。 SGIM、皮脂腺誘導培地。 SGDM (DM とも呼ばれる)、皮脂腺分化培地。 f HEKと比較したiSCの明らかな形態学的変化を示す位相コントラスト画像。 スケールバー = 100 μm。 挿入図、ボックス領域の高倍率。 g の転写発現の qRT-PCR 分析 CK7, ルリグ1, SOX9 HEK と iSC で。 データは平均値 ± SD として表示されます。 n = 3. **p < 0.01; ****p <0.0001。 h HEK および iSC における LRIG1、CK7、および FASN の代表的な免疫蛍光 (左) および LRIG1 の定量分析+、CK7+、FASN+ HEK と iSC の細胞 (右)。 スケールバー = 25 μm。 定量化は、ランダムに選択された XNUMX つの個別の顕微鏡視野で行われました。 i HEK と比較した iSC のステムネスおよび SG 関連遺伝子のヒートマップ (調整 P 値 < 0.05)。 j HEK および iSC-DM における MUC1 および PLIN2 の代表的な免疫蛍光 (左) および MUC1 の定量分析+ およびPLIN2+ HEK および iSC-DM のセル (右)。 スケールバー = 25 μm。 定量化は、ランダムに選択された XNUMX つの個別の顕微鏡視野で行われました。 iSC-DM、皮脂腺分化培地(DM)で培養されたiSC。 k HEK および iSC-DM でのオイルレッド O (ORO) 染色の代表的な画像 (左)、および HEK および iSC-DM での ORO 染色陽性細胞の定量分析 (右)。 スケールバー = 25 μm。 定量化は、ランダムに選択された XNUMX つの個別の顕微鏡視野で行われました。 l HEKとiSC-DMの超微細構造解析。 スケールバー = 2000 nm。 挿入図、ボックス領域の高倍率。 N、核。 GA、ゴルジ装置。 LD、脂肪滴。 m iSC-DM、pSC、HEK 間の代表的な KEGG 経路と遺伝子発現の GO タームを示すヒートマップ (調整 P 値 < 0.05)。 n 対照マウスおよびiSC処置マウスにおける指定日の創傷治癒の代表的な肉眼画像。 o。 元の面積と比較した、コントロールマウスと iSC 処置マウスの 0、3、7、10、14、16、および 18 日目の残存創傷面積の定量化 (n = 40、グループごと)。 *p <0.05; ****p <0.01。 p 71日目のiSC処置マウスにおける代表的なH&E染色。スケールバー=50μm。 挿入図、ボックス領域の高倍率。 q iSC処理後71日目のde novo SG構造におけるSGマーカー発現の免疫蛍光。 GFP+ 細胞は SG 様構造で観察され、再生された SG は CK7、FASN、MUC1 などの SG 特異的マーカーを発現しました。 スケールバー = 25 μm。 r 71日目の対照群およびiSC治療群の再生皮膚の代表的な肉眼画像(左)。3つの独立した実験からの皮膚の脂っこさの定量分析(右)。 s 71日目のiSC処置マウス(左)の再生皮膚の代表的なORO染色。スケールバー=50μm。 挿入図、ボックス領域の高倍率。 de novo SG の ORO 染色評価 (右) は、iSC による 71 日間の治療後、レシピエント マウスの皮膚サンプルの 15.00 ± 2.887% を示しています (n = 40) は ORO 染色陽性でした。 データは平均値 ± SD として表されます。 t 正 (アップ) および負 (ダウン) イオン化モードで取得した、iSC 処理マウスの皮膚サンプルのベース ピーク クロマトグラム。 DAG、ジグリセリド。 TAG、トリグリセリド。 FFA、遊離脂肪酸。 u PCA 負荷プロットは、総分散の 92.6% を占める、コントロール、iSC 処理、正常皮膚サンプルの間で特定された XNUMX つの主要な方向を示しています。 主な効果は、負荷が iSC 処理サンプルと正常な皮膚サンプルの間に密接に集中している SG 特徴に関連していますが、対照グループとは明確に異なります。 v 対照、iSC処理、および正常皮膚サンプルで同定された脂質化合物の正規化された強度。 XNUMX 個の列は教師なし階層クラスタリングによって配置され、行は次の結果によって配置されます。 k- クラスタリングを意味します。 w 術後 112 日目に iSC を皮下移植したマウスの再生皮膚の代表的な H&E 染色。 iSC移植マウスでは、角質化した表皮を含む皮膚様構造の出現と、その下にあるSG様構造が見られました。 点線は、異所的に再生された腺構造の外側の境界を表します。 スケールバー = 100 μm。 挿入図、ボックス領域の高倍率。 x 移植後 112 日目の異所的に再生された SG 様構造における SG マーカー発現の免疫蛍光。 PPARγ-GFP+ 異所的に再生された SG 様構造内で細胞が観察されました。 ヒト特異的ヒストンタンパク質 (H1) の免疫蛍光により、異所的に再生された SG 様構造のヒト起源がさらに確認されました。 異所的に再生された SG は SG の形態学的特徴を示し、CK7、FASN、MUC1 などの SG 特異的マーカーを発現しました。 点線は、異所的に再生された腺構造の外側の境界を表します。 スケールバー = 25 μm。 y 112 日目に異所的に再生された SG の代表的な ORO 染色 (左)。 異所的に再生された SG の ORO 染色評価 (右) には、3 つの独立した実験からの対照および iSC 処理皮膚サンプルが含まれていました。 iSC による 112 日間の治療後、レシピエント マウスの 13.33 ± 3.33% (n = 40) 対照群と比較して、脂質を含む異所性 SG を示した (n = 40)。 スケールバー = 50 μm。 挿入図、ボックス領域の高倍率。 データは平均値 ± SD として表されます。
私たちの誘導戦略の信頼性をテストするために、新生児 HEK (NHEK) にも PPARγ (NHEK-PPARγ) を形質導入しました (補足図 XNUMX)。 S3a、b)。 同様に、SG 細胞様形態は SGIM 誘導の 3 日後に現れました (補足図)。 3c)。 CK7 および MUC1 の発現の増加は、qRT-PCR および免疫蛍光によって確認されました (補足図)。 3D-F)。 注目すべきことに、CK7 (77.0 ± 4.3% vs. 36.4 ± 2.1%) および MUC1 (80.9 ± 3.9% vs. 19.9 ± 0.6%) の免疫蛍光によって証明されたように、NHEK の変換効率は成人 HEK の変換効率よりも高く、NHEK の変換効率が示唆されています。成人HEKよりも細胞の再プログラミングに対してより感受性が高かった(図XNUMX)。 1c)。 さらに、qRT-PCRと免疫蛍光により、ステムネス関連遺伝子がNHEKで高度に発現していることが明らかになりました(補足図)。 S4a、b)。 CFU アッセイの結果は、NHEK が強力なクローン増殖能力を持っていることを示しました (補足図)。 S4c、d)。 したがって、我々は、ステム性を高める追加の因子が SG 再プログラミングの効率を高める可能性があると仮説を立てました。 この目的を達成するために、ステムネスの強化における既知の役割に基づいて、SG 変換を改善するために、報告されている 616452 つの化学物質 6 (99021) および CHIRXNUMX (C) が追加されました。5,6 予想通り、qRT-PCR と免疫蛍光は、6C 処理 HEK におけるステムネス関連遺伝子の発現が上方制御されていることを示しました(補足図)。 S5a、b)。 CFU アッセイでは、6C 前処理により、より大きなコロニーを形成する能力が強化されることがさらに実証されました (図 XNUMX)。 1d).
これらの結果を考慮して、6C前処理、PPARγ過剰発現、およびSGIM培養を組み合わせることにより、HEKを誘導SG細胞(iSC)に全身的に再プログラムする戦略を設計しました(図XNUMX)。 1e)。 誘導された細胞は急速に増殖し、12日目にはSG細胞様の形態を持つ典型的な緊密な凝集体を示しました(図XNUMX)。 1f)。 さらに、mRNA レベルは、 CK7 およびSG前駆体マーカー ルリグ1 & SOX9 iSCでは有意に上方制御されていました(図XNUMX)。 1g)。 免疫蛍光により、iSC が LRIG1、CK7、および FASN を発現していることが明らかになり、SG 前駆細胞表現型の獲得が実証されました (図 XNUMX)。 1h)。 さらにゲノムヒートマップにより、脂質合成遺伝子、脂肪酸結合タンパク質遺伝子、脂質代謝関連転写因子などの発現プロファイルの点で、iSC が in vivo の対応物と類似していることが示されました。 幹細胞の維持を調節するTFや前駆細胞の増殖を調節するシグナル伝達成分もiSCに豊富に含まれており、変換されたiSCがSG前駆細胞の分子的特徴を示したことを示唆している(図XNUMX)。 1i).
インビトロでの機能特性を特徴付けるために、iSC を SG 分化培地に移しました。 10〜14日の分化後、iSCは典型的な多角形の形態を示しました(補足図)。 6a)。 免疫蛍光分析により、SG 分化培地で培養された iSC では MUC1 の割合が劇的に増加したことが実証されました。+ 細胞 (81.9 ± 2.4%) および PLIN2+ 細胞数 (92.6 ± 0.6%) (図 1j)。 分化した細胞の超微細構造解析により、ゴルジ体や脂肪滴などの典型的な脂質産生細胞小器官が示されました(図XNUMX)。 1l)。 注目すべきことに、ORO染色による機能検査では、分化したiSCにおける脂肪滴の大量の蓄積が示され、iSCが分化時に脂質合成活性を備えた天然のSG前駆細胞を模倣できることが示唆されました(図XNUMX)。 1k)。 核型分析によると、iSC と iSC 由来の分化脂血球は両方とも、正常な核型で in vitro で安定して増殖可能でした(補足図)。 6b)。 RNA-seqによる追加の遺伝子発現プロファイリングにより、分化したiSCは、脂質代謝、グリセロ脂質代謝、およびリン脂質代謝に関与する一連の遺伝子において初代SG細胞と同様の発現パターンを示すことが示されました(図XNUMX)。 1m).
インビボでの組織再構成の可能性を調べるために、iSC とヒト線維芽細胞の混合物、または線維芽細胞のみ (対照として) をパイロットの全層切除創傷に皮内注射しました。 対照群と比較して、iSC移植マウスでは創傷閉鎖の有意な加速が観察されました(図XNUMX)。 1n、o)。 さらに、SG 特徴を備えたよく組織化された新たな腺構造が、71 日までに iSC 移植マウスの真皮内に見られました(図 XNUMX)。 1p)。 採取された傷の組織切片から、GFP でマークされた iSC 子孫が生存し、GFP のクラスターが存在することが実証されました。+ MUC1、FASN、およびCK7を発現する細胞は、新しく形成されたSGで広範囲に観察されました(図XNUMX)。 1q)。 その後の再上皮化皮膚の脂っこさの評価では、iSC 治療創傷が対照創傷よりも脂っこいことを示しました (図 XNUMX)。 1r)。 ORO染色により、天然SGと同様に、再生SGが脂質合成機能を有することが確認され、iSC処理マウスの約15±2.9%が陽性のORO染色を示した(図XNUMX)。 1s)。 高速液体クロマトグラフィーと質量分析法を組み合わせた脂質プロファイルの解析により、トリアシルグリセロール、ジアシルグリセロール、遊離脂肪酸などの特定の脂質スペクトルが、iSC治療マウスの再生皮膚に豊富に含まれていることが明らかになりました(図XNUMX)。 1t)。 さらに主成分分析(PCA)と階層的クラスタリング分析により、iSC治療創傷から再生された皮膚の脂質プロファイルが正常な皮膚のものと密接にクラスター化していることが示されました(図XNUMX)。 1u、v)、iSC が機能的な SG 再生を促進できることを示しています。
iSCの再生能力が外来微小環境の影響を受けるかどうかを解明するために、次にiSCを皮下筋層に移植することでiSCの再生能力に挑戦しました。 112日後、筋膜下に異所的に再生された皮膚様構造が見られました(図XNUMX)。 1w)、角質化した多層表皮と、目に見える腺ドメインを持つSG様構造を含む真皮を持っていました(図XNUMX)。 1w)。 免疫蛍光により、iSCによって異所的に再生されたSGにおけるFASN、CK7、およびMUC1の発現が確認されました(図XNUMX)。 1x)。 さらに、ヒト特異的ヒストンタンパク質 H1 により、GFP のヒト起源がさらに確認されました。+ SG 腺構造 (図 1x)。 最後に、ORO 染色により、異所的に再生された SG には脂質合成機能があることが示され、約 (13.33 ± 3.3%) のマウスが ORO 染色で陽性でした (図 XNUMX)。 1y).
結論として、再生能力を持つヒト SG 細胞は、単一因子による系統再プログラミングによって生成可能であり、個別化された創傷治癒と皮膚老化の遅延に対する潜在的な治療的意義が強調されています。
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 自動車/EV、 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- ブロックオフセット。 環境オフセット所有権の近代化。 こちらからアクセスしてください。
- 情報源: https://www.nature.com/articles/s41392-023-01531-3