(Nanowerkニュース) 研究者たちは何十年にもわたって、有効性を最大化しながら有害な副作用を最小限に抑えるために、治療薬の分布と活性の制御の改善を模索してきました。 小分子やモノクローナル抗体などのほとんどの承認済み医薬品は、体内のどこに蓄積するか、どのくらいの期間持続するかについて、固有の正確性はほとんどなく、全身的に機能します。 この精度の欠如は毒性反応を引き起こし、高用量の投与を妨げ、進歩を抑制します。 最近、構造上の画期的な進歩 DNAナノテクノロジー 定義された形状と化学を備えた自己組織化プログラム可能なナノ構造を使用して、薬物の挙動に対して空間ガバナンスを発揮するまったく新しい道を切り開きました。 リポソームやポリマーソームなどのこれまでの受動的薬物キャリアとは異なり、これらのインテリジェント DNA システムは、モジュール式のプログラム可能性、正確なナノスケールの形状、および方向性を与える容易に調整可能な表面部分を特徴としています。 で発表された新しい研究では、 科学的なレポート (「ポリマーとDNAが結合した折り紙ナノ構造体の生体内分布と機能」)、研究者らは、疾患を標的とするアプタマーをポリエチレングリコール(PEG)で安定化したDNAナノ構造に結合させ、標的組織部位内で治療活性を集中させ、維持する能力を実証している。 研究者らは、さまざまなサイズとアスペクト比を持つ複数の棒状ナノ構造を調査し、100 nmを超える長い粒子が大幅に長く持続することを発見しました。 インビボの 注射部位からはよりゆっくりと拡散します。
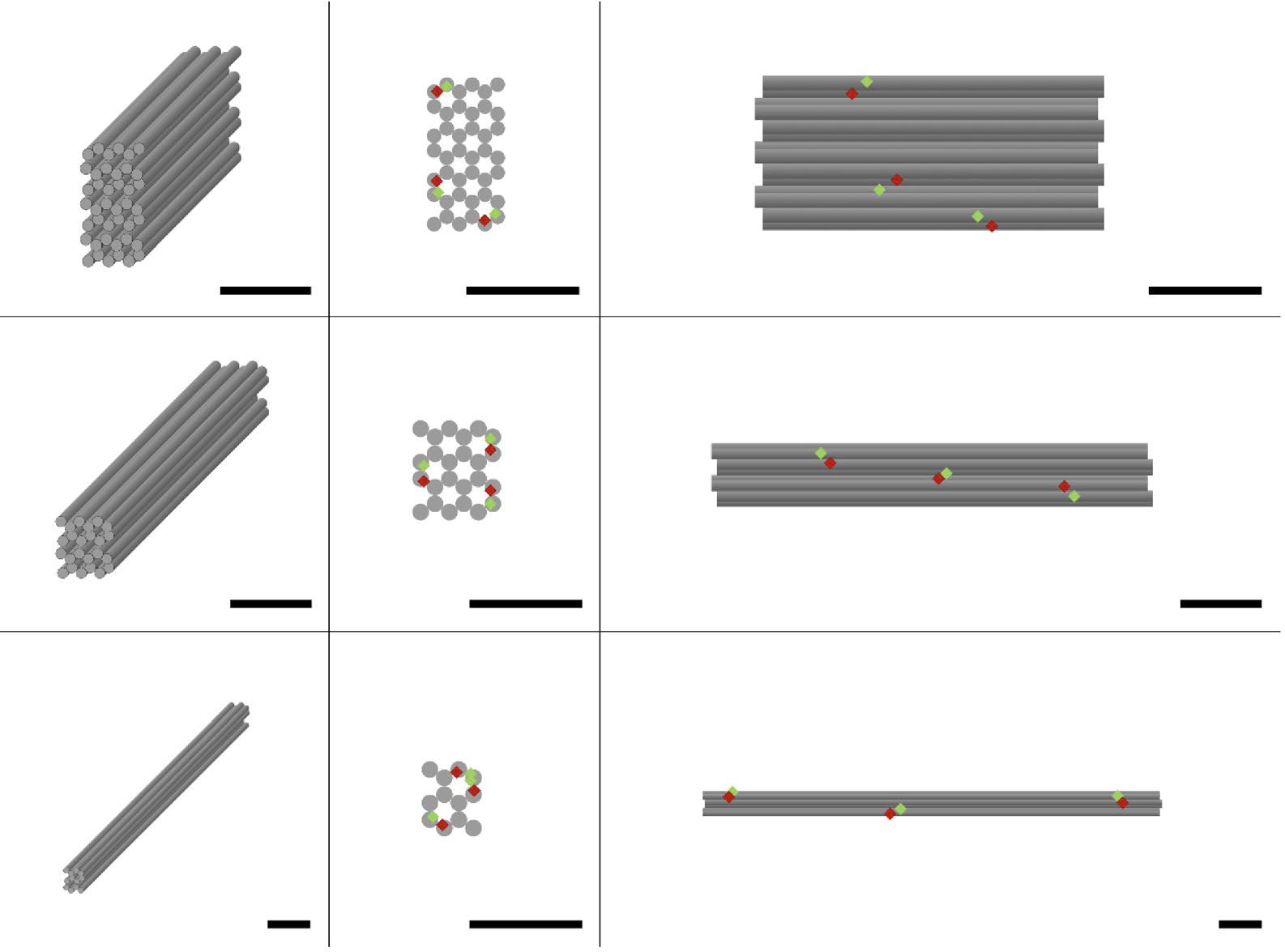 DNA 折り紙ナノ構造の構造特性評価とそのアセンブリの品質評価。 (a) 設計図。 列は、調査されたさまざまな DNA 折り紙ナノ構造を示しています: 直方体、短い棒、長い棒 (上から下)。 列は、DNA 折り紙ナノ構造のさまざまな図を示しています。3D、正面図、側面図 (左から右)。FRET ペアは DNA 折り紙ナノ構造上に均等に分布しており、赤と緑のひし形で示されています。 すべてのスケール バーは 20 nm です。 (© NPG) 炎症性サイトカイン TNF-α に対するアプタマーの結合により、遅延型過敏症反応 (DTHR) のマウス モデルに抗炎症効果が付与されました。 TNF-α中和DNAナノ構造で治療したマウスは、抗TNF-αモノクローナル抗体と同等の組織膨張の減少、免疫細胞浸潤の低下、表皮肥厚の減少を示した。 しかし、体全体に全身に分散した従来の抗体とは異なり、アプタマーのナノ構造は標的組織に集中したままでした。 この局在化効果により、全身への曝露を回避しながら疾患部位に治療効果が集中するため、治療範囲が広がります。 また、同等の治療結果を得るために必要な線量も削減されます。 これらのプログラム可能なナノ構造のモジュール性により、ターゲティング部分と治療部分を簡単に置換することにより、個別の最適化と多重化がさらに可能になります。 この発見は、固有の空間制御を備えたインテリジェントな薬物担体としての自己集合 DNA ナノ構造の破壊的な可能性を強調しています。 コストが指数関数的に低下し続ける中、このような高精度 DNA システムは、特異性を向上させるためにモノクローナル抗体などの主流技術に取って代わるとともに、相乗的なアプタマー カクテル、組織局所薬物送達、個々の遺伝学や疾患の表現型に合わせた個別化医療の開発を加速する可能性があります。
DNA 折り紙ナノ構造の構造特性評価とそのアセンブリの品質評価。 (a) 設計図。 列は、調査されたさまざまな DNA 折り紙ナノ構造を示しています: 直方体、短い棒、長い棒 (上から下)。 列は、DNA 折り紙ナノ構造のさまざまな図を示しています。3D、正面図、側面図 (左から右)。FRET ペアは DNA 折り紙ナノ構造上に均等に分布しており、赤と緑のひし形で示されています。 すべてのスケール バーは 20 nm です。 (© NPG) 炎症性サイトカイン TNF-α に対するアプタマーの結合により、遅延型過敏症反応 (DTHR) のマウス モデルに抗炎症効果が付与されました。 TNF-α中和DNAナノ構造で治療したマウスは、抗TNF-αモノクローナル抗体と同等の組織膨張の減少、免疫細胞浸潤の低下、表皮肥厚の減少を示した。 しかし、体全体に全身に分散した従来の抗体とは異なり、アプタマーのナノ構造は標的組織に集中したままでした。 この局在化効果により、全身への曝露を回避しながら疾患部位に治療効果が集中するため、治療範囲が広がります。 また、同等の治療結果を得るために必要な線量も削減されます。 これらのプログラム可能なナノ構造のモジュール性により、ターゲティング部分と治療部分を簡単に置換することにより、個別の最適化と多重化がさらに可能になります。 この発見は、固有の空間制御を備えたインテリジェントな薬物担体としての自己集合 DNA ナノ構造の破壊的な可能性を強調しています。 コストが指数関数的に低下し続ける中、このような高精度 DNA システムは、特異性を向上させるためにモノクローナル抗体などの主流技術に取って代わるとともに、相乗的なアプタマー カクテル、組織局所薬物送達、個々の遺伝学や疾患の表現型に合わせた個別化医療の開発を加速する可能性があります。
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- プラトンヘルス。 バイオテクノロジーと臨床試験のインテリジェンス。 こちらからアクセスしてください。
- 情報源: https://www.nanowerk.com/nanotechnology-news2/newsid=64109.php



