不均一な線維芽細胞がトカゲの尻尾の再成長に寄与する
尾の再成長中の各再生状態の複雑さと不均一性を調査するために、グリーンアノールトカゲの段階的な尾サンプルに対して単一細胞 RNA シーケンス (scRNAseq) を実行しました。 アノリス・カロリネンシス。 10x Genomics scRNAseq プラットフォームを利用して、尾サンプルを次の 0 つのサンプル グループのいずれかに分割しました: 元の尾 (切断後 1 日、DPA)、炎症期 (3、7、および 14 DPA)、芽細胞期 (21 および 28) DPA)、または再生されたホメオスタシス (XNUMX DPA)。 炎症期および芽腫期のサンプルには、個体間の尾再生の固有のばらつきを考慮して、サンプルグループ間の一貫性を確保するために複数のサンプル時点が含まれていました。41。 サンプル DPA の追跡に加えて、サンプルの形態および特徴的な再生段階の表現型も評価されました。42、炎症および芽細胞腫の段階で利用される複数の時点が得られます (各尾部段階の詳細な表現型/形態は「方法」に記載されています)。 シーケンス結果は 10x Genomics Cell Ranger を使用して分析されました43 パイプラインと R パッケージ Seurat44 とハーモニー45.
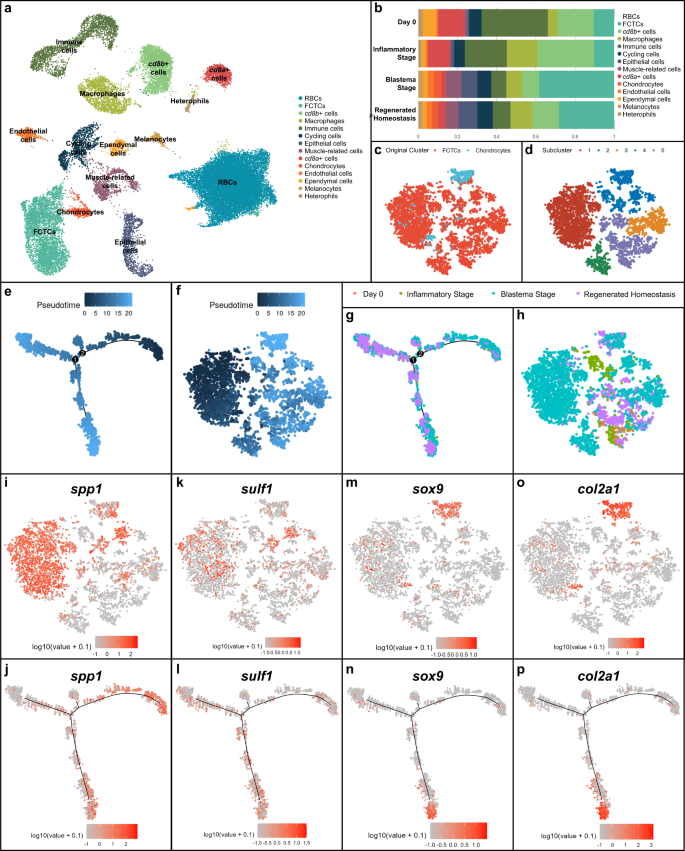
再生時間経過の教師なしUMAPクラスタリングにより、14の異なる細胞クラスターが明らかになりました(図XNUMX)。 1a)。 上位の差次的に発現される遺伝子についてクラスターを分析し、再生中の尾サンプルにおける対応する組織遺伝子発現について、in situ ハイブリダイゼーション(ISH)および組織学を介して主要な細胞タイプを検証しました(補足図)。 1)。 カテプシン B (ctsb+) マクロファージ9、高レベルの CD8 サブユニット A によって輪郭が描かれるクラスター (cd8a+) および CD8 サブユニット B (cd8b+) 発現と有核赤血球。 ケラチン II 型細胞骨格 5 (krt5+) 上皮細胞、フォンヴィレブランド因子 (vwf+) 内皮細胞、脂肪酸結合タンパク質 7 (fabp7+) 上衣細胞46、高い増殖マーカー Ki-67 を特徴とする細胞周期 (mki67) 発現、クレアチンキナーゼ M 型 (CKM+) 筋肉関連細胞15、プレメラノソームタンパク質(ピメル+) メラノサイト、SRY-box 転写因子 9 (ソックス9+) 軟骨細胞47、およびコラーゲン I 型アルファ 1 鎖 (コル1a1+)線維芽細胞性結合組織細胞(FCTC)クラスターも、差次的遺伝子発現解析および哺乳類オルソログ同定を通じて同定されました。
a トカゲの単一細胞 RNA シーケンス (scRNAseq) 結果の教師なしクラスタリングの UMAP (アノリス・カロリネンシス)無傷の0日目のトカゲの尾(切断またはDPA後0日)、炎症期(1、3、および7 DPA)、芽細胞期(14および21 DPA)、および再生された恒常性(28 DPA)サンプルで構成される尾再生時間経過。 b 赤血球を除く、テールサンプル段階ごとの相対的な細胞タイプ組成比率の定量化。 c scRNAseq データセットから分離、統合、サブクラスター化された線維芽性結合組織細胞 (FCTC) と軟骨細胞の TSNE (a). d FCTCおよび軟骨細胞サブセットの教師なしクラスタリングのTSNE。 e FCTC および軟骨細胞 scRNAseq 細胞サブセットの Monocle2 擬似時間軌跡解析 (c). f TSNE FCTC/軟骨細胞サブクラスターに重ねられた擬似時間。 g FCTC/軟骨細胞サブセットの擬似時間軌跡に再生時点を重ね合わせたもの。 h FCTC/軟骨細胞TSNEを再生時点ごとに分析しました。 i, j Spp1, k, l 硫黄1, m, n ソックス9, o, p コル2a1 それぞれ、FCTC/軟骨細胞TSNEサブクラスターおよびFCTC/軟骨細胞サブクラスターの擬似時間軌跡における遺伝子発現。
再生段階ごとに分析すると、サンプル内の総細胞数と比較した各細胞タイプの寄与率が比例的にわかります(図XNUMX)。 1b) 前述のアホロートル scRNAseq 解析と同様に、芽細胞期における FCTC 集団の大幅な拡大が明らかになりました。36。 このFCTCクラスターは、トカゲの尻尾を再生するための骨格前駆体である軟骨細胞クラスターと密接に関連していた。 比例した細胞型の寄与は、クラスター定義マーカー遺伝子を使用した蛍光 ISH (FISH) によって検証されました (補足図)。 2)、14および0 DPAと比較して7 DPAのFCTCの大幅な増加を示しています。 芽細胞期における FCTC の拡大と軟骨細胞との密接なクラスター形成を考慮して、FCTC クラスターと軟骨細胞クラスターが分離され、計算によって統合され、サブクラスター化されました (図 XNUMX)。 1c、d)FCTCクラスター内に別個の線維芽細胞集団が存在するかどうかを決定し、FCTC軟骨形成能につながる可能性のある遺伝子サインを明らかにします。
擬時間軌跡解析、scRNAseq 遺伝子発現プロファイルに基づいて生物学的遷移または細胞系統関係を推測するために使用される計算手法48、FCTC/軟骨細胞サブクラスターに対して実行されました(図。 1e、f) R パッケージ Monocle2 を使用49,50,51 そして、再生過程における潜在的な細胞運命軌道変化の小さな分岐点が XNUMX つと主要な分岐点が XNUMX つあることが明らかになりました。 再生時点ごとに分析した場合(図XNUMX) 1g、h および補足図 3)、初期の擬似時間細胞集団はほとんどが芽細胞期の細胞集団と一致していましたが、その後の擬似時間分岐点は再生された恒常性細胞と元の尾細胞によって支配されており、芽細胞期と初期の擬似時間細胞は最終分化が低く、より可塑性の高い細胞タイプであることを示唆していますが、再生恒常性は保たれています。後期擬似時間の細胞は、より制限された/定義された細胞運命を持つ可能性があります。
FCTC/軟骨細胞サブクラスターにおける差次的発現遺伝子 (DEG) のさらなる分析により、分泌リンタンパク質 1 とも呼ばれるオステオポンチンが高レベルであることが明らかになりました (spp1)、式(図 1i、j)、特に FCTC/軟骨細胞データセットのサブクラスター 1、芽細胞期サンプルおよび初期擬似時間内。 Spp1 骨の石灰化と細胞外マトリックスの沈着における役割について最初に説明されました。52、しかし、より最近の研究は示唆しています spp1 サイトカインとして作用し、損傷反応に役割を果たすことができます53,54,55,56。 例えば、 spp1 Wnt および Hedgehog (Hh) 経路シグナル伝達調節に関与している57,58 抗アポトーシス活性により、重要な細胞集団が創傷環境で生き残るのを助ける可能性があります59.
スルファターゼ1 (硫黄1) 表情(図) 1k、l) 芽腫と再生時点、およびほとんどの擬似時間にまたがり、表現は初期、中期、後期の擬似時間の範囲に及びました。 ヘパリン硫酸プロテオグリカン (HSPG) から 6-O-硫酸基を選択的に除去するヘパリン硫酸 6-O-エンドスルファターゼとして、 硫黄1 酵素活性は、ヘパリン結合成長因子およびサイトカインに対する多くの HSPG 受容体の結合および下流のシグナル伝達を調節します。60,61。 エンドスルファターゼは、哺乳類および鳥類の骨格形成中に Wnt および BMP シグナル伝達を活性化し、FGF シグナル伝達を弱めるのに必要であることが示されています。61,62,63一方、 硫黄1 特に、局所的なソニックヘッジホッグを強化することによってHhシグナル伝達を調節することも示されています(しっ) 濃度と利用可能性64.
軟骨細胞マーカー ソックス9 (イチジク。 1メートル、n) および II 型コラーゲン アルファ 1 鎖 (コル2a1)15 (イチジク。 1o、p)は、サブクラスター 2 の再生された恒常性細胞に集中しており、後期偽時間の下部ブランチで特異的に発現していました。 したがって、初期の擬似時間軌道の右側の分岐は、 spp1+ 芽細胞期の線維芽細胞と後期の偽時間の下部枝はより分化したものを表す ソックス9+ 再生中の軟骨細胞と最終分化 コル2a1+ 再生された恒常性における軟骨。 DEGs リン脂質転送タンパク質 (pltp) そしてspalt様転写因子1(販売1) 擬似時間軌跡分析によっても分析されました(補足図)。 4)しかし、擬似時間を特定の再生段階と相関させる明確な発現パターンは明らかにされませんでした。
まとめると、擬似時間軌跡分析は、線維芽細胞が再生の過程でFCTCマーカー遺伝子の発現を獲得し、最終的に潜在的な軟骨形成能力と軟骨細胞の運命につながることを示唆しました。 多くの芽腫 FCTC が発現する spp1。 これらの線維芽細胞のすべてではなく、一部が発現を続ける可能性があります。 硫黄1 尾部の再生プロセスが進むにつれて、その後、 ソックス9+ 軟骨細胞と形態 コル2a1+ 軟骨。 この scRNAseq 研究は、トカゲの尾再生の重要な時間経過解析を表しており、擬似時間軌跡を通じて、FCTC マーカー遺伝子発現と芽腫 FCTC 軟骨形成との潜在的な関係を提案しています。これについては、以下で詳しく調査します。
トカゲの尾芽細胞は FCTC で構成されています
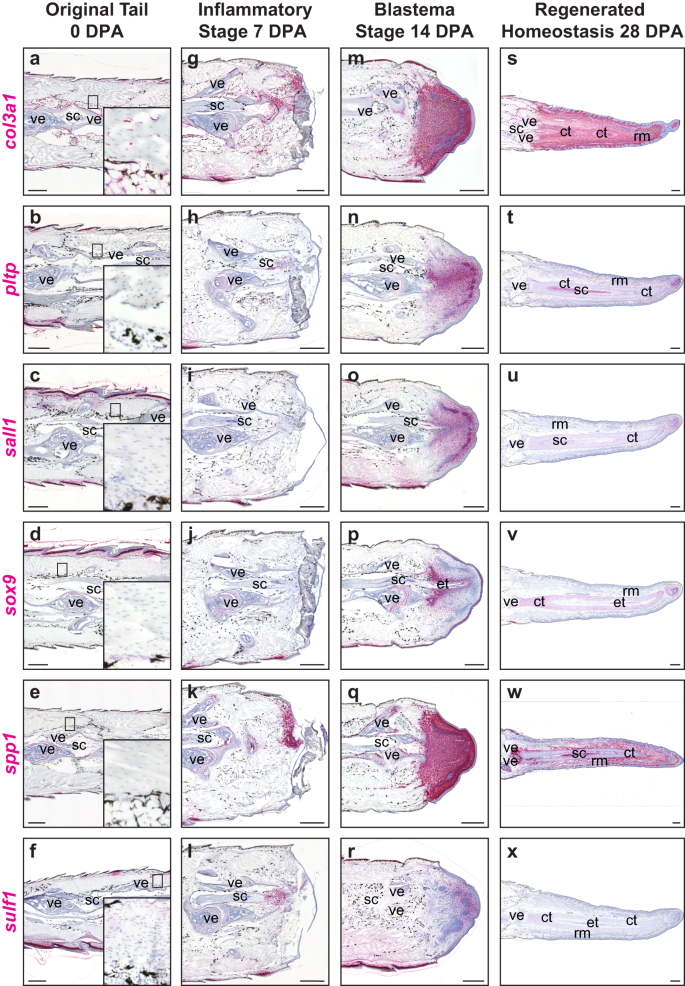
単一細胞データ分析を使用して、FCTC クラスター内で差次的に上方制御されるいくつかの線維芽細胞遺伝子が同定されました。その多くは他の生物における間葉の凝縮、軟骨形成、骨のリモデリングと沈着機能に関連しています。52,65,66。 これらのFCTCマーカー遺伝子は、尾の再生全体を通じて発現について染色され、時空間的な方法で線維芽細胞遺伝子の発現パターンの変化が明らかになりました(図XNUMX)。 2 および補足図 5)。 損傷していない元の尾では、コラーゲン タイプ III アルファ 1 鎖 (co13a1+)恒常性を維持するFCTCは、骨膜、軟骨膜、表皮、およびその他の結合組織に並んでいます(図XNUMX)。 2a–f)、多くの FCTC も低レベルのカドヘリン 11 を発現しています (cdh11)、(補足図。 5a–e)、以前に報告されたように67。 7 DPA までに、0 DPA と比較していくつかの追加の線維芽細胞遺伝子が活性化し、末端椎骨から遠位創傷部位に再局在化しました。 これらの損傷状態の FCTC は上昇を示しました spp1 (イチジク。 2k)、 と同様 コル3a1 (イチジク。 2g)、cdh11、XII型コラーゲンα1鎖 (col12a1)、ミッドカイン (mdk)、酸性でシステインが豊富な分泌タンパク質 (スパーク)、およびテネイシン様 (tnl)式(補足図。 5f-j). スルフ1 切断された脊髄に隣接する領域に局在し始めました(図)。 2l)、一方、リン脂質転送タンパク質 (pltp)、spalt 様転写因子 1 (販売1), ソックス9 (イチジク。 2時間~XNUMX時間) 7 DPA の発現はほとんどまたはまったく示されませんでした。
芽細胞形成 14 DPA の間に、FCTC は尾の遠位端に凝集し、いくつかのマーカー遺伝子の発現が増加しました。 広範囲にわたる スパーク 発現は、再生中の筋束を含む芽細胞全体で観察されました(補足図)。 5nながら、 コル3a1, spp1、col12a1、mdk, tnl は、新しく形成された芽組織をすべて標識しましたが、再生中の筋束での発現は著しく低かった(図XNUMX)。 2m、q および補足図 5l、m、o)。 いくつかの FCTC マーカーは、尾芽細胞内でより局所的な発現パターンを示しました。 Sox9 トカゲにおける軟骨形成能と軟骨再生の保存されたマーカー遺伝子の発現47、中央の再生脊髄周囲に凝縮した軟骨形成前間葉を標識し、高い内側発現から低い側方発現、および近位(高)組織から遠位(低)組織までを示しました(図XNUMX)。 2p)。 凝縮した軟骨形成間充織も、 pltp, 販売1, 硫黄1, cdh11 表情(図) 2n、o、r および補足図 5k). スルフ1 また、遠位芽細胞先端の FCTC 集団もラベル付けされており、内側から外側および近位端の組織とは逆の組織を示しています。 ソックス9 (イチジク。 2r).
28 DPA では、再生された結合組織は、 spp1、cdh11, mdk, tnl、しかし、これらのマーカーは、分化した筋肉および軟骨要素からはほとんど除外されました(図XNUMX)。 2w および補足図 5p、r、t). Col12a1 および スパーク 結合組織および再生軟骨で高度に発現されましたが、再生筋束からは特に除外されました(補足図)。 5q、s)。 のみ コル3a1 表皮、筋束、軟骨要素、および間質内の結合組織において、0から28 DPAまでの再生のあらゆる段階でFCTC集団において高い発現を維持しました(図XNUMX)。 2s). Sox9 発現は軟骨管を特異的に標識し、近位側で減少しました(図)。 2v). PLTP および 販売1 は、軟骨管の周囲の内側、および尾端の遠位で最も高度に発現していましたが、他の結合組織ではほとんど失われていました(図XNUMX)。 2t、あなた). スルフ1 28 DPAでは発現が著しく欠如しており、軟骨管には最小限の発現のみが残っています(図XNUMX)。 2x)。 全体として、再生された尾14および28 DPAは、元の尾(0 DPA)内の比較的小さく制限されたニッチにもかかわらず、FCTC集団によって支配されていましたが、尾再生7 DPAの損傷状態中にいくつかのFCTC遺伝子がオンになりました。
スルフ1 + Hh によって刺激された芽腫 FCTC が軟骨を形成する
上記の ScRNAseq の結果は、軟骨と芽細胞の FCTC クラスターが異なることを示しており、当研究室の以前の研究では、上衣に寄与する Hh シグナル伝達が芽細胞の軟骨形成を誘導するための重要なシグナルであることが特定されています。14。 薬理学的薬剤を使用して、芽細胞の軟骨形成に対する Hh の阻害と活性化の効果をテストしました(補足図)。 6)。 トカゲを、Hh 阻害剤シクロパミン、Hh スムージング アゴニスト (SAG)、またはビヒクル対照で 28 日間処理しました。 次に、尾を収集し、全体的な形態によって分析しました(補足図)。 6a – c) および組織学/FISH の発現 コル2a1、成熟軟骨分化のマーカー、 シャー、再生された尾部内の主要な Hh シグナル、および fabp7、上衣細胞マーカー(補足図。 6d–l).
ビヒクル制御で治療されたトカゲは、円筒形の典型的な再生尾を発達させた コル2a1+ 周囲の軟骨管 シャー+ fabp7+ 上衣チューブ(補足図) 6a、d、g、h)。 シクロパミンで治療されたトカゲは正常な長さの尾を再生しましたが、尾の維持にもかかわらず、軟骨が完全に欠如していました。 シャー 上衣管による発現(補足図) 6b、e、i、j)。 逆に、SAG による治療では、豊富な c で満たされた発育不全の球根状の尾が生じました。ol2a1+ 内在性軟骨管に加えて異所性軟骨領域(補足図) 6c、f、k、l)。 Hh の阻害も活性化も影響を受けない シャー による表現 fabp7+ 上衣細胞(補足図) 6h、j、l)、芽細胞FCTC軟骨形成の変化が薬物治療によって直接生じたことを示しています。 SAG によって誘発された軟骨はトカゲの他の場所では観察されず、芽細胞由来の尾部に特異的でした。 これらの結果は、Hh シグナル伝達が芽細胞 FCTC における軟骨形成の誘導に必要かつ十分であること、および芽細胞の大部分が軟骨分化できることを示唆しました。 SAG 治療からの外因性 Hh シグナルは、内因性シグナル伝達に応答して通常軟骨を形成する領域を超えて軟骨形成促進領域を拡張します。
次に、トカゲの四肢および尾の FCTC 遺伝子発現および軟骨形成能に対する Hh 活性化剤/阻害剤の影響を比較しました。 トカゲの尾および四肢をシクロパミン、SAG、またはビヒクル対照で処理した動物から 28 DPA 採取し、組織学/ISH によって分析しました。 コル2a1, spp1、GLI ファミリー ジンクフィンガー 1 (グリ1) 式(補足図) 7)。 前述のように、コントロールテールが開発されました コル2a1+ 軟骨管。 軟骨管の発達はシクロパミン治療によって阻害され、SAG治療によって拡張され、その結果、広範な異所性軟骨形成が生じました(補足図)。 7a、g、m)。 テール FCTC が維持される spp1 発現は28 DPAであり、発現はシクロパミンまたはSAG処理の影響を受けませんでした(補足図。 7b、h、n).
尾芽細胞とは対照的に、四肢の線維芽細胞は発現しませんでした。 コル2a1 または、テストされた条件のいずれかで軟骨形成を受ける(補足図)。 7d–f、j–l、p–r)。 具体的には、SAG治療グループでは異所性軟骨は形成されませんでした(補足図)。 7p)。 さらに、四肢FCTC spp1 発現は28 DPAでは維持されず、Hhシグナル伝達に対して感受性がありませんでした(補足図)。 7e、k、q). グリ1、Hh シグナル伝達経路の下流レポーター、および Hh 経路活性化の確立された読み取り値68、コントロールの尾でネイティブに発現しました(補足図。 7c)、対照の四肢では発現が見られませんでした(補足図。 7f)および四肢と尾の両方のHh阻害剤シクロパミン治療サンプル(補足図)。 7i、l)。 SAG 処理された尾と四肢は両方とも高レベルの グリ1 アクティベーション (補足図) 7o、r)、尾と四肢の両方における Hh 経路活性化因子としての SAG 治療を検証しました。 これらの結果は、SAG 治療による十分な Hh 経路活性化の証拠にもかかわらず、尾芽細胞 FCTC とは異なり、切断された四肢の線維芽細胞には Hh 応答性の軟骨形成能がないことが示されました。
上記の単一細胞配列決定結果が特定されました 硫黄1, pltp, 販売1, spp1 トカゲの尾のFCTC芽腫マーカーとして。 スルフ1 他のシステムでは Hh 刺激によって調節されることが報告されています60,64,69そしてここでは、尾芽腫マーカー発現に対する Hh の阻害と活性化の影響をテストしました (図 XNUMX)。 3)。 自然には芽腫を形成しない切断されたトカゲの四肢は、芽腫特異的マーカーと非特異的治癒反応を区別するための分析に含まれた8,70,71,72 (イチジク。 3m–x)。 シクロパミン、SAG、またはビヒクル対照で処理した同じトカゲから尾芽腫と四肢のサンプルを 14 DPA 採取し、組織学/ISH によって分析しました。 硫黄1, pltp, 販売1, spp1 マーカー発現パターン間で観察される Hh シグナル伝達依存性のコンテキストを提供します。
制御尾芽細胞の発現 硫黄1, spp1, pltp, 販売1 (イチジク。 3a–d). spp1 芽細胞全体を通じて高レベルで発現されましたが、 pltp および 販売1 比較的低いレベルで発現されました(図XNUMX)。 3b–d). スルフ1 は、最も明確な発現パターンを示し、上衣管周囲の領域、特に頂端芽腫および前軟骨管凝縮に局在していた(図2)。 3a)。 シクロパミン治療により尾芽腫が大幅に減少 硫黄1 表情(図) 3e)しかし、テストした他のマーカーには影響を与えませんでした(図XNUMX)。 3f–h)。 逆に、SAG 治療により増加および拡大した 硫黄1+ 芽腫領域(図) 3i)、特に背側および近位芽腫領域で発生したが、影響はなかった spp1, pltpまたは 販売1 表情(図) 3j–l).
切断された四肢の FCTC は高レベルの spp1 (イチジク。 3n 硫黄1, pltp, 販売1 対照条件下では四肢には存在しなかった(図)。 3m、o、p)。 アッセイされた遺伝子マーカーの発現は、四肢におけるシクロパミンまたはSAG治療の影響を受けませんでした(図XNUMX)。 3q–x)、尾芽細胞とは異なり、切断肢の FCTC は増加しませんでした。 硫黄1 SAG 治療に応答した発現 (図 XNUMX) 3u)。 これらの結果は、尾部サンプル 14 DPA のリアルタイムポリメラーゼ連鎖反応 (RT-PCR) 分析によって定量的に確認されました。 sulf1、spp1、pltp および 販売1 (補足図 8)。 これらの結果を総合すると、 硫黄1, pltp, 販売1 特定の芽腫マーカーとして。 スルフ1 は、Hh の刺激と阻害に特に反応した、試験した唯一の芽細胞マーカーでした。 Spp1 は、創傷治癒によって刺激された損傷状態の FCTC の一般的なマーカーであることがさらに確認されました。
スルフ1 軟骨形成能のある芽腫 FCTC をマークします
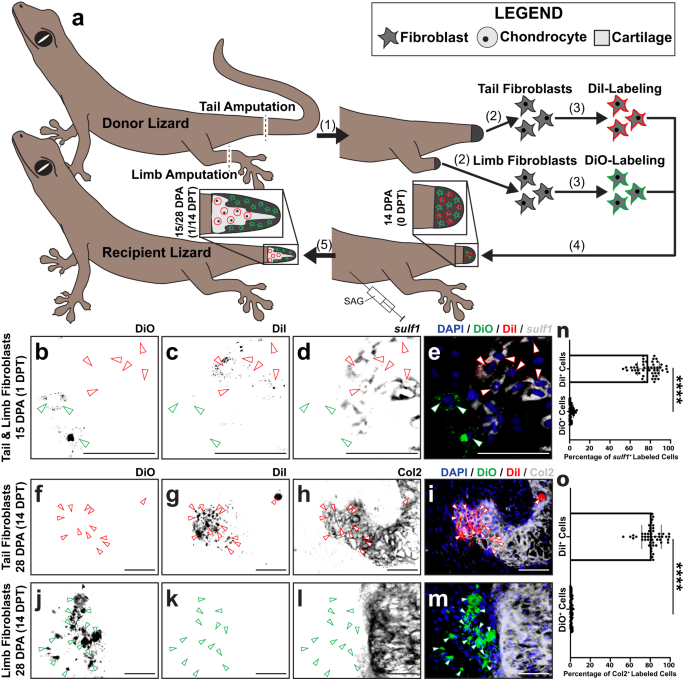
次に、トカゲの尾再生中の細胞運命を追跡するために以前に確立された移植モデルを使用して、生体内での局所的な尾の環境シグナル伝達に関係なく、どのFCTCが軟骨を形成する能力があるかを決定するために、特定の尾再生段階からのFCTCの軟骨形成能力を評価しました。73。 単為生殖したトカゲから採取した細胞 レピドダクティルス・ルグブリス 同じクローン集団に属するトカゲの切断された尾の切り株に移植した後、免疫抑制剤による治療を必要とせずに再生構造を再構成する74、以前に再生に悪影響を与えることが示されています24,75,76 (イチジク。 4)。 線維芽細胞はドナーから分離されました L.ルグブリス 元の尾、芽細胞尾 14 DPA、および再生尾 28 DPA、得られた単離細胞プールは、物理的および酵素的細胞消化と MACS® ビーズ処理を使用して FCTC 集団について濃縮されました (補足図 9)。 各FCTCプールをDiIで標識し、SAG処理したレシピエント芽細胞尾部14DPAに別々に注射した。 移植後 14 日目 (14 DPT、レシピエントのトカゲ 14 DPA) レシピエントの尾を免疫蛍光染色 (IF) によって Col28 について分析しました (図 2)。 4a)。 元の尾線維芽細胞も再生された尾線維芽細胞も Col2 に組み込まれていない+ 28 DPA による軟骨 (図 XNUMX) 4b–d、h–k)、移植された芽細胞線維芽細胞の大部分は、DiI標識とCol2発現を共染色し、元の尾線維芽細胞および再生された尾線維芽細胞よりも有意に高い割合で軟骨要素に取り込まれました(図XNUMX)。 4e–g、k)。 これは、芽細胞線維芽細胞が、恒常性のある元の尾線維芽細胞および再生された尾線維芽細胞と比較して、Hh刺激に応答して軟骨を形成する独自の能力を持っていることを示唆しました。
a 実験計画 レピドダクティルス・ルグブリス 尾部線維芽細胞移植。 (1) ドナートカゲの尻尾は切断されます。 FCTC は、元の尾 (0 DPA)、芽細胞尾 (14 DPA)、および再生された尾 (28 DPA) から分離されます。 (2) 各テール FCTC プールは、蛍光 DiI で個別に標識されます。 (3)標識されたFCTCプールを、SAG処理レシピエントトカゲの尾芽細胞(14DPA)に別々に移植する。 (4)移植後14日間のSAG処理(14DPT)後、再生尾をCol2免疫蛍光染色(IF)および蛍光顕微鏡により分析する。 b–j (b–d) オリジナルテール、 e–g 芽腫の尾、または h–j 再生された尾、Col2 IF 14 DPT/28 DPA によって分析されました。 DiI および Col2 シグナルは、共局在またはその欠如を強調するために別々に、または一緒に表示されます。 緑色の矢印は DiI を示します+ 細胞。 バー = 50 μm。 k Col2 内に取り込まれた DiI 標識細胞の定量+ 軟骨領域 14 DPT。 n = 各条件の 50 個の異なる動物/尾サンプルの 10 つの画像から測定された 3 個の細胞数。 データは平均値 +/- 標準偏差として表示されます。 不等分散に対する一元配置ウェルチ分散分析およびダネットの TXNUMX 多重比較検定を使用しました。 ****調整済み P < 0.0001 (ダネットの T3 多重比較テスト)。 ソース データはソース データ ファイルとして提供されます。
以前の研究では、Hh シグナル伝達がトカゲ芽腫の軟骨形成を調節していることが示されています。14, 硫黄1 軟骨形成中の凝縮前間葉で発現されることが報告されています77, 78。 ここでは、次の共局在化をテストしました。 硫黄1 ソックス9、シクロパミン、SAG、およびビヒクル対照による処理に応答して、トカゲの尾芽細胞内にある軟骨形成を調節する転写因子である14 DPA。 (補足図 10)。 対照尾芽細胞は、近位方向の勾配を示した。 硫黄1 および ソックス9 上衣管周囲のFCTCにおける発現(補足図) 10a、b). スルフ1 発現は遠位の頂端芽細胞領域に局在し、近位で置換されると減少しました。 ソックス9. Sox9 は、切断面の元の尾椎に隣接する近位骨格要素で最も強い発現を示しました。 シクロパミン治療により両方が減少しました 硫黄1 および ソックス9 発現と中断された近位部マーカーの局在化(補足図) 10c、d)。 SAG 処理された尾部では、両方とも 硫黄1+ および ソックス9+ 領域は上衣管から除去された領域へと末梢に拡大しましたが、近位側の発現関係は維持されました(補足図)。 10e、f).
上記の結果は、Hh シグナル伝達と 硫黄1 発現、および軟骨形成。 ここでは、次の能力を比較することでこの関係をテストしました。 硫黄1+ および 硫黄1 - トカゲの線維芽細胞は、 L.ルグブリス 移植モデル(補足図) 11)。 まず、ドナーの元の (0 DPA) 尾および四肢 FCTC を、それぞれ蛍光色素 DiI および DiO で事前に標識しました。 標識された尾および四肢のFCTCを混合し、レシピエントのトカゲ尾切断時(0 DPA)にレシピエントのトカゲの尾に同時移植した。 レシピエントのトカゲをSAGで処理し、統合評価のために14および28 DPTで尾を収集しました(補足図)。 11a)。 14 個の DPT サンプルの FISH および組織学的分析により、DiI が示されました+ 尻尾とディオ+ 四肢由来の線維芽細胞の発現 硫黄1 (補足図 11b–e、j)。 同様に、両方の DiI+ そしてディオ+ Col2を形成した線維芽細胞+ IFによって評価された28のDPTサンプルの軟骨(補足図。 11f–i、k)。 これらの結果は、尾と四肢の線維芽細胞の両方が、 硫黄1 芽細胞形成プロセスとシグナル伝達ニッチにさらされたときの発現と軟骨形成。
最後に、我々は上記の結果を、外因性尾芽腫および四肢FCTCをすでに芽腫が形成されているレシピエントの尾に移植した場合に観察された結果と比較した。 ドナーから分離された線維芽細胞 L.ルグブリス 尾芽細胞と四肢 それぞれ DiI と DiO であらかじめ標識した 14 DPA を、SAG 処理したレシピエントのトカゲの尾芽細胞に同時移植しました (図 XNUMX)。 5)。 1DPTおよび14DPTに尾を採取し、上記のように分析して、発現した外因性尾芽細胞および四肢線維芽細胞のパーセンテージを比較した。 硫黄1 FISH 経由または IF 経由の Col2 (図. 5a).
a 実験計画 L.ルグブリス 尾芽腫および切断された四肢の線維芽細胞移植。 (1) ドナートカゲの尻尾と左後肢を切断します。 (2) FCTC は尾芽腫および四肢断端 14 DPA から分離されます。 (3) 尾部 FCTC は DiI で標識され、四肢 FCTC は DiO で標識されます。 (4)標識されたFCTCを、SAG処理レシピエントトカゲの尾芽細胞(14DPA)に同時移植する。 (4) 移植後 14 日および 5 日間の SAG 処理後、再生された尾を次の方法で分析します。 硫黄1 FISH、Col2 IF、および蛍光顕微鏡検査。 b–m DiI 標識尾 FCTC および DiO 標識四肢 FCTC を事前注射した SAG 処理トカゲによって再生された尾の代表的な組織学的および蛍光分析。 b–e 硫黄1 FISH 移植後 1 日 (DPT)/15 DPA および f–m Col2 IF 14 DPT/28 DPA。 DiI、DiO、 硫黄1 またはCol2シグナルは、共局在またはその欠如を強調するために別々にまたは一緒に表示されます。 赤い矢印マーク DiI+ セル、および緑色の矢印は DiO を示します+ 細胞。 バー = 50 μm。 n, o DiI および DiO 標識細胞の定量 (n) 共表現 硫黄1 1 DPT と o Col2 に組み込まれています+ 軟骨領域 14 DPT。 n = 各条件の 50 個の異なる動物/尾サンプルの XNUMX つの画像から測定された XNUMX 個の細胞数。 データは平均値 +/- 標準偏差として表示されます。 ペアになっていない双方向 t 不等分散に対するウェルチ補正を伴う検定が使用されました。 ****P < 0.0001。 ソース データはソース データ ファイルとして提供されます。
1 DPT サンプルでは、DiI+ 尾芽細胞由来の線維芽細胞が共局在 硫黄1 表現しながら、DiO+ 四肢由来の線維芽細胞はそうではありませんでした(図XNUMX)。 5b–e、n)。 Col14 発現について IF を介して分析された 2 個の DPT サンプルにより、Col2 を形成する尾芽細胞 FCTC の割合が大幅に高いことが明らかになりました+ 四肢の線維芽細胞よりも軟骨(図) 5f–o)。 尾および四肢の線維芽細胞も、対照としてビヒクル対照またはSAGで処理したレシピエント芽細胞に別々に移植した(補足図)。 12)。 SAGによって刺激された尾線維芽細胞のみがDiIとCol2を共発現しました(補足図。 12d–f、m)、ビヒクル対照レシピエントに移植された尾および四肢のFCTC、およびSAG処理レシピエント芽細胞に移植された四肢の線維芽細胞は、Col2を発現せず、軟骨を形成しませんでした(補足図。 12a–c、g–m)。 総合すると、これらの結果は次の能力を裏付けました。 硫黄1+ FCTC 芽腫、ただしそうではない 硫黄1– 四肢の FCTC は、Hh 刺激に応答して軟骨形成を受けます。
尾部の再成長には食細胞の明確な局在化が関与する
トカゲの尻尾再生のさらなる単一細胞配列分析により、マクロファージおよび他の食細胞が調査され、不均一性と、差次的マーカー遺伝子発現および最近傍クラスタリングによって描写される異なる細胞集団が明らかになりました(補足図XNUMX)。 13a – c). CTSB+ カテプシン K 陰性 (ctsk–)マクロファージと ctsb+ ctsk+ 予想通り、破骨細胞は他の免疫細胞とクラスターを形成していました(補足図)。 13a、b)。 ただし、明確な ctsb– ctsk+ IV 型コラーゲン アルファ 1 鎖でクラスター化された集団 (コル4a1+)周皮細胞(補足図。 13a–d)。 セプトクラスト集団(骨髄系ではなく周皮細胞系に由来する貪食細胞)は、哺乳類の骨格の発達と治癒を調節することが以前に示されています。79、そして私たちは次のような仮説を立てました ctsb– ctsk+ コル4a1+ 細胞はトカゲのセプトクラスト様貪食細胞(本明細書ではセプトクラストと呼ばれる)を表した。
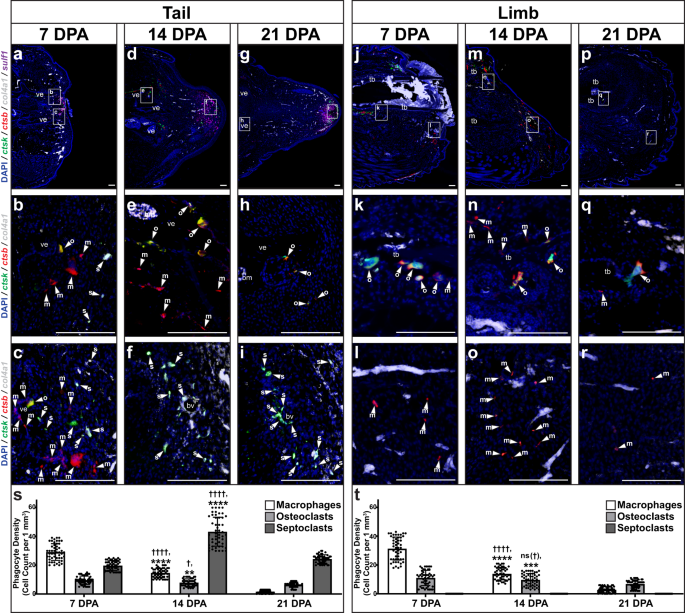
単一細胞配列決定の結果は、7、14、および 21 DPA に収集されたトカゲの尾および四肢の組織学 / FISH によって検証されました。 (イチジク。 6). CTSB+ ctsk - コル4a1 - マクロファージレベルは、7 DPA で尾部でピークに達しました (図 6a–c、s) 21 DPA 減少する前 (図 6g-i、s). CTSB+ ctsk+ コル4a1 - 破骨細胞集団数は、7 DPA までに減少する前に、14 および 21 DPA で尾部で最も高かった(図 XNUMX)。 6a–i、s)。 尾破骨細胞はもっぱら椎骨と関連しており、骨膜表面に沿った古典的な陰窩を占めていました(図XNUMX)。 6a–i). CTSB– ctsk+ コル4a1+ セプトクラストレベルは、14DPAで芽細胞形成中に尾部でピークに達しました(図XNUMX)。 6a–i、s) の間で検出されました 硫黄1+ 芽腫線維芽細胞集団(図 6a–i)。 さらに、尾部では 0、1、3、7、14 の DPA が確認されました ctsb+ マクロファージと破骨細胞の集団は、免疫細胞が活性化する炎症段階の時点7〜1 DPAの範囲内で7 DPAでピークに達しました(補足図。 14)。 しかし、尾部のマクロファージや破骨細胞とは異なり、尾部の中隔細胞数の増加は芽細胞期を超えても持続し、21 DPA では、 硫黄1+ 再生中の尾端の頂端領域(図) 6g-i)。 総合すると、これらの結果は、セプトクラストと芽細胞の状態との関係を示唆しました。
トカゲの代表的な矢状断面 (A.カロリネンシス) a–i 尻尾と j–r 手足を集めた a–c, j–l 7 DPA、 d–f, m–o 14 DPA、および g–i, p–r 21 組織学/FISH によって分析された DPA ctsb、ctsk、col4a1, 硫黄1 表現。 ( 内の対応する領域の高倍率ビュー)a, d, g, j, m, p) ハイライト ctsb+ ctsk– コル4a1– マクロファージ (m、矢印)、 ctsb+ ctsk+ コル4a1 - 破骨細胞 (o、矢じり)、および ctsb– ctsk+ コル4a1+ 近位領域のセプトクラスト (s、矢尻) b, e, h 椎骨K, n, q 脛骨、 c, f, i 遠位尾部と l, o, r 遠位肢。 bm骨髄、bv血管、tb脛骨、ve椎骨。 バー = 100 μm。 s, t トカゲで測定されたマクロファージ、破骨細胞、および中隔細胞の密度の定量化 s 尻尾と t 四肢には 7、14、21 個の DPA が採取されました。 n = 各時点の 50 個の異なる動物/サンプルの 10 つの画像から測定された 3 個の細胞密度。 データは平均値 +/- 標準偏差として表示されます。 不等分散に対する一元配置ウェルチ分散分析およびダネットの TXNUMX 多重比較検定が使用されました。 †調整 P = 0.0139; ††††調整 P < 0.0001; ns (†)、有意ではない(調整済み) P = 0.4663)、対応するセルタイプ 7 DPA (ダネットの T3 多重比較テスト) と比較。 **調整済み P = 0.0024; ***調整済み P = 0.0005; ****調整済み P < 0.0001、対応する細胞タイプ 21 DPA と比較 (ダネットの T3 多重比較テスト)。 ソース データはソース データ ファイルとして提供されます。
四肢では、時間的に一致した尾細胞集団と同様の時空間的傾向に従うマクロファージと破骨細胞の集団が示されました(図XNUMX)。 6)。 四肢マクロファージは創傷表皮と関連しており、骨関連破骨細胞とともに、14 DPA 前にピークに達し、その後 21 DPA でさらに減少しました(図 XNUMX)。 6j-r、t)。 しかし、四肢は検査されたどの時点でも識別可能なセプトクラストを示しておらず、発現もしていませんでした。 硫黄1 (イチジク。 6j-r、t)。 上述の切断されたトカゲの四肢によって示される Hh 応答性の軟骨形成の欠如を考慮すると、これらの結果はトカゲの中隔細胞、芽細胞の形成、 硫黄1 発現、Hh 感受性、軟骨形成については以下で詳しく調査します。
芽細胞の形成と軟骨形成は食細胞に依存する
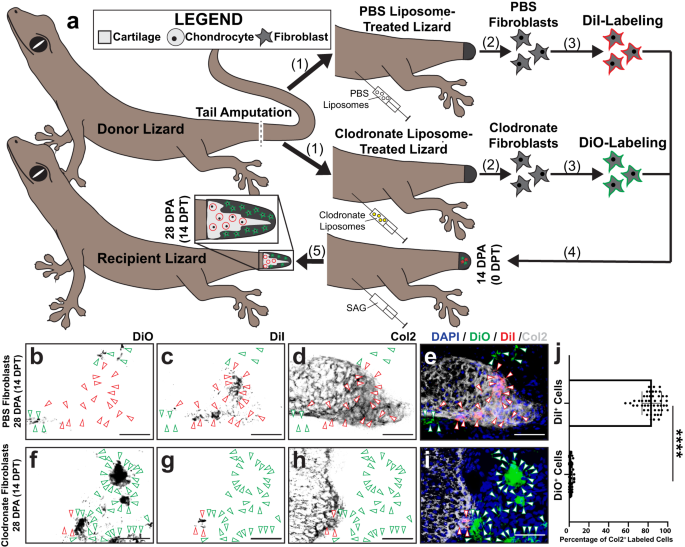
我々は以前、クロドロネートリポソーム治療がトカゲの食細胞/マクロファージ集団を枯渇させ、芽細胞の形成を阻害する効果的な方法であることを検証しました。 A.カロリネンシス9。 ここでは、トカゲの尾芽細胞形成中のマクロファージ、破骨細胞、中隔細胞の集団レベルと線維芽細胞マーカー発現に対するクロドロネート リポソーム処理の効果をテストしました(補足図)。 15)。 トカゲを尾切断の72時間および48時間前にクロドロネートまたはビヒクル対照リン酸緩衝食塩水(PBS)リポソームで前処理し、分析のために芽細胞期14DPAで尾を収集した。
組織学的検査により、クロドロネート リポソーム処理が対照と比較して芽細胞形成を抑制したことが明らかになりました(補足図)。 15a、b、f、g)、その結果、 ctsb+ ctsk - マクロファージ、 ctsb+ ctsk+ 破骨細胞と ctsb - ctsk+ コル4a1+ セプトクラスト(補足図) 15c–e、h–j)、 予想通り。 クロドロネート処理された尾も消失した spp1 および 硫黄1 FCTC における発現 (補足図. 15a、b、f、g)。 対照芽腫では、マクロファージと破骨細胞が局在していることが明らかになりました。 硫黄1 - 一方、セプトクラストは芽細胞の遠位側でのみ検出されました。 硫黄1+ 尾部の領域(補足図) 15c–e)。 の共染色 spp1 および 硫黄1 未治療芽腫における7および14のDPAが明らかになった spp1 7 と 14 DPA の両方で発現が見られますが、広い領域では 硫黄1+ 芽細胞を共発現 spp1、両方のマーカーが芽細胞FCTCの部分集団で活性であることを確認しています(補足図。 16)。 総合すると、これらの結果は、トカゲの貪食系統と FCTC マーカー遺伝子の獲得との関連性を確立しました。
次に、クロドロネート リポソーム前処理がトカゲの Hh シグナル伝達に対する FCTC 応答性に及ぼす影響をテストしました。 L.ルグブリス 芽腫線維芽細胞移植研究(図 7)。 このモデルは、内因性条件が芽細胞/軟骨形成に寄与しない場合に、その場で外因性 FCTC 軟骨形成能をテストするのに特に適用できることが判明しました。 L.ルグブリス トカゲはクロドロン酸リポソームで前処理されました(補足図で検証)。 17)、または切断前の対照PBSリポソーム、および線維芽細胞を尾14DPAから単離した。 PBS から収集した線維芽細胞とクロドロネート リポソーム処理トカゲを、SAG 処理レシピエント トカゲ芽細胞の別のコホートに同時移植する前に、それぞれ DiI または DiO で事前標識しました (図 14)。 7a).
a トカゲにクロドロネート リポソーム処理と線維芽細胞移植を適用するための実験計画 (L.ルグブリス)食細胞集団に対する芽細胞の軟骨形成の依存性の調査に向けて。 (1) PBS リポソームおよびクロドロネート リポソームで処理したドナー トカゲの尾を切断します。 (2) 尾線維芽細胞は、PBS リポソームおよびクロドロネート リポソームで処理したトカゲの尾 14 DPA から単離されます。 (3) PBS トカゲ由来の線維芽細胞は DiI で標識され、クロドロネート線維芽細胞は DiO で標識されます。 (4)標識細胞を、レシピエントのSAG処理トカゲの14DPA尾芽細胞に同時移植する。 (5)移植後14日間のSAG処理後、再生された尾をCol2 IFおよび蛍光顕微鏡により分析する。 b–i DiI 標識 PBS リポソーム処理 FCTC および DiO 標識クロドロネート リポソーム処理 FCTC を事前注射し、組織学、DiI および DiO 蛍光、Col2 IF 14 DPT/28 DPA によって分析した、SAG 処理トカゲによって再生された尾の代表的な組織学的分析。 バー = 50 μm。 j Col2 14 DPT を共発現する DiI および DiO 標識細胞の定量。 n = 各条件の 50 匹の異なる動物/尾の XNUMX つの画像から測定された XNUMX 個の細胞数。 データは平均値 +/- 標準偏差として表示されます。 ペアになっていない双方向 t 不等分散に対するウェルチ補正を伴う検定が使用されました。 ****P < 0.0001。 ソース データはソース データ ファイルとして提供されます。
尾部を 14 DPT 収集し、DiO の寄与について分析しました。+ そしてディイ+ 細胞から軟骨形成まで(図) 7b–j)。 著しく高いレベルの DiI+ 対照尾部のFCTCは軟骨形成を受け、Col2に組み込まれた+ DiOと比較して、軟骨が凝縮している領域+ クロドロネート処理したFCTCは、芽細胞の線維芽細胞が軟骨領域に寄与する一方、クロドロネート処理した尾由来の芽細胞を欠く線維芽細胞は寄与しなかったことを示唆している(図XNUMX)。 7b–j)。 SAGまたはビヒクル対照で処理したレシピエント芽細胞に別々に移植したクロドロネートおよびPBSリポソーム処理線維芽細胞でも、同様の結果が明らかになりました(補足図)。 18)、PBS リポソーム処理された線維芽細胞のみが Col2 に組み込まれます。+ 軟骨(補足図) 18d–f、m)、一方、SAG処理レシピエントのクロドロネートリポソーム線維芽細胞およびビヒクル対照芽細胞に移植されたPBSまたはクロドロネートリポソーム処理線維芽細胞はCol2を発現しませんでした(補足図。 18a–c、g–m)。 総合すると、これらの結果は、トカゲ芽腫細胞のHh応答性軟骨形成が、食細胞集団によるプレコンディショニングに依存していることを確立した。
食細胞馴化培地が芽細胞形成を救済する
我々は、複数のトカゲ組織から食細胞集団を分離および区別するためのプロトコルを以前に確立しました。9。 セプトクラストと周皮細胞を関連付ける上記の証拠を考慮して、周皮細胞が豊富な尾血管がセプトクラストの有効な供給源であると仮説を立てました。 尾側血管をトカゲの尾から単離し、食細胞単離プロトコルに供した。 以前に検証されたように、トカゲの骨髄はマクロファージの供給源として利用されました9。 尾部血管および骨髄細胞から分化した食細胞を、食作用アッセイ、フローサイトメトリー、および Ctsk の IF/FISH によって分析しました。 ctsb、インテグリン サブユニット アルファ M (それガム/cd11b), コル4a1 式(補足図) 19).
尾血管由来細胞と骨髄由来細胞の両方が、同様に高レベルの食作用を示しました(補足図)。 19a–c、g)と表現した itgam/cd11b (補足図 19日、h)、食細胞としてのアイデンティティを検証します。 ただし、血管と骨髄の食細胞は、生体内で観察された違いを反映する異なるマーカー発現を示しました(補足図)。 19d–f、h–j); 骨髄食細胞はマクロファージマーカーを発現しました ctsb (補足図 19D-F)、一方、尾側血管食細胞は中隔細胞マーカー Ctsk と Ctsk を発現しました。 コル4a1 (補足図 19時間~XNUMX時間)。 フローサイトメトリーにより、骨髄食細胞プール内の細胞の平均 94.5% が Ctsb を発現している、マクロファージおよびセプト細胞のそれぞれの集団の純度が確認されました。+ チェツク - マクロファージの特徴と尾血管食細胞の 98% 以上が Ctsb を発現 - チェツク+ セプトクラストサイン(補足図) 19k–p)。 まとめると、これらの結果は検証されました ctsb - ctsk+ コル4a1+ 尾側血管由来の食細胞培養物(セプト細胞および ctsb+ ctsk - コル4a1 - マクロファージとしての骨髄由来の食細胞培養物。
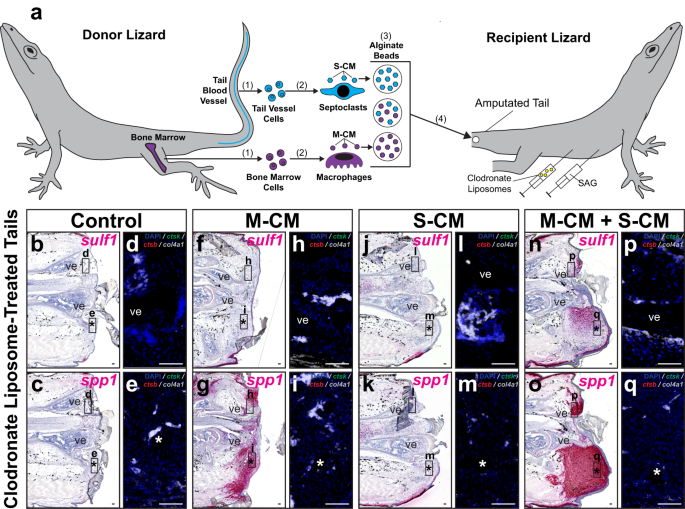
次に、Hh 応答性によって定義されるトカゲの尾芽腫細胞の軟骨形成能状態を救済する中隔細胞集団の能力をテストしました。 硫黄1 クロドロネート リポソーム処理後の発現(図 8 および補足図 20)。 マクロファージ馴化培地 (M-CM) およびセプトクラスト馴化培地 (S-CM) をそれぞれ骨髄および尾血管由来の食細胞から収集し、濃縮しました。 濃縮M-CMおよび/またはS-CMに浸したアルギン酸ビーズを、クロドロネートリポソームとSAGのいずれかで共処理したトカゲの切断された尾に移植しました(図XNUMX)。 8a)または車両制御(補足図。 20a)。 移植後 14 日目に尾を収集し、組織学/ISH/FISH によって分析しました。 硫黄1 および spp1 発現および貪食細胞マーカー(図 8b–q および補足図 20b–q).
a クロドロネート リポソーム処理トカゲにおける FCTC 遺伝子発現に対するマクロファージおよびセプトクラスト集団によって分泌される生体分子の効果をテストするための実験スキーム (A.カロリネンシス)尾。 (1) ドナーのトカゲから骨髄細胞と尾血管細胞が単離され、(2) in vitro でそれぞれマクロファージとセプトクラストに分化します。 (3) マクロファージおよびセプトクラスト馴化培地 (それぞれ M-CM および S-CM) は、別々にまたは一緒に収集、濃縮され、アルギン酸ビーズに吸収されます。 (4)アルギン酸塩ビーズを、クロドロネートリポソームおよびSAGで共処理したトカゲの切断された尾(DPA0)に移植する。 b–q トカゲの尾の代表的な矢状断面 14 DPA を SAG およびクロドロネート リポソームで共処理し、M-CM および/または S-CM ビーズを移植し、組織学/ISH/FISH で分析したもの sulf1、spp1、ctsk、ctsb, コル4a1 表現。 高倍率の蛍光観察 (b, c, f, g, j, k, n, o) はそれぞれ、周囲の示された領域を示します。 d, h, l, p 脊椎と e, i, m, q 埋め込まれたビーズ。 n = 処理条件ごとに 8 匹のトカゲ/サンプルをテスト。 *、埋め込まれたビーズの位置。 ve、脊椎。 バー = 50 μm。
Spp1 シグナルは、SAG/ビヒクル対照処理に関係なく、M-CM処理尾部で検出されました(図XNUMX)。 8g、お および補足図 20g、お)、S-CMのみの治療条件では存在しませんでした(図XNUMX)。 8k および補足図 20k). スルフ1 発現は、SAG と M-CM および S-CM の両方で共処理した尾でのみ検出されました (図 XNUMX)。 8n および補足図 20n). Spp1+ および 硫黄1+ M-CM および S-CM 処理サンプルでは、埋め込まれたビーズの周囲に尾部領域が集中しています (図 XNUMX)。 8g、n、o)。 内因性 ctsb+ ctsk - コル4a1 - マクロファージ、 ctsb+ ctsk+ コル4a1 - 破骨細胞、および ctsb - ctsk+ コル4a1+ クロドロネート リポソーム処理により予想されたように、セプトクラストはテストしたどの条件でも検出されませんでした(図 XNUMX)。 8 および補足図 20).
未調整の培地に浸したビーズを対照として利用し、クロドロネートリポソーム処理した尾に移植した(補足図)。 21)、変化がないことがわかります。 spp1 or 硫黄1 ビヒクルコントロールまたはSAG処理レシピエント尾における発現(補足図)。 21a–d)、ビーズ移植または培養培地単独ではなく、食細胞馴化培地処理が遺伝子発現の変化に関与していることを意味します。 総合すると、これらの結果は、トカゲのセプトクラストによって分泌される生体分子が、次のような芽細胞形成の特徴を救うために必要であることを示唆しました。 硫黄1 内因性セプトクラスト集団が枯渇した場合でも、Hh 刺激に応答して発現します。 マクロファージ分泌因子はFCTCを誘導するのに十分であったが、 spp1 表現 硫黄1 は、マクロファージとセプトクラストの両方の条件培地で処理した尾でのみ検出され、芽細胞確立中に FCTC マーカー遺伝子発現が連続的に追加されたことを示しています。
Septoclast-CM は切断された四肢の軟骨形成を誘導します
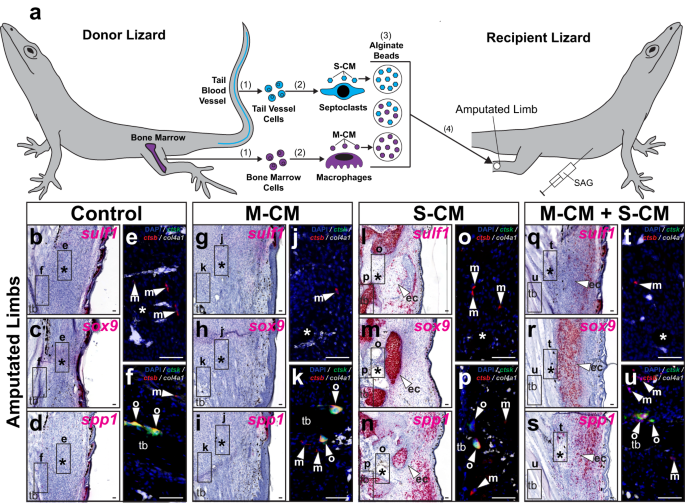
切断されたトカゲの尾と四肢の治癒の上記の比較は、FCTC 軟骨形成と中隔細胞集団との関連性を示唆し、ここではトカゲの四肢に対する S-CM の効果を示唆しています。 sulf1、spp1、 および ソックス9 発現をテストしました(図 9 および補足図 22)。 S-CM および/または M-CM に浸したビーズをトカゲの肢 7 DPA に移植しました。 SAGによる21日間の治療後(図XNUMX) 9)または車両制御(補足図。 22)、四肢を収集し、FCTCおよび軟骨形成マーカーの発現については組織学/ISHを介して、および食細胞マーカーについてはFISHを介して分析しました(図XNUMX)。 9a および補足図 22a).
a トカゲの天然線維芽細胞に対するマクロファージおよびセプトクラスト馴化培地の効果をテストするための実験スキーム (A.カロリネンシス) 手足。 (1) 骨髄細胞と尾血管細胞が単離され、(2) それぞれ in vitro でマクロファージとセプトクラストを誘導するために使用されます。 (3) マクロファージおよびセプトクラスト (M-CM および S-CM) によって条件付けされた培地は、個別にまたは一緒に収集、濃縮され、アルギン酸ビーズに吸収されます。 (4)アルギン酸塩ビーズを、SAG処理したトカゲ7DPAの切断された四肢に移植する。 b–u トカゲの四肢の代表的な矢状断面 28 DPA を SAG で処理し、M-CM および/または S-CM ビーズを移植し、組織学/ISH/FISH で分析したもの sulf1、sox9、spp1、ctsk、ctsb, コル4a1 表現。 高倍率の蛍光観察 (b–d, g–i, l–n, q–s) はそれぞれ、周囲の示された領域を示します。 e, j, o, t 埋め込まれたビーズと f, k, p, u 脛骨。 n = 処理条件ごとに 8 匹のトカゲ/サンプルをテスト。 *、埋め込まれたビーズの位置。 ec (矢じり)、異所性軟骨。 m (矢印)、マクロファージ。 o (矢印)、破骨細胞。 結核、脛骨。 バー = 50 μm。
対照四肢およびS-CMを含まないM-CMビーズを移植された四肢ではFCTCは発現しなかった。 硫黄1, ソックス9または spp1 SAG/ビヒクル制御処理に関係なく (図. 9b–d、g–i および補足図 22b–d、g–i)。 M-CM の有無にかかわらず、移植された S-CM ビーズは FCTC を誘導しました 硫黄1 および ソックス9 ビーズ移植部位周囲で発現しますが、SAG との共処理に応答してのみ発現します (図 XNUMX)。 9l、m、q、r および補足図 22l、m、q、r)。 S-CM ビーズは、M-CM の添加に関係なく、再び誘導されました。 spp1 SAG 処理とビヒクル対照処理の両方のトカゲの四肢における発現 (図 9n、s および補足図 22n、s)。 内因性マクロファージと破骨細胞は、試験したすべての条件で検出されましたが、セプト細胞は検出されませんでした。レベルは、ならし培地の種類に関係なく、薬物またはビーズ処理によって影響を受けませんでした(図XNUMX)。 9 および補足図 22).
無条件培地処理は、ビヒクル対照またはSAG処理レシピエントの四肢において遺伝子発現の変化または軟骨形成を誘導しなかった(補足図)。 21e–j)。 これらの結果は、外因性セプト細胞由来のシグナルが、自然にセプト細胞が欠損している切断肢の環境を補い、トカゲの切断肢にHh応答性の軟骨形成を導入するのに必要かつ十分であることを示唆した。 トカゲ中隔細胞因子も維持 spp1 少なくとも 28 DPA まではトカゲの四肢で発現します。 (イチジク。 9n、s および補足図 22n、s)。 紛失して以来、 spp1 トカゲの肢のFCTC 28 DPAによる発現は、28 DPAによる瘢痕形成と一致します(補足図。 7k)、これらの結果は、線維症の阻害におけるトカゲ中隔細胞集団の役割を示唆しています。
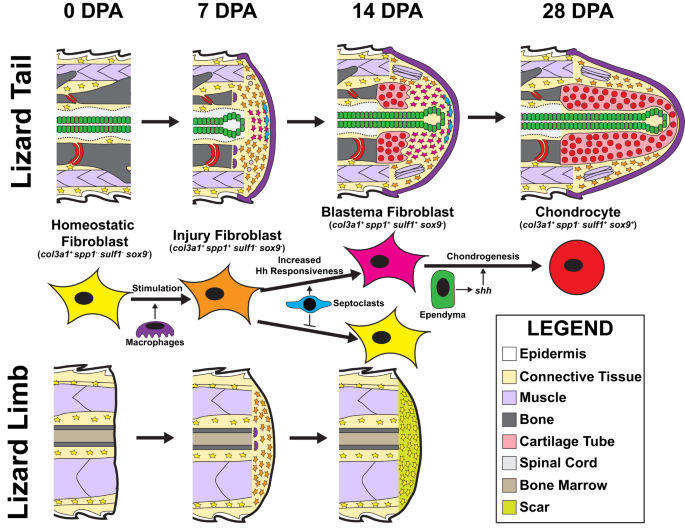
要約すると、上記の結果は、トカゲの尾胚盤形成中の連続的な線維芽細胞マーカー遺伝子獲得の次のメカニズムを示唆しています(図XNUMX)。 10). Col3a1+ 尾と四肢の両方の休止状態の線維芽細胞は、切断損傷に反応して次のような発現を示します。 spp1、などの他の損傷状態 FCTC マーカー遺伝子とともに コル12a1 および mdk。 損傷状態の FCTC は、マクロファージ集団の浸潤とマクロファージ分泌因子からのシグナル伝達に続いて切断部位に移動します。 トカゲの尾では、四肢ではなく、切断による損傷後に中隔細胞集団が見られ、FCTC Hh 感受性の増加が誘導されます。 中隔細胞分泌因子に曝露された FCTC は、 spp1 と表現 硫黄1 および ソックス9 による刺激に続いて シャー、上衣細胞によって産生されます。 この空間的なパターン形成により、芽細胞上衣管の周囲に軟骨が形成されます。 セプトクラストがなければ、切断された四肢の FCTC は生命を維持できない spp1 発現し、Hh シグナル伝達に応答しないままになります。 四肢のFCTCは発現しない 硫黄1 または、外因性 Hh シグナルで治療した場合でも軟骨形成が起こり、最終的には軟骨の代わりに瘢痕が形成されます。
Col3a1+ 恒常性を維持する元の尾部 FCTC (0 DPA) は、マクロファージのパラクリン シグナルによって刺激され、発現します。 spp1 7 DPA による損傷に反応します。 尾セプトクラストによって分泌される因子は、 spp1 FCTC で発現し、芽細胞上衣管によって寄与されるヘッジホッグ (Hh) シグナルに対する FCTC の感受性を高めます。 Hh刺激が誘発する 硫黄1 14 DPAによる中隔細胞刺激芽細胞FCTCにおける発現。 スルフ1+ FCTC は、Hh シグナルに応答して軟骨形成プログラムに入り、発現します。 ソックス9 および コル2a1、28 DPA によって軟骨細胞に分化します。 切断されたトカゲの四肢は、FCTCの動員と状態変化を示すが、軟骨形成は示さない非再生付属器として尾芽腫の形成と再成長の背景を提供します。 Col3a1+ 恒常性四肢線維芽細胞発現 spp1 切断後のマクロファージ浸潤に反応した 7 DPA で。 しかし、 spp1 切断されたトカゲの四肢には存在しないセプト細胞からの刺激がなければ発現は維持されません。 中隔細胞分泌因子に曝露されないと、四肢の FCTC は機能を失います。 spp1 14 DPA による発現、Hh シグナル伝達に応答しないままであり、発現しない 硫黄1 または軟骨形成を受けます。 その代わり、切断されたトカゲの手足には傷跡が残ります。
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 自動車/EV、 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- プラトンヘルス。 バイオテクノロジーと臨床試験のインテリジェンス。 こちらからアクセスしてください。
- チャートプライム。 ChartPrime でトレーディング ゲームをレベルアップしましょう。 こちらからアクセスしてください。
- ブロックオフセット。 環境オフセット所有権の近代化。 こちらからアクセスしてください。
- 情報源: https://www.nature.com/articles/s41467-023-40206-z