C-5ステロールデサチュラーゼErg3を欠く酵母はエスシンに対する顕著な耐性を示す
我々は、エスシンの毒性がエルゴステロールとの直接相互作用によって媒介されるのであれば、エルゴステロール生合成変異体はエスシン耐性が異なる可能性があると仮説を立てた。 ステロールは細胞膜動態の恒常性を維持する上で重要な役割を果たしていると考えられています28しかしながら、酵母菌株は、エルゴステロール生合成の最後の5つのステップを触媒する酵素を欠いている(Erg2、Erg3、Erg4、Erg5またはErg6;図10および11)。 1bおよび S1)は実行可能です。 エルゴステロール生合成における後者の酵素の基質不規則性により、これらの欠失変異体は、ステロール B 環およびステロール側鎖の二重結合の数と位置がエルゴステロールとは異なるステロール構造の混合物を蓄積します。29。 野生型株 BY4741 (WT) および酵母欠失コレクションからの変異体のマイクロプレート培養物を使用しました。30、エスシンの存在下および非存在下における複合富化培地(YPD)におけるエルゴステロール生合成変異体の増殖を評価するため(図XNUMX)。 1c)。 ステロールの抽出とガスクロマトグラフィー質量分析による分析により、エルゴステロールが変異株に蓄積していないことが確認されました(図XNUMX、XNUMX)。 S2 および S3)。 YPD培地中のWT株のエスシンの最小発育阻止濃度(MIC)は150μg/mLであった。 同様の MIC が観察されました。 エルグ2Δ、 エルグ4Δ、 エルグ5Δと エルグ6Δ株は成長するが、 エルグ3Δ株は、試験した最高濃度(1000 μg/mL)まで阻害されませんでした。 S4).
トランスクリプトーム解析
WT細胞に対するエスシンの影響と、WT細胞におけるエスシン耐性のメカニズムをさらに調査するために エルグ3Δ、WT のトランスクリプトームを分析しました。 エルグ3Δと エルグ6振盪フラスコ培養において、YPD中の0または100 μg/mLエスシンで1時間処理したΔ細胞。 の エルグ6Δ株は、多くの同様の表現型を共有するため、この実験に含まれました。 エルグ3Δ29、しかしエスシン耐性は強化されていません(MIC 150 μg/mL、図。 1c)。 この実験の範囲内で、次のトランスクリプトームも分析しました。 エルグ3Δと エルグ675 μg/mL エスシンで 1 時間処理したΔ細胞。
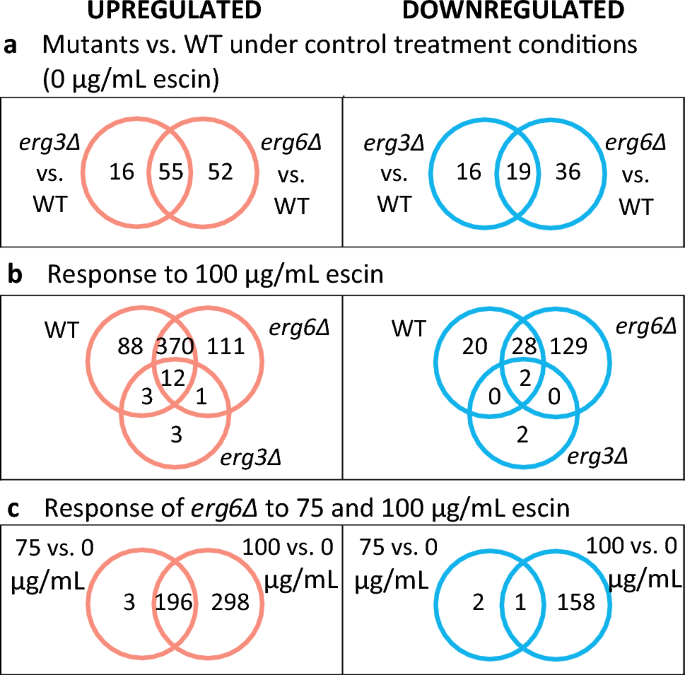
K は、発現レベルが最も変動する 2000 個の遺伝子のクラスター化を意味します。これを図に示します。 S5、遺伝子セット濃縮分析の完全な詳細は補足情報 (SI) に含まれています。 クラスター B 遺伝子 (n = 82) は一般に、 エルグ3Δと エルグ6Δはすべての条件下でWTと比較し、予想通り、このクラスターにはステロール生合成、ステロール輸送、シデロフォア輸送、およびグルコースによる転写制御に関連する遺伝子が豊富に含まれています。 クラスター A 遺伝子 (n = 821) は WT で下方制御されており、 エルグ6エスシン治療に対する反応はΔ。 このクラスターには、リボソーム生合成と RNA プロセシングに関連する遺伝子が豊富に含まれています。 クラスター C (n = 897) および D (n = 200) 遺伝子は一般に、WT および エルグ6エスシン処理に応答してΔ。クラスター D 遺伝子はクラスター C よりも大幅に上方制御されています。クラスター D には、トレハロース、マンノース、フルクトース、グルタミン酸の代謝、解糖および細胞壁の組織化に関連する遺伝子が豊富に含まれています。 クラスター D には、浸透圧、酸化、温度、飢餓ストレスに対する応答に関連する遺伝子も豊富に含まれています。 クラスター C には、後期ヌクレオファジー、脂質異化、硫黄同化、トリカルボン酸回路、糖新生に関連する遺伝子が豊富に含まれています。
対象条件間で 2 倍以上の差次的発現を示す示差的発現遺伝子 (DEG) (図 2) については、SI の完全な遺伝子セット濃縮の詳細とともに、以下でさらに詳しく説明します。
インパクト ERG3 および ERG6 酵母トランスクリプトーム上の欠失
対照条件下で株のトランスクリプトームを比較すると、変異株と WT の間の興味深い違いが明らかになります。 の削除 ERG6 結果として、より多くの DEG (n = 162) が生成されます。 ERG3 欠失 (n = 106)。 どちらの変異体でも、上方制御された DEG には、ステロールセンサーや転写活性化因子など、ステロール生合成と輸送に関連する遺伝子が豊富に含まれています。 UPC2 (イチジク。 S6)。 対照的に、スフィンゴ脂質およびリン脂質の供給に関与する非常に少数の遺伝子のみが上方制御されます(YSR3, RSB1, FAA2 および ELO2 両方の株で、そしてさらに SUR1 in エルグ6Δ; イチジク。 S7)、ただし、ステロール生合成変異体ではスフィンゴ脂質組成の大きな変化が報告されています。31.
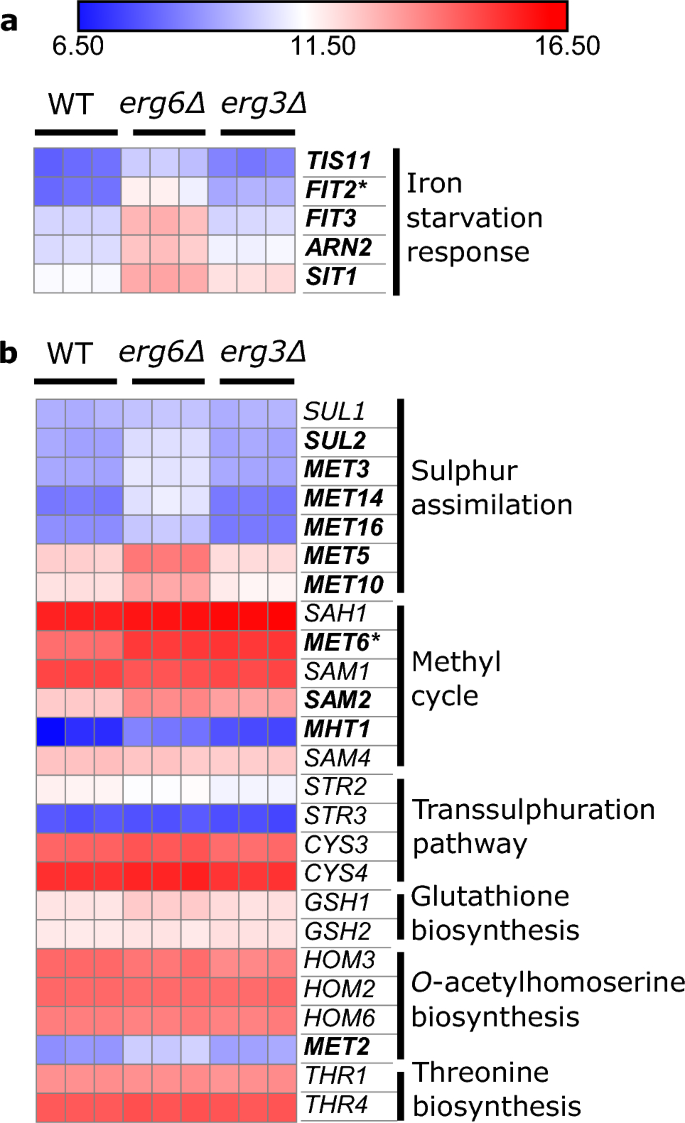
嫌気性応答細胞壁マンノプロテイン遺伝子も両方の株で高度に上方制御されています (図 XNUMX)。 S8)。 エルゴステロール生合成のいくつかの段階では補因子として酸素と鉄が必要であり、エルゴステロール、酸素、鉄に対する調節応答の間には複雑なクロストークが存在します。32,33,34,35。 多くの鉄欠乏応答遺伝子36 で上方制御されている エルグ6Δ(FIT2, FIT3, ARN2, SIT1, TIS11)、 だがしかし エルグ3Δ、WT に対するもの (図 3a)。 最近、鉄を感知する転写因子 Aft1 が、通常細胞質と核の間を行き来し、エルゴステロールが減少した細胞の液胞に蓄積することが報告されました。 upc2Δセル37。 私たちのデータは、このシグナル伝達経路がさまざまな程度に影響を受ける可能性があることを示唆しています。 エルグ6Δと エルグ3Δ.
メチオニン代謝遺伝子も上方制御されています。 エルグ6Δですが、そうではありません エルグ3Δ(図 3b)。 具体的には、上方制御された遺伝子は硫黄同化経路に関連しています (SUL2, MET3, MET14MET16, MET5、MET10)、およびメチル回路 (MET6, SAM2, MHT1)S-アデノシルメチオニン(SAM)を生成します(図。 S9)。 Erg6 酵素はメチル供与体 SAM を使用してザイモステロールをメチル化します38、Erg6–欠損株は SAM を蓄積することが以前に判明しており、これは SAM 消費量の減少に起因すると考えられていました。39.
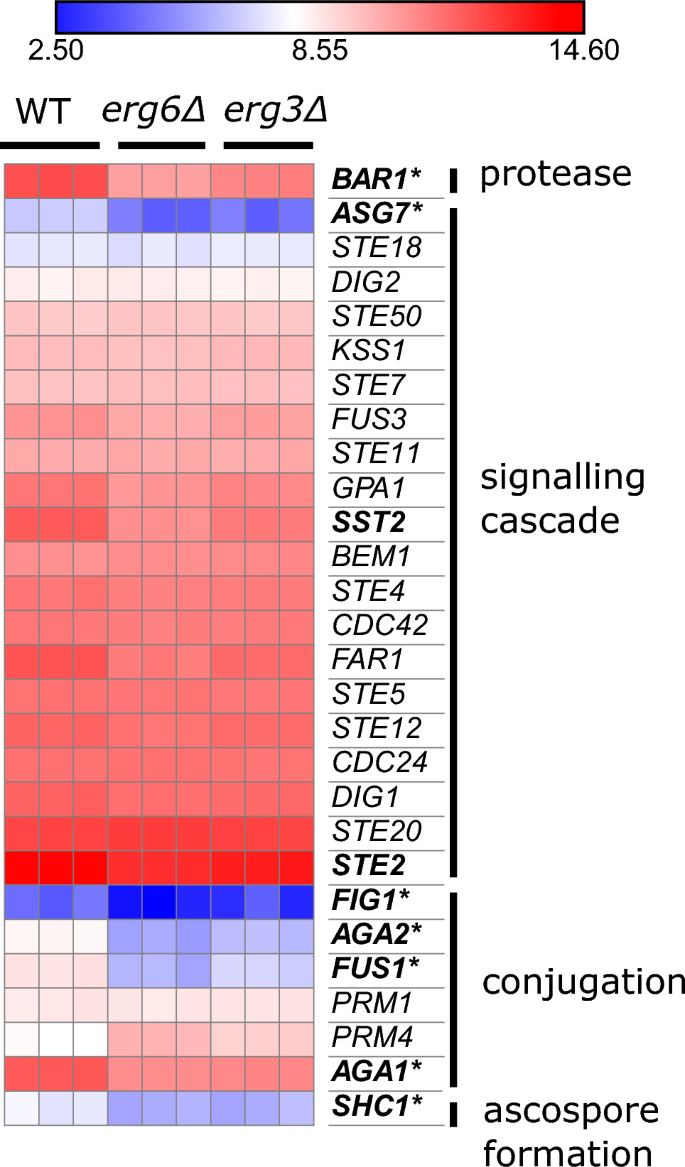
どちらの系統も交配に関与する多くの遺伝子を下方制御します(図XNUMX)。 4)。 これらは主に、接合するシュムー先端間の接合に関与する遺伝子です (FUS1, AGA1, AGA2, 図1, SHC1)、エルゴステロール生合成変異体では交配効率が著しく低下することが以前に報告されています。40,41.
どちらの株も発現します NCE102 WT よりも低いレベル (WT レベルの 42%) エルグ3Δ、および WT レベルの 40% エルグ6Δ)。 Nce102 は主に細胞膜エイソソームに局在していますが、最近、液胞融合に役割があることが報告されています。42、および空胞は、以下を含む多くのエルゴステロール生合成変異株で高度に断片化されています。 エルグ3Δではありませんが、 エルグ6Δ43,44,45.
変異体と WT の間のいくつかの DEG の機能が不明であることは注目に値します。 20 および 29 の上方制御された DEG、および 10 および 13 の下方制御された DEG エルグ3Δと エルグ6それぞれΔ。
エスシン治療に対するトランスクリプトーム反応
100 μg/mL エスシンに応答して、WT および エルグ6Δ株はそれぞれ473個と494個の遺伝子を上方制御します(図XNUMX)。 2b)。 これらの DEG には、乾燥、浸透圧ストレス、酸化ストレス、温度、化学処理、および栄養素レベル (SI) の変化に対する応答にも関連する遺伝子が豊富に含まれています。 の治療 エルグ675 μg/mL のエスシンを含む Δ 細胞は、199 個の遺伝子の上方制御をもたらしました (図 XNUMX)。 2c)。 これらの 199°には、酸化ストレス、化学ストレス、飢餓 (SI) への応答に関連する遺伝子が豊富に含まれています。
中心炭素代謝遺伝子に対するエスシン処理の影響を図に示します。 S10。 100 μg/mL エスシンに応答して、WT と エルグ6Δは、トレハロース、グリコーゲン、およびグリセロールの生合成に関連する遺伝子を強く上方制御します。 グルコースポリマーであるグリコーゲンは主に貯蔵炭水化物として機能すると考えられており、細胞の内部浸透圧にはほとんど影響を与えません。46,47。 二糖類トレハロースは、脂質二重層とタンパク質表面から水を置き換え、その後のリフォールディングを妨げる変性タンパク質の凝集を防ぐことにより、脂質膜とタンパク質の構造を保護する上で重要な役割を果たしていると考えられています。47。 グリセロールは、高浸透圧ストレス中に重要な浸透圧調節物質として機能し、リン脂質および貯蔵脂質トリアシルグリセロールの骨格を形成します。48。 トレハロース、グリコーゲン、グリセロール生合成の上方制御は、環境変化に対する一般的な反応の一部です47,48,49。 さらに、WT と エルグ6Δ株は、ポリユビキチン化とフルクトース-1,6-ビスホスファターゼの分解を開始することにより、解糖を優先して糖新生を負に制御するグルコース誘導分解欠損(GID)複合体のタンパク質をコードする遺伝子を上方制御する50 (イチジク。 S11).
100 μg/mL エスシンに応答して、WT と エルグ6Δはまた、γ-アミノ酪酸(GABA)シャント経路の酵素をコードする遺伝子を上方制御します(図XNUMX)。 S12)GABAを介してグルタミン酸を分解します。 酵母では、この経路が熱および酸化ストレス耐性に重要であることが示されています。51.
上方制御されたDEGには、胞子形成やキチン生合成などの細胞壁の組織化に関連する遺伝子も豊富に含まれています(図XNUMX)。 S13)。 高浸透圧グリセロール 1 (Hog1) 経路と細胞壁完全性 (CWI) マイトジェン活性化プロテインキナーゼ (MAPK) 経路間のクロストークは、欠陥のある変異体を利用せずに、これらの遺伝子の上方制御を開始する特定のストレスを分析することが困難であることを意味します。これらのシグナル伝達経路の特定の分岐において52,53,54.
多くのオートファジー関連遺伝子が WT で上方制御されており、 エルグ6エスシン治療に応答したΔ(図 S14)コアファゴソーム成分と、加水分解酵素を液胞に選択的に送達する細胞質から液胞への経路に関与するタンパク質を含む55。 100 μg/mL のエスシンに応答して、より多くのオートファジー関連遺伝子が 2 倍以上上方制御されます。 エルグ6WT よりもΔひずみ (11 対 7)。
エルグ6Δ株はまた、100 μg/mL エスシンに応答して WT よりも多くの遺伝子を下方制御し (159 対 50)、これらの DEG にはリボソーム生合成と翻訳に関連する遺伝子が豊富に含まれています。 これらのプロセスには大量のエネルギーが必要です56そしてそのダウンレギュレーションは一般的なストレス反応の一部であり、リソースは細胞増殖ではなくストレス耐性に向けられます。57,58.
エスシンがエルゴステロールを細胞から隔離したり、エルゴステロールまたはステロールセンサーとの相互作用によってステロール感知を阻害したりすると、次のようなステロール生合成遺伝子の転写変化が見られると予想されるかもしれません。 ERG2 および ERG11 エスシン治療に反応して。 これらの遺伝子は、エルゴステロール含有量に応じて、ステロールセンサーおよび転写活性化因子である Upc2 および Ecm22 によって制御されます。59,60。 エルゴステロール生合成遺伝子の発現差は観察されません(図XNUMX)。 S6)、統計的に有意ではあるがわずかな上方制御がありますが、 UPC2 各株で (WT では 1.3、1.9、および 1.5 倍、 エルグ6Δと エルグ3それぞれΔ)。 スフィンゴ脂質供給に関連する少数の遺伝子は、野生型および野生型においてエスシンに応答して上方制御される。 エルグ6Δ(図 S7)、ただし、スフィンゴ脂質制御の多くは翻訳後であることに注意する必要があります。31.
WT および WT で観察された大きなトランスクリプトーム変化とは対照的に、 エルグ6Δ株, エルグ3Δ株は、19 μg/mL エスシンに応答して 100 遺伝子のみを上方制御し、4 つを下方制御します (図 XNUMX)。 S15)。 これらの DEG のほとんどは、WT および/または エルグ6エスシン処理に反応するΔ株。ただし、 HAP4 (呼吸の調節因子をコード化)、 YOL163W (機能していないとみなされる)、 YGL088W (機能不明) と細胞壁マンノタンパク質遺伝子 DAN1 および ダン4。
エルグ3Δトランスクリプトームはエスシン治療のストレスに対して準備されていない
WT 株のエスシン応答 DEG がすでに差次的に発現しているかどうかを調べるために、 エルグ3制御条件下では Δ、潜在的に「プライミング」 エルグ3エスシン治療のストレスについては、WT 100 対 0 μg/mL エスシンの比較で DEG を比較しました。 エルグ3Δ 0 μg/mL エスシン 対 WT 0 μg/mL エスシン (図 S16a)。 制御条件下では、 エルグ3Δ株は、エスシン処理に応答してWTでも上方制御される18個の遺伝子の発現が上昇し、エスシン処理に応答してWTで下方制御される5つの遺伝子の発現が低下する。 これらの重複する遺伝子の発現レベルを示すヒートマップを図に示します。 S16b. これらの遺伝子の大部分は、細胞内でも差次的に調節されています。 エルグ6制御条件下でのΔひずみ、および エルグ6Δ株は強化されたエスシン耐性表現型を示さない。 例外は次のとおりです PAI3 (細胞質プロテイナーゼ A 阻害剤をコードする)、 SRL3 (細胞周期制御因子をコード化)、 HED1 (減数分裂特異的タンパク質をコードする)、 MAL31 (マルトースパーミアーゼをコード化)、 ARG3 (オルニチンカルバモイルトランスフェラーゼをコードする)、 COS111 (ミトコンドリアタンパク質をコードする)、遺伝子 YBR090C および YKR075C 未知の機能や遺伝子 YJR037W および YJL195C 機能的なタンパク質をコードしている可能性は低いです。
全体として、このデータは、エスシンが成長に影響を及ぼさず、トランスクリプトームに無視できる影響を与えていることを示しています。 エルグ3Δセル。 これが原因である可能性は低いです エルグ3Δ細胞はエスシン処理によって誘発されるストレスに対してすでに準備されており、これはその膜ステロールの化学組成に起因する可能性があります。
ブラシカステロールではなくエスシンをエルゴステロールと事前混合すると、エスシン媒介成長阻害が防止されます。
エスシンはエルゴステロールと直接相互作用することによって毒性を媒介するが、エルゴステロールに存在する変化したステロールとは相互作用しないという仮説を調査するため。 エルグ3Δ、エスシン単独、またはモル比1:1でエルゴステロールと予め混合されたエスシンでWT細胞を処理した場合の影響を評価しました。 エルゴステロールがエスシンと直接相互作用する場合、エスシンとエルゴステロールの混合物は、エスシンサポニンの接近可能性が低下するため、エスシン単独よりもWTの成長に対する影響が減少すると考えられました。 注目すべきことに、酵母細胞は好気的条件下では外因性ステロールを取り込まない37.
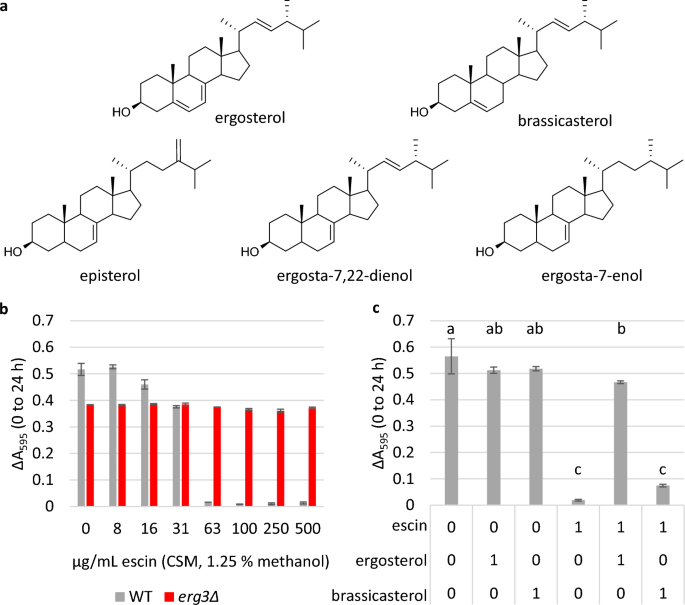
実験は、CSM の正確な含有量が定義されているため、YPD とは対照的に、マイクロプレート培養および完全サプリメント混合物 (CSM) 培地を使用して実行されました。一方、YPD は酵母抽出物からの複雑な分子を含むリッチ培地であり、エスシンとも相互作用する可能性があります。および/またはステロール。 以前の研究では、Erg7,22を欠く酵母ではエルゴスタ-3-ジエノールが主なステロールであり、エピステロールとエルゴスタ-7-エノールも蓄積することが報告されている。31,43。 ステロール含有量をガスクロマトグラフィー質量分析法で確認したところ(図2、3)。 S2 および S3)、最大ステロールピークの相対保持時間。 エルグ3Δトータルイオンクロマトグラムは、エルゴスタ-7,22-ジエノール株をYPDまたはCSMのいずれかで増殖させた場合の以前の報告に対応しました。
CSM培地中のエスシンのMICは、WT細胞について63μg/mLであると測定されました(図XNUMX)。 5b); YPDよりも2.4倍低い。 一方、 エルグ3Δ株は、試験した最高濃度(500μg/mL)まで阻害されなかった。 エスシンをエルゴステロールと1:1のモル比であらかじめ混合し、その混合物を細胞に添加すると、63μg/mLのエスシンの存在下でWT株の増殖が完全に回復しました(図XNUMX)。 5c)。 エスシンとエルゴステロールを事前に混合すると、膜不透過性色素ヨウ化プロピジウムで染色された細胞の割合も回復し、処理レベルが制御されました(図XNUMX)。 S17)、細胞透過性の低下および/または細胞生存率の増加を示します。
ブラシカステロールではなく、エスシンをエルゴステロールと事前混合すると、成長が回復します。 (a) エルゴステロール(体内の主要なステロール)の構造 S. セレビ 細胞膜)、ブラシカステロール(植物ステロール)、および体内に蓄積すると確認されているステロール エルグ3Δ株(エピステロール、エルゴスタ-7,22-ジエノール、エルゴスタ-7-エノール)。 (b)および(c)、マイクロプレート培養における増殖はΔAで示される595 (0 ~ 24 時間)。 XNUMX つの生物学的複製 ± 標準偏差 (SD)。 で (b)、CSM培地中のエスシンのMICはWTで63μg/mLであり、これは富裕複合培地よりも2.4倍低いです。 で (c)、WT細胞を、0または63μg/mLのエスシン(1.25%メタノール)単独、またはエルゴステロールまたはブラシカステロールと1:1のモル比で予め混合した存在下で増殖させた。 エルゴステロールおよびブラシカステロールのみの対照が含まれた。 統計: 事後 Tukey HSD 検定を使用した一元配置分散分析、同じ文字で接続されていない条件は大きく異なります (p ≤0.05)。
中に存在するステロールは、 エルグ3Δは入手可能性が限られているため、比較のために、エスシンをフィトステロールであるブラシカステロールと事前混合した場合の成長も評価しました。ブラシカステロールもB環に5つの二重結合を持っていますが、これの位置はC-6とC-の間にあります。 XNUMX (図 XNUMX) 5a)。 エスシンをエルゴステロールと予め混合した場合に観察された増殖の回復とは対照的に、エスシンをブラシカステロールとモル比1:1で予め混合した場合には、WTの増殖の回復は観察されなかった(図XNUMX)。 5c)。
これは、エスシンがエルゴステロールと直接相互作用し、ステロール構造の小さな変化がステロールとサポニンの相互作用の強さに大きな影響を与える可能性があるという仮説を裏付けています。
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 自動車/EV、 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- プラトンヘルス。 バイオテクノロジーと臨床試験のインテリジェンス。 こちらからアクセスしてください。
- チャートプライム。 ChartPrime でトレーディング ゲームをレベルアップしましょう。 こちらからアクセスしてください。
- ブロックオフセット。 環境オフセット所有権の近代化。 こちらからアクセスしてください。
- 情報源: https://www.nature.com/articles/s41598-023-40308-0