
Les affaires réglementaires (AR) sont une profession du secteur des sciences de la vie qui consiste à vérifier si une entreprise respecte les règles ou lois officielles concernant la sécurité et l'efficacité des produits. Les professionnels des affaires réglementaires supervisent le développement, les tests, la fabrication et la commercialisation de produits dans des domaines tels que les produits pharmaceutiques, les dispositifs médicaux, les cosmétiques, les pesticides et les médecines complémentaires. Ils travaillent également avec les agences de réglementation et le personnel sur des questions spécifiques qui affectent leur activité et conseillent leurs entreprises sur les aspects réglementaires et le climat qui pourraient affecter les activités proposées.
Cet article de blog abordera en détail les affaires réglementaires, ce que font les professionnels des affaires réglementaires et comment CSP Biotech peut vous aider à atteindre vos objectifs réglementaires.
RA is un domaine spécialisé au sein de l'industrie des sciences de la vie qui traite des processus d'approbation réglementaire et de conformité pour les produits nouveaux et existants comme produits pharmaceutiques, dispositifs médicaux, produits biologiques et autres produits de santé. Ces produits sont principalement conçus pour avoir une valeur thérapeutique et aider à traiter les patients ou d'autres consommateurs. RA apparaît lorsque ces Annonces must répondre aux exigences réglementaires strictes fixées par les agences gouvernementales comme le FDA (Administration des aliments et des médicaments) dans l' les États-Unis ou le EMA (Agence européenne des médicaments) en Europe.
Les principaux aspects de son importance comprennent :
- Approbation du produit : Obtention des approbations pour de nouveaux médicaments, dispositifs médicaux et thérapies dans les régions respectivesal agences gouvernementales de régulation. Ce processus implique une documentation complète indiquant la conception, la recherche et le développement, les aspects non cliniques et essais cliniques, études et rapports, et interactions avec les agences de réglementation pour démontrer le sécurité et efficacité du produit.
- Assurance Qualité: Les produits doivent être fabriqués, étiquetés et testés conformément aux réglementations afin de maintenir une qualité et une sécurité constantes.
- Conformité : Les entreprises doivent naviguer dans des réglementations complexes et évolutives, garantissant une conformité continue aux exigences changeantes.
- Gestion des risques: Tous les risques associés aux questions réglementaires doivent être gérés et évalués efficacement, guidant les entreprises dans la minimisation des risques juridiques et financiers potentiels.
- L'accès au marché: Les approbations réglementaires sont souvent des conditions préalables à l’accès au marché. Les approbations sont accordées par les agences gouvernementales via des présentations/dossiers de médicaments, c'est-à-dire, documents qui indiquent toutes les données de qualité, de sécurité et d’efficacité.
- Sécurité du patient: S'assurer que les produits sont sûrs et efficaces est primordial pour protégeringurgiter le bien-être des patients.
Dans l’ensemble, RA is Il est essentiel pour le secteur des sciences de la vie de commercialiser des produits de santé innovants et sûrs tout en garantissant qu’ils répondent à des normes réglementaires rigoureuses. Le non-respect de la réglementation peut entraîner des rappels de produits, des conséquences juridiques et des événements indésirables pour les patients., et atteinte à la réputation d'une entreprise.
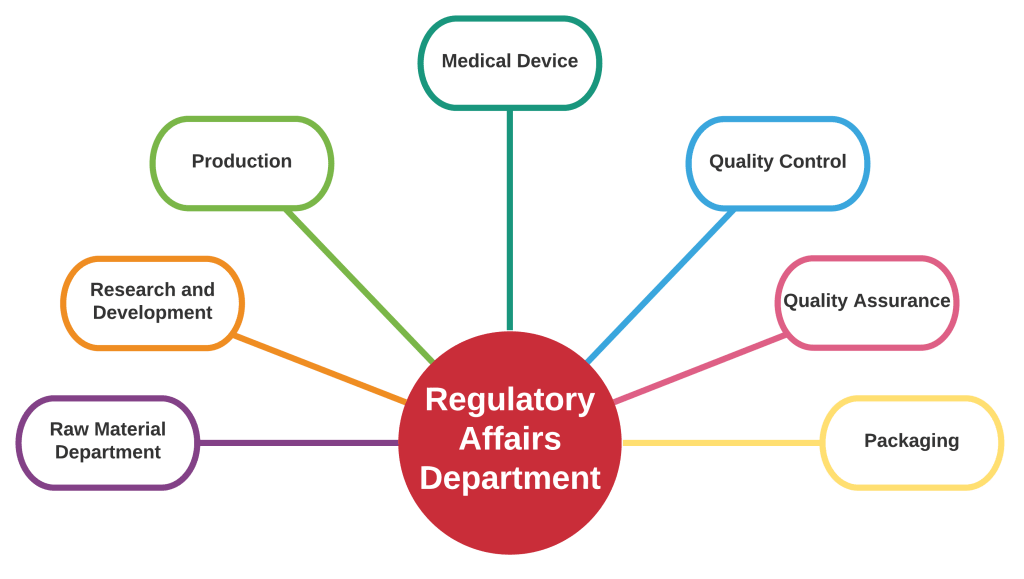
Rôle des affaires réglementaires et comment elles sont liées à tous les départements. Source: Conseiller pharmaceutique
Que font les professionnels des affaires réglementaires ?
Les professionnels de la RA jouent un rôle crucial dans le secteur des sciences de la vie en gérant les processus réglementaires complexes qui régissent le développement, l'approbation et la commercialisation des produits pharmaceutiques, des dispositifs médicaux, des produits biologiques et d'autres produits de santé. Leurs responsabilités englobent un large éventail de tâches, notamment :
- Soumissions réglementaires : Les professionnels de la RA préparent et soumettent des demandes, des dossiers et des documents aux agences de réglementation cherchant à obtenir l'approbation de nouveaux produits ou des modifications de produits existants. Cela implique de compiler des données sur la sécurité, l’efficacité et la qualité.
- Conformité : Les professionnels de la RA veillent à ce que leurs organisations respectent toutes les réglementations, normes et directives pertinentes. Ils surveillent les évolutions de la réglementation et conseillent sur les ajustements nécessaires pour maintenir la conformité.
- Essais cliniques: Ils peuvent superviser la planification et l'exécution des essais cliniques, en veillant à ce qu'ils répondent aux exigences réglementaires et aux normes éthiques. Ils collaborent avec des équipes cliniques et de recherche pour concevoir des essais qui génèrent des données acceptables pour approbation.
- Étiquetage et emballage : Les professionnels de RA apportent leur contribution à l'étiquetage et à l'emballage des produits afin de garantir qu'ils reflètent fidèlement les informations sur le produit et sont conformes aux exigences réglementaires.
- Assurance Qualité: Les professionnels de la réglementation travaillent avec des équipes d’assurance qualité pour établir et maintenir des systèmes de gestion de la qualité (QMS) robustes. Cela comprend la gestion de la documentation, des audits et des actions correctives et préventives (CAPA).
- Stratégie réglementaire : Ils élaborent et mettent en œuvre des stratégies réglementaires pour mettre les produits sur le marché de manière efficace et efficiente. Cela inclut la prise en compte des exigences réglementaires mondiales et des stratégies d’accès au marché.
- Communication avec les agences de réglementation : Ils représentent leurs organisations dans les communications avec les autorités réglementaires, répondant aux demandes de renseignements, fournissant des données supplémentaires et participant aux réunions et négociations réglementaires.
- Surveillance post-commercialisation : Une fois qu'un produit est approuvé et mis sur le marché, ils surveillent ses performances, y compris la notification des événements indésirables, pour garantir une sécurité et une efficacité continues.
- Affaires réglementaires globales: Ils naviguent dans divers systèmes et exigences réglementaires sur les marchés internationaux, garantissant ainsi que les produits peuvent être commercialisés à l'échelle mondiale.
- Gestion des risques: Ils évaluent et gèrent les risques liés à la conformité réglementaire, en tenant l'organisation informée des défis et opportunités réglementaires potentiels.
- La formation et l'éducation: Les professionnels de RA dispensent souvent des formations aux équipes internes pour garantir que les employés comprennent et respectent les processus et exigences réglementaires.
- Considérations éthiques et juridiques : Ils respectent les normes éthiques et juridiques dans toutes les interactions avec les agences de réglementation, les professionnels de la santé et le public.
Les professionnels de la RA veillent à ce que les produits de santé répondent aux normes réglementaires, soient sûrs et efficaces, et puissent être mis sur le marché conformément à toutes les lois et réglementations applicables. Leur travail est essentiel au succès et à l’intégrité de l’industrie des sciences de la vie.
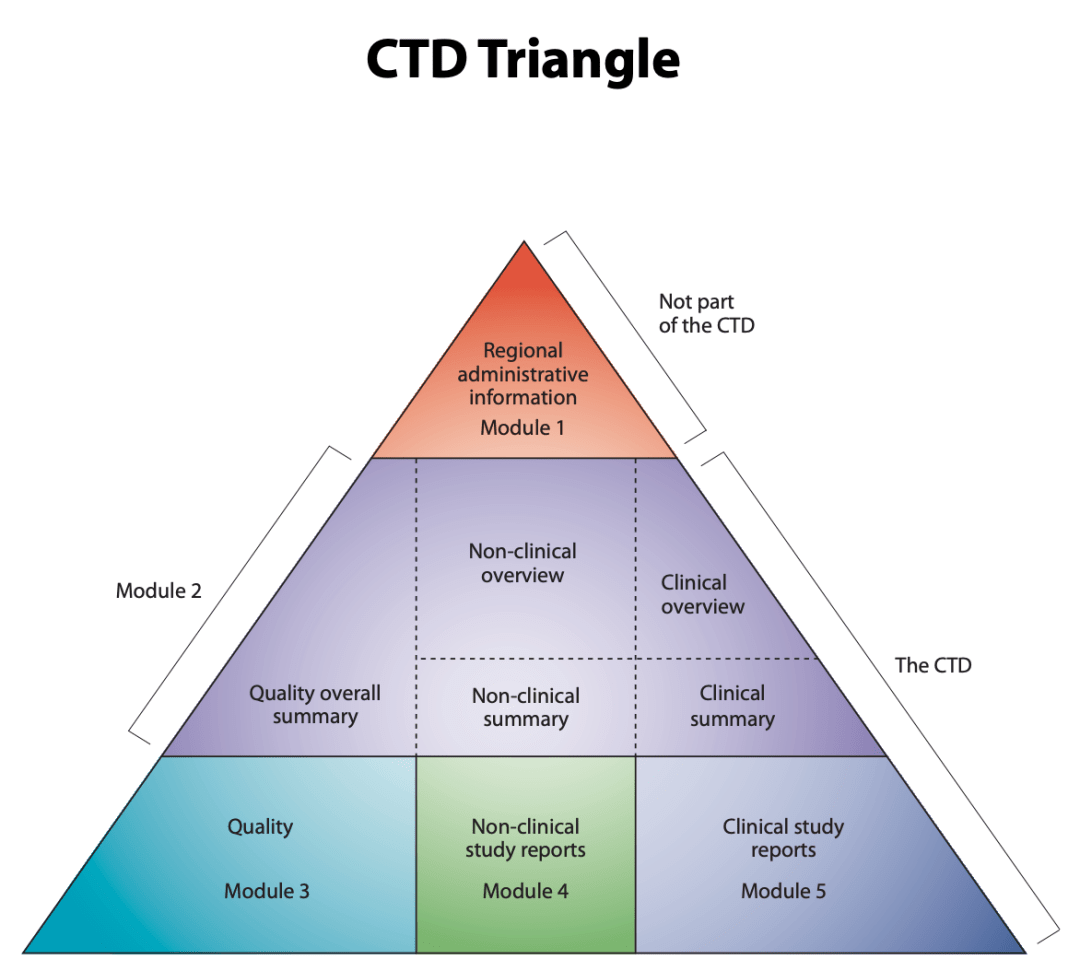
Le triangle CTD. Le Document Technique Commun est organisé en cinq modules. Le module 1 est spécifique à la région et les modules 2, 3, 4 et 5 sont destinés à être communs à toutes les régions. Source: Site Web du PCI
Comment PSC Biotech peut-il vous aider à atteindre vos objectifs réglementaires ?
L'équipe RA de PSC possède de vastes connaissances et expérience dans la soumission de documents réglementaires mondiaux. Nous prenons en charge toutes les soumissions de produits réglementés pour les produits pharmaceutiques, les dispositifs médicaux, les produits biologiques, faliments, boissons, produits cosmétiques et produits en papier tissu.
Nous pouvons soutenir les activités pré-commercialisation et post-commercialisation pour les soumissions mondiales en sciences de la vie. Nous avons travaillé sur divers projets réglementaires impliquant l'enregistrement de nouveaux produits sur les marchés internationaux, le développement et l'analyse de stratégies réglementaires, de documents de soumission et d'orientations sur les réglementations pour chaque type de produit.
Nos spécialités comprennent :
Stratégie réglementaire
- Estimez les risques réglementaires pour votre produit.
- Examiner les exigences d'étiquetage en fonction du produit et des marchés spécifiques.
- Examinez les données précliniques, sur les processus de produit et sur la fabrication.
- Examiner la documentation des études non cliniques et cliniques (études d'essais cliniques de phase 0, de phase I, de phase II, de phase III et de phase IV)
- Planification des soumissions et mesures d’approbation.
Examiner et conserver la documentation et les enregistrements du projet :
- Rédiger ou réviser la documentation relative à la qualité des produits et à la chimie, fabrication et contrôles (CMC) documentation associée et projets de remédiation
- Examiner les demandes de licence et les modèles de dossiers
- Évaluez ou évaluez la documentation pré-approbation et post-approbation, les formulaires d'essais cliniques, la documentation post-approbation, les études BA/BE et le document technique commun, également connu sous le nom de modules CTD.
- Réponse à Aquestions d'urgence, demandes de Omédicaments orphelins et désignations accélérées, assistance protocolaire
Générer et gérer les fichiers de soumission et examiner les fichiers de soumission des auteurs
- Créez des modules CTD et des modules eCTD, examinez ou gérez les soumissions et les dossiers tels que NDA, BLA, ANDA, DMF, BMF, EUA, ou toute autre soumission de nouveau produit.
- Rédiger, réviser ou gérer des soumissions de dispositifs médicaux telles que 510(k), PMA, IDE, MDR, étiquetage et dénomination de la marque pour tous les appareils de classe (I, II, III)
- Développer ou évaluer des demandes de licence, d’études précliniques, d’essais cliniques et d’autres tests.
- Gérer l'enregistrement des établissements, la réglementation du système qualité et les listes de dispositifs médicaux.
- Guider l’évolution des réglementations telles que 21 CFR, ISO, UE GMP, Lignes directrices de l'ICH ou toute autre réglementation du marché pouvant avoir un impact sur votre produit ou vos processus.
- Gérez tous vos documents et systèmes de gestion globaux pour garantir l’efficacité de toutes vos soumissions.
Analyse risques-avantages et évaluations des risques pour la conformité réglementaire :
- Effectuer une analyse appropriée des écarts et des risques pour aider les entreprises à analyser les mesures d'atténuation des risques..
- Développez des programmes d’évaluation et de gestion des risques pour votre produit dans le cadre des poster-processus de soumission d’approbation.
- Effectuer des audits simulés pour évaluer la qualité et la conformité réglementaire.
Développer des programmes de formation interne et fournir un soutien réglementaire aux équipes existantes.
PSC Biotech a également le nous a permis de concevoir pour soutenir d'autres processus qui peuvent impact ropérations de réglementation, telles que Validation du système informatique (CSV), Assurance du système informatique (ASC), Rédaction technique, Avérifications, Installation, Qualification ainsi que Validation (CQV), ainsi que activités de gestion de projet.
Voir aussi
Solutions logicielles CFP
Embaucher des consultants
PSC Biotech Services fournit une expertise rapide, économique et de haut niveau.
Suivez-nous
Partagez, engagez, restez à jour
L'assurance qualité (AQ) est un processus qui aide une entreprise à garantir que ses produits ou services répondent aux normes de qualité fixées par l'entreprise ou à ses exigences réglementaires. L'assurance qualité est impliquée dans toutes les étapes du développement d'un produit, depuis la livraison des matières premières jusqu'à…
La Convention internationale BIO est le principal événement de l'industrie mondiale de la biotechnologie, où vous pouvez réseauter avec des milliers de pairs, dirigeants et partenaires et découvrir les dernières innovations et opportunités dans le secteur des sciences de la vie. Cette année, le…
La métrologie est essentielle à tout processus de fabrication des sciences de la vie dans une industrie hautement technique et réglementée. Chez PSC Biotech, nous offrons une gamme de services de métrologie pour aider nos clients à maintenir les exigences de conformité des équipements et des systèmes et à assurer leur…
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- La source: https://biotech.com/2023/09/25/your-compass-for-navigating-biopharma-regulations/






