L'utilisation du nouveau modèle FDA eSTAR nécessite également un nouveau processus de gestion de projet eSTAR pour préparer vos soumissions 510k et De Novo.
Aperçu de dix (10) changements majeurs résultant du nouveau modèle FDA eSTAR
Au 1 octobre 2023, tous 510K ainsi que Soumissions de Novo à la FDA exigent désormais l'utilisation du nouveau modèle FDA eSTAR et le modèle doit être téléchargé sur le Portail de collaboration client (CCP) de la FDA. Hier, la FDA a publié un guide mis à jour expliquant les exigences de soumission électronique 510k, mais il y a dix (10) changements majeurs dans le processus de soumission de la Medical Device Academy résultant des nouveaux modèles eSTAR :
- Nous n'avons plus besoin d'une table des matières.
- Nous n'utilisons plus la structure du volume et du document.
- Nous ne sommes plus tenus de nous conformer aux sections ou à la pagination de l’ensemble de la soumission.
- Nous ne nous soucions plus de la sélection ou de la liste de contrôle RTA (elles n'existent pas).
- Nous ne prenons plus la peine de créer un résumé (c'est facultatif).
- Nous n'avons plus de section pour les appareils de classe 3, car il n'y a plus d'appareils de classe 3 510(k).
- Nous n'utilisons plus le formulaire FDA 3514, car ce contenu est désormais intégré à l'eSTAR.
- Nous ne créons plus de déclaration de conformité, car l'eSTAR en crée une automatiquement.
- Nous ne recommandons plus de créer un résumé 510(k), car eSTAR en crée un automatiquement
- Nous n'utilisons plus FedEx, car nous pouvons plutôt télécharger électroniquement vers le CCP de la FDA.
Qu'est-ce qui est différent dans les exigences 510k ?
Malgré tous les changements perçus dans le processus de notification préalable à la commercialisation de la FDA (c'est-à-dire le processus 510k), les exigences en matière de format et de contenu n'ont pas beaucoup changé. Le changement récent le plus important apporté au processus 510k était l'exigence d'inclure tests de cybersécurité.
Aperçu de la gestion du projet eSTAR
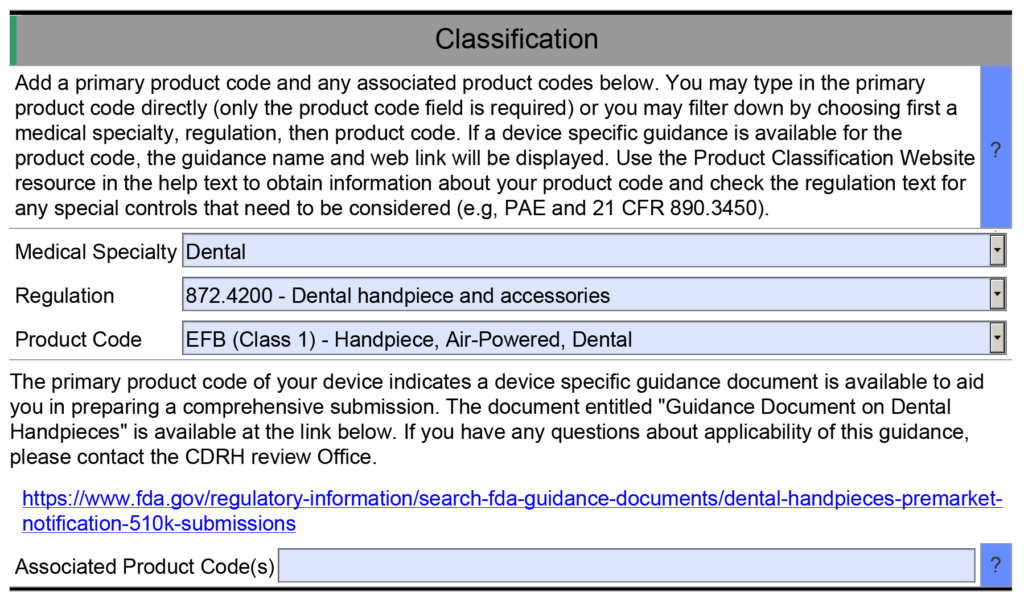
Il y avait 20 sections dans une soumission de 510 XNUMX. L'équipe de consultants de Medical Device Academy a créé un modèle pour les documents à inclure dans chaque section. La gestion de projet eSTAR est différente car il n'y a pas de numéros de section à référencer. Pour que les choses soient claires, nous vous recommandons d'utiliser un ou deux mots au début de chaque nom de fichier pour définir la section à laquelle il appartient. Les mots doivent correspondre aux signets utilisés par la FDA. Cependant, vous devez faire attention à ne pas rendre les noms de fichiers trop longs. Vous trouverez ci-dessous une liste de toutes les sections :
- Informations administratives ;
- Description de l'appareil;
- Prédicats et équivalence substantielle ;
- Avantages, risques et mesures d'atténuation ;
- Étiquetage ;
- Retraitement, stérilité et durée de conservation ;
- Biocompatibilité ;
- Logiciels/micrologiciels et cybersécurité/interopérabilité
- Logiciel;
- CEM, sécurité sans fil, électrique, mécanique et thermique ;
- Test de performance;
- Gestion de la qualité; et
- Documents administratifs.
La section Avantages, risques et mesures d’atténuation s’applique uniquement aux demandes de classification De Novo. La section Gestion de la qualité comprend des sous-sections relatives aux informations sur le système de gestion de la qualité, aux informations sur les installations, aux études post-commercialisation et aux références. Cependant, seule la sous-section Références sera visible dans la plupart des soumissions, car les trois autres sous-sections font partie du projet pilote eSTAR de Santé Canada. Les autres sections et sous-sections seront abrégées ou masquées en fonction des sélections du menu déroulant que vous sélectionnez dans eSTAR. Par exemple, la section cybersécurité restera masquée si votre appareil ne dispose pas de fonctionnalité sans fil ou de lecteur de stockage amovible.
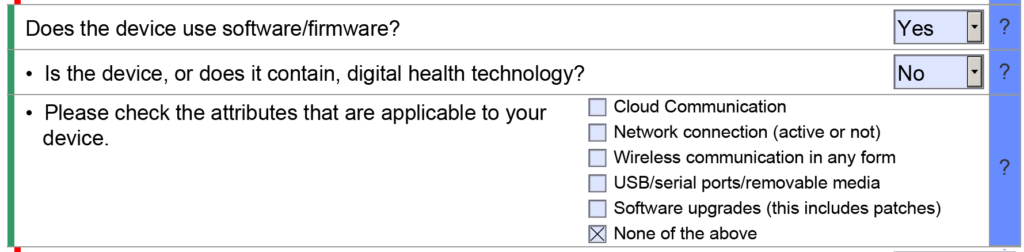
Une table des matières n'est plus requise pour les soumissions de 510 XNUMX
510 510 soumissions utilisant le format FDA eCopy nécessitaient une table des matières, et Medical Device Academy a utilisé la table des matières comme outil de gestion de projet. Parfois, nous utilisons encore notre modèle de table des matières pour communiquer les missions et gérer le projet XNUMXk. Les sections de la table des matières seraient également codées par couleur et une transition qui soit juste., Bleu, jauneet rouge pour communiquer le statut de chaque section. La gestion du projet FDA eSTAR utilise un processus de codage couleur similaire avec des barres colorées sur le côté du modèle pour indiquer si la section est incomplète, complète ou facultative.

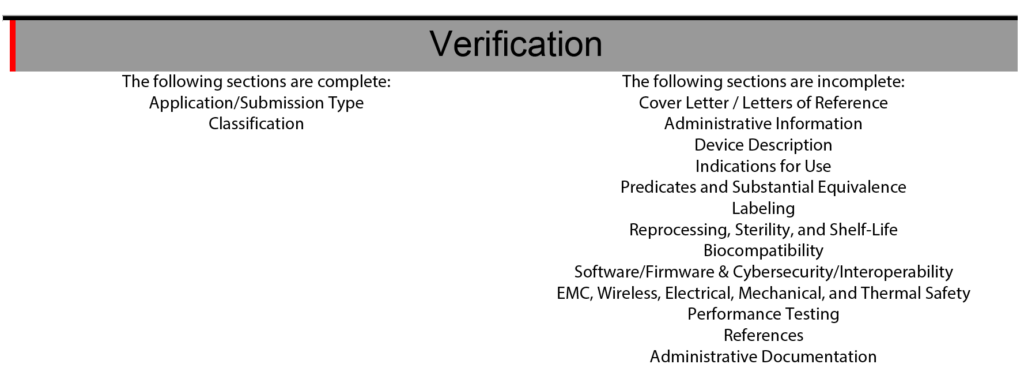
L'eSTAR comporte également une section de vérification à la fin du modèle pour faciliter la gestion du projet eSTAR. La section de vérification répertorie chacune des 13 sections principales d'un FDA eSTAR. Lorsque les sections sont complétées, le nom de la section se déplace automatiquement du côté droit de la section de vérification vers le côté gauche. Au cours des deux dernières années (2021 – 2023) de mise en œuvre du modèle eSTAR, j'ai lentement appris à m'appuyer uniquement sur eSTAR pour communiquer le statut de chaque section. Pour attribuer des responsabilités pour chaque section de la soumission 510k, nous utilisons toujours les listes simples de la table des matières et des outils de gestion de projet comme Asana. L'utilisation de la section de vérification eSTAR pour vérifier l'état de chaque section 510k augmente également la maîtrise de l'eSTAR de notre équipe à chaque fois que nous l'utilisons.
Utiliser Dropbox pour la gestion de projet eSTAR
Les modèles PreSTAR pour une réunion Q-Sub font environ la moitié de la longueur (c'est-à-dire 15 pages au lieu de 30+ pages) d'un modèle eSTAR, et la soumission de 510 XNUMX pièces nécessite beaucoup plus de pièces jointes qu'un Q-Sub. Par conséquent, nous pouvons généralement envoyer par courrier électronique une version révisée du PreSTAR à un membre de l'équipe pour examen, mais nous ne pouvons pas utiliser le courrier électronique pour partager un eSTAR presque complet avec un membre de l'équipe. Par conséquent, la Medical Device Academy utilise Dropbox pour partager les révisions de l'eSTAR entre les membres de l'équipe. Certains de nos clients utilisent One Drive ou Google Drive pour partager des révisions. Nous créons également des sous-dossiers pour chaque type de test. Cela permet de conserver tous les documents et rapports de test d'une section de l'eSTAR au même endroit. Par exemple, la documentation de validation du logiciel sera organisée dans un sous-dossier du dossier Dropbox pour un projet 510k.
Lors de l'utilisation des eCopies FDA au lieu du modèle FDA eSTAR, nous avons utilisé vingt sous-dossiers étiquetés et organisés par numéros de volume 1 à 20. Certaines de ces 20 sections sont désormais obsolètes (par exemple, le résumé de classe III) et d'autres (par exemple, les indications d'utilisation) sont intégrées directement dans le modèle eSTAR. Par conséquent, une équipe peut n'avoir besoin que de 8 à 10 sous-dossiers pour organiser les documents et les rapports de test pour un projet de 510 XNUMX $.. Nous ne joignons généralement pas ces documents et rapports de test avant la toute fin de la préparation de la soumission, car si la FDA publie une nouvelle version de l'eSTAR, les pièces jointes ne seront pas exportées d'une ancienne version de l'eSTAR vers la nouvelle version.
La coordination de la collaboration en équipe est essentielle à la réussite de la gestion du projet eSTAR
Dans le passé, la Medical Device Academy utilisait toujours une structure de volumes et de documents pour organiser une copie électronique FDA, car cela permettait à plusieurs membres de l'équipe de travailler simultanément sur la même soumission 510 4.3, même depuis des pays différents. De nombreux clients utiliseront SharePoint ou Google Docs pour faciliter la collaboration simultanée de plusieurs utilisateurs. Malheureusement, l'eSTAR ne peut pas être modifié par deux utilisateurs simultanément car il s'agit d'un modèle sécurisé qui ne peut être modifié que dans Adobe Acrobat Pro. Par conséquent, l'équipe doit communiquer lorsque le modèle eSTAR est mis à jour et suivre les révisions. Pour la communication, nous utilisons une combinaison d'applications de messagerie instantanée (par exemple, Slack ou Whatsapp) et de courrier électronique, tandis que les révisions sont suivies en ajoutant les initiales et la date de l'éditeur au nom du fichier (par exemple, nIVD 12 rvp 5-2023-XNUMX. pdf).
Importance des évaluations par les pairs
Chaque section du FDA eSTAR doit être complétée avant que la soumission puisse être téléchargée sur le portail de collaboration client (CCP). Si le FDA eSTAR est incomplet, le CCP identifiera le dossier comme incomplet. Vous ne pourrez pas télécharger le fichier. Si les questions de l'eSTAR reçoivent une réponse incorrecte, les sections qui doivent être complétées risquent de ne pas être activées en raison de la manière dont les questions ont été répondues. Vous trouverez ci-dessous deux exemples de réponses incorrectes aux questions eSTAR.
- Exemple 1 – L'une des fonctionnalités utiles de FDA eSTAR est que de nombreux champs sont remplis avec un menu déroulant de réponses. Un exemple se trouve dans la section Classification de l'eSTAR. Cette section exige que le demandeur identifie la classification de l'appareil en répondant à trois questions : 1) le comité d'examen, 2) le règlement de classification et 3) le code du produit à trois lettres. Chacun de ces champs utilise un menu déroulant pour remplir le champ, et les options déroulantes pour les questions deux et trois dépendent des réponses à la question précédente. Cependant, si vous saisissez manuellement le code produit dans le champ de la troisième question, l'eSTAR n'identifiera aucun document d'orientation sur les contrôles spéciaux applicables à votre appareil. À moins que vous ne connaissiez déjà un document d'orientation sur les contrôles spéciaux applicable, vous répondrez aux questions de l'eSTAR sur les contrôles spéciaux par « N/A ». L'eSTAR n'identifiera un document d'orientation sur les contrôles spéciaux pour votre appareil que si vous sélectionnez un code de produit dans le menu déroulant, mais l'examinateur de la FDA sait quels documents d'orientation sur les contrôles spéciaux sont applicables. C'est pourquoi la FDA effectue un examen technique de l'eSTAR avant le début de l'examen approfondi.
- Exemple 2 – Si vous indiquez la durée cumulée de contact pour un dispositif communiquant extérieurement < 24 heures, le modèle eSTAR attendra de vous que vous évaluiez les paramètres de biocompatibilité suivants : cytotoxicité, sensibilisation, irritation, toxicité systémique et pyrogénicité.
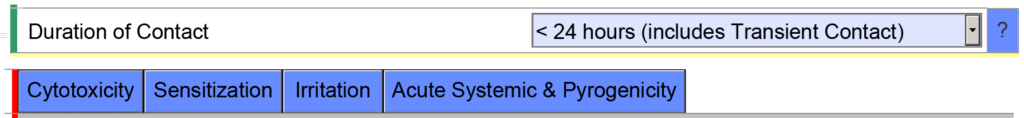
Cependant, si vous indiquez que la durée cumulée du contact est < 30 jours, le modèle eSTAR sera renseigné avec des critères de biocompatibilité supplémentaires. L'eSTAR ne connaît pas la durée cumulée d'utilisation, mais l'examinateur de la FDA le saura. C'est pourquoi la FDA effectue un examen technique de l'eSTAR avant le début de l'examen approfondi.

Pour vous assurer que toutes les sections de votre soumission sont complètes, il est utile qu'une deuxième personne examine toutes les réponses pour s'assurer que tout a été rempli correctement. Même les consultants expérimentés qui préparent 510 XNUMX soumissions chaque semaine peuvent commettre une erreur et répondre de manière incorrecte à une question dans l'un des domaines eSTAR. Par conséquent, vous ne devriez pas ignorer cette vérification QC critique.
Formation supplémentaire 510k
Le livre 510k, "Comment préparer votre 510k en 100 jours", a été achevé en 2017, mais le livre n'est disponible que dans le cadre de notre parcours 510k série composée de plus de 58 webinaires. Veuillez visiter le page webinaire pour acheter des webinaires individuels.
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- La source: https://medicaldeviceacademy.com/estar-project-management/



