إعداد ميل-PLGA مصادر القدرة النووية
تم استخدام طريقة التطاير بالمذيبات النانوية بخطوة واحدة لتخليق Mel-PLGA NPs26. تم إذابة عشرين ملغ من PLGA (P2191، اللاكتيد: جليكوليد (50:50)، مول بالوزن 30,000-60,000، سيجما ألدريتش، الولايات المتحدة الأمريكية) في الأسيتون (مل واحد)؛ تمت إضافة واثنين ملغ من Mel (73-31-4، مول بالوزن 232.28، سيجما ألدريش، الولايات المتحدة الأمريكية) متبوعًا بنصف ساعة من الطرد المركزي لتكوين الطور العضوي [2٪ (وزن / حجم)]. تم حقن المرحلة العضوية المشكلة في H2o مع التحريك المستمر لمدة نصف ساعة؛ يليه تبخر الأسيتون (عند 37 درجة مئوية تحت الفراغ).
توصيف Mel-PLGA NPs
تم الحصول على Mel-PLGA NPs المنتجة عن طريق التجفيف بالتجميد وتخزينها عند درجة حرارة 4 درجات مئوية. تمت ملاحظة شكل الجسيمات النانوية المحضرة بواسطة المجهر الإلكتروني النافذ (TEM). مالفيرن.
تم استخدام جهاز Zetasizer لتحديد حجم وإمكانات زيتا للجسيمات النانوية.
كفاءة التغليف (EE٪) وتحميل الدواء (DL٪) لـ Mel-PLGA NPs26
تم تحديد كمية Mel في Mel-PLGA NPs بواسطة تحليل كروماتوجرافي سائل عالي الأداء (HPLC). حيث تم إذابة Mel-PLGA NPs في الأسيتون متبوعة بالموجات فوق الصوتية لتحرير Mel المغلف. تم طرد المحلول عند 3000 دورة في الدقيقة لمدة عشرين دقيقة لترسيب PLGA. يمثل الميل المذاب في الطاف الكتلة المغلفة في NPs. تم تحديد إطلاق Mel من Mel-PLGA NPs عن طريق تخفيف مل واحد من NPs مع محلول ملحي فوسفات تسعة مل (PBS، pH 7.4)؛ تليها الحضانة عند 37 درجة مئوية على شاكر. عند 0 و20 و40 و60 و80 و100 ساعة، تمت إزالة 300 ميكرولتر من المحلول (تم استبداله بنفس الحجم بـ PBS) وطرده عند 3000 دورة في الدقيقة لمدة 30 دقيقة. تم حساب EE% وDL% بالمعادلات التالية:
$${text{EE}}% = left( {{text{mass}};{text{of}};{text{Mel}};{text{in}};{text{Mel}} - {text {PLGA}};{text{NPs}}/{text{total}};{text{mass}};{text{of}};{text{Mel}}} يمين) مرات {1}00.$$
$${text{DL}}% = left( {{text{mass}};{text{of}};{text{Mel}};{text{in}};{text{Mel}} – {text {PLGA }};{text{NPs}}/{text{total}};{text{mass}};{text{of}};{text{Mel}} - {text{PLGA}};{text{ NPs}}} على اليمين) ضرب {1}00.$$
في التأثيرات المختبرية لـ Mel-PLGA NPs
تأثير مضادات الأكسدة في المختبر لـ Mel-PLGA NPs 27
تم تقييم قدرة مضادات الأكسدة في Mel-PLGA NPs المحضرة من خلال آثارها الكسحة للجذور الحرة عبر 1، 1- ثنائي فينيل -2 بيكريل هيدرازيل [DPPH (281,689،3.9، سيجما ألدريتش، الولايات المتحدة الأمريكية)]. ببساطة، تم خلط تركيزات مختلفة من NPs (من 1000 إلى 0.1 ميكروغرام / مل) مع مل واحد من محلول DPPH / الإيثانول (30 مم)، ورجها، وسمح لها بالوقوف لمدة 25 دقيقة عند 517 درجة مئوية. تم قياس الامتصاصية عند XNUMX نانومتر باستخدام حمض الأسكوربيك كمادة مرجعية. نشاط مسح DPPH٪ = [(أ0-ا1)/أ0]× 100. كان امتصاص العينة A1، في حين كان امتصاص رد الفعل التحكمي A0.
في تأثير السمية الخلوية لـ Mel-PLGA NPs
تم فحص سلامة استخدام Mel-PLGA NPs، في المختبر، قبل استخدامها في الجسم الحي. تم استزراع خلايا Caco2 (سيجما ألدريش، الولايات المتحدة الأمريكية) عند 37 درجة مئوية في 5٪ من ثاني أكسيد الكربون ورطوبة نسبية قدرها 2٪، في وسط النسر المعدل (DMEM) في Dulbecco والمكمل بـ NaHCO3 (2.2 جم / لتر)، د-جلوكوز (4.5 جم / لتر)، 1٪ أحماض أمينية غير أساسية، 10٪ مصل بقري جنيني، 100 وحدة دولية / مل بنسلين و 0.1 ملجم / مل ستربتومايسين (جميع المواد المستخدمة في عملية الاستنبات تم شراؤها من سيجما الدريخ، الولايات المتحدة الأمريكية). تم إجراء اختبار السمية الخلوية في المختبر وفقًا لعلاء وآخرين.28. 100 ميكرولتر / بئر 105 تم تحضين خلايا Caco2 في أطباق زراعة الأنسجة عند 37 درجة مئوية لمدة 24 ساعة للسماح بتطوير الطبقات الأحادية للخلية. بعد الصب المتوسط، تم استخدام وسائط الغسيل لغسل الطبقات الأحادية. تم إنتاج تركيزات متدرجة من Mel-PLGA NPs من خلال الجمع بين NPs ووسط RPMI. تم تخفيف تخفيف NPs المنتج إلى 0.1 مل، وأضيف إلى الآبار، ثم ترك لمدة 24 ساعة أخرى. تلقت الآبار 20 ميكرولتر من MTT (3- (4,5،2-ثنائي ميثيل ثيازول-2-ييل) -5-5-بروميد ثنائي فينيل تيترازوليوم) بتركيز 37 ملغم/مل. تم رج الأطباق لمدة خمس دقائق لضمان خلط MTT، ثم تم تحضينها لمدة أربع ساعات عند 5 درجة مئوية مع XNUMX% من ثاني أكسيد الكربون.2. لإذابة الفورزان المطور، تم تطبيق 200 ميكرولتر من ثنائي ميثيل سلفوكسيد (DMSO) على الألواح. عند 560 نانومتر، تم قياس الامتصاصية (التي كانت مرتبطة مباشرة بالفورمازان).
تأثير التخثر في المختبر لـ Mel-PLGA NPs29
تم اختبار نشاط التخثر لـ Mel-PLGA NPs المحضرة للتنبؤ بتأثيرها عند تناولها في الجسم الحي. تم تقييم النشاط المضاد للتخثر لـ Mel-PLGA NPs عن طريق قياس وقت التخثر بالثواني عند 37 درجة مئوية، مع استخدام الهيبارين كعنصر تحكم. وفقًا لتوصيات الشركة المصنعة، تم استخدام كواشف زمن البروثرومبين (PT) وكواشف زمن الثرومبوبلاستين الجزئي (PTT) (المحتضنة مسبقًا عند 37 درجة مئوية لمدة 5 دقائق). باختصار، تم الجمع بين بلازما الفئران (900 ميكرولتر) وتركيزات Mel-PLGA NPs المختلفة (100 ميكرولتر) أو الهيبارين المذاب في المياه المالحة. تم إجراء الاختبار ثلاث مرات، وتم تسجيل وقت التخثر.
تأثير مضاد للالتهابات (تثبيط انحلال الدم) في المختبر لـ Mel-PLGA NPs
تم تحديد التأثير المضاد للالتهابات لـ Mel-PLGA NPs عن طريق اختبار تثبيط انحلال الدم وفقًا لـ Anosike et al..30. تم طرد دم الفئران الطازج المحتوي على الهيبارين (5 مل) عند 2500 دورة في الدقيقة لمدة 15 دقيقة ؛ بعد ذلك، تم إذابة الحبيبة الناتجة باستخدام المخزن المؤقت متساوي التوتر (الذي كان يعادل حجم المادة الطافية). تم الجمع بين جرعات مختلفة من Mel-PLGA NPs (من 100 إلى 1000 ميكروغرام / مل) مع 5 مل من الماء المقطر لإنشاء محلول منخفض التوتر. تم الجمع بين نفس جرعات NPs مع محلول متساوي التوتر (5 مل)؛ وتم استخدام الإندوميتاسين كعنصر تحكم. تلقت محاليل NPs والتحكم فيها 0.1 مل من معلق كريات الدم الحمراء المنتج، والذي تم تحضينه بعد ذلك لمدة ساعة عند 37 درجة مئوية قبل طرده بالطرد المركزي لمدة ثلاث دقائق عند 1500 دورة في الدقيقة. تم استخدام مقياس الطيف الضوئي لتحديد كمية الهيموجلوبين المنطلق في الطاف عند 540 نانومتر، وتم تقدير النسبة المئوية لتثبيط انحلال الدم باستخدام الصيغة: تثبيط انحلال الدم (٪) = 1−[(ODb-ODa)/(ODc-ODa)]× 100.ODa يرمز إلى امتصاص العينة في محلول متساوي التوتر، ODb لامتصاص العينة في محلول منخفض التوتر، وODc للتحكم في الامتصاص في محلول منخفض التوتر.
الحيوانات والتصميم التجريبي
تم شراء ذكور فئران سبراغ داولي، بوزن 200 جرام وعمرها ثمانية أسابيع، من بيت الحيوانات التابع للهيئة الوطنية لمكافحة وأبحاث المخدرات (القاهرة، مصر). تم تنفيذ جميع الإجراءات التجريبية وفقًا للمبادئ التوجيهية الدولية لرعاية واستخدام حيوانات المختبر والامتثال لإرشادات الوصول. تم فحص جرعتين من Mel-PLGA NPs (5 و 10 ملغم / كغم) في الجسم الحي لاختبار فعالية NPs في علاج إصابة الكبد الناجمة عن CCL4؛ وأيضا للعثور على الجرعة العلاجية المطلوبة. علاوة على ذلك، تم استخدام جرعتين من الميل المجاني (5 و 10 ملغم / كغم) في المجموعات الفرعية التجريبية ومقارنتها بالمجموعات الفرعية التي تديرها Mel-PLGA NPs لإثبات نجاح Mel-PLGA NPs المحضرة في تقليل كمية Mel المُدارة. تم تصميم مجموعات فرعية للتحكم الصحي كمجموعات فرعية مصابة بإصابة الكبد الناجمة عن CCL4 لتحقيق مقارنة نقدية وتحليل إحصائي. لذلك، تم تقسيم الحيوانات إلى مجموعتين، صحية (H) وCCL4 مصابة بالكبد (I)؛ تم تقسيم كل مجموعة إلى خمس مجموعات فرعية (خمسة فئران / مجموعة فرعية):
-
المجموعة الصحية (ح):
ح التحكم في الجهاز الهضمي: الفئران السيطرة الصحية السلبية.
H ميل (5 ملغم/كغم) GII: فئران المراقبة الصحية التي تلقت 5 ملغم/كغم من الميل.
H ميل (10 ملغم/كغم) GIII: فئران المراقبة الصحية التي تلقت 10 ملغم/كغم من الميل.
H Mel-PLGA NPs (5 مجم / كجم) GIV: فئران المراقبة الصحية التي تلقت 5 ملغم / كغم من Mel-PLGA NPs.
H Mel-PLGA NPs (10 مجم / كجم) GV: فئران المراقبة الصحية التي تلقت 10 ملغم / كغم من Mel-PLGA NPs.
-
مجموعة CCL4- جرحى الكبد (I):
أنا أتحكم في الجهاز الهضمي غير المعالج: الفئران غير المعالجة مع إصابة الكبد الناجمة عن CCL4 (التحكم الإيجابي).
أنا ميل (5 ملغم / كغم) GII: الفئران المصابة بإصابة الكبد الناجمة عن CCL4 تم علاجها بـ 5 ملغم / كغم من الميل.
أنا ميل (10 ملغم/كغم) GIII: الفئران المصابة بإصابة الكبد الناجمة عن CCL4 تم علاجها بـ 10 ملغم / كغم من الميل.
I Mel-PLGA NPs (5 مجم/كجم) GIV: الفئران المصابة بإصابة الكبد الناجمة عن CCL4 تم علاجها بـ 5 ملغم / كغم من Mel-PLGA NPs.
I Mel-PLGA NPs (10 مجم / كجم) GV: الفئران المصابة بإصابة الكبد الناجمة عن CCL4 تم علاجها بـ 10 ملغم / كغم من Mel-PLGA NPs.
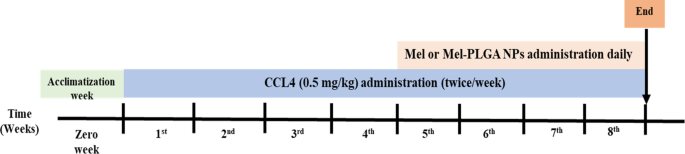
بالإضافة إلى مجموعة المركبات (VG) المكونة من فئران سليمة تلقت 0.1 مل من زيت الزيتون عن طريق الحقن داخل الصفاق مرتين / أسبوع طوال فترة التجربة. تم إذابة CCL4 في زيت الزيتون وتم إعطاؤه بجرعة 0.5 ملغم / كغم عن طريق الحقن الوريدي مرتين / أسبوع لمدة أربعة أسابيع متتالية. بعد تحريض إصابة الكبد، تمت إدارة Mel أو Mel-PLGA NPs عن طريق IP يوميًا لمدة أربعة أسابيع أخرى (ملاحظة: استمرت الفئران في تلقي جرعات CCL4 أثناء العلاج) (الشكل XNUMX أ). 1).
في نهاية التجربة، تم تخدير الفئران بشكل نهائي باستخدام 50 ملغم/كغم من بنتوباربيتال الصوديوم.31. تم جمع عينات الدم عن طريق ثقب القلب. بعد السماح للدم بالتجلط في درجة حرارة الغرفة، تم جمع المصل بعد الطرد المركزي عند 1500 دورة في الدقيقة لمدة 15 دقيقة وتقسيمه إلى قسامات ليتم حفظها عند -20 درجة مئوية. تم تشريح الفئران، من جميع المجموعات التجريبية، لجمع الأعضاء (الكبد). لفترة وجيزة، تم وضع الفئران على ظهرها على صينية التشريح وتم تثبيت أطرافها بمساعدة الشريط. تم قطع جلد الجرذ لكشف العضلات الأساسية. تم تقشير جدار البطن للخلف وإزالة الكبد بعناية. تم تجانس عينات الكبد (جرام واحد) من جميع المجموعات التجريبية باستخدام محلول Tris-HCl البارد لتحضير تجانس الكبد (10٪).
التحليل البيوكيميائي في عينات المصل
تم قياس معلمات وظائف الكبد من أجل تقييم التأثير الوقائي للكبد لـ Mel-PLGA NPs. تم قياس مستويات ناقلة أمين الأسبارتات (AST)، ألانين ترانس أميناز (ALT)، الألبومين (ab234579، ab263883، ab108789، abcam، الولايات المتحدة الأمريكية) وإجمالي البيليروبين (MBS9389057، MyBiosource، USA) بواسطة مجموعات ELISA الفئران وفقًا لفريد وآخرون.27.
علامات الإجهاد التأكسدي في تجانس أنسجة الكبد:
تم تحديد تأثير مضادات الأكسدة للـ NPs المحضرة، في الجسم الحي، عن طريق قياس علامة بيروكسيد الدهون المالونديالدهيد (MDA) والإنزيمات المضادة للأكسدة. تم قياس مستويات MDA (MBS268427، MyBioSource، USA)، GPx (MBS744364، MyBioSource، USA)، SOD (ab285310، USA) وCAT (P04762، CUSABIO، USA) بواسطة مجموعات ELISA الخاصة بالفئران وفقًا لفريد وآخرون.32 وعمرو وآخرون.33.
مستويات السيتوكينات في متجانسات أنسجة الكبد
تم تحديد التأثير المضاد للالتهابات لـ Mel-PLGA NPs عن طريق قياس مستوى السيتوكينات المؤيدة للالتهابات (TNF-α وIL-1β وIL-6) والسيتوكينات المضادة للالتهابات (IL-10). تم قياس مستويات السيتوكين في كبد الفئران بواسطة IL-1β (MBS825017، MyBioSource، الولايات المتحدة الأمريكية)، TNF-α (ab100785، abcam، UK)، IL-6 (P20607، CUSABIO، الولايات المتحدة الأمريكية) و IL-10 (P29456، CUSABIO، الولايات المتحدة الأمريكية) مجموعات ELISA الفئران وفقا لفريد وآخرون.34.
مستويات البروتينات المعدنية المصفوفة في تجانس أنسجة الكبد:
تم تقييم تأثير Mel-PLGA NPs على إعادة تشكيل أنسجة الكبد عن طريق قياس MMP9 وTIMP1 بواسطة مجموعات ELISA الخاصة بالفئران (MBS722532 وMBS2502910، على التوالي؛ MyBioSource، الولايات المتحدة الأمريكية).
تقنية قياس التدفق الخلوي
تم استخدام تقنية التدفق الخلوي للعثور على تأثير NPs المحضرة على مستويات موت الخلايا المبرمج والبروتينات داخل الخلايا. تم إنتاج مزارع خلايا خلايا الكبد في ظل ظروف معقمة. تم ترطيب الوريد البابي للفئران تحت التخدير باستخدام عازلة كولاجيناز. تم تشريح الكبد بعد التروية، وتم فصل الخلايا، وتعليقها في وسط ويليام الكامل، وتصفيتها من خلال مرشح نايلون (100 ميكرومتر)، ثم زراعتها. تم فحص مستوى موت الخلايا المبرمج في خلايا الكبد باستخدام مجموعة الكشف عن موت الخلايا المبرمج Annexin-V-FITC / PI (ab14085، abcam، الولايات المتحدة الأمريكية). تم نفاذية خلايا الكبد بواسطة السابونين (الرقم الهيدروجيني 7.4) ؛ وتم قياس البروتين المضاد لموت الخلايا المبرمج Bcl2 (11-6992-42) والبروتينات المؤيدة لموت الخلايا المبرمج [Bax (MA5-14,003)، p53 (ab90363)، كاسباس 3 (C92-605) و8 (ab32125)] عن طريق قياس التدفق الخلوي .
الفحص النسيجي والكيميائي المناعي:
تم فحص مقاطع الكبد بواسطة طريقة صبغ الهيماتوكسيلين والإيوسين العادي لتقييم التغيرات النسيجية المرضية المختلفة بين المجموعات التجريبية. تم استخدام تلطيخ مناعي كيميائي لتقييم التأثير المضاد للالتهابات لـ Mel-PLGA NPs. تم تجفيف عينات الكبد باستخدام مستويات متزايدة من الكحول: 70% كحول لمدة 1.5 ساعة، و90% كحول لمدة 1.5 ساعة، والكحول المطلق لمدة 3 ساعات. تمت بعد ذلك تصفية الكبد لمدة 4 ساعات في الزيلين. بعد التطهير، تخضع عينات الكبد لإجراء التسلل، حيث تم تشريبها بالبرافين الناعم النقي عبر ثلاث درجات متميزة (تدوم كل منها ساعة واحدة) عند درجة حرارة 56 درجة مئوية. تم بعد ذلك ترتيب العينات في كتل وغمرها في شمع البارافين عند درجة حرارة 58 مئوية. للتحليل النسيجي، تم قطع شرائح البارافين بسماكة 4 ميكرون، وصبغها بالهيماتوكسيلين والأيوسين، وتركيبها في زيلين بوليسترين ثنائي بوتيل فثاليت، ثم تغطيتها.33,35. للفحص المناعي28، ح2O2 (3٪) [متبوعًا بغسل PBS وحجب لمدة 60 دقيقة باستخدام ألبومين المصل البقري (BSA، 5٪))] تم استخدامه لمنع نشاط البيروكسيديز الداخلي. تم غسل أقسام الكبد في برنامج تلفزيوني، بعد حضانة لمدة 30 دقيقة مع الجسم المضاد الأولي [الجسم المضاد للعامل كابا بيتا (NF-кB) p65 (ab86299، abcam، الولايات المتحدة الأمريكية) أو الجسم المضاد للبروتين التفاعلي C (C1688) ، سيجما ألدريتش، الولايات المتحدة الأمريكية)]. تم تطبيق الجسم المضاد الثانوي IgG لبيروكسيديز الفجل (HRP) - الأرانب المضاد للفئران (ab6734، abcam، الولايات المتحدة الأمريكية) على أقسام الكبد واحتضانه لمدة 60 دقيقة. تم استخدام 3، 3-diaminobenzidine (DAB) لتطوير اللون، حيث يشير اللون البني إلى نتيجة إيجابية. تم غسل أقسام الكبد ثم صبغها بالهيماتوكسيلين (0.1٪).
تحليل احصائي
تم التعبير عن البيانات على أنها متوسط ± SD وتم فحصها من خلال تحليل التباين أحادي الاتجاه (ANOVA) باستخدام الإصدار 20.0 من SPSS (SPSS Inc.، Chicago، USA). تم فحص الاختلافات بين الوسائل بواسطة اختبار توكي اللاحق. متى P <0.05، اعتبرت القيم هامة.
موافقة الأخلاق
تمت الموافقة على جميع الإجراءات التجريبية وصيانة الحيوان من قبل لجنة رعاية واستخدام الحيوان المؤسسية.
- محتوى مدعوم من تحسين محركات البحث وتوزيع العلاقات العامة. تضخيم اليوم.
- PlatoData.Network Vertical Generative Ai. تمكين نفسك. الوصول هنا.
- أفلاطونايستريم. ذكاء Web3. تضخيم المعرفة. الوصول هنا.
- أفلاطون كربون، كلينتك ، الطاقة، بيئة، شمسي، إدارة المخلفات. الوصول هنا.
- أفلاطون هيلث. التكنولوجيا الحيوية وذكاء التجارب السريرية. الوصول هنا.
- المصدر https://www.nature.com/articles/s41598-023-43546-4