Chuẩn bị NP Mel-PLGA
Phương pháp bay hơi dung môi-kết tủa nano một bước được sử dụng để tổng hợp NP Mel-PLGA26. Hai mươi mg PLGA (P2191, lactide: glycolide (50:50), mol wt 30,000–60,000, Sigma Aldrich, Hoa Kỳ) đã được hòa tan trong axeton (một ml); và hai mg Mel (73-31-4, mol wt 232.28, Sigma Aldrich, Hoa Kỳ) được thêm vào sau đó nửa giờ ly tâm để tạo thành pha hữu cơ [2% (w/v)]. Pha hữu cơ hình thành được bơm vào H cất2O khuấy liên tục trong nửa giờ; tiếp theo là làm bay hơi axeton (ở 37°C trong chân không).
Đặc tính của NP Mel-PLGA
Các NP Mel-PLGA được sản xuất thu được bằng cách đông khô và bảo quản ở 4°C. Hình dạng của các hạt nano đã chuẩn bị được quan sát bằng kính hiển vi điện tử truyền qua (TEM). Malvern.
Thiết bị Zetasizer được sử dụng để xác định kích thước và thế zeta của hạt nano.
Hiệu suất đóng gói (EE%) và tải thuốc (DL%) của NP Mel-PLGA26
Lượng Mel trong NP Mel-PLGA được xác định bằng phương pháp sắc ký lỏng hiệu năng cao (HPLC). Trong đó, NP Mel-PLGA được hòa tan trong axeton sau đó được siêu âm để giải phóng Mel được bao bọc. Dung dịch được ly tâm ở tốc độ 3000 vòng/phút trong 7.4 phút để kết tủa PLGA. Mel hòa tan trong phần nổi phía trên đại diện cho khối lượng được bao bọc trong NP. Sự giải phóng Mel từ NP Mel-PLGA được xác định bằng cách pha loãng 37 ml NP với 0 ml nước muối đệm photphat (PBS, pH 20); tiếp theo là ủ ở 40°C trên máy lắc. Ở 60, 80, 100, 300, 3000 và 30 giờ, XNUMX µl dung dịch được loại bỏ (thay thế bằng cùng thể tích bằng PBS) và ly tâm ở tốc độ XNUMX vòng/phút trong XNUMX phút. EE% và DL% được tính theo các phương trình sau:
$${text{EE}}% = left( {{text{mass}};{text{of}};{text{Mel}};{text{in}};{text{Mel}} – {text {PLGA}};{text{NPs}}/{text{total}};{text{mass}};{text{of}};{text{Mel}}} đúng) lần {1}00.$$
$${text{DL}}% = left( {{text{mass}};{text{of}};{text{Mel}};{text{in}};{text{Mel}} – {text {PLGA }};{text{NPs}}/{text{total}};{text{mass}};{text{of}};{text{Mel}} – {text{PLGA}};{text{ NPs}}} phải) lần {1}00.$$
Tác dụng in vitro của NP Mel-PLGA
Tác dụng chống oxy hóa trong ống nghiệm của NP Mel-PLGA 27
Khả năng chống oxy hóa của NP Mel-PLGA đã điều chế đã được đánh giá từ tác dụng loại bỏ gốc tự do của chúng thông qua 1, 1-diphenyl-2-picryl hydrazyl [DPPH (281,689, Sigma Aldrich, Hoa Kỳ)]. Đơn giản, các nồng độ NP khác nhau (từ 3.9 đến 1000 μg/ml) được trộn với một ml dung dịch DPPH/etanol (0.1 mM), lắc và để yên trong 30 phút ở 25°C. Độ hấp thụ được đo ở bước sóng 517 nm sử dụng axit ascorbic làm chất đối chiếu. Hoạt động thu hồi DPPH% = [(A0CẩuA1)/MỘT0]× 100. Độ hấp thụ của mẫu là A1, trong khi độ hấp thụ của phản ứng đối chứng là A0.
Tác dụng gây độc tế bào trong ống nghiệm của NP Mel-PLGA
Sự an toàn của việc sử dụng NP Mel-PLGA đã được kiểm tra in vitro trước khi sử dụng in vivo. Tế bào Caco2 (Sigma Aldrich, Hoa Kỳ) được nuôi cấy ở nhiệt độ 37°C trong 5% CO2 và độ ẩm tương đối 95%, trong môi trường Eagle sửa đổi (DMEM) của Dulbecco có bổ sung NaHCO3 (2.2 g/l), d-glucose (4.5 g/l), 1% axit amin không thiết yếu, 10% huyết thanh bào thai bò, penicillin 100 IU/ml và streptomycin 0.1 mg/ml (tất cả các nguyên liệu được sử dụng trong quá trình nuôi cấy được mua từ Sigma Aldrich, Mỹ). Xét nghiệm độc tế bào in vitro được thực hiện theo Alaa et al.28. 100 µl/giếng 105 Tế bào Caco2 trong đĩa nuôi cấy mô được ủ ở 37°C trong 24 giờ để cho phép phát triển các đơn lớp tế bào. Sau khi gạn vừa, phương tiện rửa được sử dụng để rửa các lớp đơn. Nồng độ phân loại của NP Mel-PLGA được tạo ra bằng cách kết hợp NP với môi trường RPMI. Độ pha loãng NP được tạo ra được pha loãng thành 0.1 ml, thêm vào giếng và sau đó để yên trong 24 giờ nữa. Các giếng nhận được 20 µl MTT (3-(4,5-dimethylthiazol-2-yl)-2-5-diphenyltetrazolium bromide) ở nồng độ 5 mg/ml. Các đĩa được lắc trong 37 phút để đảm bảo trộn MTT, sau đó ủ trong 5 giờ ở XNUMX°C với XNUMX% CO2. Để hòa tan formazan đã tạo thành, 200 µl dimethyl sulfoxide (DMSO) được bôi lên các đĩa. Ở bước sóng 560 nm, người ta đo độ hấp thụ (được liên kết trực tiếp với formazan).
Tác dụng đông máu trong ống nghiệm của NP Mel-PLGA29
Hoạt động đông máu của các NP Mel-PLGA đã chuẩn bị đã được thử nghiệm để dự đoán tác dụng của chúng khi sử dụng in vivo. Hoạt tính chống đông máu của NP Mel-PLGA được đánh giá bằng cách đo thời gian đông máu tính bằng giây ở 37°C, với heparin đóng vai trò đối chứng. Theo khuyến nghị của nhà sản xuất, thuốc thử thời gian protrombin (PT) và thời gian tromplastin một phần (PTT) (ủ trước ở 37°C trong 5 phút) đã được sử dụng. Tóm lại, huyết tương chuột (900 μl) và nồng độ NP Mel-PLGA khác nhau (100 μl) hoặc heparin hòa tan trong nước muối đã được kết hợp. Thử nghiệm được hoàn thành ba lần và thời gian đông máu được ghi lại.
Tác dụng chống viêm (ức chế tan máu) trong ống nghiệm của NP Mel-PLGA
Tác dụng chống viêm của NP Mel-PLGA được xác định bằng xét nghiệm ức chế tan máu theo Anosike et al.30. Máu chuột tươi có heparin (5 ml) được ly tâm ở tốc độ 2500 vòng / phút trong 15 phút; sau đó, viên thu được được hòa tan bằng dung dịch đệm đẳng trương (tương đương với thể tích phần nổi phía trên). Các liều NP Mel-PLGA khác nhau (từ 100 đến 1000 μg/ml) được kết hợp với 5 ml nước cất để tạo ra dung dịch nhược trương. Liều lượng NP tương tự được kết hợp với dung dịch đẳng trương (5 ml); và indomethacin được sử dụng làm đối chứng. Dung dịch NP và đối chứng nhận được 0.1 ml huyền phù hồng cầu được tạo ra, sau đó được ủ trong một giờ ở 37 ° C trước khi ly tâm trong ba phút ở tốc độ 1500 vòng / phút. Máy đo quang phổ được sử dụng để định lượng lượng hemoglobin được giải phóng ở phần nổi phía trên ở bước sóng 540 nm, và tỷ lệ ức chế tan máu được ước tính bằng công thức: ức chế tan máu (%) = 1−[(ODb−ODa)/(ODc−ODa)]× 100. ODa là viết tắt của độ hấp thụ của mẫu trong dung dịch đẳng trương, ODb cho độ hấp thụ của mẫu trong dung dịch nhược trương và ODc để kiểm soát độ hấp thụ trong dung dịch nhược trương.
Động vật và thiết kế thí nghiệm
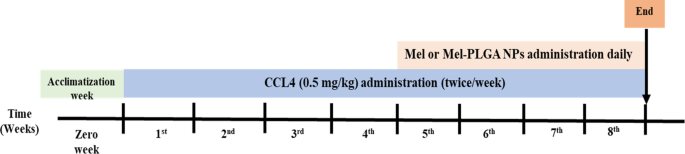
Chuột đực Sprague Dawley, nặng 200 g và 5 tuần tuổi, được mua từ nhà động vật của Tổ chức Nghiên cứu và Kiểm soát Ma túy Quốc gia (Cairo, Ai Cập). Tất cả các quy trình thí nghiệm được thực hiện theo các hướng dẫn quốc tế về chăm sóc và sử dụng động vật trong phòng thí nghiệm và tuân thủ các hướng dẫn ARRIVE. Hai liều NP Mel-PLGA (10 và 4 mg/kg) đã được thử nghiệm in vivo để kiểm tra hiệu quả của NP trong điều trị tổn thương gan do CCL5; và ngoài ra, để tìm ra liều điều trị cần thiết. Hơn nữa, hai liều Mel tự do (10 và 4 mg/kg) đã được sử dụng trong các phân nhóm thử nghiệm và được so sánh với các phân nhóm do NP Mel-PLGA quản lý để chứng minh sự thành công của các NP Mel-PLGA đã chuẩn bị trong việc giảm lượng Mel được quản lý. Các phân nhóm đối chứng khỏe mạnh được thiết kế thành các phân nhóm bị tổn thương gan do CCL4 để đạt được sự so sánh và phân tích thống kê quan trọng. Do đó, động vật được chia thành hai nhóm, khỏe mạnh (H) và CCLXNUMX-bị tổn thương gan (I); mỗi nhóm được chia thành năm nhóm nhỏ (năm con chuột/nhóm nhỏ):
-
Nhóm khỏe mạnh (H):
GI điều khiển H: chuột đối chứng khỏe mạnh âm tính.
H Mel (5 mg/kg) GII: chuột đối chứng khỏe mạnh nhận được 5 mg/kg Mel.
H Mel (10 mg/kg) GIII: chuột đối chứng khỏe mạnh nhận được 10 mg/kg Mel.
H NP Mel-PLGA (5 mg/kg) GIV: những con chuột đối chứng khỏe mạnh đã nhận được 5 mg/kg NP Mel-PLGA.
H NP Mel-PLGA (10 mg/kg) GV: những con chuột đối chứng khỏe mạnh đã nhận được 10 mg/kg NP Mel-PLGA.
-
Nhóm tổn thương gan CCL4 (I):
Tôi kiểm soát GI chưa được điều trị: chuột bị tổn thương gan do CCL4 không được điều trị (kiểm soát dương tính).
I Mel (5 mg/kg) GII: chuột bị tổn thương gan do CCL4 được điều trị bằng 5 mg/kg Mel.
I Mel (10 mg/kg) GIII: chuột bị tổn thương gan do CCL4 được điều trị bằng 10 mg/kg Mel.
I NP Mel-PLGA (5 mg/kg) GIV: chuột bị tổn thương gan do CCL4 được điều trị bằng 5 mg/kg NP Mel-PLGA.
I NP Mel-PLGA (10 mg/kg) GV: chuột bị tổn thương gan do CCL4 được điều trị bằng 10 mg/kg NP Mel-PLGA.
Ngoài nhóm phương tiện (VG) bao gồm những con chuột khỏe mạnh được tiêm 0.1 ml dầu ô liu bằng cách tiêm trong màng bụng (ip) hai lần/tuần trong suốt thời gian thử nghiệm. CCL4 được hòa tan trong dầu ô liu và dùng với liều 0.5 mg/kg bằng đường truyền ip hai lần/tuần trong bốn tuần liên tiếp. Sau khi gây ra tổn thương gan, NP Mel hoặc Mel-PLGA được quản lý bằng đường ip hàng ngày trong bốn tuần nữa (lưu ý: chuột tiếp tục nhận liều CCL4 trong quá trình điều trị) (Hình XNUMX). 1).
Vào cuối thí nghiệm, chuột được gây mê giai đoạn cuối bằng natri pentobarbital 50 mg/kg.31. Các mẫu máu được thu thập thông qua chọc tim. Sau khi để máu đông ở nhiệt độ phòng, huyết thanh được thu thập sau khi ly tâm ở tốc độ 1500 vòng/phút trong 15 phút và chia thành nhiều phần để giữ ở −20°C. Chuột, từ tất cả các nhóm thí nghiệm, được mổ xẻ để thu thập nội tạng (gan). Tóm lại, chuột được đặt nằm ngửa trên khay mổ và các chi của nó được cố định bằng băng dính. Da chuột bị cắt để lộ các cơ bên dưới. Thành bụng được bóc ra sau và gan được cắt bỏ cẩn thận. Các mẫu gan (một g), từ tất cả các nhóm thử nghiệm, được đồng nhất hóa bằng cách sử dụng dung dịch đệm Tris–HCl lạnh để chuẩn bị chất đồng nhất gan (10%).
Phân tích sinh hóa trong mẫu huyết thanh
Các thông số chức năng gan được đo để đánh giá tác dụng bảo vệ gan của NP Mel-PLGA. Nồng độ aspartate aminotransferase (AST), alanine transaminase (ALT), albumin (ab234579, ab263883, ab108789, abcam, USA) và tổng bilirubin (MBS9389057, MyBiosource, USA) được đo bằng bộ dụng cụ ELISA của chuột theo Farid et al..27.
Các dấu hiệu stress oxy hóa trong các chất đồng nhất của mô gan:
Tác dụng chống oxy hóa của các NP đã chuẩn bị đã được xác định in vivo bằng cách đo chất đánh dấu peroxid hóa lipid malondialdehyd (MDA) và các enzyme chống oxy hóa. Mức MDA (MBS268427, MyBioSource, USA), GPx (MBS744364, MyBioSource, USA), SOD (ab285310, USA) và CAT (P04762, CUSABIO, USA) được đo bằng bộ dụng cụ ELISA của chuột theo Farid et al.32 và Amr và cộng sự.33.
Nồng độ Cytokine trong chất đồng nhất của mô gan
Tác dụng chống viêm của NP Mel-PLGA được xác định bằng cách đo mức độ của các cytokine gây viêm (TNF-α, IL-1β và IL-6) và cytokine chống viêm (IL-10). Nồng độ Cytokine được đo trong gan chuột bằng IL-1β (MBS825017, MyBioSource, USA), TNF-α (ab100785, abcam, UK), IL-6 (P20607, CUSABIO, USA) và IL-10 (P29456, CUSABIO, USA) bộ dụng cụ ELISA của chuột theo Farid et al.34.
Nồng độ metallicoproteinase ma trận trong các chất đồng nhất của mô gan:
Tác dụng của NP Mel-PLGA đối với việc tái tạo mô gan được đánh giá bằng cách đo MMP9 và TIMP1 bằng bộ dụng cụ ELISA của chuột (MBS722532 và MBS2502910, tương ứng; MyBioSource, Hoa Kỳ).
Kỹ thuật tế bào học dòng chảy
Kỹ thuật tế bào học dòng chảy đã được sử dụng để tìm ra ảnh hưởng của các NP đã chuẩn bị đến mức độ apoptosis và protein apoptotic nội bào. Nuôi cấy tế bào gan được sản xuất trong điều kiện vô trùng. Tĩnh mạch cửa của chuột được gây mê được tưới máu bằng đệm collagenase. Gan được mổ xẻ sau khi tưới máu, các tế bào được tách ra, lơ lửng trong môi trường hoàn chỉnh của William, được lọc qua bộ lọc nylon (100 μm), sau đó được nuôi cấy. Mức độ apoptosis trong tế bào gan được kiểm tra bằng bộ phát hiện apoptosis Phụ lục-V-FITC/PI (ab14085, abcam, Hoa Kỳ). Tế bào gan được thẩm thấu bởi saponin (pH 7.4); và protein chống apoptotic Bcl2 (11-6992-42) và protein prooptotic [Bax (MA5-14,003), p53 (ab90363), caspase 3 (C92-605) và 8 (ab32125)] được đo bằng phương pháp tế bào học dòng chảy .
Xét nghiệm mô bệnh học và hóa mô miễn dịch:
Các phần gan được kiểm tra bằng phương pháp nhuộm hematoxylin và eosin thông thường để đánh giá những thay đổi mô bệnh học khác nhau giữa các nhóm thử nghiệm. Nhuộm hóa mô miễn dịch được sử dụng để đánh giá tác dụng chống viêm của NP Mel-PLGA. Các mẫu gan được khử nước bằng cách tăng nồng độ cồn: cồn 70% trong 1.5 giờ, cồn 90% trong 1.5 giờ và cồn tuyệt đối trong 3 giờ. Gan sau đó được làm sạch trong 4 giờ trong xylene. Sau khi làm sạch, các mẫu gan trải qua quy trình thẩm thấu, trong đó chúng được ngâm tẩm parafin mềm, tinh khiết qua ba cấp độ riêng biệt (mỗi cấp độ kéo dài một giờ) ở 56°C. Sau đó, các mẫu thử được sắp xếp thành khối và ngâm trong sáp parafin ở nhiệt độ 58°C. Để phân tích mô học, các lát parafin có độ dày 4 micron được cắt, nhuộm bằng hematoxylin và eosin, gắn vào dibutylphthalate polystyrene xylene, sau đó phủ lên.33,35. Để kiểm tra hóa mô miễn dịch28, H2O2 (3%) [tiếp theo là rửa PBS và chặn 60 phút bằng albumin huyết thanh bò (BSA, 5%)] được sử dụng để ức chế hoạt động peroxidase nội sinh. Các phần gan được rửa trong PBS, sau đó ủ 30 phút với kháng thể chính [kháng thể kháng nhân-kappa beta (NF-кB) p65 (ab86299, abcam, USA) hoặc kháng thể Anti-C-Reactive Protein (C1688) , Sigma Aldrich, Hoa Kỳ)]. Kháng thể thứ cấp IgG chống chuột peroxidase peroxidase (HRP) (ab6734, abcam, Hoa Kỳ) đã được áp dụng cho các phần gan và ủ trong 60 phút. 3, 3-diaminobenzidine (DAB) được sử dụng để phát triển màu sắc, với màu nâu biểu thị kết quả dương tính. Các phần gan được rửa sạch và sau đó nhuộm tương phản với hematoxylin (0.1%).
Phân tích thống kê
Dữ liệu được biểu thị dưới dạng trung bình ± SD và được điều tra bằng phân tích phương sai một chiều (ANOVA) bằng SPSS phiên bản 20.0 (SPSS Inc., Chicago, USA). Sự khác biệt giữa các phương tiện được kiểm tra bằng bài kiểm tra bài Tukey. Khi P < 0.05, các giá trị được coi là đáng kể.
Phê duyệt đạo đức
Tất cả các quy trình thí nghiệm và bảo dưỡng động vật đã được phê duyệt bởi Ủy ban Chăm sóc và Sử dụng Động vật Thể chế.
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- PlatoSức khỏe. Tình báo thử nghiệm lâm sàng và công nghệ sinh học. Truy cập Tại đây.
- nguồn: https://www.nature.com/articles/s41598-023-43546-4