Bu blog, 5.0 Aralık 6'te yayınlanan FDA eSTAR'ın en yeni sürümü olan sürüm 2023'a derinlemesine bir bakış sunuyor.
FDA neden yeni eSTAR sürümünü v5.0 yerine v4.4 olarak yayınladı?
Ana sürüm güncellemesi, politika değişikliklerinden, mevzuat değişikliklerinden veya şablondaki büyük değişikliklerden oluşur ve büyük sürüm numarası artışıyla gösterilir (örn. 4.3'ten 5.0'a). Küçük sürüm güncellemesi diğer değişiklikleri içerecek ve küçük sürüm numarası artışıyla gösterilecektir (örn. 4.3'ten 4.4'e). Politika veya mevzuat değişiklikleri varsa, uygulama tarihinden önce eSTAR'ın yeni bir ana sürümü yapılır ve eSTAR'ın önceki sürümü kaldırılır. Bu durumda, PMA içeriğinin etkinleştirilmesi, uygulamanın uluslararası pilotunun güncellenmesi Health Canada ile eSTARve siber güvenlik dokümantasyon gerekliliklerinin uygulanması, küçük sürüm güncellemesi (ör. 5.0) yerine büyük sürüm güncellemesi (ör. 4.4) ihtiyacını tetikleyen büyük değişiklikler olarak kabul edilir. Bu değişiklikler aşağıdakiler için geçerlidir: IVD eSTAR ve IVD olmayan eSTAR. Genel olarak FDA eSTAR'a aşina değilseniz lütfen sayfamızı ziyaret edin. 510k kurs sayfası.
V5.0'ı kullanmak için son tarih nedir?
FDA eSTAR'ın hem nIVD hem de IVD versiyonları olan 4.3 versiyonu, tarihinde FDA web sitesinden kaldırılacaktır. Şubat 4, 2024. eSTAR'ın süresi dolmuş bir sürümüyle gönderilen tüm başvurular reddedilecektir. Bilgileri şablonun daha eski bir sürümüne zaten yüklediyseniz, eSTAR'ın alt kısmına kaydırmanız ve verileri bir HTML dosyasına aktarmanız gerekecektir. Daha sonra HTML dosyasını eSTAR'ın daha yeni sürümüne aktarırsınız. Şablonun eski sürümüne yaptığınız ekler dışa aktarılmayacaktır ve tüm ekleri yeni şablona eklemeniz gerekecektir.
PMA içeriği yeni FDA eSTAR'da etkindir
FDA eSTAR'ın önceki sürümleri aşağıdaki işlevleri içeriyordu: pazarlama öncesi onay (PMA) gönderimleriancak sürüm 5.0'da FDA nihayet bu işlevselliği etkinleştirdi. 510k gönderimlerin üç türü vardır: 1) Geleneksel, 2) Kısaltılmış ve 3) Özel. PMA gönderimlerinin de farklı türleri vardır. Yeni bir cihaz için iki tür PMA gönderimi vardır: geleneksel ve modüler. Ne yazık ki FDA eSTAR, modüler yaklaşımı kullanan PMA'lara yönelik değildir. Sınıf 3 cihazlar için FDA, değişiklikler konusunda Sınıf 1 ve 2 cihazlara göre daha sıkı kontrollere sahiptir. Bu nedenle, bir PMA takviyesi PMA onaylı cihazlarda aşağıdaki değişiklik türleri için gereklidir:
- kullanım için yeni endikasyonlar;
- değişiklikleri etiketleme;
- imalat veya paketleme için tesis değişiklikleri;
- üretim yöntemlerindeki değişiklikler;
- kalite kontrol prosedürlerindeki değişiklikler;
- sterilizasyon prosedürlerinde değişiklikler;
- ambalajdaki değişiklikler;
- performans veya tasarım özelliklerindeki değişiklikler ve
- son kullanma tarihinin uzatılması.
PMA takviyelerinin çeşitli türleri vardır ancak yalnızca üç tür takviye FDA eSTAR'ı kullanabilir: 1) Panel-Track, 2) 180-Gün ve 3) Gerçek Zamanlı. Hangi tür PMA takviyesi kullanmanız gerektiğini belirlemek için FDA, aşağıdakiler için kılavuz yayınladı: pazarlama öncesi onay sürecine tabi olan cihazlarda yapılan değişiklikler.
PMA İçeriği
FDA eSTAR'daki aşağıdaki bölümler PMA gönderim içeriği gerekliliklerine özeldir:
- Kalite Yönetim Sistemi Bilgileri
- Tesis Bilgileri
- Piyasa Sonrası Araştırma (PMS) Planları
- uyarınca bir hariç tutma bildirimi veya bir Çevresel Değerlendirme Raporu ekleyin. 21 CFR 814.20(b)(11)
Health Canada, FDA eSTAR ile bir pilot uygulama yürütüyor
Health Canada'nın FDA eSTAR pilot programı şu anda toplam 10 katılımcıyla dolu (başlangıçta yalnızca 9 kişi planlanmıştı). Pilot uygulama, Health Canada'ya gönderilen başvurular için eSTAR kullanımını test edecek. Pilot uygulamanın sonuçlarının yakın zamanda tamamlanması bekleniyor ve sonrasında pilot uygulamanın daha fazla sayıda başvuru sahibini kapsayacak şekilde genişletilmesini bekliyoruz. HC eSTAR'ın aşırı karmaşık olduğuna dair söylentiler duyduk. Umarım v5.0 basitleştirilmiştir.
EMC testi bölümünde herhangi bir değişiklik oldu mu?
EMC Etiketleme soruları, bu bölümde genellikle yalnızca bir alıntı verildiğinden dört yerine tek bir soruda birleştirildi. Eski versiyonun bir kopyası aşağıda verilmiştir.
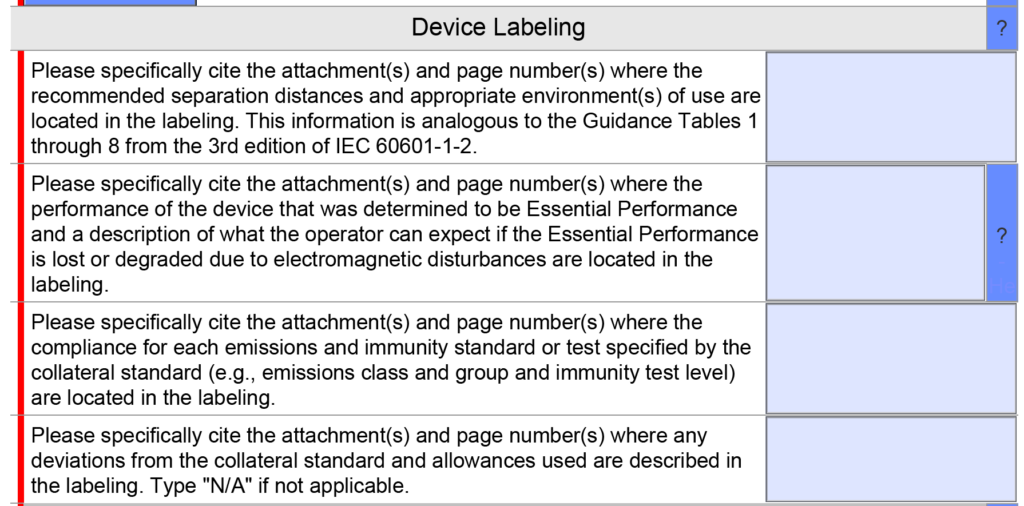
Güncellenmiş sürüm 5.0 aşağıda gösterilmektedir ve yalnızca bir soru içermektedir ancak yardım metni değiştirilmiştir.

FDA eSTAR artık daha fazla siber güvenlik belgesi gerektiriyor mu?
Bhoomika Joyappa güncellememizi güncelledi siber güvenlik çalışma talimatı (WI-007) Siber güvenlik belgelerine yönelik güncellenmiş FDA kılavuzunu ele almak için. Revizyonlar bu ayın başlarında tamamlandı ve güncellenen şablonları web sitemizden satın alabilirsiniz. Ayrıca abonelerimize FDA eSTAR'da önemli bir revizyon beklemelerini söylüyoruz.  bu olduğunda şablon. Güncellenmiş eSTAR sürümünün yayımlanması iki aydan biraz fazla sürdü ve değişiklik, siber güvenlik belgelerine ayrılmış üç sayfalık bir bölümle sonuçlandı. Şablonun önceki sürümleri, siber güvenlik risk yönetiminin belgelenmesine yönelik bir gereklilik ve sürekli destek için bir siber güvenlik yönetim planı/planı içeriyordu. Siber güvenlik cihazınız için geçerliyse bu bölüme aşağıdaki belgelerin eklenmesi gerekir:
bu olduğunda şablon. Güncellenmiş eSTAR sürümünün yayımlanması iki aydan biraz fazla sürdü ve değişiklik, siber güvenlik belgelerine ayrılmış üç sayfalık bir bölümle sonuçlandı. Şablonun önceki sürümleri, siber güvenlik risk yönetiminin belgelenmesine yönelik bir gereklilik ve sürekli destek için bir siber güvenlik yönetim planı/planı içeriyordu. Siber güvenlik cihazınız için geçerliyse bu bölüme aşağıdaki belgelerin eklenmesi gerekir:
- risk yönetimi – rapor (ekleyin)
- risk yönetimi – tehdit modeli (ekleyin)
- tehdit metodolojisi listesi (metin kutusu)
- Tehdit modeli belgelerinin içerdiği doğrulama (evet/hayır açılır listesi):
- küresel sistem görünümü
- Çoklu hasta hasarı görünümü
- Güncellenebilirlik/yama yapılabilirlik görünümü
- Güvenlik kullanım senaryosu görünümleri
- siber güvenlik risk değerlendirmesi (ek)
- Metodoloji ve kabul kriterlerinin belgelendiği sayfa numaraları (metin kutusu)
- Risk değerlendirmesinin, olasılık değerlendirmesi için olasılık kullanmaktan kaçındığının ve bunun yerine yararlanılabilirliğin kullanıldığının doğrulanması (evet/hayır açılır listesi)
- yazılım malzeme listesi veya SBOM (ekleyin)
- Her bir yazılım bileşeni için yazılım desteği düzeyi ve destek sonu tarihi (ekleyin)
- Kullanılan işletim sistemi ve sürümü (metin kutusu)
- güvenlik açıklarının emniyet ve güvenlik değerlendirmesi (ek)
- çözülmemiş anormalliklerin değerlendirilmesi (ekleyin)
- Siber güvenlik ölçümlerinin izlenmesinden elde edilen veriler (ekleyin)
- güvenlik kontrolleri hakkında bilgi (ek)
- her güvenlik kontrolünün adreslendiği sayfa numaraları (metin kutusu):
- Kimlik doğrulama kontrolleri
- Yetkilendirme kontrolleri
- Şifreleme kontrolleri
- Kod, veri ve yürütme bütünlüğü kontrolleri
- Gizlilik kontrolleri
- Olay algılama ve günlüğe kaydetme kontrolleri
- Dayanıklılık ve kurtarma kontrolleri
- Firmware ve yazılım güncelleme kontrolleri
- mimari görünümler (ekleyin)
- siber güvenlik testi (ekleyin)
- Siber güvenlik etiketlemesinin sağlandığı sayfa numaraları (metin kutusu)
Sterilite bölümü değişiklikleri, EO kalıntılarına ilişkin güncellenmiş bir soruyu içermektedir
FDA eSTAR'ın sterilite bölümünde sterilant kalıntılarıyla ilgili bir soru vardı. Spesifik olarak soru şuydu: "Cihazda kalan maksimum sterilan kalıntı seviyeleri nedir?" Bilgilerin girilmesi için ayrılan alan da küçüktü.
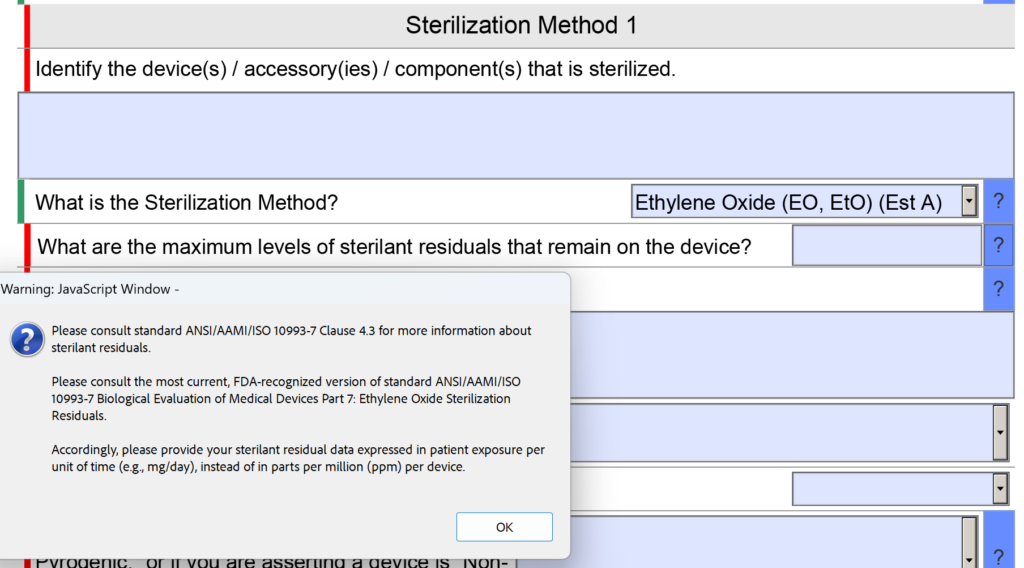
Şimdi soru şu şekilde yeniden ifade ediliyor: "Cihazda kalan maksimum sterilan kalıntı seviyeleri nelerdir ve bu seviyelerin cihaz türü ve beklenen hasta temas süresi için neden kabul edilebilir olduğuna dair açıklamanız nedir?" Bu soruya ilişkin yardım metninde herhangi bir değişiklik yapılmadı.
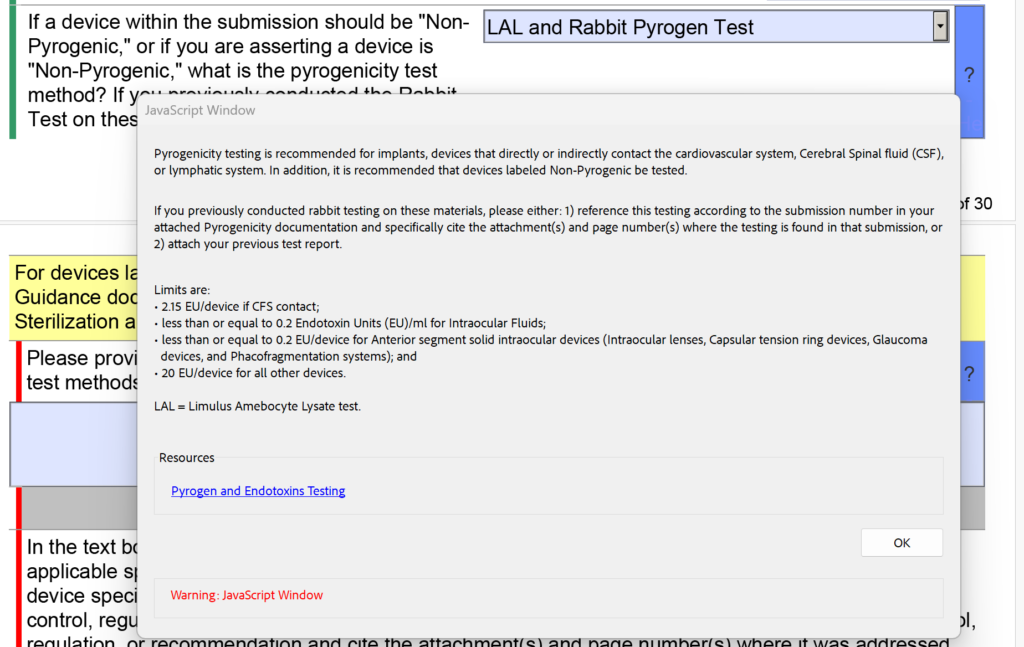
EO kalıntılarına ilişkin sterilite bölümündeki değişikliklere ek olarak FDA, pirojenite testi için açılır menüyü ve yardım metnini de değiştirdi. Ayrı ayrı “LAL” ve “Tavşan Testi” seçenekleri mevcuttu ancak artık bunlar “LAL ve Tavşan Pirojen Testi” olarak birleştirildi. Ek olarak, aşağıdaki yardım metni eklenmiştir: "Daha önce bu materyaller üzerinde tavşan testi yaptıysanız, lütfen aşağıdakilerden birini yapın: 1) bu teste ekteki Pirojenlik belgelerinizdeki gönderim numarasına göre referans verin ve özellikle ekleri ve sayfa numaralarını belirtin (s) testin söz konusu başvuruda bulunduğu yer veya 2) önceki test raporunuzu ekleyin."
V5.0'ı kullanmak için son tarih nedir?
Birçok müşteri, FDA eSTAR şablonunu açmaya çalıştıklarında bir hata mesajı aldıklarını söylüyor. Bunun nedeni, eSTAR'ı Adobe Acrobat Pro yerine bir PDF görüntüleyiciden açmalarıdır.

Bazı kişiler bunun yerine ücretsiz Adobe Acrobat Reader yazılımını kullanarak paradan tasarruf etmek ister ancak bu, eSTAR'ı düzgün bir şekilde tamamlamanıza izin vermez. Bu nedenle FDA, Adobe Acrobat Reader'ın kullanılması durumunda bir Açılır mesaj ekledi.
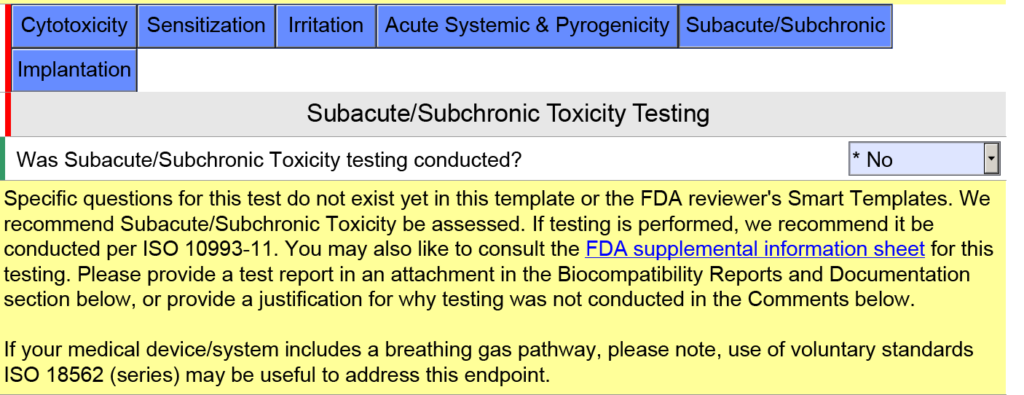
Solunum gazı yoluna sahip cihazlar biyouyumluluk açısından nasıl değerlendirilir?
Aşağıdaki ekran görüntüsünde, solunum gazı yolu cihazı için doku teması türü olarak kasıtlı olarak "Yüzey Cihazı: Mukozal Membran"ı seçtim çünkü cihaz ağzınıza yerleştirilmiş bir ağızlığa (yani mukozal membran) sahip olacaktır. Bu yaygın bir hatadır. FDA eSTAR'ın 5.0 versiyonunda FDA, bu cihazların "dışarıdan iletişim kuran" olarak değerlendirilmesi gerektiğini ve doku temasının "doku/kemik/dentin" olduğunu açıklıyor. Özellikle doku teması akciğerlerdir. Bu nedenle FDA, ISO 18562-1, -2, -3 ve -4'ün uygulanabilirliğine ilişkin aşağıda gösterilen yardım metnini JavaScript Penceresine ekledi.
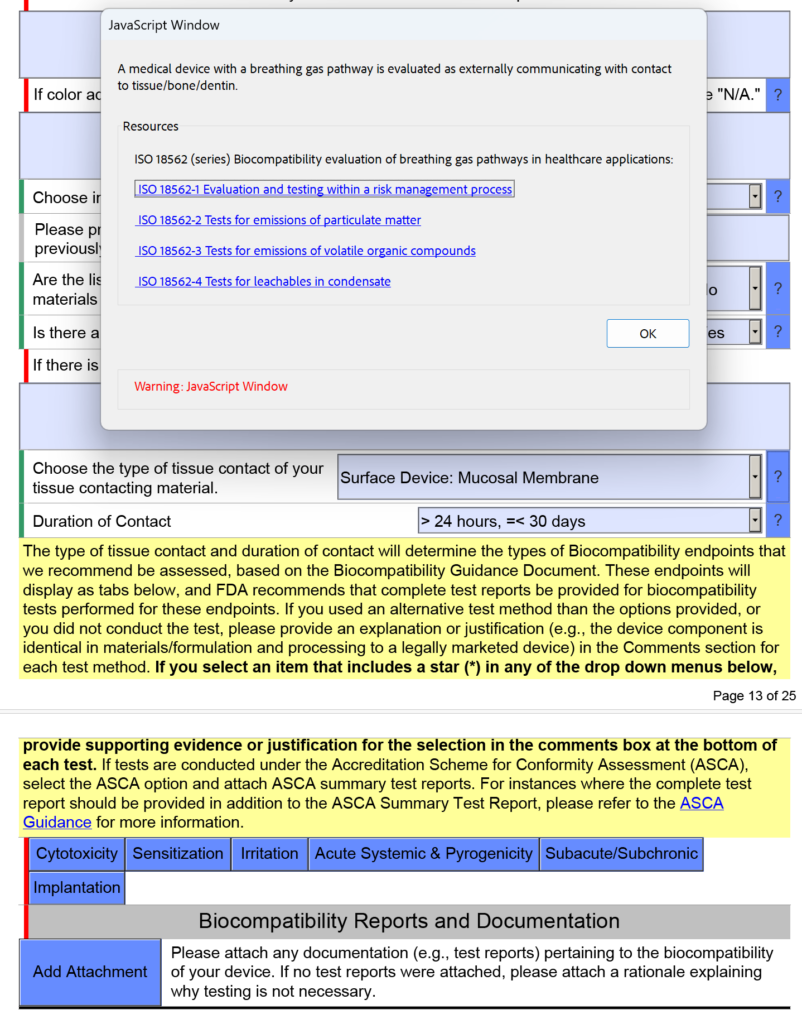
Yukarıda gösterilen mavi kutulara tıkladığınızda ek sorular ve rehberlik görünecektir. “Subacute/Subchronic” etiketli mavi kutuda ISO 18562 standartlarına ilişkin ek yardım metni bulacaksınız. "Akut Sistemik ve Pirojeniklik" etiketli mavi kutuya tıkladığınızda da benzer yardım metni bulunur.

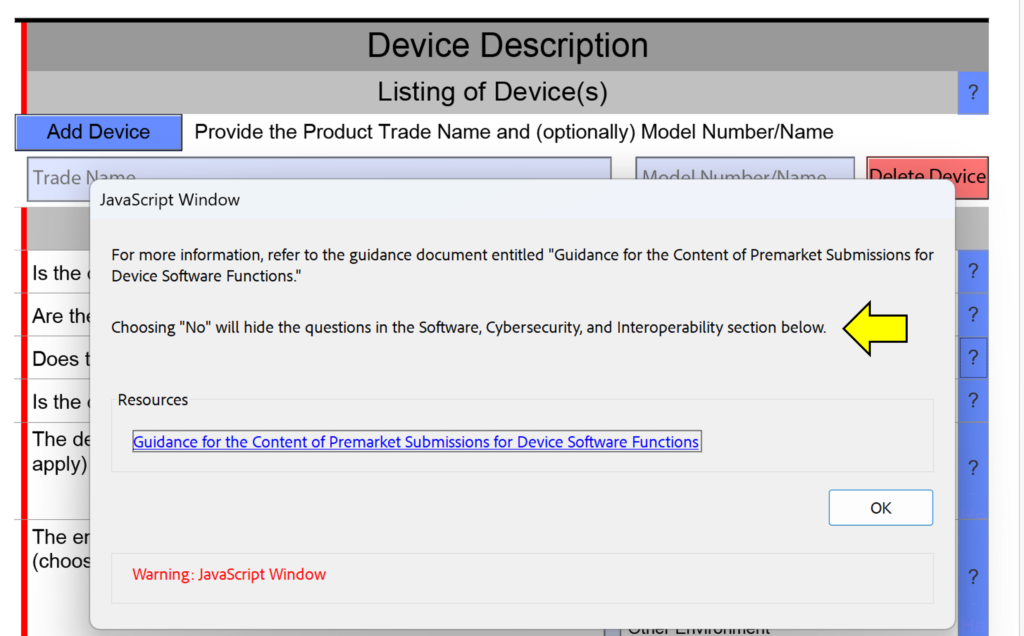
Kesit değişikliği hatırlatıcısı nedir?
Bu FDA eSTAR sürümünde yapılan küçük değişikliklerden biri, cihaz açıklaması bölümündeki yardım metnine "kesit değişikliği hatırlatıcılarının" eklenmesidir. Bu, gönderiminizdeki soruları yanıtlamaktan kaçınmanıza yardımcı olmak anlamına gelmez; çünkü gönderiminizin bir bölümünü "Evet" yerine "Hayır" yanıtını verdiğiniz için kaçırırsanız, FDA inceleme uzmanı bu hatayı Teknik İnceleme süreci sırasında tespit edecektir. Bu, gönderiminizin beklemeye alınmasıyla sonuçlanacak ve düzeltmeleri yeniden gönderdiğinizde inceleme süresi saati sıfır güne sıfırlanacaktır. Aşağıdaki ekran görüntüsü, bu kesit değişikliği hatırlatıcılarından birinin örneğini göstermektedir.
FDA eSTAR'ın klinik test bölümünde ne gibi değişiklikler yapıldı?
Klinik test bölümü artık kullanıldığında görüntülenecektir PDF-XChange Editörancak FDA eSTAR'ı düzenlemek için yalnızca Adobe Acrobat Pro'yu kullanmanızı öneririz. Bu değişiklik bir hata düzeltmesidir ve nIVD eSTAR'a özeldir. IVD eSTAR ve nIVD eSTAR'ın her ikisi de performans testi bölümünde bir klinik test bölümü içerir ancak performans testi bölümü FDA eSTAR'da bulunur. önce elektriksel güvenlik ve EMC testi bölümü, performans testi bölümü ise sonra elektriksel güvenlik ve EMC testi bölümü. Şirketiniz gelecekteki bir FDA sunumunda klinik verileri sunmayı planlıyorsa aşağıdaki önerilerimiz var:
- bir şeyi izlemek CDRH Learn web seminerleri 21 CFR 812 konusu hakkında
- IRB gönderiminden veya etik inceleme kuruluna gönderimden önce klinik çalışma protokolünüz hakkında sorular sormak için başvuru öncesi bir telekonferans düzenleyin
- Ön-ön toplantı talebini göndermeden önce, FDA'nın FDA eSTAR'da De Novo veya PMA sunumu için hangi genel klinik bilgileri istediğine bakın.

Not: Yukarıda gösterilen klinik bölüm yalnızca De Novo veya PMA gönderimini seçerseniz FDA eSTAR'da bulunur. Klinik verileri içeren 510k'lik bir gönderim gönderirseniz klinik bölümü aşağıda gösterildiği gibi kısaltılacaktır.

- SEO Destekli İçerik ve Halkla İlişkiler Dağıtımı. Bugün Gücünüzü Artırın.
- PlatoData.Network Dikey Üretken Yapay Zeka. Kendine güç ver. Buradan Erişin.
- PlatoAiStream. Web3 Zekası. Bilgi Genişletildi. Buradan Erişin.
- PlatoESG. karbon, temiz teknoloji, Enerji, Çevre, Güneş, Atık Yönetimi. Buradan Erişin.
- PlatoSağlık. Biyoteknoloji ve Klinik Araştırmalar Zekası. Buradan Erişin.
- Kaynak: https://medicaldeviceacademy.com/fda-estar/



