F16BP-mikropartiklar är inom fagocyterbart område
För att demonstrera styrkan i en sådan strategi valdes PFK15 (block-6-fosfofrukto-2-kinasfruktos-2,6-bifosfatas 3-PFKFB3) för att blockera glykolys, eftersom det är ett av de hastighetsbegränsande stegen i glykolys20. Dessutom valdes fruktos-1,6-bifosfat (F16BP), som genereras av fosfofruktokinas (PFK) som är ett steg nedströms om PFKFB3 som metabolit för att generera fagocyterbara partiklar21. F16BP-baserade mikropartiklar genererades med användning av kalciumfosfatkemi. Dynamisk ljusspridning visade att storleken på dessa partiklar var 2.3 ± 0.4 µm (Fig. 1b) och svepelektronmikrofotografier visade att dessa partiklar hade jämn sfärisk morfologi (Fig. 1c). Med hjälp av 1H NMR och EDX-kartläggning bestämdes det att F16BP var inkorporerat i dessa mikropartiklar (Fig. 1c; S1) och partiklarna hade 2 ± 0.14 kalcium till fosfor (Ca:P) förhållande (Fig. 1c).
F16BP-mikropartiklar fagocyteras av DCs
För att testa om F16BP MP kunde frisätta F16BP, utfördes frisättningskinetik i fosfatbuffrad saltlösning. Det observerades att F16BP MPs kunde släppa F16BP i 6 timmar på ett ihållande sätt (Fig. S2). Dessa data visade att de genererade MP innehåller F16BP, är i det fagocyterbara området för DC och kan frigöra F16BP för att potentiellt tillåta glykolys att gå framåt. Förutom F16BP genererades också partiklar av andra kontrollmetaboliter såsom ribulos 5 fosfat (R5P), fosfoenolpyrodruvsyra (PEP) och fruktos-6 fosfat (F6P) (Fig. S3). I denna studie valdes PBS för att efterlikna in vivo fysiologiska förhållanden för fosfater, och frisättningen av F16BP i detta medium bestämdes22. Dessutom, eftersom aktiverade DC förväntas överleva i 1–3 dagar in vivo vid fagocytos, är den kortsiktiga aktiviteten eller stabiliteten hos F16BP MP:er önskvärd23.
För att testa om dessa partiklar kan fagocyteras av DC, utfördes konfokal avbildning. Specifikt genererades F16BP MP:er med FITC interkalerad i partiklarna. Benmärgshärledda DCs (DCs) inkuberades sedan med dessa partiklar i 60 minuter och färgades för aktin och kärnor, och fluorescerande avbildning utfördes. Cytokalasin D i närvaro av F16BP-FITC MP användes som kontroll. Det observerades att DC kunde associera med partiklarna effektivt, och de konfokala skivorna i z-riktningen visade att partiklarna internaliserades (Fig. S4).
F16BP-mikropartiklar räddar glykolys i DC in vitro
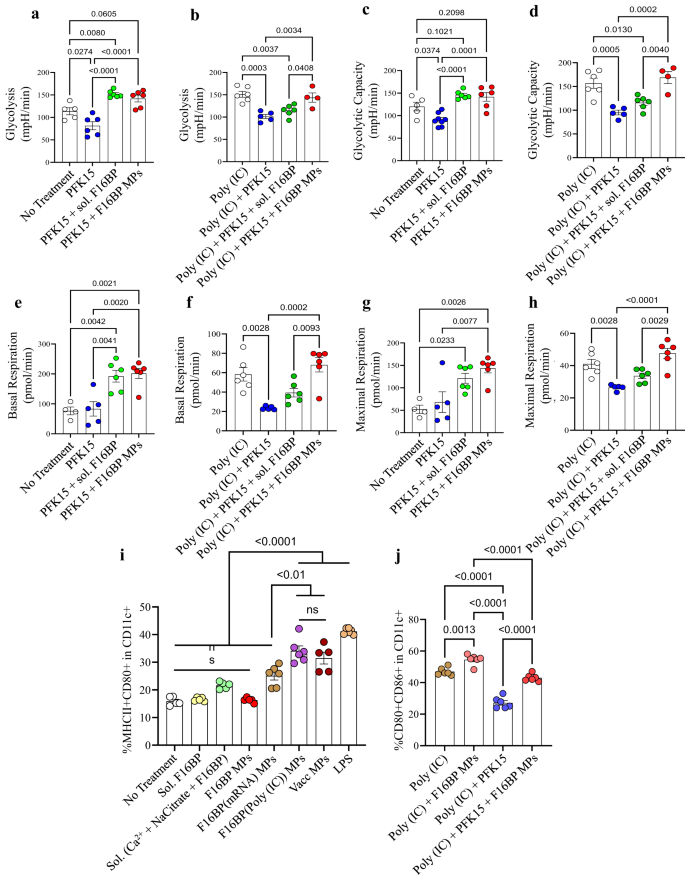
Därefter testades förmågan hos F16BP MPs att rädda glykolys i DCs i närvaro av glykolytisk inhibitor PFK15 med hjälp av extracellulära flödesanalyser. DCs odlades med antingen PFK15, F16BP MPs, lösligt fruktos-6-fosfat (F6P-uppströms PFKFB3) eller PFK15 + F16BP MPs, eller enskilda komponenter av F16BP MPs under 2 timmar, och extracellulär försurningshastighet (ECAR–hastigheten av glykolys) mätningar erhölls. Det observerades att PFK15 gav glykolys och glykolytisk kapacitet (y-axis-ECAR) lägre än kontrollen utan behandling (Fig. 2a–d; S5). Viktigt är att glykolys och glykolytisk kapacitet var signifikant högre i F16BP MP även i närvaro av PFK15, jämfört med PFK15 enbart kontroll (Fig. 2a–d). Dessutom, i närvaro av poly(IC) (ett aktiverande medel för DC)24, PFK15 minskade glykolysen och den glykolytiska kapaciteten, och F16BP MP kunde rädda denna minskning även i närvaro av PFK15 (Fig. 2e–h). Sammantaget tyder dessa data på att de fagocytoserbara F16BP MP:erna kunde rädda glykolys i DC även i närvaro av glykolytisk hämmare PFK15, och därför kan användas för immunterapier där glykolysvägen för cancerceller är målinriktad. Detta är viktigt eftersom DCs under inflammationsförhållanden behöver utföra ökade nivåer av glykolys för att stödja den inflammatoriska proteinproduktionen11,25.
a-d DCs behandlade med F16BP MP:er räddade glykolys och glykolytisk kapacitet från glykolytisk hämning (PFK15), in vitro (n = 6; envägs ANOVA Tukeys test), e-h DC som behandlats med F16BP MP accelererar basal och maximal andning även under glykolytisk hämning (PFK15), in vitro (n = 6; Envägs ANOVA Tukeys test). i Vaccinpartiklar inducerade signifikant högre frekvens av MHCII + CD86+ i CD11c+ DCs jämfört med de individuella komponentkontrollerna av MPs (n = 6; Envägs ANOVA Tukeys test). j F16BP MP kunde rädda aktiveringen av DC även i närvaro av PFK15 (PFK15 konc. = 25 µM) (n = 6; Envägs ANOVA Tukeys test). Data representerade som medelvärde ± standardfel.
F16BP-mikropartiklar räddar aktivering av DCs in vitro
För att testa om F16BP MP kan modulera funktionen hos DC formulerades mRNA-baserade och peptidbaserade vaccin F16BP MPs. Dessa vacciner genererades genom att interkalera di-fosforylerat melanompeptidantigen Tyrosin-relaterat protein 2 (pTRP2) och poly(IC) och mRNA härledda från melanomceller, som innehåller flera fosfatgrupper i sin ryggrad (Fig. S6). Eftersom pTRP2p och poly(IC) har fosfatgrupper kan dessa molekyler inkorporeras i F16BP MPs med användning av kalciumfosfatkemin. Mängden pTRp2 och poly(IC) inkorporerade i F16BP MP bestämdes till 78 ± 3.4 respektive 50.9 ± 7.9 µg. Därefter inkuberades F16BP MPs interkalerade med poly(IC) och pTRP2 med DCs över natten, och flödescytometri användes för att testa om dessa partiklar kunde aktivera DCs (Fig. 2i, j). Det observerades att vaccinpartiklarna inducerade signifikant högre frekvens av MHCII + CD86+ i CD11c+ DCs jämfört med de individuella komponentkontrollerna av MPs (Fig. 2i). Dessutom observerades det att PFK15 kunde minska aktiveringen av DCs (CD80 + CD86+ i CD11c + ) även i närvaro av poly(IC), och F16BP MP kunde rädda aktiveringen av DCs även i närvaro av PFK15 (Fikon. 2j). Dessutom ledde kalciumjoner i den koncentration som tillsattes till DCs som F16BP MP inte till förändringar i aktiveringsprofilen (MHCII + CD80+ i CD11c +) för DCs (Fig. S5). Dessa data indikerar att de F16BP-baserade vaccin MPs räddar DC-aktivering även i närvaro av PFK15, vilket är viktigt om in vivo cancervaccinsvar måste genereras i närvaro av glykolysinhibering.
För att ytterligare analysera om DCs behandlade med F16BP MP-formuleringar modulerar T-cellssvar, utfördes en syngen blandad lymfocytreaktion (MLR). C57BL/6j benmärgshärledda DCs behandlades med olika tillstånd (Fig. S72 timmar och odlades sedan med T-celler isolerade från C57BL/6j-möss under 60 timmar. Cellerna färgades sedan mot CD4, CD8, CD44, Tbet, RORɣT, GATA3, CD25 och Foxp3 och analyserades med flödescytometri. Det observerades att F16BP MP, F16BP(pTRP2), F16BP(poly(IC), F16BP(pTRP2+poly(IC)), PFK15 + F16BP MP, och PFK15 + F16BP(pTRP2+poly(IC)) alla signifikant uppreglerade frekvensen av aktiverade Th1, aktiverade Th17 och aktiverade Tcl-celler, samtidigt som frekvensen av Th1, Tregs och aktiverad Th2 nedregleras (fig. S7). Intressant nog observerades att behandlingen av DC med F16BP MP ledde till de största förändringarna i T-cellpolarisering och aktivering. Denna förändring som observerades var även i närvaro av adjuvans poly(IC) eller antigenet pTRP2. Dessutom inducerade löslig F16BP och dess komponenter tillsatta DCs en signifikant lägre frekvens av aktiverade Th1, Tc1 och Th17 jämfört med F16BP MPs i alla möjliga kombinationer. Dessa data tyder på att närvaron av partiklar var viktig för att snedvrida pro-inflammatoriska T-cellsfrekvenser i en MLR-reaktion.
F16BP-vacciner med glykolytiska hämmare genererar robusta antitumörsvar
För att testa om det immunmetabolismmodulerande tillvägagångssättet att rädda glykolys i närvaro av glykolytiska hämmare och generera cancervaccinimmunterapier, valdes mycket aggressiva former av melanommusmodeller. Specifikt injicerades vaccin MPs subkutant i möss innehållande YUMM1.1 (murin BRAFv600e mutation liknande människor) melanomtumörer, och deras förmåga att minska tumörtillväxt och modulera medfödda och adaptiva immunsvar testades.
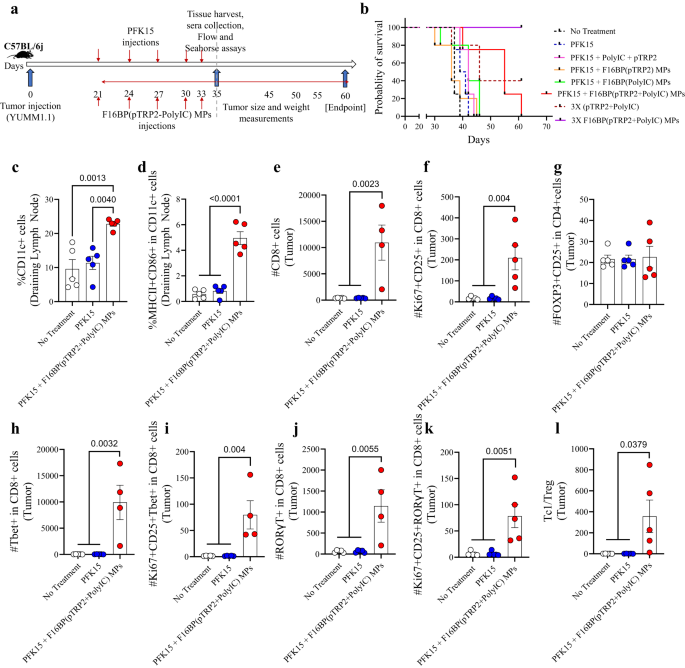
I denna melanommodell, 0.75 × 106 YUMM1.1-celler injicerades subkutant i C57BL/6j immunkompetenta möss, och PFK15 injicerades varannan dag under studiens varaktighet. Dessutom injicerades F16BP(pTRP2+poly(IC)) subkutant på samma dagar som PFK15-injektionerna (Fig. 3a). In vitro fastställdes det att PFK15 var effektivt för att förhindra proliferation av YUMM1.1 cancerceller (Fig. S8). Det observerades att behandlingsgruppen av PFK15 + vaccin MPs ledde till signifikant ökad överlevnad för möss (dag 60 - slutpunkt) och långsammare tumörtillväxt jämfört med alla olika kontroller (Fig. 3b; S9). Denna ökning i överlevnad hos vaccinets MP var associerad med en ökning av DC-populationen och aktiverad DC-population i de dränerande inguinallymfkörtlarna på dag 35, vilket antyder att vaccinets MPs kunde modulera de medfödda immunsvaren (Fig. 3c, d). F16BP var avgörande för att generera antitumörsvar hos möss eftersom möss utan F16BP inte överlevde efter dag 45. Dessutom kunde 3 gånger dosen av F16BP (pTPR2+ poly IC) MP utan PFK15 upphäva befintliga tumörer, som inte upptäcktes förrän dag 60 (fig. 3b; S9). Dessutom fann man också att poly(IC) och pTRP2 behövde införlivas i F16BP MPs, och injektionerna av F16BP MPs med lösliga (poly(IC) + pTRP2), minskade inte tumörtillväxt hos möss (Fig. S9). F16BP MPs i sig kan påskynda glykolysen i olika celler i möss, vilket observerades in vitro i DCs. Denna acceleration av glykolysen kan då göra att immunsvaret snedvrids mot antitumörsvar. Denna kontroll testades dock inte på möss och är en begränsning av denna studie. Inom tumören observerades inga signifikanta skillnader i antalet CD4+ T-celler från olika behandlingsgrupper; det fanns emellertid en signifikant ökning av de prolifererande och aktiverade CD4+-cellerna hos möss behandlade med vaccin-MP jämfört med de andra behandlingsgrupperna (Fig. Sla). Vidare observerades inga signifikanta skillnader i antalet T-hjälpare typ 1 (Th1) och aktiverade och prolifererande Th1-celler; en signifikant ökning av T-hjälpare typ 17 (Th17) och aktiverade och prolifererande Th17-celler observerades i möss som behandlats med vaccin MPs jämfört med andra behandlingsgrupper (Fig. Sla). Det observerades också att när möss behandlades med PFK15 och med löslig pTRP2 och löslig poly (IC) utan F16BP, ledde det till ökade nivåer av aktiverade DC, jämfört med en kontroll utan behandling, dock modulerades DC inte i andra organ (fig. S10b). Dessutom, utan F16BP, modulerade formuleringen inte pro-inflammatoriska T-cellssvar jämfört med kontrollen utan behandling (Fig. S10C). Dessa data tyder på att F16BP krävdes i formuleringen för att generera pro-inflammatoriska T-cellssvar. Inom tumören var det dessutom en signifikant ökning av antalet CD8+ T-celler och prolifererande och aktiverade CD8+ T-celler hos möss behandlade med vaccin MPs jämfört med andra behandlingsgrupper, vilket indikerar minskningen av tumörtillväxtkinetiken hos möss som behandlats med vaccin MPs svar (Fig. 3e, f). Inga signifikanta skillnader observerades i regulatoriska T-celler i de olika behandlingsgrupperna (Fig. 3g). Dessutom fanns det en signifikant ökning av antalet Tcl, Tc1 och prolifererande och aktiverade Tc17- och Tc1-celler hos möss som behandlats med vaccin-MPs jämfört med andra behandlingsgrupper (Fig. 3h–k). Dessutom observerades en signifikant ökning av Tc1/Treg-förhållandet hos möss behandlade med vaccin-MPs jämfört med andra behandlingsgrupper (Fig. 3l). Dessa data visar att vaccinets MP kunde generera robusta pro-inflammatoriska adaptiva immunsvar i tumören.
a Schematisk representation av subkutan injektion av Vacc MP, in vivo, b Kaplan-Meir-kurva som visar signifikant högre överlevnad för möss behandlade med Vacc MP, c, d Möss som behandlats med Vacc MPs hade en signifikant högre andel av den totala såväl som aktiverade DCs i den dränerande lymfan (n = 5; Envägs ANOVA Tukeys test), e, f Möss som behandlats med Vacc MPs hade signifikant högre antal Tc och aktiverade och prolifererande Tc jämfört med andra behandlingsgrupper (n = 4 eller 5; Envägs ANOVA Tukeys test), g Inga signifikanta skillnader i antalet tregs observerades mellan behandlingsgrupper (n = 5; Envägs ANOVA Tukeys test), h-k Möss som behandlats med Vacc MPs hade signifikant högre antal Tc, Tc1, aktiverade och prolifererande Tc1 och Tc17 celler (n = 4; Envägs ANOVA Tukeys test), l Signifikant högre Tc1/Treg-förhållande observerades hos möss behandlade med Vacc MPs jämfört med kontrollgrupperna (n = 4; Envägs ANOVA Tukeys test). Data representerade som medelvärde ± standardfel.
F16BP-vacciner bibehåller DC- och T-cells metabolisk funktion in vivo
För att testa om DC- eller T-cellerna bibehåller sin metaboliska funktion efter behandling avlivades möss med tumörer och cellerna från tumörer, mjälte och inguinala LN isolerades. Dessa celler odlades sedan med 2NBDG och flödet användes för att bestämma upptaget av 2NBDG som representerar nivån av glykolys. Det observerades att i tumören var gMFI av 2NBDG i CD80+ DCs och makrofager signifikant högre i PFK15 + F16BP(polyIC) MPs jämfört med PFK15 endast tillstånd, men dessa skilde sig inte signifikant från kontroll utan behandling (Fig. S11a–g). I mjälten var gMFI för 2NBDG i DCs, CD80+ DCs, men inte i CD206+ DCs signifikant högre i PFK15 + F16BP (polyIC) MPs behandlade möss jämfört med alla kontroller (Fig. S11h–j). Dessa trender vändes i makrofager isolerade från mjälten från PFK15 + F16BP(polyIC) MP-behandlade möss jämfört med alla kontroller (Fig. S11k–m). Dessa data tyder på att MPs systemiskt differentiellt modulerade glykolys av DC och makrofager. I inguinal LNs uppreglerades gMFI av 2NBDG också i aktiverade CD80+ DCs och CD206+ DCs (Fig. S11n–s). 2NBDG-analysen visade således att DC- och makrofagglykolysen fortfarande upprätthölls i en tumör, mjälte och i dränerande inguinala LN. En liknande studie utfördes för adaptiva T-celler för att förstå glykolytisk plasticitet i dessa celler. Det observerades särskilt att CD45-celler isolerade från tumören hade signifikant lägre 2NBDG gMFI i PFK15, PFK15+ löslig F16BP + löslig poly(IC) och PFK15 + F16BP(polyIC) MPs behandlade möss jämfört med kontrollen av ingen behandling (Fikon. Sla). Dessa data tyder på att MP eller lösliga delar av MP inte kunde väsentligt modulera glykolysen av icke-immuna celler eller att dessa celler har en högre nivå av metabolisk plasticitet jämfört med immunceller. Dessutom var gMFI av 2NBDG i T-hjälparceller i tumören inte signifikant annorlunda i PFK15 + F16BP(polyIC) MPs jämfört med kontrollen utan behandling, och dessa två tillstånd var signifikant högre än de andra kontrollerna (Fig. S12b). gMFI för 2NBDG i CD8 + T-celler i tumören var inte signifikant annorlunda i PFK15 + F16BP (polyIC) MPs jämfört med kontrollen utan behandling (Fig. S12C), men var högre än PFK15+ löslig F16BP + löslig poly(IC)-tillstånd. I mjälten observerades inga signifikanta skillnader i CD4+ T-celler, dock hade CD8+ T-celler högre 2NBDG gMFI jämfört med kontrollerna i PFK15 + F16BP(polyIC) MP-behandlade möss, men inte annorlunda än kontroll utan behandling (Fikon. S12d, t.ex). I de inguinala lymfkörtlarna hade PFK15 + F16BP(polyIC) MPs behandlade möss också sänkt 2NBDG gMFI jämfört med kontrollen utan behandling (Fig. S12f, g). T-cells 2NBDG-analysen tyder på att i tumören bibehåller både CD4+ och CD8+ T-celler sin glykolys även efter ex vivo-odling, och kan således stödja antitumörsvar in vivo. Sammantaget visade dessa data att vaccinets MP:er som levererar F16BP och kan rädda DC:er kunde generera robusta immunsvar mot en aggressiv form av melanomtumörer.
F16BP räddar adoptivt överförd DC-metabolism hos möss
Utöver strategin för subkutana vaccin har adoptiv överföring av DC testats på kliniker för behandling av prostatacancer26,27,28. Dessa strategier har dock inte varit särskilt framgångsrika på kliniker, delvis på grund av deras låga effektivitet för förbättring av överlevnad. För att testa mångsidigheten hos F16BP-PFK15-systemet valdes en annan aggressiv B16F10-melanommodell och förmågan till adoptiv överföring av DC laddades med MPs användes som en behandlingsmodalitet (Fig. 4a). I denna modell laddades DCs med F16BP MPs interkalerade med mRNA isolerat från B16F10-cancerceller och poly(IC) (Vacc DCs) och överfördes adoptivt till möss innehållande B16F10-tumörer. Denna cellulära terapis förmåga att modulera adaptiva immunsvar, minska tumörtillväxt och förbättra överlevnaden mättes.
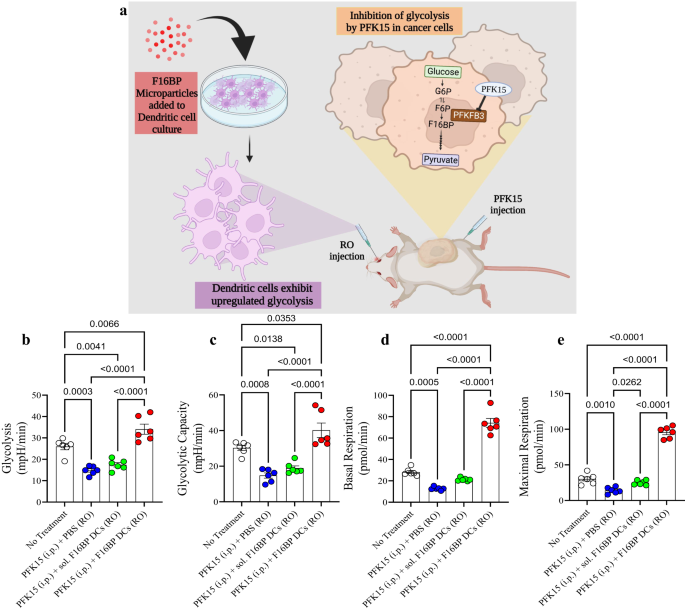
a Schematisk representation av den adoptiva cellulära terapimodellen som används. b, c Möss injicerade med adoptivt överförda DCs tillsammans med F16BP MP kunde rädda glykolys och glykolytisk kapacitet från glykolytisk hämning (PFK15), in vivo (n = 6; Envägs ANOVA Tukeys test), d, e Möss injicerade med adoptivt överförda DCs tillsammans med F16BP MPs accelererade basal och maximal andning även under glykolytisk hämning (PFK15), in vivo (n = 6; Envägs ANOVA Tukeys test). Data representerade som medelvärde ± standardfel.
Först, för att testa om F16BP MPs (utan poly(IC) eller mRNA) kan rädda DCs in vivo, laddades F16BP MPs in i DCs genom att inkubera dessa partiklar med DCs i 2 timmar. Därefter överfördes dessa DCs adoptivt intravenöst i möss och PFK15 injicerades intraperitonealt. DC isolerades från mjälten och extracellulära flödesanalyser utfördes på dessa celler. Det förväntas att dessa DC:er isolerade från mjälten kommer att vara en blandning av både endogena mjält-DC:er och adoptivt överförda DC:er. Det observerades att F16BP MP kunde rädda glykolys och glykolytisk kapacitet hos DC som observerats av de ökade ECAR-värdena i närvaro av PFK15 jämfört med kontrollerna (Fig. 4b, c). Dessutom kunde F16BP MPs också rädda basal och maximal andning av DCs i närvaro av PFK15, jämfört med kontrollerna (Fig. 4d, e). Dessa data visade att dessa partiklar inte bara kan rädda glykolys och mitokondriell andning i dessa celler in vitro utan också in vivo, och därmed kan de kunna generera funktionella immunterapeutiska svar.
Metabolisk räddning av DC genererar robust adoptiv cellimmunterapi
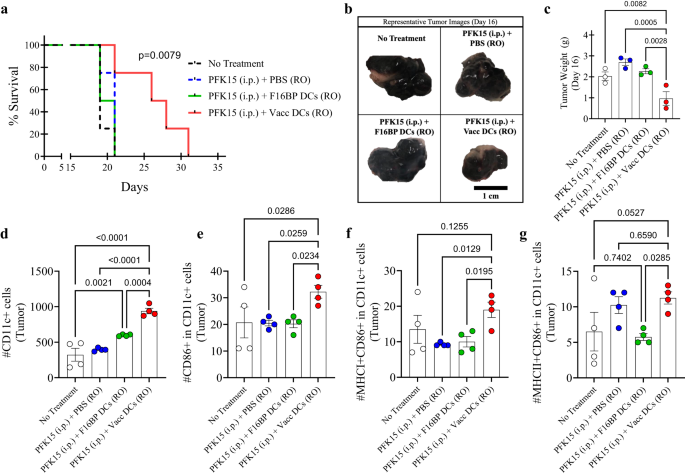
För att testa om den metaboliska räddningen i DC kan tillämpas på adoptiv cellterapi, testades adoptivöverföringen av DC-vacciner på möss (Fig. S13). Först, in vitro, bestämdes det att PFK15 var effektivt för att förhindra spridning av B16F10-cancerceller (Fig. S14). Närmare bestämt 0.75 × 106 B16F10-celler injicerades i C57BL/6j immunokompetenta möss och PFK15 injicerades varannan dag under studiens varaktighet (Fig. S13). Dessutom överfördes ex vivo DCs laddade med F16BP (mRNA + poly(IC)) (Vacc DCs) eller DC laddade med F16BP MPs adoptivt med retro-orbitala injektioner (RO) på dagarna 6 och 19 (Fig. S13). Det observerades att överlevnaden för möss som fick Vacc DCs + PFK15 ökade dramatiskt jämfört med alla kontroller, och tumören växte långsammare hos möss som fick Vacc DCs jämfört med kontrollerna (Fig. 5a; S15). Dessa data bekräftades ytterligare av tumörvikter och bilder som erhölls vid halvpunkten av studien på dag 16 (Fig. 5b, c). Dessa data indikerar att det efter bara två injektioner av Vacc DCs fanns ett robust svar mot tumören, vilket sedan minskade tumörtillväxten hos möss.
a Kaplan–Meir-kurva som visar signifikant högre överlevnad för möss som behandlats med adoptivt överförda Vacc MP (n = 10, p <0.001), b Representativa tumörbilder av olika behandlingsgrupper dag 16. c Möss behandlade med adoptivt överförda Vacc DCs hade signifikant lägre tumörvikter jämfört med andra behandlingsgrupper, in vivo (n = 3; Envägs ANOVA Tukeys test). d, e Signifikant högre totalsumma, såväl som aktiverade DCs, observerades hos möss behandlade med adoptivt överförda Vacc DCs jämfört med andra behandlingsgrupper, in vivo (n = 4; Envägs ANOVA Tukeys test). f Signifikant högre MHCI+ aktiverade DCs observerades hos möss behandlade med adoptivt överförda Vacc DCs jämfört med andra behandlingsgrupper, in vivo (n = 4; Envägs ANOVA Tukeys test). g Signifikant högre MHCII+ aktiverade DCs observerades i möss behandlade med adoptivt överförda Vacc DCs jämfört med F16BP DCs, in vivo (n = 4; Envägs ANOVA Tukeys test). Data representerade som medelvärde ± standardfel.
Därefter, för att testa om Vacc DCs kunde modulera immunsvaren efter deras administrering, på dag 16, isolerades mjälten, lymfkörtlarna och tumörerna från olika tillstånd och färgades för aktiveringsprofilen för DCs och T-celler. Det observerades att det totala antalet DCs och aktiverade DCs i tumörer för Vacc DCs var signifikant högre jämfört med alla kontroller (Fig. 5d, e). Dessutom uppreglerade Vacc DCs också antalet DCs som var MHCI + CD86 + CD11c+ i tumören jämfört med andra behandlingsgrupper, vilket tyder på att Vacc DCs stöder aktiveringen av DCs in vivo (Fig. 5f). Vacc DCs uppreglerade också antalet DC som var MHCII + CD86 + CD11c+ i tumören jämfört med adoptivt överförda F16BP DCs, vilket tyder på att Vacc DCs sneda mot MHCII-associerade svar in vivo (Fig. 5g). Dessa data indikerar att glykolys kan behövas för potentiell infiltration av DCs i mjälten och tumören, och F16BP MP ger DCs förmåga att glykolys ska ske.
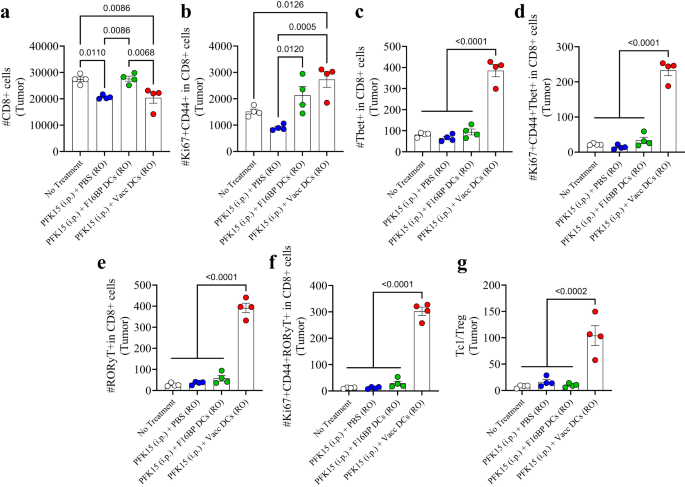
De adaptiva T-cellssvaren i tumören var snedställda mot pro-inflammatoriska svar (Fig. 6a–g; S16). Det observerades att enbart PFK15-behandling signifikant minskade det totala antalet CD8+ T-celler i tumören, och att DC laddade med F16BP kunde ge detta antal lika med kontrollen utan behandling (Fig. 6a). Inom detta CD8+ T-cellsnummer observerades det att det fanns en 2-3-faldig ökning av aktiverade och prolifererande (Ki67+CD44+ i CD8+) T-celler i tumören i Vacc DC-gruppen jämfört med kontrollgrupperna (Fig. 6b). Dessutom fanns det en 4-faldig signifikant ökning av cytotoxisk Tbet+ i CD8+ T-celler (Tc1) i Vacc DCs-gruppen jämfört med alla andra grupper (Fig. 6c). Dessutom var antalet aktiverade och prolifererande Tcl-celler > 1 gånger högre i Vacc DCs-gruppen jämfört med alla andra behandlingstillstånd (Fig. 6d). På liknande sätt var antalet Tc17-celler (RORγt+ i CD8+), och aktiverat och prolifererande Tc17 (RORγt+Ki67+CD44+ i CD8+), som framträder som en viktig pro-inflammatorisk celltyp som inducerar cancercellsdöd, också >10- gånger betydligt högre än kontrollerna i tumörerna (fig. 6e, f). Förutom Tc-populationerna ledde Vacc DCs också till en minskning av antalet T-hjälparceller (Th), aktiverade och prolifererande Th-celler, Th1 (Tbet+ i CD4+), Th2 (GATA3+ i CD4+), aktiverade och prolifererande Th1 (Tbet+CD44+Ki67+ i CD4+), och aktiverade och prolifererande Th2-celler (GATA3+CD44+Ki67+ i CD4+) nummer i Vacc DC-gruppen (Fig. S16). Det fanns en signifikant minskning av antalet Treg (CD25+Foxp3+ i CD4+) i tumören hos möss behandlade med Vacc DCs jämfört med obehandlade möss (Fig. S16). Dessutom fanns det en signifikant ökning av Th17 (RORγt+ i CD4+) och aktiverade och prolifererande Th17-celler (RORγt+Ki67+CD44+ i CD4+) i tumören i de Vacc DC-behandlade mössen jämfört med alla andra grupper (Fig. . S16). Dessutom var förhållandet mellan Tc1 och Treg-celler 5–10 gånger högre i tumören hos de Vacc DC-behandlade mössen jämfört med kontrollerna (Fig. 6g). Dessa data tyder på att Vacc DCs kunde inducera ett robust adaptivt immunsvar mot tumörerna, vilket främst kan drivas av ökningar i Tc1- och Tc17-cellpopulationer.
a, b Signifikant modulering av totala (CD8+) såväl som aktiverade och prolifererande (Ki67+CD44+ i CD8+) cytotoxiska T-celler observerades hos möss behandlade med adoptivt överförda Vacc DCs jämfört med andra behandlingsgrupper, in vivo (n = 4; Envägs ANOVA Tukeys test). c-f Signifikant högre total Tc1 (Tbet+ i CD8+), aktiverad och prolifererande Tc1 (Tbet+Ki67+CD44+ i CD8+), total Tc17 (RORɣT+ i CD8+), aktiverad och prolifererande Tc17 (RORɣT+Ki67+CD44+ i CD8+) observerades med adoptivt överförda Vacc DCs jämfört med andra behandlingsgrupper, in vivo (n = 4; Envägs ANOVA Tukeys test). g Betydligt högre förhållande mellan cytotoxiska och regulatoriska T-celler (Tc1/Treg) observerades hos möss behandlade med adoptivt överförda Vacc DCs jämfört med andra behandlingsgrupper, in vivo (n = 4; Envägs ANOVA Tukeys test). Data representerade som medelvärde ± standardfel.
Eftersom Vacc DC administreras systemiskt, analyserades också mjälte och cervikala lymfkörtlar för förändringar i medfödda och adaptiva immunsvar (fig. S17-S20). Noterbart var att den totala frekvensen av DCs (CD11c+) och aktiverade DCs (MHCII+CD86+ i CD11c+, MHCI+CD86+ i CD11c+, CD86+ i CD11c+, MHCI+ i CD11c+, MHCII+ i CD11c+) var signifikant högre jämfört med mjälten; denna skillnad observerades dock inte i de cervikala lymfkörtlarna (fig. S17 och S18). Dessa fynd tyder på att adoptiv överföring av DCs primärt genererar immunsvar genom att modulera de medfödda immunsvaren i mjälten. I motsats till tumören observerades det att det i mjälten fanns signifikanta minskningar av Th17-frekvensen i Vacc DC-grupper jämfört med alla kontroller (Fig. S19), signifikanta ökningar i Th2-frekvensen jämfört med alla kontroller (Fig. S19), och en signifikant minskning av Tc17-frekvensen jämfört med enbart PFK15, och PFK15 + F16BP DCs kontroller (Fig. S20). Dessa fynd indikerar att även om Vacc DC administrerades systemiskt, återfanns de pro-inflammatoriska adaptiva immunsvaren primärt i tumören och inte i mjälten. Dessutom bibehöll Vacc DCs isolerade från mjälten på möss också högre ECAR och OCR jämfört med kontrollerna (Fig. S21). För att testa om F16BP-komponenten i formuleringen är viktig för att generera medfödda och adaptiva immunsvar injicerades DC laddade med lösligt mRNA + löslig poly (IC) i möss retroorbitalt och de medfödda och adaptiva immunsvaren genererade i iLN, mjälte och tumörer testades och jämfördes med kontroll utan behandling. Det observerades att för att öka pro-inflammatoriska både DCs och T-cellsvar F16BP laddade i DCs var väsentliga, eftersom det inte observerades några signifikanta skillnader mellan kontroll utan behandling och DC laddade med lösligt mRNA + löslig poly (IC) i dessa organ (Fikon. S22).
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Fordon / elbilar, Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- PlatoHealth. Biotech och kliniska prövningar Intelligence. Tillgång här.
- ChartPrime. Höj ditt handelsspel med ChartPrime. Tillgång här.
- BlockOffsets. Modernisera miljökompensation ägande. Tillgång här.
- Källa: https://www.nature.com/articles/s41467-023-41016-z