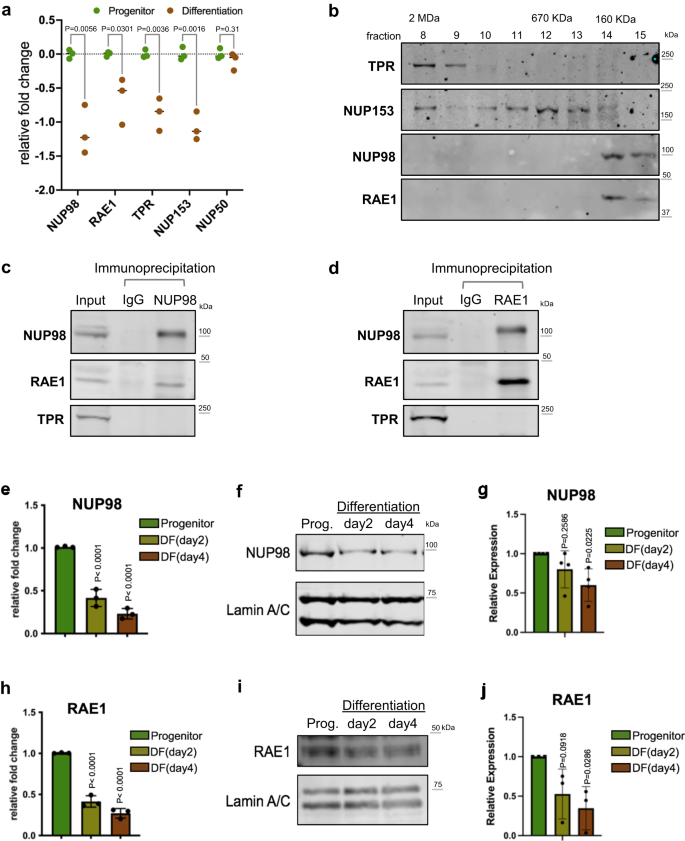
NUP98 och RAE1 är berikade på stamfader och utgör ett distinkt komplex
Mellan stamfadertillståndet kontra keratinocyterna i differentieringstillståndet identifierade vi att 4 av 5 nukleära korg-NUPs är signifikant nedreglerade i differentiering (Fig. 1a), utnyttjar RNA-seq-data som vi nyligen genererade20. För att bestämma hur anrikningen av dessa kärnkorgs-NUPs kan påverka stamfaderunderhåll, frågade vi om dessa NUPs finns i andra komplex inuti kärnan. Vi extraherade de lösliga fraktionerna från kärnorna i progenitor-state keratinocytes och utförde storleksuteslutningskromatografi. Medan TPR och NUP153 eluerade i en rad tidigare fraktioner, motsvarande större proteinkomplexstorlekar upp till 2MDa, eluerade NUP98 och RAE1 endast i de senare fraktionerna runt 160 KDa-markören (Fig. 1b). Samelueringen av NUP98 och RAE1, i samma fraktioner som motsvarar små proteinkomplex, antyder att dessa två proteiner kan associera med varandra oberoende av varandras NUP. För att testa detta utförde vi samimmunutfällning med hjälp av kärnextraktion från keratinocyter i stamfadertillståndet. NUP98-antikroppen samimmunoutfällde både NUP98 och RAE1; RAE1-antikroppen samimmunoutfällde också både RAE1 och NUP98. Båda co-immunoutfällningarna berikade inte andra nukleoporiner som TPR (Fig. 1c, d). Eftersom RNA kunde förmedla NUP98s interaktioner med andra proteiner23, undersökte vi detta genom att jämföra NUP98-RAE1 co-immunoprecipitationer med eller utan RNase-behandling. Intressant nog påverkades sambandet mellan NUP98 och RAE1 minimalt av RNase (kompletterande Fig. 1a), vilket tyder på att NUP98-RAE1-interaktionen inte kräver en RNA-komponent i detta sammanhang. Dessutom sonderade vi de immunutfällda proteinerna med NUP98- eller RAE1-antikroppen med användning av mAb414, som känner igen flera FG-domäninnehållande NUP. Även om mAb414 detekterade flera band i ingångslysatet, observerades inte detta bandmönster i immunoutfällningen av NUP98- eller RAE1-antikroppen (kompletterande Fig. 1b). Dessa data tyder på att NUP98 och RAE1 kan spela en roll i progenitortillståndet oberoende av andra NUP.
a Relativt mRNA-uttryck av nukleära korg-NUP:er, jämför stamfadertillståndet kontra de differentierade (dag 4) primära humana keratinocyterna, baserat på RNA-sekv-data (flera oparade t-test, N = 3 biologiska replikat). b Western blöts som visar fördelningen av nukleära korg NUPs i fraktionerna från storleksuteslutningskromatografi (SEC), med användning av den lösliga extraktionen från kärnorna av keratinocyter i progenitor-tillstånd. De fraktioner som motsvarar proteinstandarderna för SEC är märkta på toppen. c, d Western blöts som visar samimmunoutfällningen mellan NUP98 och RAE1 i den lösliga extraktionen från kärnorna (keratinocyter i stamfadertillståndet). NUP98 och RAE1 co-immunoprecipiterade varandra, men inte andra kärnporssubenheter såsom TPR. e RT-qPCR som jämför det relativa NUP98-uttrycket på mRNA-nivå i progenitor-tillståndet, tidigt (dag 2) och mitten (dag 4) differentieringstillstånd av keratinocyter (envägs ANOVA med post-hoc-test, N = 3 biologiska replikat, data representeras som medelvärde ± standardavvikelse). f, g Western blottar och kvantifieringar som jämför NUP98-proteinuttryck i keratinocytdifferentiering, med Lamin A/C som används som laddningskontroll (Envägs ANOVA med post-hoc-test, N = 4, data representeras som medelvärde ± standardavvikelse). h RT-qPCR som jämför det relativa RAE1-mRNA-uttrycket i keratinocytdifferentiering (envägs ANOVA med post-hoc-test, data representeras som medelvärde ± standardavvikelse). i, j Western blöts och kvantifieringar som jämför RAE1-proteinuttrycksnivåer i keratinocytdifferentiering, med Lamin A/C som används som laddningskontroll (envägs ANOVA med post-hoc-test, N = 3, kvantifieringsdata representeras som medelvärde ± standardavvikelse).
För att bättre förstå det tidsmässiga uttrycket av NUP98 och RAE1, övergång från stamfadertillståndet mot terminal differentiering, utförde vi både qRT-PCR och western blotting för att kvantifiera deras mRNA- och proteinnivåer under tidsförloppet för kalciuminducerad keratinocytdifferentiering. Signifikant minskning av NUP98 och RAE1 upptäcktes på dag 2 (tidig differentiering), och denna minskning sträckte sig till dag 4 (mitt differentiering) av differentieringstidsförloppet (Fig. 1e–j). Dessa data indikerar att nedregleringen av NUP98 och RAE1 är en tidig händelse i keratinocytdifferentiering, vilket kan spela en roll för att reglera övergången från stamfadertillståndet mot differentiering.
NUP98 eller RAE1 knockdown försämrar progenitors regenerativa förmåga
För att avgöra om nedregleringen av NUP98 eller RAE1 främjar övergången från stamfadertillståndet mot differentiering, utnyttjade vi shRNA-medierad knockdown i progenitor-state-keratinocyterna, och justerade deras uttryck till en nivå som är jämförbar med differentieringstillståndet. Tre oberoende shRNA för NUP98 eller RAE1 validerades på mRNA- och proteinnivåerna (Fig. 2a, b, Kompletterande Fig. 2a–d). Reduktion av antingen NUP98 eller RAE1 med dessa 6 shRNA individuellt var tillräcklig för att minska keratinocytklonogenicitet (Fig. 2c–f). För att utvärdera rollerna för NUP98 eller RAE1 för att påverka progenitors regenerativa kapacitet, utförde vi progenitor-konkurrens i hudepidermal regenerering. En 50:50-blandning av GFP- eller DsRed-uttryckande progenitor-state keratinocyter såddes på devitaliserad human dermis, uppväxt i vätske-luft-gränssnitt. Denna organotypiska regenereringsprocess slutförs på en vecka och bildar arkitektoniskt trogen överhudshud18,19. De GFP-uttryckande keratinocyterna samuttryckte kontroll icke-målinriktad shRNA; de DsRed-uttryckande keratinocyterna samuttryckte en av de tre shRNA:erna: icke-målinriktat kontroll-shRNA, NUP98-riktat shRNA eller RAE1-riktat shRNA. För epidermis regenererad med keratinocyter som båda uttrycker de icke-målinriktade kontroll-shRNA:erna, visade de röda och gröna fluorescerande keratinocyterna jämförbar representation i vävnaden, vilket indikerar att uttrycket av GFP eller DsRed inte differentiellt påverkade stamfaders regenerativa kapacitet. Däremot utkonkurrerades de röda keratinocyterna som samuttrycker NUP98 eller RAE1 shRNA av de gröna keratinocyterna som samuttrycker kontroll shRNA, med minskad representation i det basala progenitorfacket (Fig. 2g, h). Dessa fynd tyder på att den höga uttrycksnivån av både NUP98 och RAE1 är väsentlig för stamfaderunderhåll.
a, b RT-qPCR som visar knockdown-effektivitet för 3 oberoende shRNA-mål NUP98 eller RAE1 (envägs-ANOVA med post-hoc-test, N = 3, data representeras som medelvärde ± standardavvikelse). c-f Representativa bilder och kvantifiering av klonogenicitetsanalys som jämför keratinocyter med NUP98 eller RAE1 knockdown kontra kontroll (envägs ANOVA med post-hoc test, N = 3, kvantifieringsdata representeras som medelvärde ± standardavvikelse.) g Representativa bilder av konkurrensanalys i epidermal vävnadsregenerering. Ett lika stort antal keratinocyter som uttrycker DsRed eller GFP blandades såddes på human dermis. GFP-uttryckande keratinocyter co-uttrycker kontroll shRNA, och DsRed-uttryckande keratinocyter co-uttrycker kontroll shRNA eller shRNA inriktning NUP98 eller RAE1 (skala stapel = 125 μm). h Kvantifiering av DsRed eller GFP-uttryckande keratinocyter i basalskiktet av den regenererade epidermis, data representeras som medelvärde ± standardavvikelse. i Venn-diagram som visar överlappningen av NUP98 och RAE1 knockdown differentiellt uttryckta gener (Fishers exakta test, p = 1 × 10-321). j Värmekarta som visar det relativa uttrycket av delade gener med NUP98 eller RAE1 knockdown. k Topp tre genontologi (GO) termer för de uppreglerade eller nedreglerade generna som delas av NUP98 och RAE1 knockdown, identifierade av RNA-seq analyser.
För att identifiera de centrala cellulära processerna som påverkas av NUP98 eller RAE1 knockdown, utförde vi transkriptomprofilering med RNA-seq. Totalt identifierade vi 1493 signifikant förändrade gener med NUP98 knockdown, och 1401 signifikant förändrade gener med RAE1 knockdown (p < 0.05, tvåsvansad, Wald-test, genomsnittlig veckförändring för tre oberoende shRNA > 2 och individuell shRNA-faldig förändring > 1.5, Kompletterande data 1, Kompletterande data 2). Dessa två uppsättningar delar 597 gener (p = 1 × 10-321, Fishers exakta test), som ändras i samma riktning (uppreglerade eller nedreglerade) med antingen NUP98 eller RAE1 knockdown (Fig. 2i, j). Top genontologi (GO) termer för de delade uppreglerade generna inkluderar epidermal utveckling och keratinocytdifferentiering; Topp GO-termer för de delade nedreglerade generna är relaterade till celldelning (Fig. 2k). Vi identifierade vidare att 77% av dessa delade gener också är signifikant förändrade i kalciuminducerad differentiering (kompletterande fig. S2e). Dessutom undersökte vi om NUP98 eller RAE1 knockdown var tillräcklig för att utlösa apoptos, med två olika färgämnen som är känsliga för mitokondrierpotential. Medan färgningen avskaffades i keratinocyterna med positiv kontroll behandlade med H2O2, keratinocyter med NUP98 eller RAE1 knockdown behöll färgningen liknande kontroll knockdown (tilläggsbild. 2f, g), vilket tyder på att knockdown-strategin inte utlöste apoptos. Således tyder dessa fynd på att anrikningen av NUP98 och RAE1 i progenitortillståndet är avgörande för att upprätthålla spridning och undertrycka differentiering.
NUP98 binder nära TSS:erna för nyckelregulatorer vid underhåll av stamfader
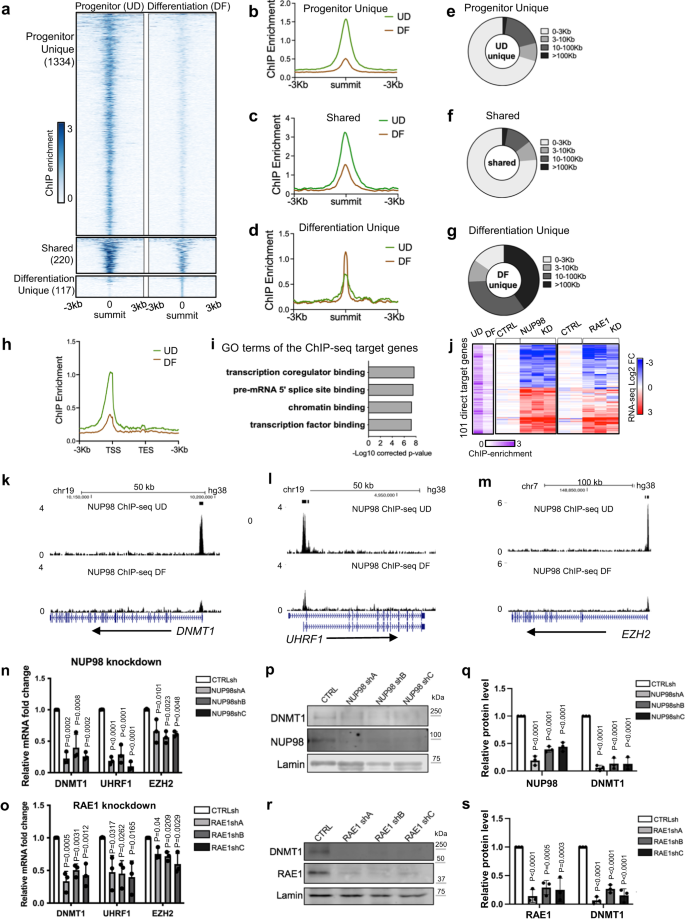
NUP98 har rapporterats binda till olika genomiska regioner i samband med olika celltyper14,24. För att undersöka hur NUP98 genomisk bindning kunde påverka genuttryck i epidermal stamfader underhåll, utförde vi NUP98 ChIP-seq i keratinocyter. I keratinocyterna i progenitortillståndet identifierade vi totalt 1554 NUP98 ChIP-toppar. I differentieringstillståndet reduceras emellertid NUP98-bindningen över alla dessa regioner. Majoriteten (86%, 1334 toppar) av dessa NUP98 ChIP-seq toppar är unika för stamfadertillståndet, men inte för differentieringstillståndet. Endast 14% av dessa toppar (220 toppar) anropades också i differentieringstillståndet, men ChIP-anrikningen i dessa regioner reduceras också i differentiering. Ett litet antal (117) NUP98 ChIP-toppar identifierades som unika för differentieringstillståndet, varav de flesta (74.3%) är belägna minst 10 kb från TSS:erna. Däremot är de flesta toppar (71%) identifierade i progenitortillståndet belägna inom 3 kb från transkriptionsstartställena (Fig. 3a–g, Kompletterande data 3). Således involverade bytet från stamfadertillståndet mot differentiering en total minskning av NUP98 genomisk bindning, särskilt nära transkriptionsstartställena (Fig. 3h).
a-d Toppmötescentrerade värmekartor och medeldiagram som jämför NUP98 ChIP-anrikning mellan stamfadertillståndet (UD) och differentieringstillståndet (DF). e-g Cirkeldiagram som visar fördelningen av NUP98 ChIP-seq-topparna, baserat på deras avstånd till närmaste Transcriptional Start Sites (TSS). h Genomsnittligt diagram som jämför NUP98 ChIP-seq-anrikning nära transkriptionsstart- och slutställena för målgenerna. i Top Gene Ontology (GO) termer för de närmaste generna associerade med NUP98 ChIP-seq toppar. j Värmekarta som visar de 101 generna, med NUP98 ChIP-seq anrikning och förändras avsevärt med NUP98 knockdown. Relativ NUP98 ChIP-anrikning i UD och DF associerade med dessa gen, och deras relativa uttryck med NUP98 eller RAE1 knockdown, ingår för var och en av dessa gener sida vid sida. k-m Webbläsare spårar exempel på NUP98 ChIP-seq-anrikning, jämför UD vs. DF. n, o qRT-PCR-validering av representativa målgener med NUP98 eller RAE1 knockdown (envägs ANOVA med post-hoc test, N = 3 biologiska replikat, data representeras som medelvärde ± standardavvikelse). p-s Western blot och kvantifiering som jämför DNMT1 proteinnivåer med NUP98 eller RAE1 knockdown, med Lamin som används som laddningskontroll (envägs ANOVA med post-hoc test, N = 3, kvantifieringsdata representeras som medelvärde ± standardavvikelse).
Vi kommenterade därefter dessa gener, som är associerade med NUP98 ChIP-seq-bindningstoppar i progenitortillståndet. De bästa GO-termerna är relaterade till bindning av transkriptionskoregulator, kromatinbindning och transkriptionsfaktorbindning (Fig. 3i), vilket tyder på att dessa gener kan vara uppströmsregulatorer av viktiga biologiska processer. Skärningen av ChIP-seq-målen med NUP98 RNA-seq-data identifierade totalt 101 direkta målgener. Majoriteten av dessa 101 direkta målgener visar också liknande uppreglering eller nedreglering med RAE1 knockdown (Fig. 3j). Intressant nog inkluderar de nedreglerade Direct Target-generna nyckelregulatorer för underhåll av epidermal stamfader, inklusive DNA-metyltransferaset DNMT1 och dess rekryterare URHF16, polykamgruppsproteinet EZH23 (Fikon. 3k–o), förutom DNA-replikationsregulatorerna CDT1 och RRM2. Dessa direkta målgener inkluderar också uppreglerade gener som DUSP10 och JARID2, som är mindre väl karakteriserade i samband med keratinocytdifferentiering (tilläggsdata 4).
För att avgöra om RAE1 binder till kromatin tillsammans med NUP98, genererade vi en HA-märkt RAE1-konstruktion och uttryckte den i keratinocyter, eftersom de kommersiellt tillgängliga antikropparna vi screenade inte gav högkvalitativa ChIP-seq-data. HA-RAE1 co-immunoutfälld NUP98 i keratinocyterna i progenitor-tillståndet (kompletterande fig. 3a), vilket bekräftar att HA-taggen inte stör RAE1:s association med NUP98. Med hjälp av dubbeltvärbindande ChIP-seq, identifierade vi att RAE1 är berikad i 83% av NUP98 ChIP-seq-toppregionerna. De NUP98-RAE1-överlappande ChIP-seq-topparna, men inte de unika NUP98-topparna, är övervägande belägna nära TSS:erna (tilläggsbild. 3b–f). Bland de 101 direkta målgenerna av NUP98 är 96 av dessa gener också associerade med RAE1 ChIP-seq anrikning, inklusive DNMT1 och EZH2 (kompletterande Fig. 3g–i). Dessa fynd tyder på att NUP98 och RAE1 binder direkt nära TSS för att reglera genuttryck.
DNMT1 har tidigare karaktäriserats som en nyckelregulator för underhåll av human epidermal stamfader6. Vi bekräftade den drastiska nedregleringen av DNMT1 i keratinocytdifferentiering med hjälp av western blotting (kompletterande fig. 4a, b). Utnyttja de publicerade transkriptomprofileringsdata från DNMT1 knockdown i progenitor-state keratinocyter6jämförde vi de differentiellt uttryckta generna vid DNMT1 knockdown med de differentiellt uttryckta generna vid NUP98 eller RAE1 knockdown. Skärningspunkten mellan dessa datamängder identifierade totalt 236 delade gener (kompletterande fig. 4c, d). De översta GO-termerna för de uppreglerade delade generna är associerade med epidermal utveckling och keratinocytdifferentiering; de nedreglerade generna är relaterade till celldelning och DNA-replikation (kompletterande fig. 4e, f). Vi validerade vidare med hjälp av western blotting att DNMT1-proteinnivåerna minskas drastiskt med NUP98 eller RAE1 knockdown, i keratinocyter odlade i stamfaderns tillstånd (Fig. 3p–s). Således står DNMT1-nedreglering åtminstone delvis för differentieringsinduktionen och proliferationshämningen som observerats med NUP98 eller RAE1 knockdown. Sammantaget tyder dessa data på att kromatinbindningen av NUP98 och RAE1 är involverad i stamfaderunderhåll, genom att direkt kontrollera uttrycket av nyckelproliferation/differentieringsregulatorer som DNMT1.
NUP98 samlokaliserar med HDAC1 på kromatin och samarbetar med HDAC i genreglering
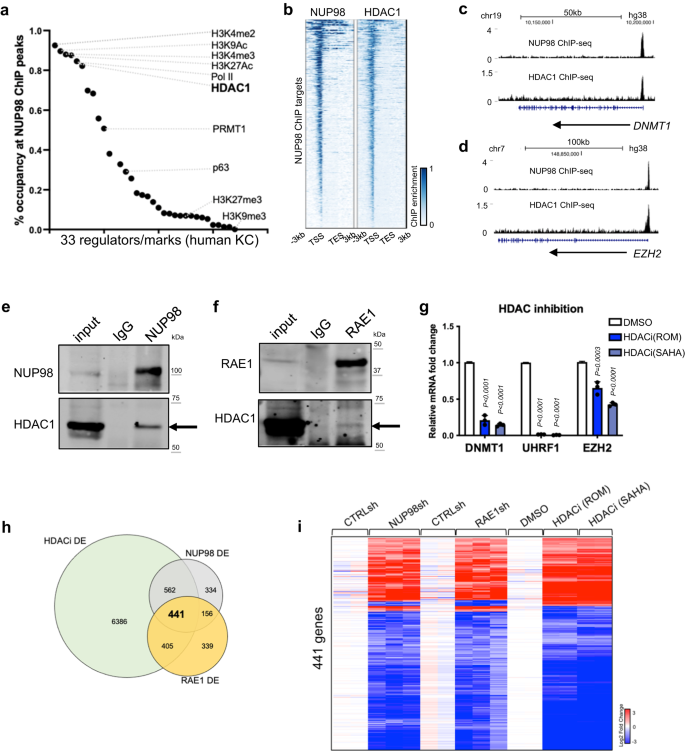
Med tanke på NUP98:s kromatinbindning till gener som kodar för nyckelregulatorer för proliferation/differentieringsprocessen, undersökte vi potentiella mekanismer som underlättar NUP98:s kromatinbindning till dessa specifika genomiska regioner. Motivsökning avslöjade inte specifika transkriptionsfaktorer som kan förklara majoriteten av de genomiska bindningsställena. Vi jämförde sedan NUP98 ChIP-seq-toppar med ChIP-seq-toppfilerna för andra transkriptionella regulatorer och histonmärken genererade med samma celltyp av primära humana keratinocyter (Fig. 4a, Kompletterande data 5). I överensstämmelse med NUP98s bindning nära transkriptionsstartställena är NUP98 ChIP-seq-toppregioner kraftigt (>80%) samockuperade av histonmärkena (H3K4me2/3, H3K27Ac, H3K9Ac) och Pol II. Intressant nog samupptar HDAC1 också 82% av alla NUP98 ChIP-seq-toppar, jämförbart med Pol II (85%) och mycket högre än den härstamningsspecifika transkriptionsfaktorn p63 (29%). I likhet med NUP98 binder HDAC1 också nära TSS:erna för NUP98-målgenerna, såsom DNMT1 och EZH2 (Fig. 4b–d). Således stod HDAC1 ut som en kandidat som kunde samarbeta med NUP98 i kromatinbindning och genreglering.
a Beläggning av andra epigenetiska märken eller regulatorer i NUP98 ChIP-seq toppregioner. b Värmekarta som jämför NUP98 ChIP-seq och HDAC1 ChIP-seq på NUP98-toppar. c, d Webbläsarspår som visar sambeläggning av NUP98 och HDAC1 på representativa målgener. e, f Tvärbindande co-immunoutfällning med NUP98 eller RAE1 antikropp för att detektera HDAC1. g qRT-PCR som visar det relativa uttrycket av RAE1-NUP98 målgener med HDAC-hämning (envägs ANOVA med post-hoc-test, N = 3, data representeras som medelvärde ± standardavvikelse). hVenn-diagram som visar överlappningen av NUP98, RAE1 och HDACi differentiellt uttryckta gener. i Värmekarta som visar uttrycket av de differentiellt uttryckta generna som delas mellan NUP98 knockdown, RAE1 knockdown och HDAC-hämning.
Denna omfattande överlappning av NUP98 och HDAC1 ChIP-seq toppar antydde att dessa två proteiner fysiskt kunde associera med varandra. Vi bekräftade detta med hjälp av tvärbindande immunoutfällning, att NUP98- eller RAE1-antikroppen samimmunoprecipiterade HDAC1 i keratinocytlysat (Fig. 4e, f). För att avgöra om HDAC påverkar genuttryck liknande NUP98 och RAE1, utnyttjade vi HDAC-hämmarna Romidepsin (ROM) och SAHA. När de tillsattes till keratinocyter odlade i progenitortillståndet nedreglerade dessa hämmare konsekvent representativa NUP98 direkta målgener, såsom DNMT1, UHRF1 och EZH2 (Fig. 4g). Med hjälp av RNA-seq identifierade vi vidare att 74% av NUP98-RAE1 målgener också signifikant förändras av HDAC-hämning (Fig. 4h, jag, Kompletterande data 6). Eftersom p300 också identifierades som ett interagerande protein med NUP98-fusionsproteiner i hematopoetiska maligniteter25, fann vi att p300-hämning inte drastiskt förändrade NUP98:s målgenuttryck i keratinocyter (kompletterande Fig. 5a), vilket stöder att den HDAC är specifikt involverad i modulering av målgenerna som kontrolleras av NUP98 och RAE1 vid underhåll av epidermal stamfader.
Byggande på genuttrycksförändringarna av NUP98 och RAE1:s målgener inducerade av HDAC-hämning, undersökte vi ytterligare rollerna för HDAC1. Vi designade och validerade totalt 3 oberoende shRNAs inriktade på HDAC1. Intressant nog nedreglerade alla tre av dessa shRNA konsekvent målgenerna för NUP98 och RAE1, såsom DNMT1 och UHRF1 (Kompletterande Fig. 5b). Således är HDAC1 involverad i att reglera NUP98 och RAE1:s målgenuttryck i stamfadertillståndet. I keratinocytdifferentieringsprocessen är HDAC1:s proteinnivå något reducerad, med ett genomsnitt på 54% relativt uttryck på differentieringsdag 4 jämfört med progenitortillståndet (kompletterande fig. 5c). Konsekvent reducerades HDAC1 ChIP-anrikningen endast måttligt i differentieringstillståndet (tilläggsbild. 5d). Vi jämförde vidare HDAC1 ChIP-seq-anrikning i NUP98-bindningsställen mellan progenitortillståndet kontra differentieringstillståndet (dag 4, kompletterande fig. 5e–h). Majoriteten (92.1%) av dessa ställen visade inte drastisk minskning av HDAC1-bindning vid differentiering. Endast i en mycket liten del (7.7 %) av dessa ställen visade HDAC1-anrikning signifikant minskning (faldig förändring >2, p < 0.05). Således reducerades HDAC1 ChIP-anrikning endast måttligt i differentiering i NUP98-bindningsställena, i motsats till den drastiska minskningen av NUP98 på dessa ställen i differentiering, vilket tyder på att NUP98 inte krävs för att bibehålla HDAC1:s kromatinbindning i deras delade bindningsställen.
NUP98-kromatinbindning är beroende av HDAC-aktivitet
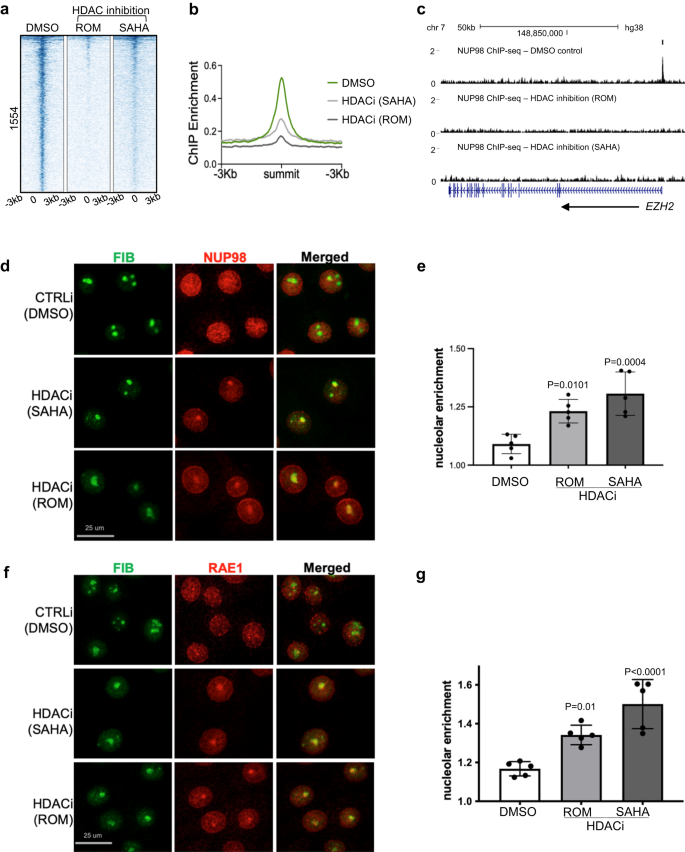
Med tanke på överlappningen mellan NUP98 och HDAC1 i genomiska bindningsställen och i genreglering, frågade vi om HDAC-aktivitet fungerar uppströms för att påverka NUP98 genomisk bindning. Vi utförde NUP98 ChIP-seq i keratinocyter med eller utan HDAC-hämning. Anmärkningsvärt var att NUP98 ChIP-seq-signalerna minskade med HDAC-inhibering med användning av antingen SAHA eller Romidepsin (Fig. 5a-c), vilket tyder på att NUP98:s genomiska bindning till dess målgener är beroende av HDAC-aktivitet.
a Värmekarta som visar NUP98 ChIP-anrikning med HDAC-hämning (med ROM eller SAHA) jämfört med DMSO-kontroll. b Genomsnittlig profil som visar NUP98 ChIP-anrikning med HDAC-hämning (med ROM eller SAHA) jämfört med DMSO-kontroll. c Webbläsarspår som visar en representativ målgen EZH2, jämför NUP98 ChIP-anrikning med HDAC-hämning kontra DMSO-kontrollen, i keratinocyter odlade i stamfadertillståndet. d Representativa bilder som visar keratinocyter sam-immunfärgade med antikroppar riktade mot NUP98 och nukleolusmarkören Fibrillarin (FIB), som jämför HDAC-hämning kontra DMSO-kontroll (skalbar = 25 μm). e Kvantifiering av den relativa NUP98-anrikningen i kärnan i HDAC-hämning kontra DMSO-kontrollen (envägs ANOVA med post-hoc-test, N = 5, data representeras som medelvärde ± standardavvikelse). f, g Samimmunfärgning av RAE1 och FIB i keratinocyter behandlade med HDAC-hämmare kontra DMSO-kontrollen (skalastapel = 25 μm), och kvantifiering (envägs ANOVA med post-hoc-test, N = 5, kvantifieringsdata representeras som medelvärde ± standard avvikelse).
För att bestämma om NUP98s subcellulära lokalisering också påverkades av HDAC-hämning, utförde vi NUP98-immunfluorescensfärgning i keratinocyter med HDAC-hämning jämfört med DMSO-kontroll. Medan NUP98 visade diffus färgning inuti kärnan i kontrolltillståndet, utöver dess nukleära periferiberikning, resulterade HDAC-hämning av SAHA eller Romidespin konsekvent i 1–2 aggregerade foci av NUP98 i varje kärna. Samfärgning med nukleolusmarkören fibrillin bekräftade att NUP98 lokaliserades till nukleolen (Fig. 5d, e). I likhet med NUP98 aggregerade RAE1 också till kärnan vid HDAC-inhibering (Fig. 5f, g).
En färsk artikel beskrev FUS-inriktning mot kärnan under transkriptionsstress26. Vi frågade om FUS är involverad i NUP98 och RAE1:s nukleolusanrikning. Samimmunofluorescensfärgning utfördes för både NUP98 och FUS med HDAC-inhibering, jämfört med kontrollen. Medan NUP98 konsekvent berikades i kärnan med HDAC-hämning, upptäcktes ingen FUS-anrikning (kompletterande Fig. 6). Dessa data tyder på att NUP98 och RAE1:s nukleolära inriktning är oberoende av de mekanismer som är involverade i att rikta FUS till nukleolen.
NUP98 och RAE1:s nukleolära lokalisering balanseras av HDAC- och HAT-aktiviteter
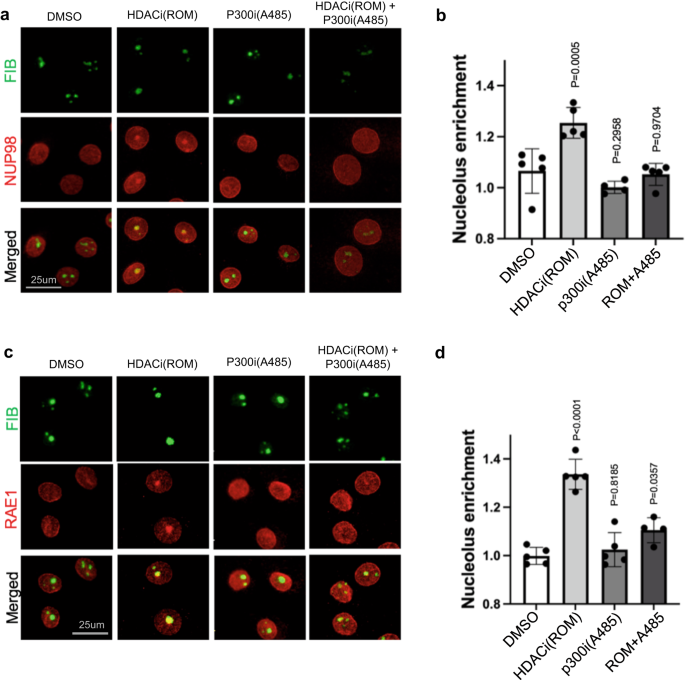
Den nukleolära anrikningen av NUP98 och RAE1, inducerad av HDAC-hämning, tyder på att proteinacetylering kan vara involverad i denna process. För att testa detta designade vi ett experiment för att hämma proteinacetylering i kombination med HDAC-hämning, genom att utnyttja p300/CBP HAT-hämmarna A485 och C64627,28. Som visas i fig. 6 och tilläggsbild. 7, HAT-inhibering ensam förändrade inte signifikant den subnukleära lokaliseringen av NUP98 eller RAE1; men när keratinocyterna förbehandlades med HAT-hämmare i 6 timmar kunde HDAC-inhibering inte längre inducera NUP98 eller RAE1:s nukleolära lokalisering. Denna antagonism mellan HAT-hämning och HDAC-hämning observerades konsekvent bland de två oberoende p300/CBP-hämmarna (A485 eller C646). Dessa data stödjer en roll av proteinacetylering i att mediera den nukleolära lokaliseringen av NUP98 eller RAE1, som en konsekvens av HDAC-hämning.
a Samimmunfärgning av NUP98 och nukleolusmarkör FIB i keratinocyter behandlade med HDAC-hämmare, ROM och/eller HAT-hämmaren A485 (skalbar = 25 μm). b kvantifiering av NUP98 nukleolusanrikning i dessa behandlingsförhållanden (envägs ANOVA med post-hoc test, N = 5, data representeras som medelvärde ± standardavvikelse). c Samimmunfärgning av RAE1 och nukleolusmarkören FIB i keratinocyter behandlade med HDAC-hämmare, ROM och/eller HAT-hämmaren A485 (skalbar = 25 μm). d kvantifiering av RAE1 nukleolusanrikning bland dessa tillstånd (envägs ANOVA med post-hoc test, N = 5, data representeras som medelvärde ± standardavvikelse).
Inbördes beroende mellan NUP98 och RAE1 i nukleolär lokalisering vid HDAC-hämning
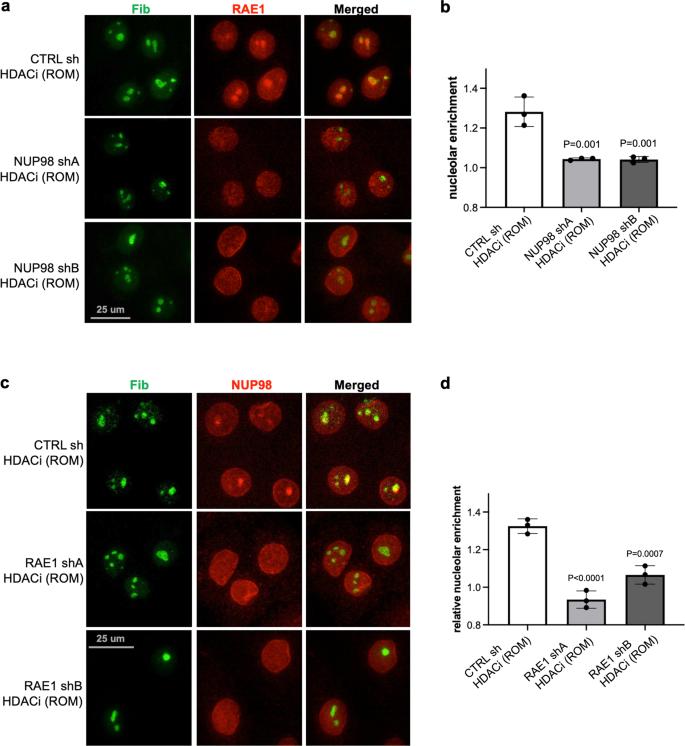
Med tanke på sambandet mellan NUP98 och RAE1 frågade vi vidare om NUP98s nukleolära inriktning på HDAC-hämning beror på RAE1. Medan keratinocyter som uttrycker kontroll-icke-målinriktad shRNA fortfarande visade NUP98-aggregation med HDAC-hämning, avskaffades denna nukleolära aggregation i keratinocyter som uttrycker shRNA som riktar sig mot RAE1 (Fig. 7a, b). Den nukleolära anrikningen av NUP98 kräver således den intakta funktionen av RAE1. Vi undersökte därefter om RAE1:s nukleolära inriktning på HDAC-hämning också berodde på NUP98. Vi behandlade keratinocyter som uttryckte antingen NUP98 shA, NUP98 shB eller kontroll icke-målinriktad shRNA med HDAC-hämmaren ROM. RAE1:s nukleolära inriktning avskaffades i keratinocyter som uttrycker NUP98 shRNA, men inte den icke-inriktade kontrollen. Genom att använda två oberoende shRNA som riktade sig till NUP98, riktade RAE1 inte heller mot kärnan (Fig. 7c, d). RAE1 knockdown ensam inducerade inte NUP98 nukleolär lokalisering, och NUP98 knockdown inducerade inte RAE1 nukleolär lokalisering, utan HDAC-hämning (kompletterande Fig. 8). Dessa fynd indikerar att NUP98 och RAE1 är beroende av varandra för att lokalisera till kärnan vid HDAC-hämning.
a, b Representativa bilder som visar samimmunfärgning av RAE1 och nukleolusmarkören FIB i keratinocyter behandlade med NUP98 knockdown kontra kontroll knockdown (skala bar = 25 μm), och kvantifieringar av RAE1 nukleolär anrikning bland dessa tillstånd (envägs ANOVA med post-hoc test, N = 3, kvantifieringsdata representeras som medelvärde ± standardavvikelse). c, d Samimmunfärgning av NUP98 och nukleolusmarkören FIB i keratinocyter behandlade med RAE1 knockdown kontra kontroll knockdown (skalastapel = 25 μm), och kvantifieringar av NUP98 nukleolär anrikning bland dessa tillstånd (envägs ANOVA med post-hoc test, N = 3 , representeras kvantifieringsdata som medelvärde ± standardavvikelse).
Sammantaget antyder dessa fynd en modell som NUP98 och RAE1 främjar progenitorunderhåll genom att direkt binda till och kontrollera uttrycket av viktiga epigenetiska regulatorer under två förhållanden: förhöjt uttryck och HDAC-aktivitet. Det förhöjda uttrycket i progenitortillståndet tillåter närvaron av en löslig intranukleär pool av NUP98 och RAE1, vilket tillåter kromatinbindning förutom deras nukleära porförening; HDAC-aktivitet är också väsentlig för att motverka den nukleolära inriktningen för NUP98 och RAE1, främja NUP98 genomisk inriktning till de epigenetiska nyckelregulatorerna för självförnyelse (Fig. 8).
NUP98 och RAE1 stödjer underhåll av epidermal stamfader genom bindning till kromatin nära transkriptionsstartställena för nyckelmålgener som den epigenetiska repressorn DNMT1. NUP98 och RAE1:s roller i progenitorunderhåll beror på två faktorer: högt uttryck och HDAC-aktivitet. Det höga uttrycket av NUP98 och RAE1 ger den kromatinbindande poolen, förutom deras kärnpor-inkorporering; HDAC-aktivitet stöder NUP98s bindning på kromatin nära TSS:erna för nyckelmålgener, vilket motverkar den nukleolära lokaliseringen av NUP98 och RAE1.
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Fordon / elbilar, Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- BlockOffsets. Modernisera miljökompensation ägande. Tillgång här.
- Källa: https://www.nature.com/articles/s42003-023-05043-2