Kära redaktör,
Fladdermössens unika biologiska egenskaper, inklusive livslängd, antivirala egenskaper, viloläge och ekolokalisering, har fått stor uppmärksamhet från det vetenskapliga samfundet. För att förbättra användningen av fladdermöss i biologiska experiment, har forskare gjort ansträngningar för att generera inducerade pluripotenta stamceller (iPSC) från fladdermusfibroblaster1,2. Det är dock fortfarande osäkert om transgenfria iPSCs kan differentiera in vivo, vilket indikerar en hög grad av stamcellskvalitet och avsevärt utökar deras potential för olika tillämpningar.
För att generera transgenfria iPSCs, fladdermusembryonala fibroblaster (BEFs) från Myotis Lucifugus transfekterades med en uppsättning av 8 omprogrammeringsfaktorer (OCT4, SOX2, cMYC, KLF4, NANOG, LIN28, NR5A2Och en miR302/367 kluster) i 3i/LIF-mediet som innehåller små molekylhämmare (PD0325901, CHIR99021 och A8301) (Fig. 1a, b). Efter positivt (neomycin) och negativt (tymidinkinas) urval av iPSCs, valdes monoklonala celler ut för detektion av exogena faktorer. Vi använde 20 uppsättningar av primerpar för att amplifiera sekvensen av plasmiden3. Resultaten visade att två transgenfria iPSC-kloner erhölls (Fig. 1c).
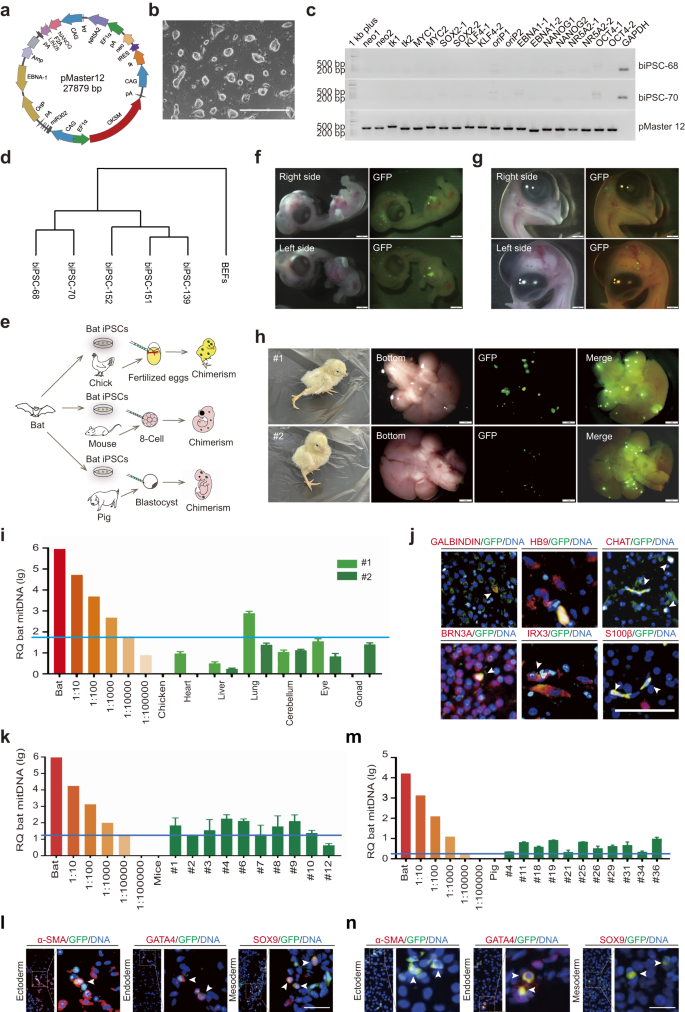
a Schematiskt diagram av den inducerbara vektorn, pMaster12, som kodar för 8 omprogrammeringsfaktorer med positiva/negativa selektionsgener. b Bild av biPSCs; skalstång, 1000 µm. c PCR-analys bekräftade frånvaron av pMaster12-vektorsekvenser i biPSC-68 och biPSC-70. GAPDH användes som den interna referensgenen, och renat pMaster12 DNA tjänade som den positiva kontrollen. d Dendrogramklustring av genuttrycksprofiler: BEF, transgen och transgenfria biPSCs. e Illustrativ modell: transgenfria biPSCs genererar interspecies chimärer (mus, gris, kyckling) in vivo. f Representativa bilder av D6.5 fladdermus/kyckling chimära embryon med GFP-fluorescens i huvudet / bröstet. Skalstänger, 1 mm. g Representativa bilder av D9.5 fladdermus/kyckling chimära embryon som visar GFP-fluorescens i huvudet. Skalstänger, 1 mm. h Representativa bilder av interspecies fladdermus/kyckling levande chimärer vid 3 d efter födseln, som visar GFP-fluorescens i huvudet. Skalstänger, 1 mm. i Kvantitativ genomisk PCR-analys av fladdermus mtDNA i chimära neonatala kycklingar (#1 och #2). Utspädningar av fladdermus-kycklingceller användes för analysen. Den blå linjen representerar fladdermus-mtDNA-detekteringsnivån (1 fladdermuscell per 10,000 XNUMX kycklingceller). j Representativa IF-färgningsbilder av huvudet på fladdermus/kyckling-chimär #2, som visar positiv färgning för neurala markörer (GALBINDIN, HB9, CHAT, BRN3A, IRX3, S100β). Vita pilar indikerar celler som är positiva för både GFP och neurala markörer. Skalstänger, 50 μm. k Kvantitativ genomisk PCR-analys av fladdermus-mtDNA i vävnader av E8.5 chimära musembryon med användning av fladdermus-muscellspädningar. Den blå linjen representerar fladdermus-mtDNA-detekteringsnivån (1 fladdermuscell per 10,000 XNUMX musceller). l Representativa IF-färgningsbilder som visar integration av GFP-uttryckande biPSCs i musgroddlager. Vita pilar indikerar celler som är positiva för både GFP och linjemarkörer (α-SMA, GATA4, SOX9). Skalstång, 50 µm. m Kvantitativ genomisk PCR-analys av fladdermus-mtDNA i E25 chimära svinembryon med användning av fladdermus-griscellsspädningar. Den blå linjen representerar fladdermus-mtDNA-detekteringsnivån (1 fladdermuscell per 10,000 XNUMX grisceller). n Representativa IF-färgningsbilder som visar integration av GFP-uttryckande biPSCs i grisgroddslager. Vita pilar indikerar celler dubbelt positiva för GFP och härstamningsmarkörer (α-SMA, GATA4, SOX9). Skalstång, 50 µm.
Våra fladdermus iPSCs (biPSCs) uttryckte pluripotensmarkörer både på RNA- och proteinnivåer (kompletterande bild. Sla, b). För att bekräfta pluripotensen transfekterade vi biPSCs med hOCT4-GFP och cellerna visade ljust GFP-uttryck (kompletterande Fig. S1C), vilket indikerar upprätthållandet av pluripotens i biPSCs. biPSC:erna uppvisade positiv alkalisk fosfatas (AP)-färgning och bibehöll en normal karyotyp (42 + XY) efter 37 passager (kompletterande fig. S1d, t.ex). De kunde odlas på Matrigel under matningsfria förhållanden (tilläggsbild. S2a–c). In vitro kan biPSCs bilda embryoidkroppar och sedan differentiera sig till tre embryonala groddlager (kompletterande fig. Sla, b). RNA-sekvenseringsanalys avslöjade distinkt klustring av genuttryck mellan biPSCs och BEFs (Fig. 1d), med högt uttryck av pluripotensgener i biPSCs (kompletterande Fig. S3C). Dessa resultat tyder på att biPSCs är transgenfria och pluripotenta.
För att bedöma chimerismen och utvecklingskapaciteten hos biPSCs, märkte vi biPSCs med GFP/tdTomato (kompletterande Fig. S4a–d) för cellspårning. Kycklingembryon valdes ut som en plattform för heterologa cellchimerismstudier på grund av den lätta manipulationen. Vi injicerade 5 × 105 GFP-märkta biPSCs i blodkärl från befruktade kycklingembryon 52 timmar efter kläckning (Fig. 1e). På dag 6.5 (D6.5) observerades signifikant grön fluorescens i huvudet och bröstet på de chimära kycklingembryona (fig. 1f), bekräftad av GFP-färgning på paraffinsnitt (kompletterande fig. Sla). Samfärgning av chimära kycklingembryosektioner med GFP och groddlagermarkörer bekräftade integrationen av differentierade biPSCs i alla tre groddlager (kompletterande fig. S5b). Genom D9.5 var grön fluorescens begränsad till huvudet på chimära kycklingar (Fig. 1g).
Två levande chimära kycklingar erhölls efter inkubation och signifikant GFP-fluorescens observerades i deras hjärnor (Fig. 1h). För att bestämma de chimära proportionerna i andra organ genomförde vi mitokondriell DNA (mtDNA) analys. Våra resultat indikerade en varierande grad av chimerism i olika vävnader, från 1/100,000 1 till 1000/1. Vi upptäckte integrationen av gröna celler i gonader hos de chimära kycklingarna, där en kyckling inte visade någon chimerism och den andra uppvisade mindre än 10,000/XNUMX XNUMX chimerism (Fig. 1i). Dessutom visade immunfluorescens (IF) färgning för hjärnparaffinsektioner (#2) differentiering av biPSCs till olika neuronala celltyper (Fig. 1j). Dessa fynd tyder på att biPSCs kan differentiera till funktionella neuronala celler i den chimära kycklingmodellen.
För att undersöka den chimärbildande potentialen för biPSCs i två olika däggdjursmodeller, möss och grisar, introducerade vi först 10 GFP-märkta biPSCs i musembryon i 8–16-cellsstadiet. Bland dem uppvisade 98.09% av injicerade embryon signifikant GFP-fluorescens, med ett genomsnitt på 17.78 ± 0.95 biPSCs per blastocyst (kompletterande bild. S6a–c). biPSCs integrerade i den inre cellmassan (ICM) av chimära blastocyster, med ett genomsnitt på 2.93 ± 0.37 celler per ICM (kompletterande bild. S6d, t.ex). Vi utvärderade också integrationen av biPSCs i mus-trophectoderm, och avslöjade deras bidrag både till ICM och trophectoderm (kompletterande Fig. Sla). Speciellt uppvisade individuella biPSC: er robust proliferation inom musembryon, med 31.25% av de chimära embryona som uppvisade enkelcellsproliferation (kompletterande fig. S7b och tabell S1). Dessutom resulterade saminjektion av tdTomato-märkta biPSCs och GFP-märkta musembryonala stamceller (mESCs) i rumslig överlappning av röda och gröna fluorescenssignaler (kompletterande Fig. S7C), vilket tyder på delad utvecklingspotential mellan biPSCs och mESCs inom den embryonala mikromiljön.
Därefter bedömde vi den chimära potentialen för biPSCs i post-implantationsmusembryon (Fig. 1e). Vi implanterade 553 chimära blastocyster härledda från GFP-märkta biPSCs i 33 surrogatmöss. Framgångsrika graviditeter inträffade och chimära embryon samlades in vid embryonal dag 8.5 (E8.5). Chimerism bekräftades med hjälp av genomisk PCR med fladdermusspecifika primrar (kompletterande Fig. Sla), och mtDNA-analys avslöjade höga andelar chimerism hos 8 av 10 foster, där 3 översteg 1/1000 (Fig. 1k). IF-analys vid E10.5 visade signifikant GFP-uttryck i chimära prover (kompletterande fig. S8b), med samuttryck av GFP och härstamningsmarkörer som indikerar differentiering av biPSCs i alla tre groddskikten i de chimära musembryona (Fig. 1l). Våra fynd visar den anmärkningsvärda chimära potentialen hos biPSCs i tidiga musembryon, även om denna potential kan minska när musutvecklingen fortskrider, och därför uppnår vi inte neonatala interspecifika chimärer.
Vi undersökte sedan den chimära potentialen för biPSCs i svinembryon. GFP-märkta biPSCs injicerades i E5 porcina partenogena embryon. Bland de injicerade embryona uppvisade 92.79% GFP-fluorescens, med ett genomsnitt på 14.14 ± 1.14 biPSCs per blastocyst (kompletterande Fig. S9a–c). IF-färgning visade bidraget från biPSCs till ICM, med ett genomsnitt på 3.78 ± 0.31 biPSCs per ICM (kompletterande Fig. S9d, t.ex). Dessa resultat belyser livskraften och integrationsförmågan hos biPSCs i ICM för tidiga grisembryon.
Vi bedömde också den chimära potentialen för biPSCs i post-implantation svinembryon. Vi transplanterade 610 in vitro-befruktade chimära blastocyster till 4 surrogatsuggor. Alla 4 surrogaten blev gravida, vilket resulterade i totalt 39 embryon som samlades in mellan E25–E27. MtDNA-genotypning bekräftade 11 embryon som chimärer, med biPSCs chimerism som översteg 1/10,000 XNUMX (Fig. 1m). IF-färgning med GFP-antikropp på sektioner av dessa chimära embryon bekräftade ytterligare närvaron av fladdermusceller (kompletterande fig. S10). IF-färgning av härstamningsmarkörer visade differentieringen av biPSCs till alla tre embryonala groddskikten i de chimära grisembryona (Fig. 1n). Dessa fynd tyder på att biPSCs uppvisar högre chimär effektivitet i tidiga svinembryon och har förmågan att differentiera till alla tre embryonala groddskikten in vivo.
I denna studie observerade vi framgångsrik integration av biPSCs i pre-implantationsmus- och grisembryon. Chimerism som observerades i embryon efter implantation var dock begränsad, vilket kan påverkas av faktorer som evolutionärt avstånd, graviditetsperiod och cellkonkurrens. Tidigare studier har visat att rått-ESC:er och mus-iPSC:er inte kunde bidra till grisembryon, och bidraget från mänskliga PSC:er till grisembryon efter implantation var mycket begränsat4. Denna begränsning kan tillskrivas det evolutionära avståndet mellan arter5. Den evolutionära skillnaden mellan fladdermöss och möss, beräknad ha inträffat för cirka 94 och 81 miljoner år sedan (http://www.timetree.org/), kan avsevärt påverka effektiviteten av xenochimerism.
I denna studie observerades det högsta chimerismförhållandet och framgångsrik generering av levande chimära kycklingar när biPSCs injicerades i kycklingembryon. De chimära kycklingarna uppvisade differentiering av biPSCs till funktionella celler i nervsystemet, vilket gav värdefulla insikter om biPSCs utveckling och differentiering i heterologa värdar. Kycklingembryon är en väletablerad experimentell modell för xenotransplantat, som erbjuder ett bekvämt system för att studera embryonal utveckling och differentiering6. Kycklingembryot tillhandahåller ett effektivt utvärderingssystem för xenocellers utvecklingspotential in vivo, eftersom tidigare studier har visat pluripotensen hos mänskliga PSC i kycklingembryon7. Den ökade effektiviteten hos fladdermus/kyckling-chimärer kan bero på initialt högre antal injicerade celler och det icke fullt utvecklade immunsystemet i kycklingembryon8, vilket resulterade i minskad exogen cellavstötning. Begränsad gonadal chimerism berodde på injektionen i ett mer avancerat utvecklingsstadium (HH14–HH15) jämfört med det på blastocyststadiet. Att testa olika injektionsstadier, platser och metoder i framtida studier kan förbättra resultatet av chimerism.
Sammantaget genererade vi transgenfria biPSCs genom elektroporering av episomala plasmider. Dessa biPSCs uppvisade chimär potential i tre modelldjur. Transgenfria iPSCs är av högre kvalitet, eftersom de inte har cellinjedifferentieringsbias och undviker risken för tumörbildning och död hos chimära avkommor9,10,11. De kan också differentiera till ett brett spektrum av celltyper eller organoider12 under lämpliga förhållanden. Våra biPSCs har potential att differentiera till relevanta organoider in vitro, vilket möjliggör mekanistiska undersökningar av fladdermuslivslängd, antiviralt försvar och ekolokalisering.
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Fordon / elbilar, Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- PlatoHealth. Biotech och kliniska prövningar Intelligence. Tillgång här.
- ChartPrime. Höj ditt handelsspel med ChartPrime. Tillgång här.
- BlockOffsets. Modernisera miljökompensation ägande. Tillgång här.
- Källa: https://www.nature.com/articles/s41421-023-00587-3