Vilka är de bästa frågorna om mänskliga faktorer att ställa till FDA under ett förhandsmöte, och vilket informationsinnehåll behöver du i en 510k?
[Inbäddat innehåll]
Prata med FDA innan validering av mänskliga faktorer
FDA började inte upprätthålla kravet på att tillämpa mänskliga faktorer och användbarhetsteknik på design av medicintekniska produkter förrän 2017 eftersom den slutliga versionen av vägledningsdokument för mänskliga faktorer släpptes inte förrän den 3 februari 2016. Ungefär nittio procent av testrapporterna för mänskliga faktorer som lämnats in till FDA i 510 510 inlämningar före marknaden är bristfälliga eftersom innehållet i 510 XNUMX inlämnandet endast inkluderar den slutliga summativa testrapporten. FDA behöver en komplett fil för användarvänlighet, och informationen om mänskliga faktorer måste följa FDA:s riktlinjer för formatet och innehållet i en XNUMX XNUMX inlämning före marknaden – inte bara IEC 62366-1: 2015.
Vilken information om mänskliga faktorer vill FDA ha?
Under flera år indikerade FDA-inlämning av brister att du inte skulle inkludera frekvensen av förekomsten i din uppskattning av användningsrelaterade risker, men FDA gav aldrig denna information i ett vägledningsdokument. Den 9 december 2022 släppte FDA äntligen en utkast till vägledning för mänskliga faktorer angående formatet och innehållet i en 510 2 pre-market-inlämning. Det nya utkastet till vägledning inkluderar kravet på en användningsrelaterad riskanalys (URRA) i tabell XNUMX (kopierat nedan).
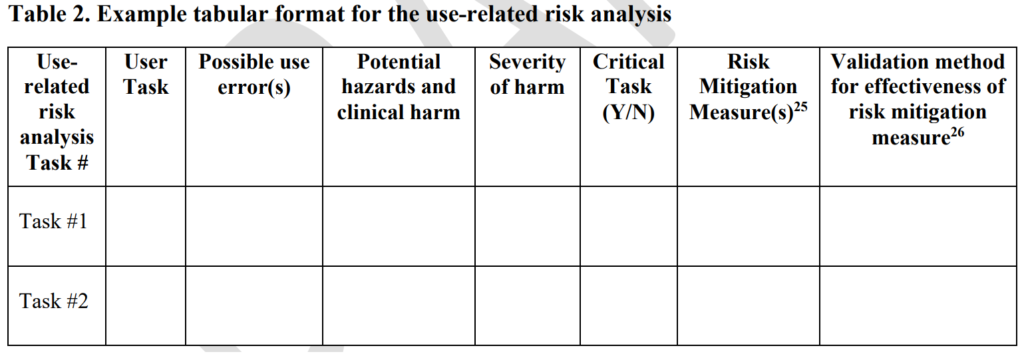
I detta nya utkast till FDA-vägledning identifierar FDA tre olika kategorier för inlämning av mänskliga faktorer. För den första kategorin behövs bara en slutsats och en sammanfattning på hög nivå. För den andra kategorin behövs också en användarspecifikation. För den tredje kategorin behöver du en omfattande teknisk rapport om mänskliga faktorer med följande delar som beskrivs i avsnitt IV i utkastet till FDA-riktlinjer:
Inlämningskategori 1, 2 och 3
- Slutsats och sammanfattning på hög nivå
Inlämningskategori 2 och 3
- Beskrivningar av avsedda enhetsanvändare, användningar, användningsmiljöer och utbildning
- Beskrivning av enhet-användargränssnittet
- Sammanfattning av kända användningsproblem
Endast inlämningskategori 3
- Sammanfattning av preliminära analyser och utvärderingar
- Användningsrelaterad riskanalys för att analysera faror och risker i samband med användningen av enheten
- Identifiering och beskrivning av kritiska uppgifter
- Detaljer om valideringstestning av den slutliga designen
Innan du spenderar tiotusentals eller hundratusentals dollar på testning av mänskliga faktorer, vill du se till att FDA håller med din testplan för mänskliga faktorer. Annars kommer du att betala för testet två gånger: en gång för din första inlämning och en andra gång i ditt svar på FDA:s begäran om ytterligare information för att åtgärda brister. Testning kan kosta mer än din elsäkerhetstestning. Anläggningen behöver ha rätt utrustning och utrymme för testningen, du behöver stödpersonal för att sätta upp utrustningen, du behöver rekrytera deltagare, du behöver kompensera deltagare och du behöver apparatprover.
När kan du ställa frågor om mänskliga faktorer till FDA?
FDA kan inte ge råd om en inlämning, och byrån kommer inte att granska data under förhandsmöten. FDA kan ge feedback om protokoll, specifikationer och vetenskapliga motiveringar. Därför bör du skicka frågor till FDA i en förinlämning när du har ett utkast till protokoll, ett utkast till specifikation eller ett utkast till motivering till varför en uppgift inte är kritisk. Förhandsinlämningar är "icke-bindande". Du kan ändra din design och inställning till mänskliga faktorer. Vänta därför inte tills din information är 100 % klar. Dela din dokumentation på utkaststadiet under utvecklingsfasen och innan din design fryser. Dessa svar behöver du när du planerar en studie och tar in offerter.
Vilka är de bästa frågorna om mänskliga faktorer att ställa i en pre-sub?
I FDA-vägledningen för möten före inlämning tillhandahåller FDA föreslagna frågor att ställa:
- Har byrån synpunkter på vår föreslagna tekniska process för mänskliga faktorer?
- Är den bifogade användningsrelaterade riskanalysplanen tillräcklig? Håller byrån med om att vi har identifierat alla kritiska uppgifter?
- Håller byrån med om vår föreslagna rekryteringsplan för testdeltagare för valideringstestning av mänskliga faktorer?
Ovanstående exempel är bara förslag, men det bästa tillvägagångssättet är att ge ett kort exempel på hur informationen om mänskliga faktorer kommer att se ut och be FDA att kommentera exemplen. FDA har inte tid att granska data under ett pre-sub-möte, men FDA kan granska några rader som extraherats från din URRA och kommentera ditt föreslagna tillvägagångssätt för processen med mänskliga faktorer.
Mänskliga faktorer frågor som inte är lämpliga
Smakämnen FDA vägledning före inlämning varnar dig för att bara ställa 3-4 frågor för varje mötesförfrågan eftersom FDA har svårt att svara på fler frågor under en 60-minuters telekonferens. Därför bör du inte ställa frågor som redan har besvarats i FDA:s vägledning. Det nya utkastet till vägledning innehåller exempel på när en enhetsändring kan dra nytta av befintlig information om mänskliga faktorer och när ny information behövs för att stödja en premarket-inlämning. Istället för att ställa en fråga som är specifik för att utnyttja befintlig information om mänskliga faktorer, ge istället din motivering för att utnyttja befintliga data och fråga om FDA har några problem med din övergripande inställning till mänskliga faktorer.
Rekommenderade åtgärder för mänskliga faktorer
Skapa en procedur för din mänskliga faktorers process som inkluderar detaljerade instruktioner för att skapa den information som krävs i en användbarhetsteknisk rapport och mallar för varje dokument.
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- Platoblockchain. Web3 Metaverse Intelligence. Kunskap förstärkt. Tillgång här.
- Källa: https://medicaldeviceacademy.com/human-factors-questions/



