ATF3 induceras snabbt och övergående under SC tidig aktivering
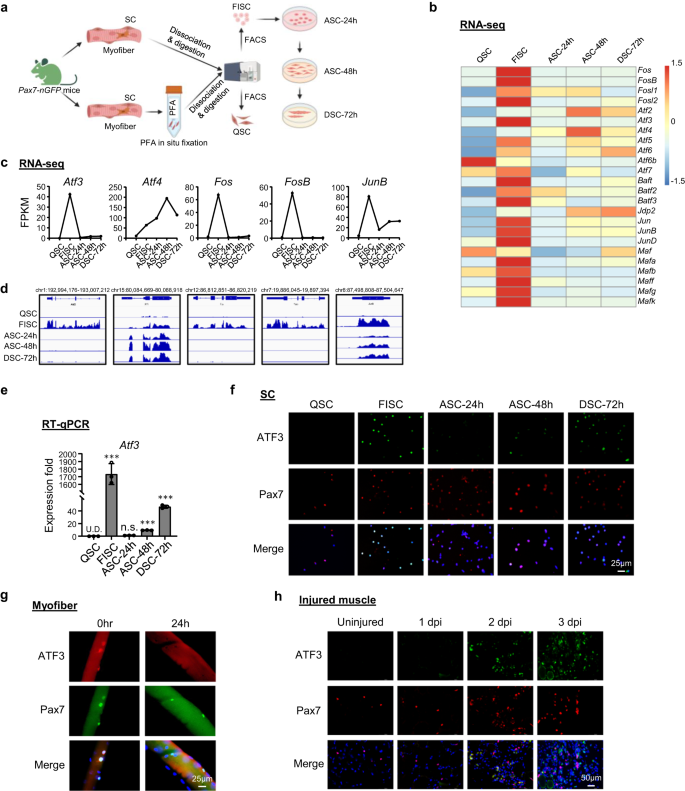
För att utforska de transkriptionella regulatoriska händelserna som styr övergången från SC-vila till aktivering, analyserade vi om våra tidigare publicerade transkriptomiska profildatauppsättningar36 förvärvade från SCs i släktlinjen. Kortfattat, muskler från Pax7-nGFP möss37 fixerades in situ av PFA innan de utsattes för standard 3 timmar lång celldissociation och isoleringsprocessen, och FACS-sortering för att erhålla QSCs13, eller utan föregående fixering för att erhålla nyligen isolerade tidigt aktiverande SC: er (FISC) (Fig. 1a och tilläggsbild. 1a); FISCs odlades in vitro under 24, 48 eller 72 timmar för att erhålla fullt aktiverade (ASC-24h), prolifererande (ASC-48h) eller differentierande (DSC-72h) celler. Överensstämmer med resultaten från andra senaste rapporter38,39,40AP-1-familjens gener inklusive Fos, Atf, Jun och Min f underfamiljer inducerades dramatiskt i FISCs jämfört med QSCs (Fig. 1b). I synnerhet, Atf3 inducerades kraftigt (42.4 gånger) i FISCs men minskades sedan snabbt vid ACS-24h (Fig. 1c, d); detta bekräftades också av RT-qPCR (Fig. 1e), vilket indikerar att det är en snabb och övergående känslig gen för tidig aktivering inducerad av isoleringen. Dessutom visade immunfluorescens (IF) färgning den samtidiga induktionen av ATF3-protein i FISC:er och en minskning av ASC:er (Fig. 1f). Även på den nyligen isolerade enkla myofibern som tros bevara den vilande nischen i viss utsträckning och minimera SC-aktivering41,42, visade de associerade SC:erna hög expressionsnivå av ATF3-protein omedelbart efter 2 timmars isolering som minskade vid 24 timmar i kultur (Fig. 1g), vilket förstärker uppfattningen att ATF3 snabbt induceras i tidiga aktiverade SCs. För att ytterligare bekräfta ATF3-induktionen in vivo injicerades BaCl2 i Tibialis Anterior (TA)-musklerna hos C57BL/6-möss för att inducera akut muskelskada. I denna skademodell36,43,44vävnadsdegenerering med rikliga immuncellinfiltrat observeras normalt 1 dag efter skada (dpi); SC: er aktiveras snabbt för att expandera som prolifererande myoblaster som sedan smälter samman för att bilda små nya myofiber som uttrycker embryonal myosin tung kedja (eMyHC) och kännetecknas av centralt lokaliserade kärnor (CLN); dessa eMyHC+-fibrer är lätta att se vid 5 dpi. Vid 7 dpi är muskeln huvudsakligen sammansatt av större regenererade myofiber med nedreglerat eMyHC-uttryck; muskelskador och inflammatoriska celler rensas till stor del vid 14 dpi medan de regenererade myofibrerna fortsätter att växa i storlek och mogna för att uppnå full regenerering runt 30 dpi. Som väntat detekterades inte ATF3-protein på oskadade TA-muskler av IF utan kunde lätt ses vid 1 dpi; viss färgning smälte inte samman med Pax7+-celler, vilket är i linje med dess rapporterade allestädes närvarande induktion i flera celler efter skada45. Vid 2 dpi ökade ATF3-uttrycket i Pax7+-celler kraftigt, samtidigt med full aktivering av SCs i detta skede (Fig. 1h). Flera andra AP-1 familjemedlemmar, Atf4, Fos, FosBoch JunB, delade en liknande dynamisk uttrycksprofil (Fig. 1b–d), vilket också bekräftades av RT-qPCR (tilläggsbild. 1b) och immunfluorescerande färgning (tilläggsbild. 1c) resultat. Sammantaget visar våra resultat att ATF3 och flera andra AP-1-familjemedlemmar snabbt och övergående induceras under tidig SC-aktivering, vilket tyder på deras potentiella roller i regleringen av SC tidig aktivering.
a Schema för isolering av vilande satellitceller (QSC) efter in situ fixering, nyligen isolerade SCs (FISC) utan föregående fixering från muskler med Tg: Pax7-nGFP möss. FISCs odlades därefter och aktiverades i 24 (ASC-24h), 48 (ASC-48h) eller 72 h (DSC-72h). RNA extraherades för RNA-Seq-analys. Skapad med BioRender.com. b Värmekartor som indikerar genuttrycksnivåer (Log2[FPKM]) för TF:er i AP-1-familjen detekterade av RNA-Seq. c, d Expressionsnivåer (FPKM) och genomiska ögonblicksbilder av Atf3, Atf4, Fos, FosB, JunB mRNA från ovanstående RNA-Sekv. e RT-qPCR-detektion av Atf3 i ovanstående celler. n = 3 möss per grupp. p = 0.000025, 0.12, 0.0000011 och 0.0000052. f Immunofluorescens (IF) färgning av ATF3 och Pax7 proteiner på ovanstående celler. Skalstång: 50 μm. g IF-färgning av ATF3- och Pax7-proteiner på enstaka myofiber från EDL-muskler omedelbart efter isolering eller odlade i 24 timmar. Skalstång: 25 μm. h IF-färgning av ATF3- och Pax7-protein på TA-muskelsnitt från oskadade möss eller 1, 2 och 3 dpi. Skalstång: 50 μm. Alla stapeldiagram presenteras som medelvärde ± SD. Students t test (tvåsidigt oparat) användes för att beräkna den statistiska signifikansen (e): *p < 0.05, **p < 0.01, ***p < 0.001. har ingen betydelse. Källdata tillhandahålls som en källdatafil.
Kortsiktigt Atf3 deletion påskyndar akut skadeinducerad muskelregenerering
För att underlätta dissektion av ATF3-funktion i SCs, korsade vi Atf3Flox allel46, i vilka två LoxP-ställen infogades på Atf3 exon2, med PAX7CreERT2/CreERT2-R26RYFP/YFP mus43 att generera kontroll (Ctrl) (Atf3+ / +– Pax7CreERT2/CreERT2-R26RYFP/YFP) och inducerbara knockoutmöss av Atf3 (Atf3 iKO) (Atf3 Flox/Flox– Pax7CreERT2/CreERT2-R26RYFP/YFP) (Kompletterande bild. 2a). Efter på varandra följande 5 dagars intraperitoneal (IP) injektion av Tamoxifen (TMX) (Fig. 2a), bekräftades framgångsrik radering av ATF3 i FISCs av WB (kompletterande Fig. 2b) eller IF (tilläggsbild. 2c); dess utarmning bekräftades ytterligare av IF-färgning av SCs på enstaka myofiber (kompletterande Fig. 2d). Morfologiskt visade den 2 månader gamla iKO ingen uppenbar skillnad från Ctrl-kullmössen; inga förändringar i kroppsstorlek och vikt upptäcktes heller (tilläggsbild. 2e).
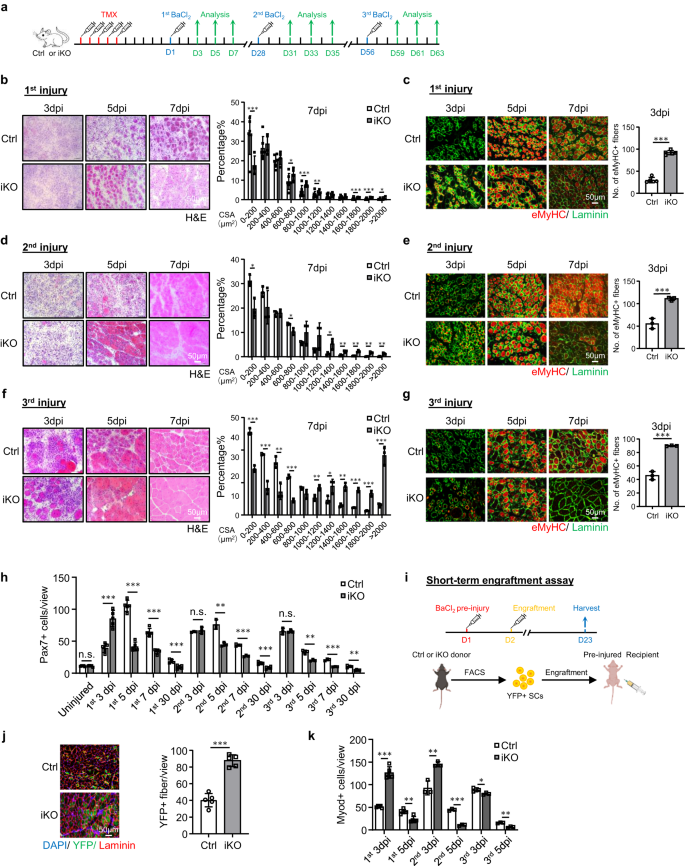
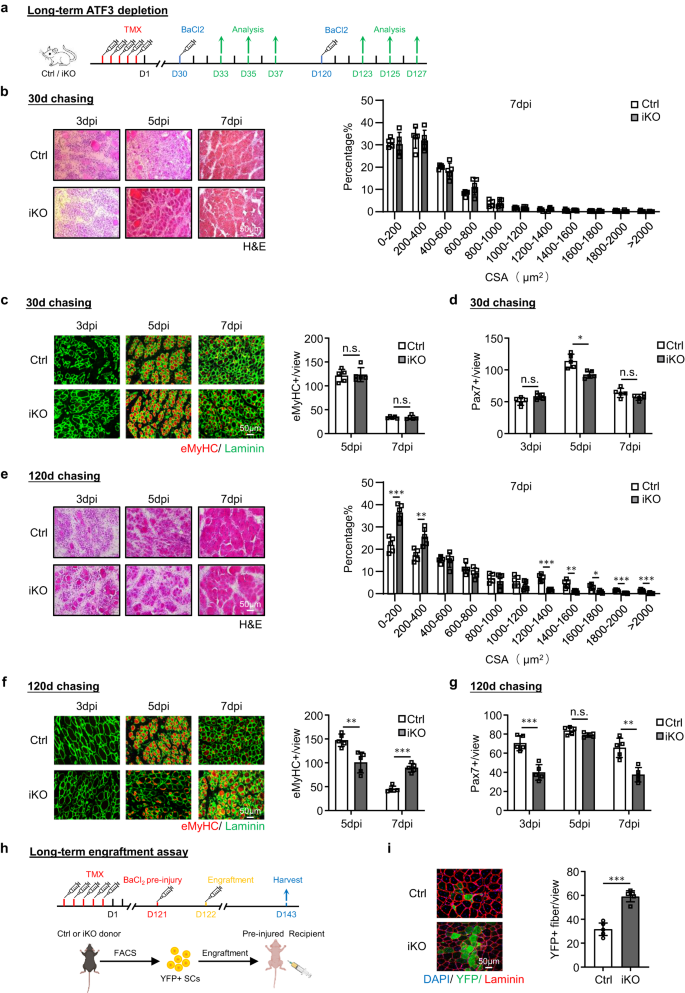
a Schematisk beskrivning av den experimentella designen. b H&E-färgning av TA-muskler uppsamlade 3, 5 och 7 dagar efter 1:a skadeomgången (dpi). Skalstång: 50 μm. Tvärsnittsareor (CSA) av nybildade fibrer kvantifierades från TA-musklerna vid 7 dpi. p = 0.000066, 0.018, 0.00069, 0.0087, 0.00082, 0.00047 och 0.046. c IF-färgning av eMyHC (röd) och Laminin (grön) utfördes på ovanstående TA-muskler. Skalstång: 50 μm. p = 0.00000011. d, e H&E- och eMyHC-färgning av TA-musklerna efter 2:a omgångens skada. Skalstång: 50 μm. p = 0.012, 0.019, 0.033, 0.0057, 0.0022, 0.0022 och 0.0093 (d); p = 0.00021 (e). f, g H&E- och eMyHC-färgning av TA-musklerna efter 3:e omgångens skada. Skalstång: 50 μm. p = 0.00015, 0.00087, 0.0063, 0.000074, 0.0089, 0.035, 0.0014, 0.00011, 0.00042 och 0.00071 (f); p = 0.000023 (g). h Pax7+ SCs per vy kvantifierades på Ctrl- och iKO TA-muskler på oskadade eller efter de 3 omgångarna av skada. p = 0.96, 0.00011, 0.0000013, 0.000014, 0.00066, 0.45, 0.0023, 0.00017, 0.00032, 0.95, 0.0022, 0.00019, 0.0012. i Schematisk för engraftment-analys. Skapad med BioRender.com. j IF-färgning av YFP (grön) och Laminin (röd) på TA-musklerna 21 dagar efter engraftment. Skalstång: 50 μm. n = 5 möss per grupp. p = 0.0000091. k Kvantifiering av Myod+ SCs per visning på Ctrl- och iKO TA-muskler efter de 3 omgångarna av skada. p = 0.0000012, 0.0013, 0.0054, 0.000028, 0.041 och 0.0012. n = 5 möss per grupp under 3, 5, 7 dagar efter den 1:a skadan och 30 dagar efter den 1:a, 2:a och 3:e skadan och engraftmentanalysen; n = 3 möss per grupp under 3, 5, 7 dagar efter 2:a och 3:e skadan. Alla stapeldiagram presenteras som medelvärde ± SD, Students t test (tvåsidigt oparat) användes för att beräkna den statistiska signifikansen (b-h, j, k): *p < 0.05, **p < 0.01, ***p < 0.001. har ingen betydelse. Källdata tillhandahålls som en källdatafil.
Med tanke på den snabba induktionen av ATF3 under tidig SC-aktivering, resonerade vi att dess förlust kan påverka SC-medierad muskelregenerering. För att testa denna uppfattning, BaCl2 injicerades i TA-musklerna hos Ctrl- eller iKO-möss för att inducera akut muskelskada 5 dagar efter TMX-deletion (Fig. 2a). Genom att undersöka ovanstående skadade TA-muskler vid 3, 5, 7 och 30 dpi (Fig. 2a), visade iKO-musklerna en kraftigt accelererad regenereringshastighet. Genom H&E-färgning (Fig. 2b), vid 5 dpi, var regenererande fibrer med CLN redan närvarande i iKO men inte Ctrl-musklerna. Vid 7 dpi var den skadade muskeln nästan reparerad med homogena fibrer och inga tecken på immunceller i iKO och fiberstorleken var också betydligt större jämfört med Ctrl (kvantifieringen till höger). Dessa experimentella observationer stöddes ytterligare av IF-färgning av eMyHC (Fig. 2c); eMyHC+-fibrer observerades lätt i iKO även vid 3 dpi (91.64 i iKO mot 29.86 i Ctrl) men minskade kraftigt med 7 dpi. Genomgående var antalet Pax7+-celler vid 3 dpi signifikant högre i iKO jämfört med Ctrl men lägre vid 5 dpi och 7 dpi (Fig. 2h och tilläggsbild. 2f). Dessutom hade TA-musklerna som samlats in från iKO-mössen vid 30 dpi ökad muskelvikt jämfört med Ctrl (43.7 mot 48.4 mg) (tilläggsbild. 2g) och förstorad muskelfiberstorlek (1137.4 vs. 862.8 μm2) (Kompletterande bild. 2h), vilket återspeglar den förbättrade reparationen.
Överraskande, den förbättrade regenerativa förmågan hos Atf3 iKO SCs bestod efter ytterligare en omgång av BaCl2-inducerad akut skada som ges en månad senare (Fig. 2a). Som visas i fig. 2d, e, förblev den accelererade regenereringen lika stark baserat på den ökade fiberstorleken vid 7 dpi och antalet eMyHC+-fibrer vid 3 dpi efter den andra skadan. Vid 2 dpi visade iKO-muskeln också ökad muskelvikt jämfört med Ctrl (30 vs. 61.7 mg) (kompletterande bild. 2i) och något förstorad muskelfiberstorlek (1724.8 vs. 1633.8 μm2) (Kompletterande bild. 2j). Den tredje skadeomgången gavs sedan (fig. 2a) och den påskyndade reparationen var fortfarande uppenbar (Fig. 2f, g), eftersom antalet eMyHC+-fibrer vid 3 dpi fortfarande var högre i iKO kontra Ctrl-musklerna (89.9 mot 45.7) (Fig. 2g) och ett högre antal större fibrer observerades vid 7 dpi (Fig. 2f). Men trots något ökad TA-muskelvikt i iKO jämfört med Ctrl 30 dagar efter 3:e skada (tilläggsbild. 2k), fanns det ingen signifikant skillnad i den genomsnittliga muskelfiberstorleken (tilläggsbild. 2l), vilket tyder på att den accelererade regenereringen i iKO-muskeln så småningom försvann efter den tredje skadan.
Engraftment-analysen utfördes sedan för att ytterligare validera den förbättrade regenerativa förmågan hos iKO SCs. Som illustreras i fig. 2i21 dagar efter att YFP+ SCs från Ctrl- eller iKO-mössen injicerades i de förskadade TA-musklerna hos receptorn nakna möss, samlades TA-musklerna för att utvärdera donatorcellers regenerativa förmåga baserat på YFP-uttryck. Faktum är att vi observerade ett högre antal YFP+ myofiber i receptormössen transplanterade med iKO vs Ctrl SCs (Fig. 2j). Sammantaget visar våra resultat det Atf3 deletion förstärker akut skadeinducerad muskelregenerering.
Atf3 deletion provocerar för tidig SC-aktivering och pseudo-regenerering i homeostatisk muskel
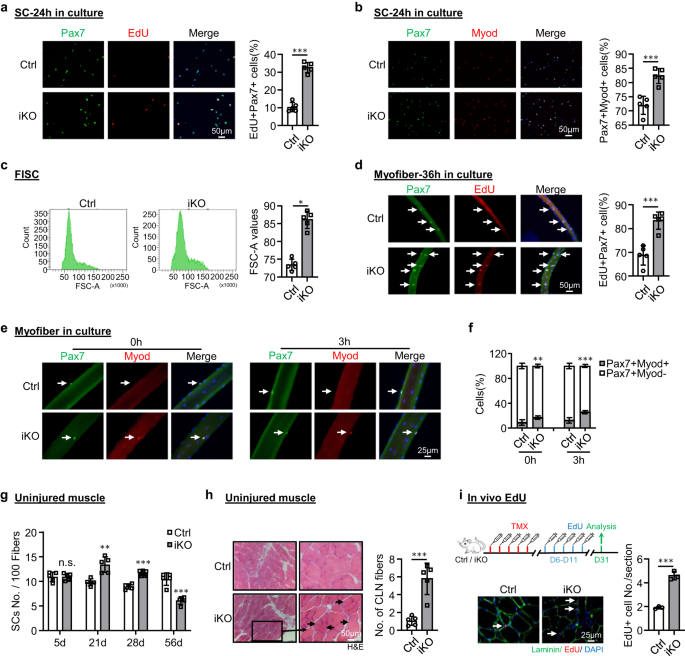
För att dissekera den underliggande orsaken till den förbättrade regenerativa kapaciteten vid ATF3-förlust, spekulerade vi att iKO SCs genomgick snabb aktivering på BaCl2 skada. Faktum är att när man ritar dynamiken hos MyoD+ SCs längs med de tre omgångarna av skada/regenerering. ett mycket högre antal MyoD+-celler detekterades vid 3 dpi (Fig. 2k och tilläggsbild. 2m), men cellantalet sjönk snabbt vid 5 dpi. Ett sådant fenomen fanns under de två första skadeomgångarna men försvann i den tredje omgången (fig. 2k och tilläggsbild. 2m). Jämfört med Ctrl innebär den snabbare aktiveringen av iKO-celler vid akut skada en snabbare övergång från vila till aktivering. Faktum är att FISCs från Atf3-iKO-möss visade en slående ökad benägenhet för cellcykelinträde baserat på EdU-inkorporering 24 timmar efter odling (~ 23% ökning) (Fig. 3a). Dessutom uppvisade Pax7+MyoD+-celler i iKO 10% ökning jämfört med Ctrl 24 timmar efter odling (Fig. 3b). Dessutom var FISC:erna från iKO-musklerna också något större än Ctrl-musklerna (86.1 mot 72.9) (Fig. 3c). Konsekvent hade isolerade enstaka myofiber från iKO-musklerna signifikant högre EdU-inkorporering (14% ökning) än Ctrl-en 36 timmar efter odling (Fig. 3d), vilket förstärker det snabbare cellcykelinträdet för iKO SCs. iKO SCs på nyligen isolerade enstaka myofiber producerade också 1.90 gånger och 2.08 gånger fler Pax7 + MyoD + celler än de Ctrl SCs utan odling eller med 3 timmar (Fig. 3e, f). Sammantaget indikerar dessa resultat att förlusten av ATF3 resulterar i frisättning från vila och därmed snabb SC-aktivering utan akut skada.
a SCs från Ctrl- eller iKO-möss odlades i 24 timmar och behandlades med EdU i 6 timmar innan färgning för EdU (röd) och Pax7 (grön). Skalstång: 50 μm. p = 0.0000014. b IF-färgning av Pax7 (grön) och MyoD (röd) på ovanstående SCs odlade i 24 timmar. Skalstång: 50 μm. p = 0.00050. c Representativa FACS-plots som visar storleken på FISC sorterade från Ctrl- eller iKO-muskler. p = 0.050. d Nyisolerade myofibber från Ctrl- eller iKO-möss odlades i 36 timmar och behandlades med EdU i 6 timmar innan färgning för EdU (röd) och Pax7 (grön). Skalstång: 50 μm. p = 0.00034. e IF färgning av Pax7 (grön) och MyoD (röd) på ovanstående myofiber omedelbart efter isolering eller odlade i 3 timmar. Skalstång: 25 μm. f Kvantifiering av andelen Myod-Pax7+ och Myod+Pax7+ SCs. p = 0.0098 och 0.00035. g Kvantifiering av antalet Pax7+ SC per 100 fibrer på oskadade Ctrl- eller iKO-muskler 5, 21, 28 och 56 dagar efter TMX-injektion. p = 0.96, 0.0018, 0.000049 och 0.00018. h H&E-färgning av ovanstående oskadade muskler 56 dagar efter TMX-injektion. Skalstång: 50 μm. p = 0.00043. i Övre: Schematisk översikt av in vivo EdU-analysen utförd på oskadad Ctrl- eller iKO-muskel; EdU injicerades av IP 5 dagar efter TMX. Musklerna samlades upp 21 dagar senare. Lägre IF-färgning av EdU (röd) och Laminin (grön). Skalstång: 25 μm. p = 0.00024. n = 5 möss per grupp (a-h); n = 3 möss per grupp (i). Alla stapeldiagram presenteras som medelvärde ± SD, Students t test (tvåsidigt oparat) användes för att beräkna den statistiska signifikansen (a-d, f-i): *p < 0.05, **p < 0.01, ***p < 0.001. har ingen betydelse. Källdata tillhandahålls som en källdatafil.
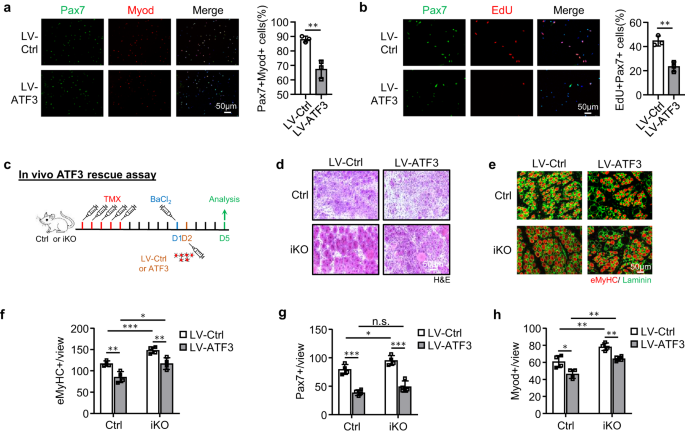
Den förbättrade regenerativa förmågan hos iKO SCs fick oss att ytterligare testa om ATF3-förlusten kan leda till spontan aktivering och pseudo-regenerering i muskler utan skada. Jämfört med Ctrl, fanns det ingen ökning av Pax7+ SCs i iKO TA-musklerna 5 dagar efter TMX-injektion men en signifikant ökning av Pax7+-celler i iKO TA-musklerna vid 21 (13.4 vs. 9.58) och 28 dagar (11.7 vs. 8.9) (Fig. 3g och Sla), vilket indikerar förekomsten av spontan aktivering och expansion av iKO SCs i homeostatiska muskler. Intressant nog, 56 dagar efter TMX-injektion, minskade till slut antalet Pax7+-celler i iKO-musklerna jämfört med Ctrl (fig. 3g och Sla); detta åtföljdes av lätt sedda CLN+-fibrer (Fig. 3h), vilket indikerar fusionen av de aktiverade SC-härledda myoblasterna till befintliga fibrer, vilket är känt som pseudo-regenerering47. För att bekräfta dessa fynd utförde vi fem doser av EdU-injektioner 5 dagar efter TMX-injektion för att visa att det fanns fler EdU+-celler på muskelsektionerna av iKO än Ctrl 21 dagar efter EdU-injektion (Fig. 3i). På liknande sätt, med en enstaka dos av EdU administrerad, upptäcktes EdU+-celler endast på de isolerade iKO-myofiberna eller TA-musklerna 12 timmar senare men inte på Ctrl-cellerna (tilläggsbild. 3b). Sammantaget tyder dessa resultat på det Atf3 deletion provocerar för tidigt aktivering av SCs i homeostatiska muskler, så ATF3 kan fungera för att aktivt undertrycka SC-aktivering. Detta stärktes ytterligare genom att överuttrycka ATF3 i FISCs av ett lentivirus (kompletterande Fig. 3c); det hämmade signifikant SC-aktivering (Fig. 4a, 20.9 % minskning av Pax7+MyoD+-celler och Fig. 4b21.3 % minskning av EdU+-celler). Dessutom överuttrycker ATF3 in vivo genom intramuskulär injektion av lentiviruspartiklarna vid 1 dpi (Fig. 4c) fördröjde regenereringen i Ctrl-möss och avtrubbade också den accelererade regenereringen i iKO-möss (fig. 4d–h och S3d, t.ex).
a FISCs från Ctrl- eller iKO-möss infekterades med ATF3-överuttryckande lentivirus och färgades för Pax7 (grön) och Myod (röd) efter 48 timmar. Skalstång: 50 μm. p = 0.0050. b EdU-analys utfördes och EdU+-celler kvantifierades. Skalstång: 50 μm. p = 0.0031. c Schematisk för att överuttrycka ATF3 in vivo. ATF3-uttryckande lentivirus injicerades i Ctrl- eller iKO TA-muskler 1 dag efter BaCl2 skada. Musklerna samlades upp 5 dagar efter infektion för analys. d H&E-färgning av ovanstående TA-muskler. Skalstång: 50 μm. e IF-färgning av eMyHC (röd) och Laminin (grön) utfördes på ovanstående TA-muskler. Skalstång: 50 μm. f Antalet eMyHC+-fibrer per vy kvantifierades. p = 0.0044, 0.00081, 0.015 och 0.0072. g Antalet Pax7+-celler per vy på ovanstående TA-muskler kvantifierades. p = 0.00018, 0.041, 0.098 och 0.00040. h Antalet Myod+-celler per vy på ovanstående TA-muskler kvantifierades. p = 0.016, 0.0058, 0.0010 och 0.0019. n = 3 möss per grupp (a, b); n = 4 möss per grupp (d-h). Alla stapeldiagram presenteras som medelvärde ± SD. Students t test (tvåsidigt oparat) användes för att beräkna den statistiska signifikansen (a, b, f-h): *p < 0.05, **p < 0.01, ***p < 0.001. har ingen betydelse. Källdata tillhandahålls som en källdatafil.
Dessutom observerade vi att det var 24% ökning av MyoD + MyoG + differentierande celler i de isolerade iKO muskelfibrerna jämfört med Ctrl efter 72 timmars odling (tilläggsbild. 3f), Föreslår det Atf3 deletion kan påskynda differentiering av SC-avkommor. Detta bekräftades genom färgning för MyoD och MyoG på SCs odlade i 72 timmar; 9% ökning av de dubbelpositiva cellerna upptäcktes i iKO vs. Ctrl (Supplementary Fig. 3g). Intressant nog var det också en liten minskning av Pax7+MyoD−-celler i iKO-muskelfibrerna jämfört med Ctrl (10.13% mot 8.48%) (kompletterande bild. 3h), vilket tyder på att Atf3-förlust också kan leda till försämrad självförnyelse. Konsekvent märkte vi också en progressiv nedgång i SC-nummer efter varje skadeomgång (Fig. 2h och tilläggsbild. 2f).
Långsiktig Atf3 brist utarmar SC pool och försämrar muskelregenerering
Nästa, för att testa om det är långsiktigt Atf3 brist orsakar SC-utmattning och försämrar muskelregenerering, vi inducerade muskelskada av BaCl2 administrering 30 dagar eller 120 dagar efter radering Atf3 från SCs och undersökte de skadade TA-musklerna vid 3, 5 och 7 dpi (Fig. 5a). Trettio dagar efter raderingen visade muskelregenereringen (baserat på muskelfiberstorleken och eMyHC+ fiberantalet) inga signifikanta förändringar jämfört med Ctrl-mössen (Fig. 5b, c). Antalet Pax7+ SC var också jämförbart vid 3 och 7 dpi och bara något lägre i iKO vid 5 dpi (Fig. 5d och tilläggsbild. 4a). Däremot, 120 dagar efter raderingen, var muskelregenereringen uppenbarligen äventyrad i iKO jämfört med Ctrl-mössen. En signifikant ökning av mindre fibrer observerades vid 7 dpi (Fig. 5e); antalet eMyHC+-fibrer var mycket lägre vid 5 dpi men högre vid 7 dpi (Fig. 5f); antalet Pax7+ SCs reducerades också signifikant vid både 3 och 7 dpi (Fig. 5g och tilläggsbild. 4b). Dessa resultat visar att på lång sikt Atf3 brist är skadlig för regenerering genom att krympa SC-poolen. Intressant nog, när samma antal YFP+-celler isolerade från Ctrl- eller iKO-mössen 4 månader efter TMX-injektion användes i engraftment-analysen (Fig. 5h), observerades ett högre antal YFP+ myofiber i mottagarmössen transplanterade med iKO-cellerna (59.28 vs. 31.72, Fig. 5i), vilket tyder på att förbättrad regenerativ förmåga hos iKO-cellerna kvarstår efter långvarig ATF3-förlust och den försämrade muskelregenereringen uppstår verkligen från den minskade cellpoolen.
a Schematisk översikt över den experimentella designen för att testa effekten av långsiktighet Atf3 deletion på muskelregenereringsprocessen. 30 eller 120 dagar efter TMX-injektion gavs före BaCl2 injektion. b Vänster: H&E-färgning av TA-musklerna uppsamlade vid 3, 5 och 7 dpi efter den 30 dagar långa jaktperioden. Skalstång: 50 μm. n = 5 möss per grupp. Höger: CSA av nybildade fibrer kvantifierades från den ovan färgade TA-muskeln vid 7 dpi och fördelningen visas. n = 5 möss per grupp. c Vänster: IF-färgning av eMyHC (röd) och Laminin (grön) utfördes på ovanstående TA-muskler. Skalstång: 50 μm. Höger: Kvantifiering av antalet eMyHC+-fibrer per vy vid 5 och 7 dpi. n = 5 möss per grupp. p = 0.83 och 0.98. d Kvantifiering av antalet Pax7+ SC:er per visning. n = 5 möss per grupp. p = 0.054, 0.0047 och 0.11. e-g Ovanstående analyser/kvantifieringar utfördes på Ctrl- eller iKO-musklerna uppsamlade vid 3, 5 och 7 dpi efter den 120 dagar långa jaktperioden. Skalstång: 50 μm. n = 5 möss per grupp. p = 0.00020, 0.0047, 0.000068, 0.0024, 0.013, 0.00019 och 0.00057 (e); p = 0.0034 och 0.000018 (f); p = 0.00031, 0.063 och 0.0010 (g). h Schematiskt för engraftment-analysen. 120 dagar efter TMX-injektion injicerades FISC från donatormöss (Ctrl/iKO) i förskadade mottagarmöss. TA-muskler uppsamlades 21 dagar efter engraftment för analys. Skapad med BioRender.com. i Vänster: IF-färgning av YFP (grön) och Laminin (röd) på ovanstående TA-muskler. Skalstång: 50 μm. Höger: antalet YFP+-fibrer per vy kvantifierades. n = 5 möss per grupp. p = 0.000047. Alla stapeldiagram presenteras som medelvärde ± SD. Students t test (tvåsidigt oparat) användes för att beräkna den statistiska signifikansen (b-g, i): *p < 0.05, **p < 0.01, ***p < 0.001. har ingen betydelse. Källdata tillhandahålls som en källdatafil.
För att ytterligare fastställa vikten av Atf3 i SC etablering och underhåll har vi raderat Atf3 i Pax7+ myogena progenitorer genom att korsa Atf3Flox allel med en icke-inducerbar PAX7Cre-R26RYFP transgen musstam48, där Cre-rekombinaset uttrycks i Pax7+ progenitorceller så tidigt som E9.5 (kompletterande Fig. 5a-c). Intressant nog uppvisade cKO-musklerna 84 % ökning av Pax7+ SCs jämfört med Ctrl cirka 1 månad efter födseln när SC-poolen etablerades49, men 79% minskning hos två månader gamla vuxna möss (kompletterande fig. 5e), vilket indikerar att ATF3 krävs för SC-underhåll i vuxen ålder men är nödvändig för SC-etablering. En minskad TA-muskelvikt upptäcktes i cKO vid 1 månads ålder (29.42 mg mot 34.88 mg, tilläggsbild. 5f) men ingen signifikant skillnad i kroppsvikt (12.66 mg vs. 12.42 mg, tilläggsbild. 5d) och fiberstorlek (861.96 μm2 mot 848.71 μm2, Kompletterande Fig. 5g), är det därför svårt att dra slutsatsen om muskelhypertrofi förekommer hos de unga cKO-mössen. Förväntat, när de vuxna SCs isolerades och odlades, visade cKO-celler en mycket högre benägenhet för aktivering bedömd av både Pax7 + Myod + färgning (kompletterande Fig. 5h, 23.8 % ökning i cKO vs. Ctrl) och EdU-analys (kompletterande bild. 5i, 99.9 % ökning). På motsvarande sätt var den regenerativa kapaciteten efter akut skada uppenbarligen äventyrad i cKO-musklerna (kompletterande fig. 5j–l). Därför inducerar förlusten av ATF3 brådmogen SC-aktivering och leder till en eventuell minskning av SC-poolen.
Atf3 deletion ökar SC-aktiveringen under frivilliga träningar och uthållighetsövningar
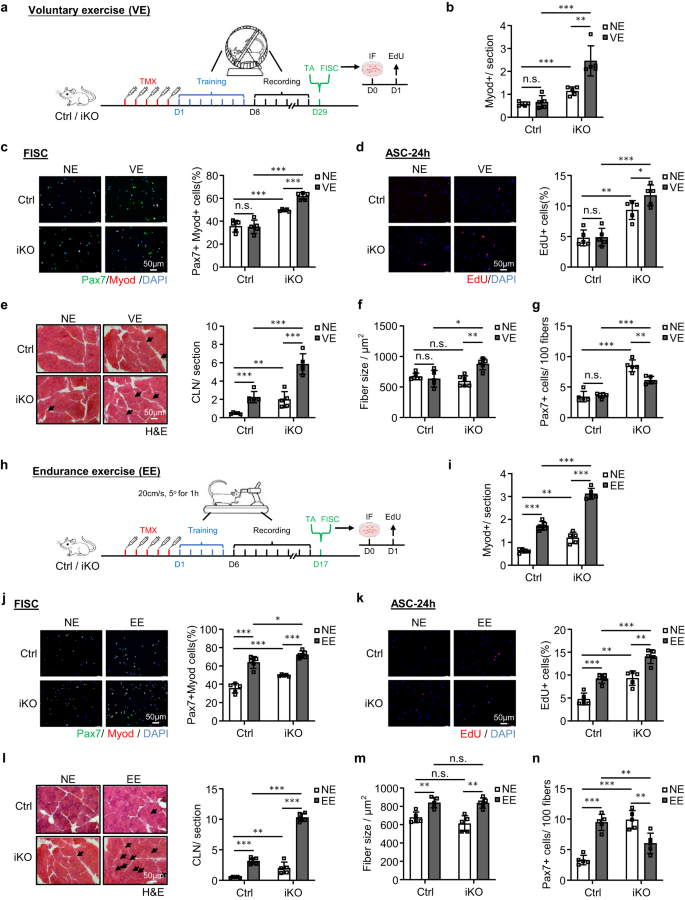
Kortvarig och icke-ansträngande frivillig träning (VE) orsakar inte SC-aktivering men uthållighetsträning (EE) aktiverar SCs50,51,52,53,54. För att ytterligare bevisa funktionen hos ATF3 för att förhindra SC-aktivering, försökte vi avgöra om ATF3-utarmningen påverkar den VE-inducerade SC-aktiveringen. Omedelbart efter fem doser av TMX-injektion utsattes Ctrl- och iKO-möss för en etablerad frivillig hjulkörning; mössen försågs med tillgång till fritt roterande löphjul; en stabil VE-rutin uppnåddes inom 7 dagar efter träning och fortsatte i ytterligare 21 dagar lång VE (Fig. 6a). Den dagliga löpsträckan registrerades och ingen signifikant skillnad upptäcktes mellan Ctrl (14.38 km) kontra iKO (13.78 km) möss (tilläggsbild. 6a, b).
a Schematisk beskrivning av den experimentella designen för VE. b Kvantifiering av Myod+-celler på ovanstående TA-muskler. p = 0.54, 0.00024, 0.00049 och 0.0024. c IF-färgning av Pax7 (grön) och MyoD (röd) på SCs isolerade från ovanstående möss och odlade i 24 timmar sorterade. Skalstång: 50 μm. p = 0.91, 0.00035, 0.000018 och 0.000032. d EdU (röd) färgades på SCs sorterade från ovanstående möss och odlades i 24 timmar. Skalstång: 50 μm. p = 0.90, 0.0010, 0.00013 och 0.046. e H&E-färgning av ovanstående TA-muskler. Skalstång: 50 μm. p = 0.00043, 0.0073, 0.00021 och 0.00047. f Fiberstorlek för ovanstående TA-muskler (e). p = 0.54, 0.19, 0.012 och 0.0017. g Kvantifiering av Pax7+ SCs på ovanstående TA-muskler. p = 0.66, 0.000023, 0.000052 och 0.0017. h Schematisk beskrivning av den experimentella designen (EE). i Kvantifiering av Myod+-celler på TA-musklerna insamlade från ovanstående Ctrl- och iKO-möss med eller utan EE. p = 0.0000026, 0.0010, 0.0000073 och 0.0000015. j IF-färgning av Pax7 (grön) och MyoD (röd) på SCs sorterade från ovanstående möss och odlade i 24 timmar. Skalstång: 50 μm. p = 0.000062, 0.00035, 0.035 och 0.0000018. k EdU (röd) färgades på SCs isolerade från ovanstående möss och odlades i 24 timmar. Skalstång: 50 μm. p = 0.00031, 0.0010, 0.00034 och 0.0012. l H&E-färgning av ovanstående TA-muskler. Skalstång: 50 μm. p = 0.0000039, 0.0073, 0.000000071 och 0.00000026. m Fiberstorlek för ovanstående TA-muskler (l). p = 0.0022, 0.19, 0.91 och 0.0012. n Kvantifiering av Pax7+ SCs per på ovanstående TA-muskler. p = 0.000018, 0.000024, 0.0067 och 0.0049. n = 5 möss per grupp (b-g, i-n). Alla stapeldiagram presenteras som medelvärde ± SD. Students t test (tvåsidigt oparat) användes för att beräkna den statistiska signifikansen (b-g, i-n): *p < 0.05, **p < 0.01, ***p < 0.001. har ingen betydelse. Källdata tillhandahålls som en källdatafil.
Förväntat inducerades uttrycken av AP-1-familjemedlemmar av VE i Ctrl SCs (kompletterande Fig. 6c). Också överensstämmande med tidigare rapporter54VE inducerade inte SC-aktivering i Ctrl-mössen eftersom inga MyoD+-celler detekterades på muskelsektionerna före och efter VE (Fig. 6b och tilläggsbild. 6d); konsekvent Pax7 + MyoD + färgning av FISCs (Fig. 6c) eller EdU-färgning av ASC: er odlade i 24 timmar (Fig. 6d) avslöjade inte ökad aktiveringshastighet före och efter VE. Däremot aktiverades iKO-cellerna lätt av VE (Fig. 6b–d och tilläggsbild. 6d). Konsekvent, i iKO-musklerna upptäckte vi också ett signifikant ökat antal CLN-fibrer (136% ökning) (Fig. 6e) och uppenbar hypertrofi (fiberstorleken ökade med 43.3%) efter VE (Fig. 6f). I Ctrl-musklerna ökades antalet CLN efter VE men inte tillräckligt för att orsaka hypertrofisk tillväxt (Fig. 6e, f). Ovanstående fynd förstärker således uppfattningen att ATF3-förlust inducerar snabb aktivering av SC:er av VE. Som ett resultat var det minskad SC-pool (38.2 % minskning av Pax7+ FISCs) i slutet av VE-regimen (Fig. 6g och tilläggsbild. 6e).
Eftersom EE är känt för att orsaka SC-aktivering och muskelhypertrofi50,51,52,53, undersökte vi nästa om Atf3 brist påverkar den EE-inducerade SC-aktiveringen. För detta ändamål var Ctrl- och iKO-möss utsatta för löpbandskörning55,56 där löpbandet var inställt på 5° lutning och en hastighet av 20 cm/s under 60 min. Efter fem doser av TMX-injektion tränades mössen för en 5-dagars anpassningsperiod, sedan följt av en 10-dagars uthållighetsträning (+EE) eller, som kontrollvillkor, utan någon träning (NE) (Fig. 6h). Som väntat inducerades uttrycken av AP-1-familjemedlemmar snabbt av EE i SCs (kompletterande Fig. 6c). Dessutom orsakade EE tydlig SC-aktivering i Ctrl-musklerna, men aktiveringen var mycket starkare i iKO-musklerna (Fig. 6i–k och tilläggsbild. 6f). Konsekvent inducerades CLN-fibrer i både Ctrl- och iKO-musklerna efter EE; och en högre ökning av CLN-fibrer sågs i iKO jämfört med Ctrl-musklerna (Fig. 6l). Dessutom visade både Ctrl- och iKO-musklerna hypertrofisk tillväxt efter EE men ingen skillnad upptäcktes (Fig. 6m). I slutet av EE-regimen ökade antalet Pax7+ FISCs signifikant i Ctrl men minskade i iKO (Fig. 6n och tilläggsbild. 6g), vilket indikerar den snabba uttömningen av iKO SC-poolen. Sammantaget indikerar dessa fynd att förlusten av ATF3 provocerar SC-aktivering av VE och också förbättrar SC-aktivering av EE.
ATF3 reglerar H2B genuttryck och nukleosommönster
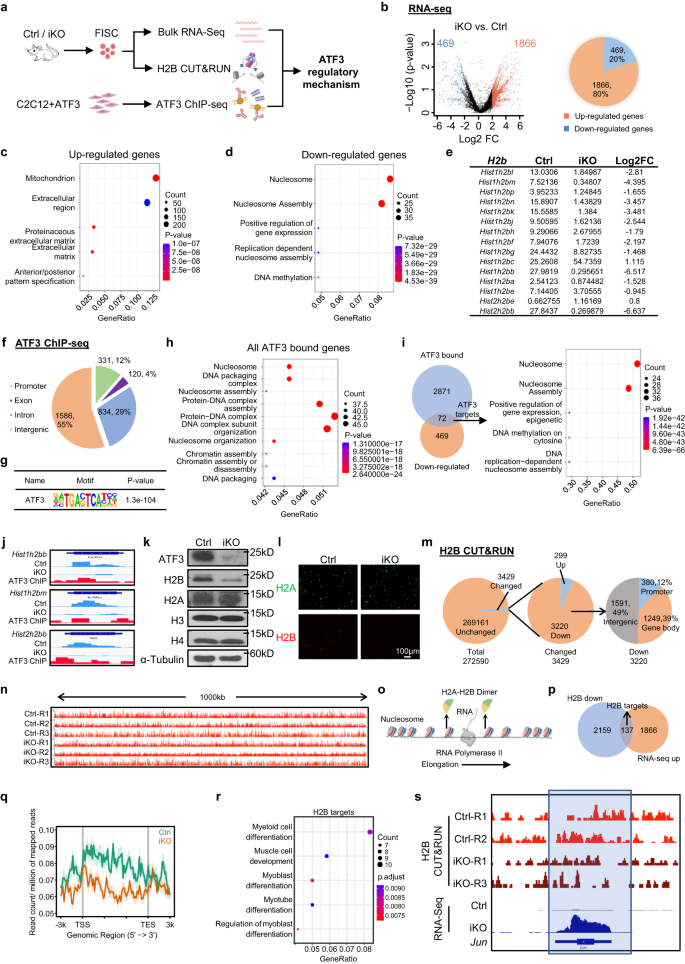
Sammantaget antyder ovanstående resultat en viktig roll för ATF3-induktion för att förhindra brådmogen SC-aktivering, för att belysa den underliggande molekylära mekanismen, profilerade vi ATF3-transkriptionsutgången genom att utföra RNA-Seq i FISCs som samlats in från Ctrl- och iKO-musklerna (Fig. 7a). Totalt 1866 transkript (röda prickar) (79.9%) uppreglerades i iKO jämfört med Ctrl, medan 469 (blå prickar) (20.1%) nedreglerades (Fig. 7b, Kompletterande Fig. 7a och kompletterande data 1), vilket tyder på att ATF3-förlusten inducerade global transkriptionsaktivering. GO-analysen avslöjade att de uppreglerade generna berikades för "mitokondrier", "extracellulär matris", etc. (Fig. 7c och kompletterande data 1). Observera att förhöjd mitokondriell aktivitet och extracellulärt matrixuttryck tidigare har beskrivits i GVarna celler10, vilket tyder på att ATF3 fungerar för att undertrycka uttrycket av dessa aktiverande gener, vilket förhindrar för tidig SC-aktivering. De nedreglerade generna berikades intressant för "nukleosom" och "nukleosomsammansättning" etc. (Fig. 7d och kompletterande data 1). Speciellt var generna som kodar för histonproteiner starkt representerade bland de nedreglerade generna (Fig. 7e), vilket också bekräftades av RT-qPCR (19–46 % minskning) (kompletterande bild. 7b). Histonkodande gener är vanligtvis organiserade i multigenkluster och H2B-protein kodas av 2 genkluster med 15 på Chr13 som bildar en Hist1h2b kluster och 2 på Chr3 som bildar en Hist2h2b kluster (tilläggsbild. 7c). Anmärkningsvärt, 13 av de 17 H2b gener nedreglerades i iKO SCs (Fig. 7e). Dessutom utförde vi också RNA-Seq på FISCs isolerade från Ctrl och Atf3-cKO-möss och liknande resultat erhölls (kompletterande Fig. 7d–g och kompletterande data 3). Dessa resultat visar att ATF3-förlusten minskar H2b genexpression.
a Schematisk beskrivning av den experimentella designen. Skapad med BioRender.com. b DEG identifierades från ovanstående Ctrl vs. iKO RNA-seq. c, d GO-analys av ovanstående upp- och nedreglerade gener. e FPKM och Log2FC av H2b gener i iKO vs Ctrl. f Genomisk fördelning av 2871 ATF3-bindningstoppar. g Anrikning av kanoniska ATF3-motiv i ovanstående bindningsregioner. h GO-analys för alla ovanstående gener med ATF3-bindning. i Till vänster: Venn-diagram som visar överlappningen (72 gener) mellan det ovan identifierade ChIP-Seq-målet (2871) och de nedreglerade generna (469). Höger: GO-analys av ovanstående 72 gener avslöjade en extrem berikning av histonrelaterade termer. j Genomiska ögonblicksbilder av 3 av ovanstående identifierade H2b gener med ATF3-bindning i sina TSS (ChIP-Seq-spår) och nedreglerade av ATF3-deletion (RNA-Seq-spår). k ATF3-, H2A-, H2B-, H3- och H4-proteiner mättes med western blot i FISC från Ctrl- och iKO-möss. a-Tubulin användes som en laddningskontroll. l IF-färgning av H2A (grön) och H2B (röd) på ovanstående FISC. Skalstång: 100 μm; n = 3 möss per grupp. m Cirkeldiagram som visar antalet lagerplatser med H2B ändrat (3429, 299 upp och 3220 ner) och oförändrade (269161) (vänster och mitten), och den genomiska fördelningen av nedreglerade H2B-signaler (höger). n Genomiska ögonblicksbilder av en 1000 kb region Integrative Genomics Viewer (IGV) spår av H2B-signal i Ctrl vs. iKO på Chr4. o Schematisk beskrivning av RNA-polymeras II-förlängningsprocessen under DNA-transkription. Skapad med BioRender.com. p Venn-diagram som visar de överlappande (137 generna) mellan ovanstående regioner med nedreglerade H2B CUT&RUN-signaler (2159) och de uppreglerade generna (1866) från ovanstående (A) RNA-Seq. q Metaplots som visar genomsnittliga H2B CUT&RUN-signaler 3 kb upp till nedströms TSS. r GO-analys av ovanstående 252 gener från (P). s Genomiska ögonblicksbilder av juni gen som visar nedreglerad H2B CUT&RUN-signal och uppreglerad RNA-Seq-signal i iKO vs. Ctrl. Regioner med H2B-signalreduktion i iKO kontra Ctrl är markerade i blå ram. Källdata tillhandahålls som en källdatafil.
Därefter utförde vi ChIP-Seq på C2C12-myoblasterna med exogent ATF3-överuttryck som ett surrogatsystem för att definiera direkta bindande mål för ATF3 (Fig. 7a och tilläggsbild. 7h). Totalt 2871 bindningstoppar identifierades i 869 gener med 60%, 28% och 9% lokaliserade i intergena regioner, introner respektive promotorer (Fig. 7f och kompletterande data 2). Dessa toppar berikades för det kända ATF3-bindningsmotivet, TGACTCA (Fig. 7g), vilket intygar den goda datakvaliteten. GO-analys av dessa ATF3-bundna gener indikerade anmärkningsvärd anrikning för termerna relaterade till nukleosom (Fig. 7h och kompletterande data 2). Genom att integrera RNA-Seq och ChIP-Seq-resultaten innehöll 72 nedreglerade gener ATF3-bindningsställen och återigen berikades de för nukleosomrelaterade GO-termer och många var histongener (Fig. 7i och kompletterande data 2). Noterbart är att 8 av de 13 nedreglerade H2b gener hade ATF3-bindningsställen i sina promotorer (Fig. 7i, j, Kompletterande Fig. 7i och kompletterande data 2). Under tiden hade 112 uppreglerade gener ATF3-bindning och berikades för mitokondrierrelaterade GO-termer (kompletterande fig. 7j och kompletterande data 2). Western blot (fig. 7k) och IF-färgning (Fig. 7l) resultat bekräftade en avsevärd minskning eller nästan förlust av H2B-protein i iKO FISCs medan andra histonproteiner som H3, H4 och H2A förblev oförändrade. Dessa resultat visar det H2b gener är bona fide transkriptionsmål för ATF3.
Global minskning av histoner leder till minskad mängd nukleosomer, utökat nukleosomavstånd och förändrar nukleosombeläggning vilket påverkar transkriptionen57,58,59, för att avgöra om H2B-förlusten i iKO SCs ändrar nukleosomens positionering och beläggning, CUT&RUN-analys60,61 utfördes för att kartlägga den genomiska lokaliseringen av H2B i Ctrl- och iKO-celler (Fig. 7a). Totalt 272590 XNUMX bins definierades genom hela genomet från de tre replikaten (tilläggsdata 4). Oväntat var de genomsnittliga H2B CUT&RUN-signalerna i stort sett oförändrade i iKO vs. Ctrl med endast 3429 fack (1.4%) som visade förändringar (Fig. 7 m, n). Ändå visade 3220 av de förändrade fackarna verkligen minskad H2B-berikning i olika genomiska regioner, inklusive promotor (12%), genkropp (39%) och intergena regioner (49%) (Fig. 7m). Eftersom nukleosomen delvis demonteras genom avlägsnande av en H2A-H2B-dimer för att underlätta Pol II-transkription61 (Fikon. 7o), antog vi att den lokala förlusten av H2B kunde underlätta nukleosomdestabilisering för att främja transkriptionen av associerade gener. Genom att skära med RNA-Seq-data visade 137 uppreglerade gener faktiskt minskade H2B-signaler på deras promotorer eller genkroppar (Fig. 7p, q och kompletterande data 4). Dessa H2B-målgener berikades för GO-termer relaterade till muskeldifferentiering och inkluderades också id3, IGF-1 och junietc. (Fig. 7r, s), vilket överensstämde med aktiveringstillståndet för iKO SCs11,62,63. Sammantaget visar dessa fynd att den minskade H2B-nivån kan förmedla den brådmogen SC-aktiveringen efter ATF3-förlusten.
H2B förmedlar ATF3-funktion i SC-aktivering och muskelregenerering
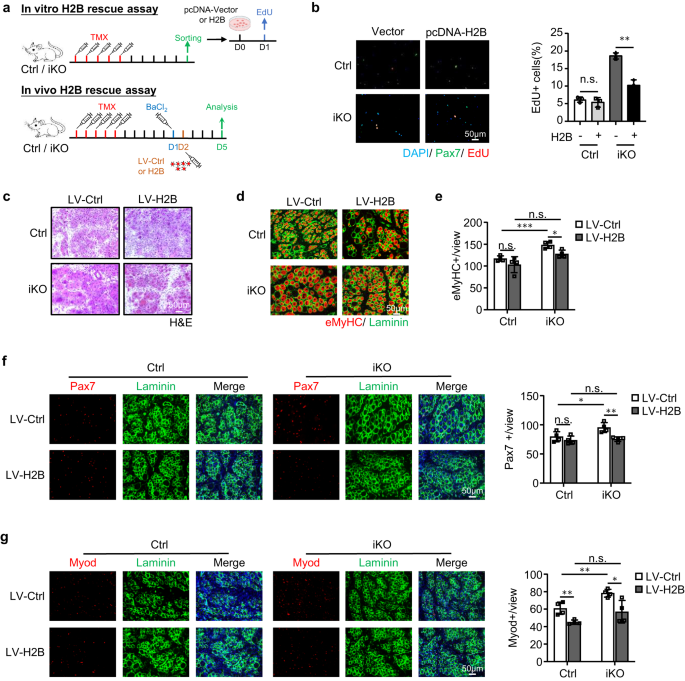
För att solidifiera den funktionella länken mellan ATF3 och H2B i SC-aktivering och muskelregenerering fann vi att överuttryck av H2B genom att transfektera en pcDNA-H2B-plasmid i FISC:er verkligen undertryckte den accelererade aktiveringen av Atf3 iKO-celler men ingen inverkan på Ctrl-celler (Fig. 8a, b). Och in vivo överuttryckte vi också H2B (tilläggsbild. 7k) genom intramuskulär injektion av lentivirala partiklar vid 1 dpi (Fig. 8a). Som visas i fig. 8c–g, detta återställde också den akuta skadainducerade regenereringen i Atf3-iKO-mössen: ett signifikant lägre antal eMyHC+-fibrer observerades 5 dpi (Fig. 8d, e), vilket åtföljdes av minskat antal Pax7+-celler (Fig. 8f) och MyoD+-celler (Fig. 8g). Sammantaget bekräftar dessa fynd att H2B-förlust medierar den brådmogen SC-aktivering och förbättrade muskelregenerering som observeras vid ATF3-förlust.
a Övre: Schematisk för överuttryck av H2B in vitro. FISC från Ctrl- eller iKO-möss transfekterades med en kontroll (Ctrl) eller pCDNA-H2B-plasmid och EdU-analys utfördes för att bedöma SC-aktivering. Nedre: Schematisk för att överuttrycka H2B in vivo via lentivirus. H2B-uttryckande lentivirus injicerades i Ctrl- eller iKO TA-muskler 1 dag efter BaCl2 skadan och musklerna samlades upp 5 dagar efter infektion för analys. b Vänster: Ovanstående transfekterade celler odlades i 24 timmar innan de behandlades med EdU i 6 timmar; EdU-positiva celler färgades och kvantifierades. Skalstång: 50 μm; n = 3 möss per grupp. p = 0.44 och 0.0013. c H&E-färgning av ovanstående TA-muskler uppsamlade vid 5 dpi efter infektion. Skalstång: 50 μm. n = 4 möss per grupp. d IF-färgning av eMyHC (röd) och Laminin (grön) utfördes på ovanstående TA-muskler. Skalstång: 50 μm. e Antalet eMyHC+-fibrer per vy kvantifierades. n = 4 möss per grupp. Från vänster till höger, p = 0.20, 0.00081, 0.052 och 0.012. f Vänster: IF-färgning av Pax7 (röd) och Laminin (grön) utfördes på ovanstående TA-muskler. Skalstång: 50 μm. Höger: antalet Pax7+-celler per vy kvantifierades. n = 4 möss per grupp. Från vänster till höger, p = 0.33, 0.041, 0.67 och 0.0052. g Vänster: IF-färgning av Myod (röd) och Laminin (grön) utfördes på ovanstående TA-muskler. Skalstång: 50 μm. Höger: antalet Myod+-celler per vy kvantifierades. n = 4 möss per grupp. Från vänster till höger, p = 0.0053, 0.0058, 0.12 och 0.020. Alla stapeldiagram presenteras som medelvärde ± SD. Students t test (tvåsidigt oparat) användes för att beräkna den statistiska signifikansen (b, e-g): *p < 0.05, **p < 0.01, ***p < 0.001. har ingen betydelse. Källdata tillhandahålls som en källdatafil.
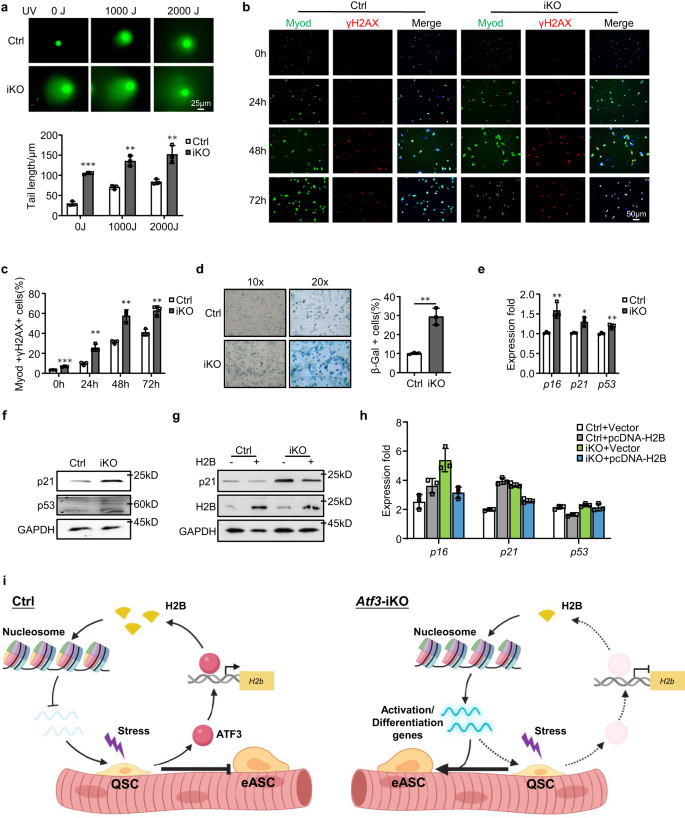
H2B-förlust ökar DNA-skador och åldrande i Atf3 iKO SCs
För att ytterligare belysa konsekvensen av H2B-förlust i SCs, undersökte vi genominstabilitet och cellulär senescens med tanke på att histonproteiner är viktiga för kromatinintegritet och genomstabilitet57,59. FISC från iKO- eller Ctrl-muskler behandlades med olika doser (0, 1000 eller 2000J) UV-ljus och kometanalys utfördes. I själva verket observerades en betydande ökning av kometens svanslängd under alla tre doserna i iKO jämfört med Ctrl (Fig. 9a), vilket tyder på att H2B-minskning orsakar genomisk instabilitet. Detta bekräftades ytterligare av en mycket högre andel γH2AX+-celler i de odlade iKO-cellerna jämfört med Ctrl (Fig. 9b, c). För att undersöka om den genomiska instabiliteten leder till cellulär senescens, odlades celler i tillväxtmedium under 9 dagar och β-Gal-färgning utfördes; en 19% ökning av β-Gal+ celler upptäcktes i iKO jämfört med Ctrl (Fig. 9d). Genomgående en betydande uppreglering av p16, p21och p53 mRNA (fig. 9e) och en högre nivå av p21- och p53-proteiner detekterades också i iKO (Fig. 9f). Sammantaget visar ovanstående fynd att H2B-förlust leder till ökad genominstabilitet och cellulär senescens i Atf3 iKO-celler. Förväntat minskade H2B-överuttryck i iKO-cellerna ackumuleringen av DNA-skada och hämmade cellulär senescens enligt bedömning av minskat p21-protein (Fig. 9g) såväl som p16, p21 och p53 mRNA (fig. 9h). Dessa resultat indikerar att det minskade H2B-uttrycket gör att SC:er genomgår replikativ senescens.
a Comet assay utfördes på Ctrl eller iKO SCs efter 0, 1000 eller 2000J UV-behandling. Skalstång: 25 μm. n = 3 möss per grupp. p = 0.000029, 0.0012 och 0.0071. b IF-färgning av γH2AX (röd) och Myod (grön) utfördes på SCs från Ctrl- eller iKO-möss efter odling i 0, 24, 48 eller 72 timmar. Skalstång: 50 μm. c Kvantifiering av procentandelen Myod+/γH2AX+-celler; n = 3 möss per grupp. p = 0.00014, 0.0024, 0.0021 och 0.0031. d β-Gal (blå) färgning utfördes på SCs från Ctrl eller iKO möss efter odling i 9 dagar. n = 3 möss per grupp. p = 0.0017. e Expression av de utvalda senescensmarkörgenerna inklusive p16, p21 och p53 i SCs från Ctrl och iKO kvantifierades med RT-qPCR. p = 0.0078, 0.011 och 0.0061. f p21- och p53-proteinnivåer detekterades genom Western blotting i SCs från Ctrl- och iKO-möss. GAPDH användes som en laddningskontroll. g, h SCs från Ctrl- och iKO-möss transfekterades med en H2B-överuttryckande eller vektorkontrollplasmid. 96 timmar efter transfektion detekterades uttryck av de angivna generna genom Western blotting och RT-qPCR. GAPDH användes som en laddningskontroll. i Schematisk modell som visar den funktionella rollen för ATF3 för att förhindra SC för tidigt aktivering. I homeostatisk muskel främjar den snabba induktionen av ATF3 vid mindre stress H2b uttryck för att upprätthålla korrekt nukleosompositionering och undertrycka uttrycket av aktiveringsgener, vilket förhindrar förtidig aktivering av SCs. Vid förlust av ATF3 uppstår H2B-brist vilket leder till förändrad nukleosompositionering och uppreglering av aktiveringsgener, vilket gör att SC:er bryter stillheten och går in i ett tidigt aktiveringsstadium. Skapad med BioRender.com. Alla stapeldiagram presenteras som medelvärde ± SD. Students t test (tvåsidigt oparat) användes för att beräkna den statistiska signifikansen (a, c-e): *p < 0.05, **p < 0.01, ***p < 0.001. har ingen betydelse. Källdata tillhandahålls som en källdatafil.
Screening av andra funktionella AP-1 familjemedlemmar i SCs och regenerering
Efter den ovanstående holistiska karakteriseringen av funktionen och mekanismen för ATF3 i SCs, försökte vi utöka studien genom att fråga om andra AP-1-familjens TF: er som ATF4, FOS, FOSB och JUNB, också spelar funktionella roller i SCs med tanke på deras liknande snabb och övergående induktionsdynamik under SC tidig aktivering (fig. 1b–d och S1C). För att testa idén genomförde vi en funktionell screening med hjälp av vår nyligen utvecklade PAX7Cas9/AAV-sgRNA-medierad in vivo-genomredigeringsplattform64, som är baserad på en Cre-beroende Cas9 knock-in möss och AAV-medierad sgRNA leverans. Kortfattat selekterades ett par sgRNA som riktade sig mot varje TF och förpackades i AAV9-viruspartiklar; 4 × 1011 virala genom (vg)/mus av AAV9-sgRNA injicerades intramuskulärt (IM) i TA-musklerna hos PAX7Cas9 möss vid postnatal (P) ålder av 10 dagar (P10). För kontrollgruppen (Ctrl) injicerades samma dos av AAV9-virus innehållande pAAV9-sgRNA-vektorryggraden utan någon sgRNA-insättning. Mössen avlivades sedan för SC-isolering och analys efter åtta veckor (fig. Sla). Framgångsrik DNA-redigeringseffektivitet bekräftades för alla fyra TF: er (kompletterande fig. 8b–e); konsekvent detekterades knock down (KD) av varje protein i olika grader (52.4%–83.6%) av WB (tilläggsbild. 7b–e) eller IF (tilläggsbild. 8f) trots oförändrade mRNA-nivåer (kompletterande fig. 8g).
För att undersöka effekten av ovanstående AP-1 TF KD på SC-aktivering, odlades FISC från varje mutant för in vitro EdU-analys (kompletterande Fig. 8a). Liknande Atf3 KO, den Fos-KD-celler visade accelererad SC-aktivering medan JunB-KD visade trubbig aktivering; de Atf4 or FosB-KD, å andra sidan, hade ingen inverkan (tilläggsbild. 8h). Vid mätning av Pax7+-celler på de ~2 månader gamla oskadade musklerna observerades intressant nog minskat antal på Atf4, Fos or JunB-KD (tilläggsbild. 8i), vilket tyder på en förlust av SC-pool. Sedan Atf4 or JunB-KD ledde inte till brådmogen SC-aktivering, SC-nummerförlusten kan orsakas av andra orsaker med tanke på att raderingen inträffade mycket tidigt i det postnatala skedet64. De FosB-KD hade ingen inverkan på Pax7+ SC-poolen.
För att ytterligare undersöka effekten på muskelregenerativ förmåga, BaCl2 injicerades 7 veckor efter AAV-injektionen (kompletterande fig. 8a) och regenereringen utvärderades av H&E (Supplementary Fig. 8j), eMyHC (tilläggsbild. 8k), Pax7 (tilläggsbild. 8l) och MyoD (tilläggsbild. 8m) färgning vid 5 dpi. En försämrad regenerering avslöjades i Atf4 och Fos-KD förmodligen på grund av utmattning av SCs efter dess långvariga radering; Förnyelsen i JunB-KD äventyrades troligen på grund av en minskad SC-pool; genomgående observerades ingen påverkan på regenereringen i FosB-KD. Sammantaget visar våra resultat att dessa AP-1-familjemedlemmar kan spela olika funktioner i SC-aktivering och muskelregenerering.
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Fordon / elbilar, Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- PlatoHealth. Biotech och kliniska prövningar Intelligence. Tillgång här.
- ChartPrime. Höj ditt handelsspel med ChartPrime. Tillgång här.
- BlockOffsets. Modernisera miljökompensation ägande. Tillgång här.
- Källa: https://www.nature.com/articles/s41467-023-40465-w