Determinação e isolamento do produto recém-gerado
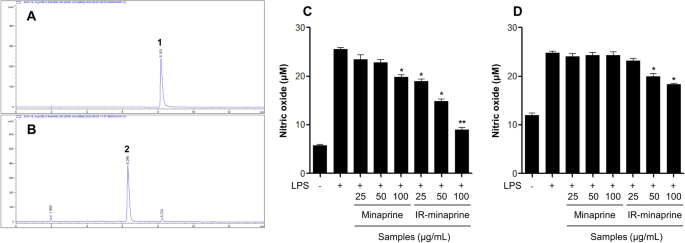
A radiação ionizante foi aplicada conforme descrito anteriormente. Uma solução de amostra contendo minaprina pura (400 mg) em metanol (400 mL) foi diretamente irradiada com raios gama, e o padrão de transformação foi analisado usando um aparelho HPLC de fase reversa. Após irradiação com dose de 30 kGy, minaprina (1) foi quase reduzido e o pico recém-gerado em um tR 6.2 min correspondeu a uma taxa de conversão de 95% (Fig. 1A,B). Os reagentes irradiados com uma dose de 30 kGy mostraram efeitos inibitórios aumentados na produção de NO em macrófagos RAW 264.7 e DH82 estimulados por lipopolissacarídeo (LPS) em comparação com a minaprina pura (Fig. 1CD). A separação cromatográfica em coluna repetida dos reagentes irradiados com 30 kGy levou ao isolamento e purificação do novo derivado de hidropiridzina 2. O novo produto hidroxialquilado 2 foi encontrado para conter grupos funcionais raros com uma porção de nitrogênio na aminopiridazina da minaprina (Fig. 2UMA).
Efeitos da transformação radiolítica da minaprina. (A, B) Cromatogramas de HPLC de (A) minaprina pura e (B) reagente irradiado a 30 kGy. (C, D): produção de NO de minaprina e minaprina irradiada (IR-minaprina) em (C) RAW 264.7 e (D) Células de macrófagos DH82 foram analisadas por um ensaio de reagente de Griess. Os resultados são expressos como média ± DP (n = 3). *p <0.05; **p <0.01; vs. grupo tratado com LPS. 1: minaprina, 2: minprinol.
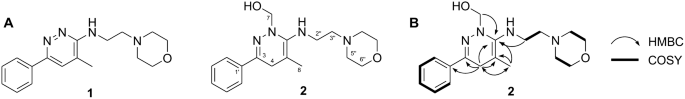
Compound 2 foi purificado como um óleo amarelado, e os máximos de absorção em 219 e 284 nm no espectro UV sugeriram a presença de um esqueleto de hidropiridazina17. O HRESIMS revelou um pico de íon pseudomoelcular em m / z 331.2126 [M + H]+ correspondente à fórmula molecular C18H27N4O2. O 1Espectro H NMR (600 MHz) de 2 em CD3OD mostrou sinais de ressonância de um anel de benzeno em δH 7.90 (2H, dd, J = 8.4, 1.8 Hz, H-2', 6'), 7.51 (1H, dd, J = 8.4, 1.8 Hz, H-4') e 7.49 (2H, t, J = 8.4 Hz, H-3', 5'), 6 sinais de prótons de metileno em δH 3.73 (4H, t, J = 4.2 Hz, H-6″, 7″), 3.61 (2H, t, J = 5.4 Hz, H-2″), 2.77 (2H, t, J = 5.4 Hz, H-3″) e 2.60 (4H, br s, H-5″, 8″), o que sugere a presença de uma fração de benzeno e alquilmorfolina18. Um grupo metil singleto em δH 1.36 (3H, s, H-8) e prótons de metileno em δH 2.94 (1H, d, J = 17.4 Hz, H-4a) e 2.88 (1H, d, J = 17.4 Hz, H-4b). Além disso, os espectros 1D NMR e HSQC revelaram a presença de um substituinte hidroximetil em δH 3.80 (1H, d, J = 11.4 Hz, H-7a) e 3.71 (1H, d, J = 11.4 Hz, H-7b) (Tabela 1).
Dezoito sinais de carbono observados no 13Os espectros C NMR e HSQC podem ser classificados como 9 sp2 carbonos (atribuídos a um anel aromático e três olefinas), 8 carbonos metileno em δC 67.9 (C-6″, 7″), 67.1 (C-7), 56.6 (C-3″), 54.1 (C-5″, 8″), 41.6 (C-2″) e 30.8 (C- 4), e um sinal de metil em δC 19.9 (C-8) (Tabela 1). Os dados acima são indicativos de uma hidropiridazina incomum com porções hidroximetil (Fig. 2A). A estrutura de 2 foi posteriormente confirmado pelo HMBC. As relações HMBC de H-4 a C-3, -5 e -6, de H-8 a C-4 e -6, de H-1' a C-3 e de H-2″ a C- 6, confirmou que 2 tem um esqueleto de aminopiridazina. Os picos cruzados em H-4, -8 e -2″ para C-6 confirmaram que 2 é uma 3-benzil-8-metil-6-aminopiridazina com morfolina localizada em C-6. As funcionalidades hidroximetil foram localizadas na posição de nitrogênio da unidade de aminopiridazina hidratada, conforme suportado pela correlação chave de HMBC entre H-7 e C-6 (Fig. 2B). Assim, a estrutura da incomum hidroaminopiridazina 2 foi totalmente atribuído como minaprinol, que é um novo produto de transformação, conforme mostrado na Fig. 2A.
A radiólise de condições metanólicas na presença de uma atmosfera produz vários radicais livres, como hidroximetil (·CH2OH), hidroxila (.OH), metoxi (CH3O·) e peroxil (HOO·), que são posteriormente síntese verde de novos candidatos a medicamentos19,20. Nossos resultados sugerem que o hidroximetil (·CH2OH) radical também pode estar envolvido na modificação do composto 2 quando a minaprina é exposta à radiação ionizante em solução metanólica. Este é o primeiro exemplo da nova hidroximetilação radiolítica das drogas amionpiridazinas.
Efeitos inibitórios de anti-inflamatórios em células macrófagas estimuladas por LPS
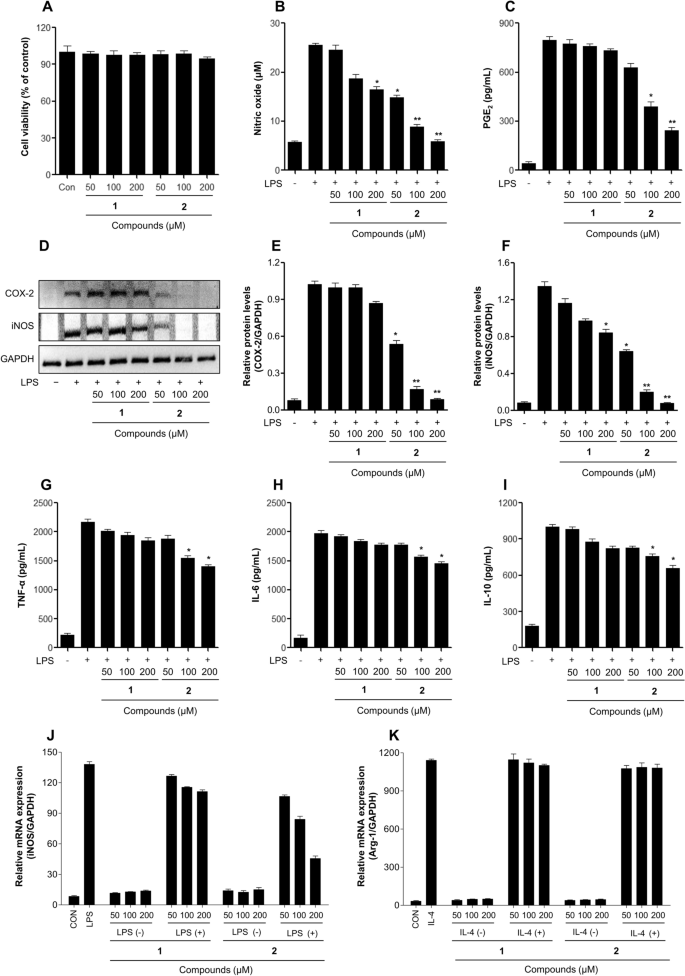
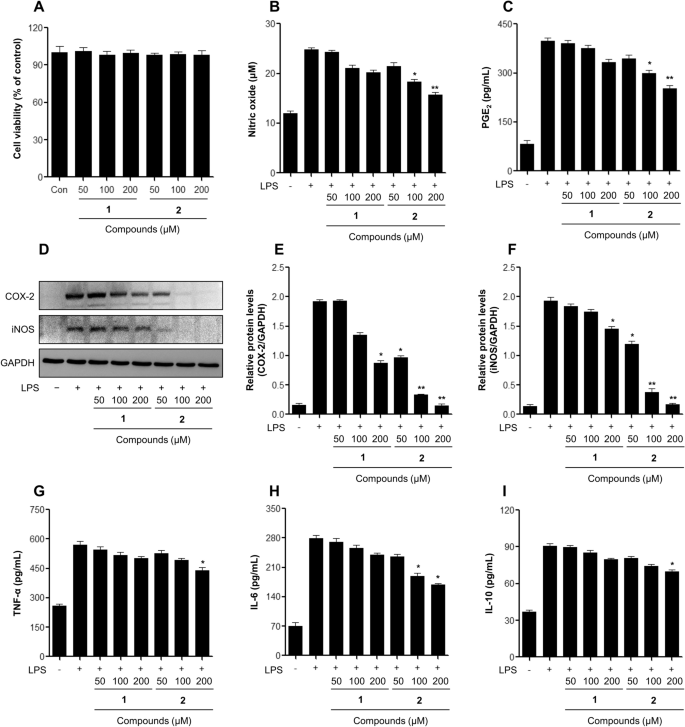
A estrutura do planejador caracterizada por compostos 2 foi avaliada para determinar sua atividade antiinflamatória em células macrófagas RAW 264.7 e DH82. Tratamento com compostos 1 e 2 não afetou a viabilidade das células RAW 264.7 e DH82 a 5% ou menos (até 200 μM) (Figs. 3A e 4A). Nós avaliamos os efeitos anti-inflamatórios do novo derivado de hidropiridazina minaprinol (2) detectando a produção de mediadores pró-inflamatórios, incluindo NO e PGE2 em macrófagos RAW 264.7 e DH82 estimulados por LPS (Figs. 3 e 4).
Efeitos do produto de aminopiridazina nas atividades anti-inflamatórias em células de macrófagos RAW 264.7 estimuladas por LPS. (A) Detecção de viabilidade celular pelo ensaio MTT em células RAW 264.7 após tratamento com amostras por 24 h. As células foram tratadas com amostras por 2 h, seguidas de tratamento com o LPS (0.1 μg/mL) por 24 h. (B) O teor de nitrito do meio de cultura foi analisado por um ensaio de reagente de Griess. (C) A PGE2 o conteúdo de produção dos meios de cultura foi analisado por ELISA. (D, E, F) Expressão de COX-2 (E) e iNOS (F) induzida pelo tratamento de amostras de ambas as células macrófagas RAW 264.7 por 24 h. (G, H, I) Produção de citocinas (G: TNF-α, H:IL-6, I: IL-10) do meio de cultura foi medido por ELISA. (J, K) O iNOS (J) e Arg-1 (K) A expressão de mRNA foi determinada por análise qPCR. A expressão relativa de cada gene foi quantificada usando o nível de expressão do GAPDH mRNA. Os resultados são expressos como média ± DP (n = 3). *p <0.05; **p <0.01; vs. grupo tratado com LPS. 1: minaprina, 2: minprinol.
Efeitos do produto aminopiridazina nas atividades anti-inflamatórias em células macrófagas DH82 estimuladas por LPS. (A) Detecção de viabilidade celular pelo ensaio MTT em células DH82 após tratamento com amostras por 24 h. As células foram tratadas com amostras por 2 h, seguidas de tratamento com o LPS (1 μg/mL) por 24 h. (B) O teor de nitrito do meio de cultura foi analisado por um ensaio de reagente de Griess. (C) A PGE2 o conteúdo de produção dos meios de cultura foi analisado por ELISA. (D, E, F) Expressão de COX-2 (E) e iNOS (F) induzida por tratamento de amostras de ambas as células macrófagas DH82 por 24 h. (G, H, I) Produção de citocinas (G: TNF-α, H:IL-6, I: IL-10) do meio de cultura foi medido por ELISA. Os resultados são expressos como média ± DP (n = 3). *p <0.05; **p <0.01; vs. grupo tratado com LPS. 1: minaprina, 2: minprinol.
Minaprinol (2) possui funcionalidade hidroximetil e, em concentrações de 200 μM, mostrou potentes atividades inibitórias aumentadas contra NO e PGE2 produção em células RAW 264.7 estimuladas com LPS, com reduções de aproximadamente 10.6 μM e 490.4 pg/mL em relação à minaprina parental, respectivamente (Fig. 3B, C). Em células DH82, supressão significativa de NO e PGE2 foi observada (fig. 4B, C). Durante a inflamação, as enzimas COX-2 e iNOS promovem a secreção de mediadores pró-inflamatórios21. Portanto, 2 foi investigado por análise de western blot para determinar se inibia COX-2 e iNOS em células macrófagas induzidas por LPS. Como mostrado nas Figs. 3D e 4D, composto 2 suprimiu a expressão da proteína COX-2 e iNOS induzida por LPS de maneira dose-dependente, resultando na inibição da produção de mediadores pró-inflamatórios, como NO e PGE2.
Foram determinadas alterações na secreção de citocinas pró-inflamatórias, incluindo TNF-α e IL-6, e citocinas anti-inflamatórias, como IL-10, por macrófagos estimulados por LPS. Figura 3G‒I exibe os efeitos inibitórios do produto recém-gerado 2 de minaprina irradiada na secreção de citocinas inflamatórias TNF-α, IL-6 e IL-10 por células RAW 264.7 estimuladas por LPS (Fig. 3). Minaprinol (2) também mostrou maior inibição da produção de citocinas pró e anti-inflamatórias em comparação com a minaprina (1) em células DH82 de canino (Fig. 4G–I). O candidato recém-gerado 2 não afetou os níveis de expressão de mRNA de iNOS e Arg-1 no macrófago RAW 264.7, o que sugere não estar envolvido na polarização do macrófago (Fig. 3J,K). Curiosamente, a hidroximetilação da aminopiridazina induzida por radiação ionizante melhorou as propriedades anti-inflamatórias dos macrófagos estimulados por LPS. Em um estudo recente, crisina e luteolina mostraram atividades anti-inflamatórias melhoradas in vitro e in vivo induzidas por radiação γ, e a estrutura química de compostos substituídos por hidroxialquil foi identificada12,21. Além disso, a transformação radiolítica de alcaloides e esteróides mostrou potentes efeitos anticancerígenos aprimorados em câncer de melanoma, mama, fígado e pulmão11,22,23,24,25.
Mudança de cor e modificação de agentes anti-inflamatórios de minaprina por radiólise
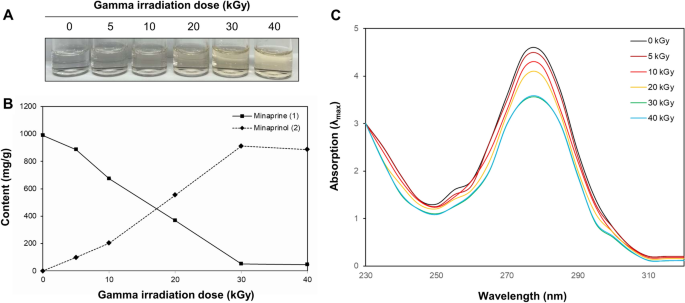
Os efeitos da irradiação ionizante nas mudanças de cor e modificação do novo composto causadas pela hidroximetilação da minaprina, que é o tipo mais comum de hidroaminopiridazina, foram examinados. A cor branca da minaprina foi gradualmente reduzida de maneira dependente da dose e foi efetivamente transformada na dose de 30 kGy de irradiação gama (Fig. 5UMA).
Alteração da propriedade físico-química da minaprina por irradiação gama. (A) As mudanças de cor em condições metanólicas de minaprina após irradiação gama foram monitoradas visualmente. (B) Minaprinol recém-gerado (2) da minaprina (1) transformadas por irradiação gama foram analisadas por HPLC a 280 nm. (C) Alteração das absorções UV (λmax) de minaprina transformada por dose de irradiação gama.
Os conteúdos do composto isolado da mianprina irradiada de 5, 10, 20, 30 e 40 kGy foram quantificados usando o método do padrão externo e os resultados são mostrados na Fig. 5B. Cinco pontos de concentração (n = 5) foram utilizados para a preparação da curva de calibração e a curva de calibração de soluções puras dos compostos padrão foi completamente linear (R2 > 0.999). Os tempos de retenção do minaprinol recém-formado (2, tR 6.3 min) e minaprina (1, tR 8.2 min) foram detectados para cinco reagentes irradiados. A análise quantitativa revelou que o conteúdo absoluto do minaprinol mais potente (2) nas amostras irradiadas a 5, 10, 20, 30 e 40 kGy foram 98.6 ± 0.6, 202.7 ± 1.5, 554.6 ± 1.6, 912.0 ± 2.0 e 886.0 ± 2.0 mg/g, respectivamente, o que está de acordo com a melhora da capacidade antiinflamatória nas células macrófagas de cada amostra. Em contraste, a redução da minaprina (1) foi observado por irradiação ionizante.
As características químicas da minaprina modificada foram verificadas por espectrometria UV (Fig. 5C). A absorbância em 280 nm foi atribuída às ligações de piridazina da minaprina (1). Em contraste, as amostras irradiadas com 30 kGy e a absorbância diminuída em 280 nm em comparação com o controle (0 kGy), o que sugere maior transformação para estrutura principal de diidropiridazina. Esses resultados sugerem que o teor de minaprinol (2) aumentou até 30 kGy dose de radiação ionizante como o principal produto da minaprina. Nossos resultados indicam que a hidroximetilação induzida pela aplicação de radiação ionizante à minaprina pode ser benéfica na supressão da geração de inflamação excessiva em células macrófagas de animais de companhia.
- Conteúdo com tecnologia de SEO e distribuição de relações públicas. Seja amplificado hoje.
- PlatoData.Network Gerativa Vertical Ai. Capacite-se. Acesse aqui.
- PlatoAiStream. Inteligência Web3. Conhecimento Amplificado. Acesse aqui.
- PlatãoESG. Automotivo / EVs, Carbono Tecnologia Limpa, Energia, Ambiente, Solar, Gestão de resíduos. Acesse aqui.
- BlockOffsets. Modernizando a Propriedade de Compensação Ambiental. Acesse aqui.
- Fonte: https://www.nature.com/articles/s41598-023-37812-8