Este blog fornece um mergulho profundo na versão mais recente do FDA eSTAR, versão 5.0, lançada em 6 de dezembro de 2023.
Por que o FDA lançou a nova versão do eSTAR como v5.0 em vez de v4.4?
Uma atualização de versão principal consiste em alterações de política, alterações regulatórias ou alterações importantes no modelo e será indicada por um incremento de número de versão principal (por exemplo, 4.3 a 5.0). Uma atualização de versão secundária consistirá em outras alterações e será indicada por um incremento de número de versão secundária (por exemplo, 4.3 a 4.4). Se houver alterações políticas ou regulatórias, uma nova versão principal do eSTAR será feita antes da data de implementação e a versão anterior do eSTAR será removida. Neste caso, habilitando o conteúdo do PMA, atualizações do piloto internacional do eSTAR com Saúde Canadá, e a implementação de requisitos de documentação de segurança cibernética são consideradas mudanças importantes que desencadeiam a necessidade de uma atualização de versão principal (ou seja, 5.0) em vez de uma atualização de versão secundária (ou seja, 4.4). Estas alterações aplicam-se ao DIV eSTAR e os votos de eSTAR não IVD. Se você geralmente não está familiarizado com o FDA eSTAR, visite nosso Página do curso 510k.
Qual é o prazo para usar a v5.0?
A versão 4.3 do FDA eSTAR, tanto a versão nIVD quanto a versão IVD, serão removidas do site da FDA em 4 de fevereiro de 2024. Quaisquer inscrições enviadas com uma versão expirada do eSTAR serão rejeitadas. Se você já carregou informações para uma versão mais antiga do modelo, você precisará rolar até a parte inferior do eSTAR e exportar os dados para um arquivo HTML. Em seguida, você importa o arquivo HTML para a versão mais recente do eSTAR. Quaisquer anexos feitos na versão mais antiga do modelo não serão exportados e você terá que anexar todos os anexos ao novo modelo.
O conteúdo PMA está habilitado no novo FDA eSTAR
Versões anteriores do FDA eSTAR incluíam a funcionalidade para submissões de aprovação pré-comercialização (PMA), mas na versão 5.0 o FDA finalmente habilitou essa funcionalidade. Os envios de 510 mil têm três tipos: 1) Tradicional, 2) Abreviado e 3) Especial. Os envios de PMA também têm tipos diferentes. Existem dois tipos de envios de PMA para um novo dispositivo: tradicional e modular. Infelizmente, o FDA eSTAR não se destina a PMAs que utilizam a abordagem modular. Para dispositivos de Classe 3, o FDA tem controles mais rigorosos sobre as alterações do que os dispositivos de Classe 1 e 2. Portanto, um Suplemento PMA é necessário para os seguintes tipos de alterações em dispositivos aprovados pela PMA:
- novas indicações de uso;
- mudanças de rotulagem;
- mudanças nas instalações de fabricação ou embalagem;
- mudanças nos métodos de fabricação;
- mudanças nos procedimentos de controle de qualidade;
- mudanças nos procedimentos de esterilização;
- mudanças nas embalagens;
- mudanças nas especificações de desempenho ou design, e
- prorrogação do prazo de validade.
Existem vários tipos de suplementos de PMA, mas apenas três tipos de suplementos podem usar o FDA eSTAR: 1) Panel-Track, 2) 180 dias e 3) Tempo Real. Para determinar que tipo de suplemento de PMA você deve usar, a FDA publicou orientações para modificações em dispositivos sujeitos ao processo de aprovação pré-comercialização.
Conteúdo PMA
As seções a seguir no FDA eSTAR são específicas para os requisitos de conteúdo de envio de PMA:
- Informações do Sistema de Gestão da Qualidade
- Informações sobre instalações
- Planos de estudo pós-mercado (PMS)
- Anexe uma declaração de exclusão ou um Relatório de Avaliação Ambiental de acordo com 21 CFR 814.20(b)(11)
Health Canada está conduzindo um piloto com o FDA eSTAR
O piloto FDA eSTAR da Health Canada está agora completo com um total de 10 participantes (originalmente apenas 9 foram planejados). O piloto testará o uso do eSTAR para inscrições enviadas à Health Canada. Os resultados do piloto deverão estar concluídos em breve, e então esperamos uma extensão do piloto a um número mais amplo de candidatos. Ouvimos rumores de que o HC eSTAR era excessivamente complicado. Esperançosamente, a v5.0 é simplificada.
Houve alguma alteração na seção de testes de EMC?
As perguntas sobre rotulagem da EMC foram consolidadas em uma única pergunta, em vez de quatro, porque normalmente apenas uma citação é fornecida nesta seção. Uma cópia da versão mais antiga é fornecida abaixo.
A versão atualizada 5.0 é mostrada abaixo e possui apenas uma pergunta, mas o texto de ajuda foi alterado.

O FDA eSTAR agora exige mais documentação de segurança cibernética?
Bhoomika Joyappa atualizou nosso instrução de trabalho de segurança cibernética (WI-007) para abordar as orientações atualizadas da FDA para documentação de segurança cibernética. As revisões foram concluídas no início deste mês e você pode adquirir os modelos atualizados em nosso site. Também temos dito aos nossos assinantes para anteciparem uma revisão significativa do FDA eSTAR  modelo quando isso acontecer. O lançamento da versão atualizada do eSTAR demorou pouco mais de dois meses e a mudança resultou em uma seção de três páginas dedicada à documentação de segurança cibernética. As versões anteriores do modelo incluíam um requisito de documentação da gestão de riscos de segurança cibernética e um plano/plano de gestão de segurança cibernética para suporte contínuo. Os seguintes documentos devem ser anexados nesta seção se a segurança cibernética se aplicar ao seu dispositivo:
modelo quando isso acontecer. O lançamento da versão atualizada do eSTAR demorou pouco mais de dois meses e a mudança resultou em uma seção de três páginas dedicada à documentação de segurança cibernética. As versões anteriores do modelo incluíam um requisito de documentação da gestão de riscos de segurança cibernética e um plano/plano de gestão de segurança cibernética para suporte contínuo. Os seguintes documentos devem ser anexados nesta seção se a segurança cibernética se aplicar ao seu dispositivo:
- gestão de risco – relatório (anexar)
- gerenciamento de risco – modelo de ameaça (anexar)
- lista de metodologia de ameaças (caixa de texto)
- verificação de que a documentação do modelo de ameaça inclui (menu suspenso sim/não):
- visão global do sistema
- Visão de danos para vários pacientes
- Visualização de capacidade de atualização/patchabilidade
- Visualizações de casos de uso de segurança
- avaliação de risco de segurança cibernética (anexar)
- números de páginas onde a metodologia e os critérios de aceitação estão documentados (caixa de texto)
- verificação de que a avaliação de risco evita o uso de probabilidade para a avaliação de probabilidade e usa a explorabilidade (menu suspenso sim/não)
- lista de materiais do software ou SBOM (anexar)
- nível de suporte do software e data de término do suporte para cada componente de software (anexo)
- sistema operacional e versão usada (caixa de texto)
- avaliação de segurança e proteção de vulnerabilidades (anexar)
- avaliação de quaisquer anomalias não resolvidas (anexar)
- dados do monitoramento de métricas de segurança cibernética (anexar)
- informações sobre controles de segurança (anexar)
- números das páginas onde cada controle de segurança é endereçado (caixa de texto):
- Controles de autenticação
- Controles de autorização
- Controles de criptografia
- Controles de integridade de código, dados e execução
- Controles de confidencialidade
- Controles de detecção e registro de eventos
- Controles de resiliência e recuperação
- Controles de atualização de firmware e software
- visualizações de arquitetura (anexar)
- testes de segurança cibernética (anexar)
- números de páginas onde a rotulagem de segurança cibernética é fornecida (caixa de texto)
As alterações na seção de esterilidade incluem uma pergunta atualizada sobre resíduos de EO
Na seção de esterilidade do FDA eSTAR havia uma pergunta sobre resíduos de esterilizantes. Especificamente, a pergunta era “Quais são os níveis máximos de resíduos de esterilizante que permanecem no dispositivo?” O espaço disponibilizado para inserção das informações também era pequeno.
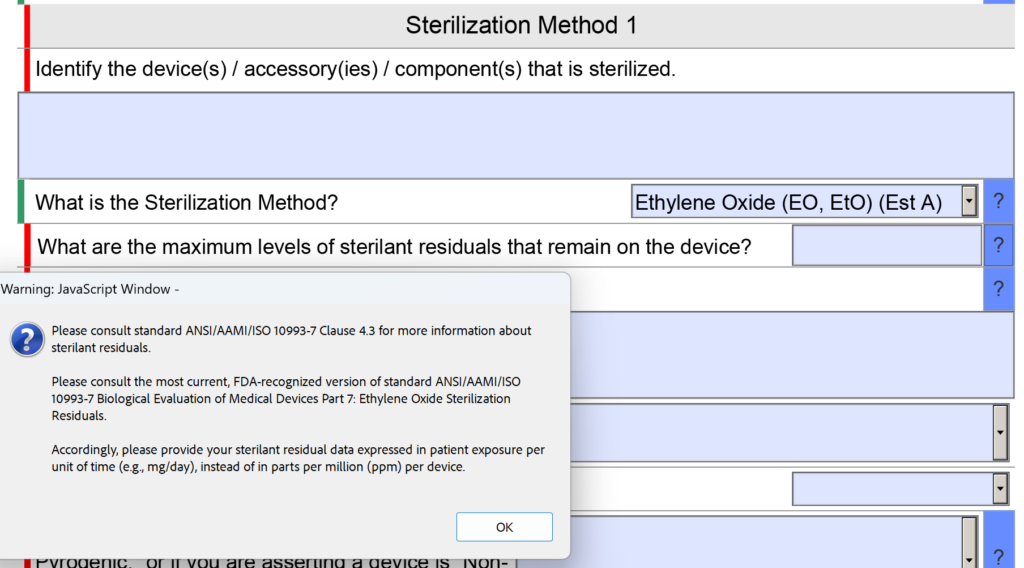
Agora a pergunta foi reformulada para: “Quais são os níveis máximos de resíduos de esterilizante que permanecem no dispositivo e qual é a sua explicação para o motivo pelo qual esses níveis são aceitáveis para o tipo de dispositivo e a duração esperada do contato com o paciente?” Nenhuma alteração foi feita no texto de ajuda desta pergunta.
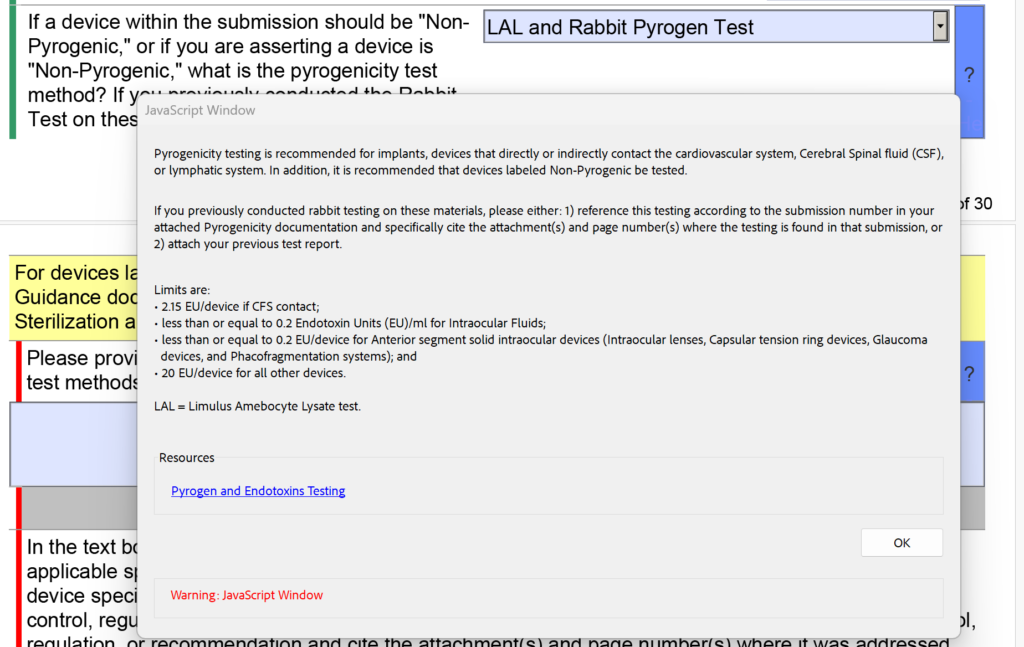
Além das alterações na seção de esterilidade referente aos resíduos de EO, o FDA também modificou o menu suspenso e o texto de ajuda para testes de pirogenicidade. Havia opções para “LAL” e “Teste de Coelho” separadamente, mas agora elas são combinadas em “LAL e Teste de Pirogênio em Coelho”. Além disso, o seguinte texto de ajuda foi adicionado: “Se você já realizou testes em coelhos com esses materiais, por favor: 1) faça referência a este teste de acordo com o número de envio na documentação anexa de Pirogenicidade e cite especificamente o(s) anexo(s) e o número da página (s) onde o teste se encontra nesse envio, ou 2) anexar seu relatório de teste anterior.”
Qual é o prazo para usar a v5.0?
Muitos clientes dizem que recebem uma mensagem de erro quando tentam abrir o modelo FDA eSTAR. Isso ocorre porque eles estão abrindo o eSTAR em um visualizador de PDF em vez do Adobe Acrobat Pro.

Algumas pessoas querem economizar dinheiro usando o software gratuito Adobe Acrobat Reader, mas isso não permitirá que você conclua o eSTAR corretamente. Portanto, o FDA adicionou uma mensagem pop-up se o Adobe Acrobat Reader for usado.
Como os dispositivos com via de gás respiratório são avaliados quanto à biocompatibilidade?
Na captura de tela abaixo, selecionei intencionalmente “Dispositivo de superfície: membrana mucosa” como o tipo de contato tecidual para um dispositivo de via de gás respiratório porque o dispositivo terá um bocal colocado em sua boca (ou seja, membrana mucosa). Este é um erro comum. Na versão 5.0 do FDA eSTAR, o FDA esclarece que esses dispositivos devem ser avaliados como “comunicação externa” e o contato com o tecido é “tecido/osso/dentina”. Especificamente, o contato com o tecido são os pulmões. Por esse motivo, o FDA adicionou o texto de ajuda mostrado abaixo na janela JavaScript referente à aplicabilidade da ISO 18562-1, -2, -3 e -4.
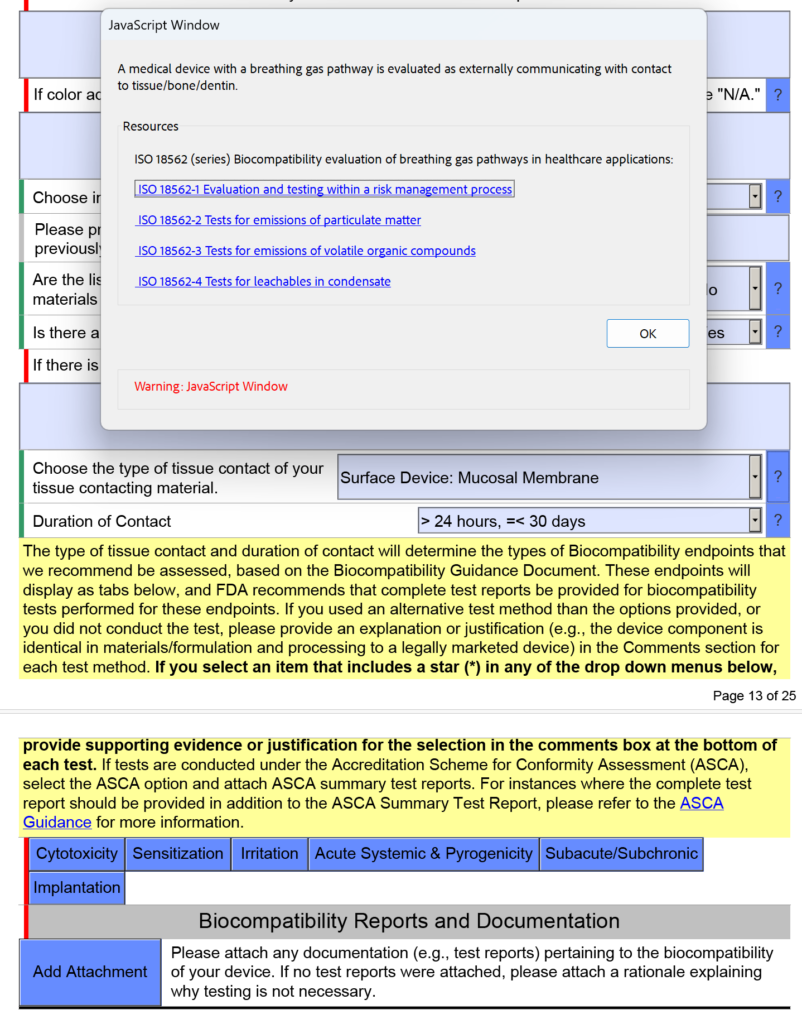
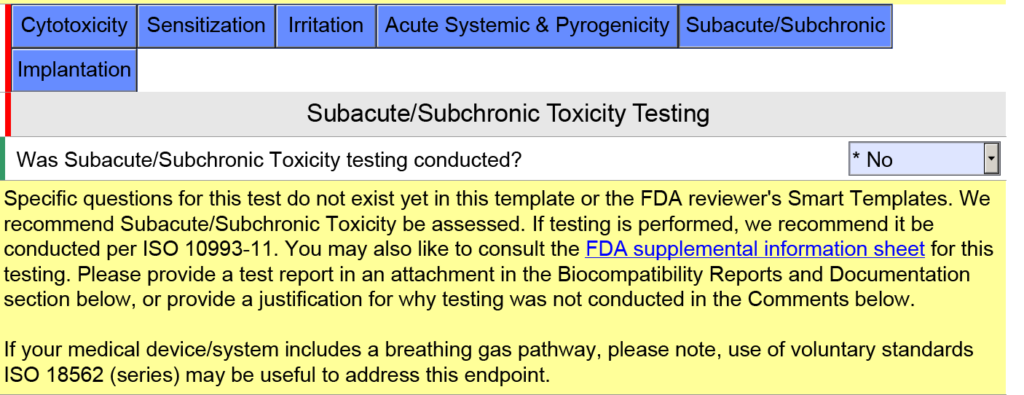
Perguntas e orientações adicionais aparecerão quando você clicar nas caixas azuis individuais mostradas acima. Para a caixa azul denominada “Subagudo/Subcrônico”, você encontrará texto de ajuda adicional relacionado aos padrões ISO 18562. Um texto de ajuda semelhante é encontrado quando você clica na caixa azul chamada “Acute Systemic & Pyrogenicity”.

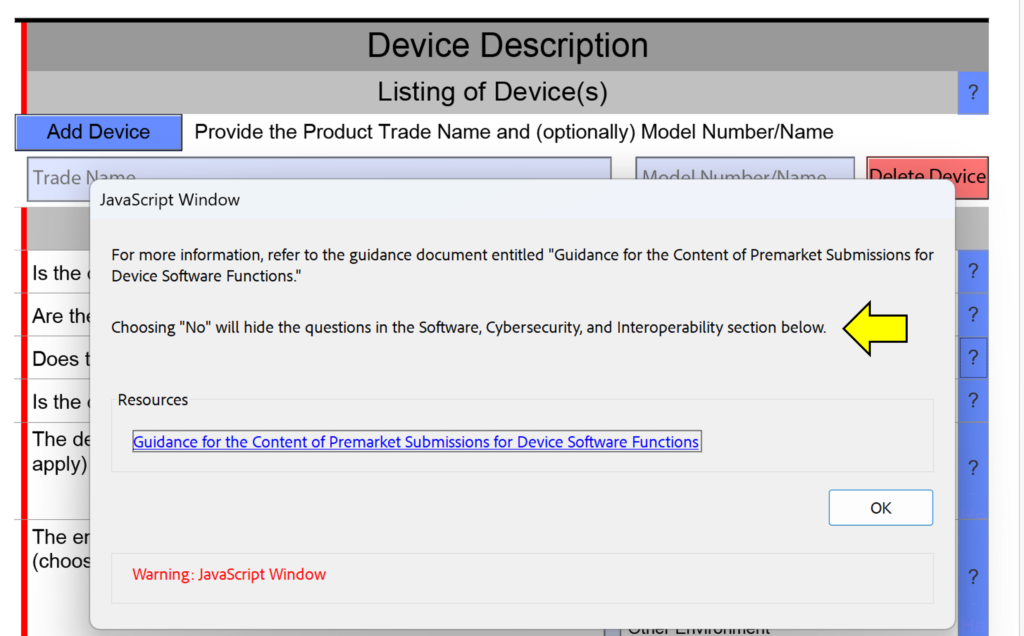
O que é um lembrete de alteração de seção?
Uma das pequenas alterações feitas nesta versão do FDA eSTAR é a adição de “lembretes de alteração de seção transversal” ao texto de ajuda na seção de descrição do dispositivo. Isto não tem o objetivo de ajudá-lo a evitar responder perguntas em sua submissão, porque se você estiver faltando uma seção da submissão porque respondeu “Não” em vez de “Sim”, o revisor da FDA identificará esse erro durante o processo de Revisão Técnica. Isso resultará na suspensão do seu envio e o relógio de revisão será redefinido para zero dias quando você reenviar com as correções feitas. A captura de tela abaixo mostra um exemplo de um desses lembretes de alteração de seção transversal.
Que alterações foram feitas na seção de testes clínicos do FDA eSTAR?
A seção de testes clínicos agora será exibida ao usar Editor de PDF-XChange, mas recomendamos usar apenas o Adobe Acrobat Pro para editar o FDA eSTAR. Esta alteração é uma correção de bug e é específica do nIVD eSTAR. O IVD eSTAR e o nIVD eSTAR incluem uma seção de testes clínicos dentro da seção de testes de desempenho, mas a seção de testes de desempenho é encontrada no FDA eSTAR antes a seção de segurança elétrica e testes EMC, enquanto a seção de testes de desempenho é encontrada depois de seção de segurança elétrica e testes EMC. Se a sua empresa planeja enviar dados clínicos em uma submissão futura à FDA, temos as seguintes recomendações:
- assistir ao Webinars de aprendizagem do CDRH sobre o tema 21 CFR 812
- conduzir uma teleconferência pré-envio para fazer perguntas sobre o protocolo do seu estudo clínico antes do envio ao IRB ou ao conselho de revisão ética
- antes de enviar a solicitação de pré-reunião, observe quais informações clínicas gerais o FDA deseja para um envio De Novo ou PMA no FDA eSTAR

Nota: A seção clínica mostrada acima só é encontrada no FDA eSTAR se você selecionar uma submissão De Novo ou PMA. Se você enviar uma submissão de 510k com dados clínicos, a seção clínica será abreviada conforme mostrado abaixo.

- Conteúdo com tecnologia de SEO e distribuição de relações públicas. Seja amplificado hoje.
- PlatoData.Network Gerativa Vertical Ai. Capacite-se. Acesse aqui.
- PlatoAiStream. Inteligência Web3. Conhecimento Amplificado. Acesse aqui.
- PlatãoESG. Carbono Tecnologia Limpa, Energia, Ambiente, Solar, Gestão de resíduos. Acesse aqui.
- PlatoHealth. Inteligência em Biotecnologia e Ensaios Clínicos. Acesse aqui.
- Fonte: https://medicaldeviceacademy.com/fda-estar/



