(Nanowerk Nieuws) Stel je een wereld voor in je lichaam waar kleine cellen lijken op werkers die weefselstructuren bouwen en repareren. Ze hebben interactie met hun omgeving, waaronder een schavot dat de extracellulaire matrix (ECM) wordt genoemd. Deze steiger lijkt op de bouwplaats, waar cellen instructies krijgen over wat en hoe ze moeten doen. Nu hebben wetenschappers deze bouwplaats onderzocht om te begrijpen hoe het veranderen van de stijfheid van dit schavot, zoals het zachter of harder maken, een speciaal type cel beïnvloedt: stamcellen. Deze stamcellen zijn net als de universele bouwers, die in verschillende celtypen kunnen veranderen om te helpen bij reparaties. Wat is hier zo interessant aan? Stel je voor dat we het gedrag van deze cellen zouden kunnen beïnvloeden door simpelweg de stijfheid van hun bouwplaats te veranderen.
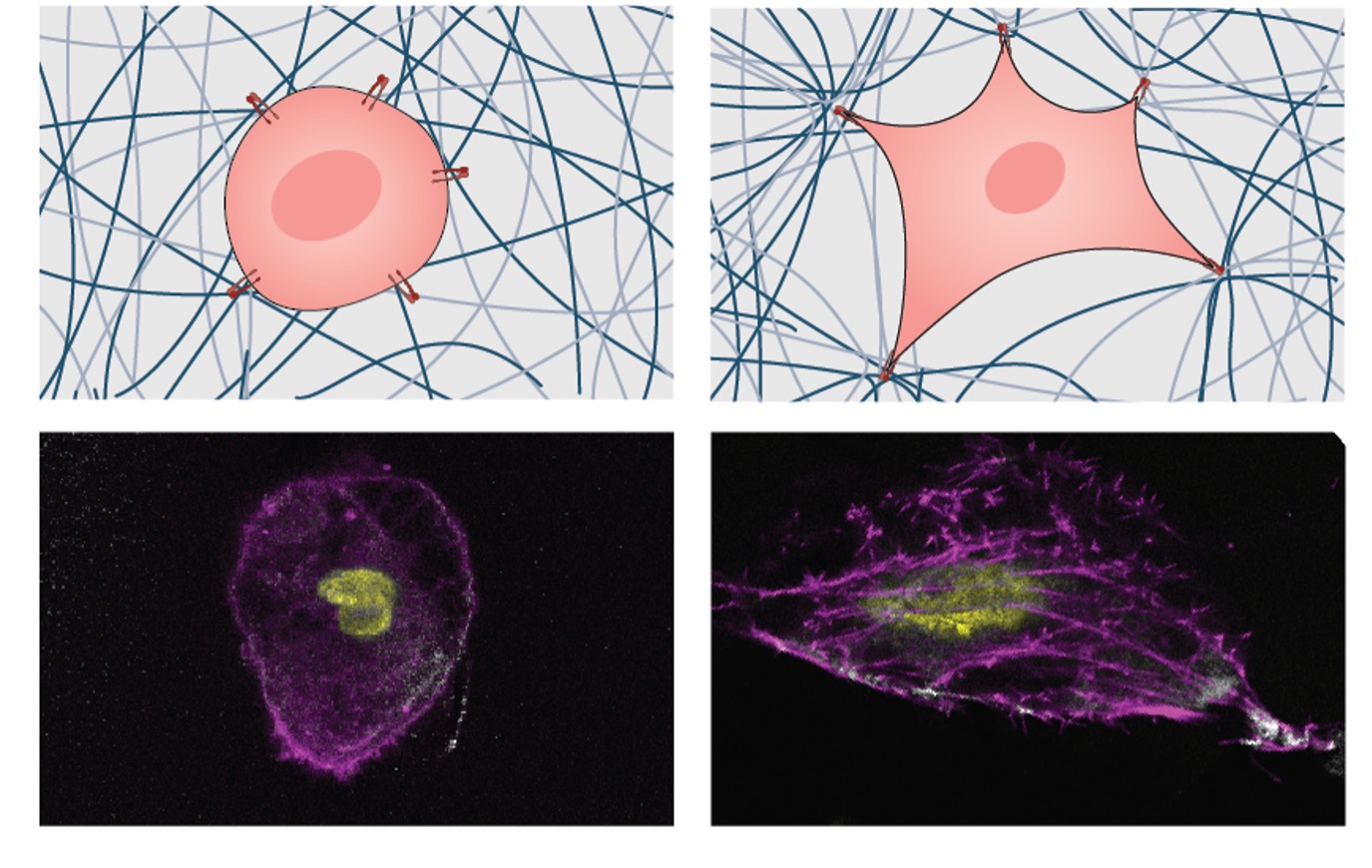 Het team merkte op dat de stijve hydrogels de opkomende ECM-productie en -remodellering bevorderden, wat een mechanotransductiecascade veroorzaakte. Deze veranderingen werden veroorzaakt door intracellulaire PI3AKT-signalering, regulatie van epigenetische modificatoren en activering van YAP/TAZ. (Afbeelding: met dank aan de onderzoekers) In een recente studie gepubliceerd in het tijdschrift biomaterialen (“Door stijfheid geassisteerde hermodellering van de celmatrix worden 3D-mechanotransductie-regulatieprogramma’s geactiveerd”), Dr. Akhilesh Gaharwar, professor en onderzoeksdirecteur van de afdeling Biomedische Technologie, en Dr. Irtisha Singh, assistent-professor bij de afdeling Celbiologie en Genetica, hebben een nieuwe klasse van hydrogelen, een geleiachtig materiaal om te bestuderen hoe cellen bewegen en reageren op stijfheid. Ze gebruikten nanodeeltjes om het schavot stijver te maken, zonder verder iets te veranderen. Het is alsof je meer steunbalken aan een gebouw toevoegt zonder de stenen te veranderen. Wat ze ontdekten was fascinerend. “Toen de rigiditeit van het skelet werd vergroot, ondergingen de cellen morfologische veranderingen en vertoonden ze verbeterd proliferatief gedrag, wat duidde op versnelde groeisignalering”, aldus Gaharwar. “Dit fenomeen is een voorbeeld van ‘3D-mechanotransductie’ – een proces waarbij cellen de mechanische eigenschappen van hun omringende matrix waarnemen en erop reageren.” Maar hier wordt het nog spannender. Toen ze stamcellen in deze stijvere omgeving introduceerden, gebeurde er iets verbazingwekkends. Deze stamcellen voelden ook de verandering in stijfheid en transformeerden in gespecialiseerde reparatiecellen, klaar om eventuele schade te herstellen. “3D-mechanotransductie functioneert als een ingewikkeld cellulair communicatiemechanisme met de extracellulaire matrix”, legt Singh uit. “Veranderingen in de stijfheid van de matrix brengen verschillende signalen over, die tot uiteenlopende reacties leiden: in kankercellen bevordert een verhoogde stijfheid doorgaans agressieve fenotypes, terwijl het in stamcellen differentiatie in reparatieve lijnen kan initiëren.” Deze ontdekking is ongelooflijk belangrijk omdat het betekent dat we mogelijk kunnen bepalen hoe cellen zich gedragen door de stijfheid van hun omgeving te manipuleren. In de context van kanker is het alsof we een signaal kunnen afgeven om de kankercellen te vertragen en de reparatieploeg aan te moedigen om binnen te komen en de schade te herstellen. In eenvoudige bewoordingen leren we hoe we de taal van cellen moeten spreken en hen instructies kunnen geven door het gevoel van hun omgeving te veranderen. Dit zou nieuwe manieren kunnen openen om kanker te begrijpen en te behandelen, allemaal door gebruik te maken van de kracht van 3D-mechanotransductie. Hoewel er nog meer te ontdekken valt, biedt dit onderzoek hoop op een toekomst waarin we betere hulpmiddelen hebben om deze complexe ziekte te bestrijden. Andere medewerkers zijn onder meer Dr. Tanmay Lele, een onderzoeker van het Cancer Prevention and Research Institute of Texas (CPRIT) en professor op de afdeling biomedische technologie van de Texas A&M University.
Het team merkte op dat de stijve hydrogels de opkomende ECM-productie en -remodellering bevorderden, wat een mechanotransductiecascade veroorzaakte. Deze veranderingen werden veroorzaakt door intracellulaire PI3AKT-signalering, regulatie van epigenetische modificatoren en activering van YAP/TAZ. (Afbeelding: met dank aan de onderzoekers) In een recente studie gepubliceerd in het tijdschrift biomaterialen (“Door stijfheid geassisteerde hermodellering van de celmatrix worden 3D-mechanotransductie-regulatieprogramma’s geactiveerd”), Dr. Akhilesh Gaharwar, professor en onderzoeksdirecteur van de afdeling Biomedische Technologie, en Dr. Irtisha Singh, assistent-professor bij de afdeling Celbiologie en Genetica, hebben een nieuwe klasse van hydrogelen, een geleiachtig materiaal om te bestuderen hoe cellen bewegen en reageren op stijfheid. Ze gebruikten nanodeeltjes om het schavot stijver te maken, zonder verder iets te veranderen. Het is alsof je meer steunbalken aan een gebouw toevoegt zonder de stenen te veranderen. Wat ze ontdekten was fascinerend. “Toen de rigiditeit van het skelet werd vergroot, ondergingen de cellen morfologische veranderingen en vertoonden ze verbeterd proliferatief gedrag, wat duidde op versnelde groeisignalering”, aldus Gaharwar. “Dit fenomeen is een voorbeeld van ‘3D-mechanotransductie’ – een proces waarbij cellen de mechanische eigenschappen van hun omringende matrix waarnemen en erop reageren.” Maar hier wordt het nog spannender. Toen ze stamcellen in deze stijvere omgeving introduceerden, gebeurde er iets verbazingwekkends. Deze stamcellen voelden ook de verandering in stijfheid en transformeerden in gespecialiseerde reparatiecellen, klaar om eventuele schade te herstellen. “3D-mechanotransductie functioneert als een ingewikkeld cellulair communicatiemechanisme met de extracellulaire matrix”, legt Singh uit. “Veranderingen in de stijfheid van de matrix brengen verschillende signalen over, die tot uiteenlopende reacties leiden: in kankercellen bevordert een verhoogde stijfheid doorgaans agressieve fenotypes, terwijl het in stamcellen differentiatie in reparatieve lijnen kan initiëren.” Deze ontdekking is ongelooflijk belangrijk omdat het betekent dat we mogelijk kunnen bepalen hoe cellen zich gedragen door de stijfheid van hun omgeving te manipuleren. In de context van kanker is het alsof we een signaal kunnen afgeven om de kankercellen te vertragen en de reparatieploeg aan te moedigen om binnen te komen en de schade te herstellen. In eenvoudige bewoordingen leren we hoe we de taal van cellen moeten spreken en hen instructies kunnen geven door het gevoel van hun omgeving te veranderen. Dit zou nieuwe manieren kunnen openen om kanker te begrijpen en te behandelen, allemaal door gebruik te maken van de kracht van 3D-mechanotransductie. Hoewel er nog meer te ontdekken valt, biedt dit onderzoek hoop op een toekomst waarin we betere hulpmiddelen hebben om deze complexe ziekte te bestrijden. Andere medewerkers zijn onder meer Dr. Tanmay Lele, een onderzoeker van het Cancer Prevention and Research Institute of Texas (CPRIT) en professor op de afdeling biomedische technologie van de Texas A&M University.
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://www.nanowerk.com/nanotechnology-news3/newsid=64680.php



