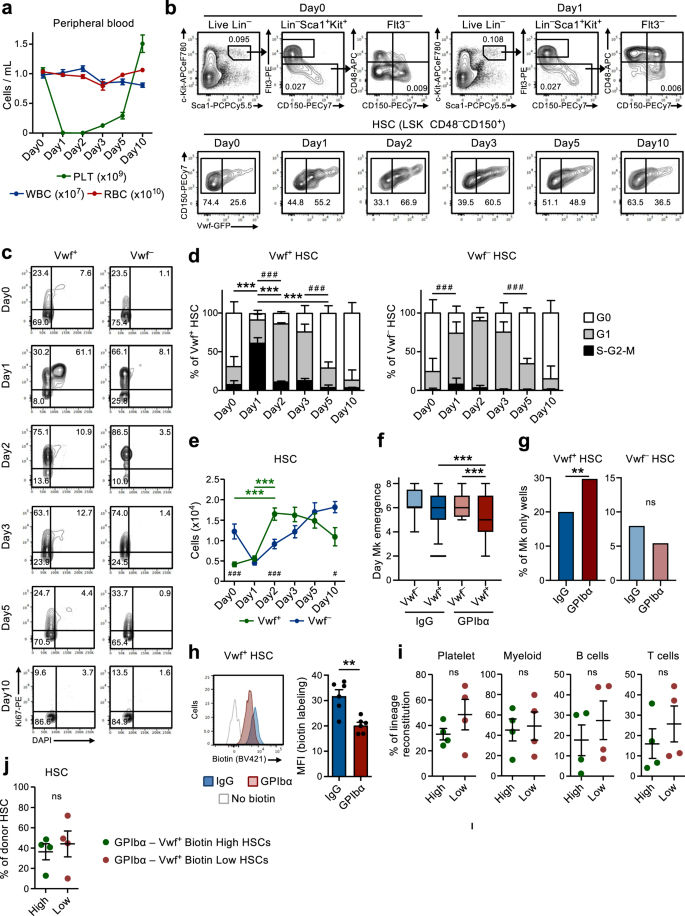
Acute uitputting van bloedplaatjes zorgt ervoor dat rustende HSC's snel in proliferatie terechtkomen
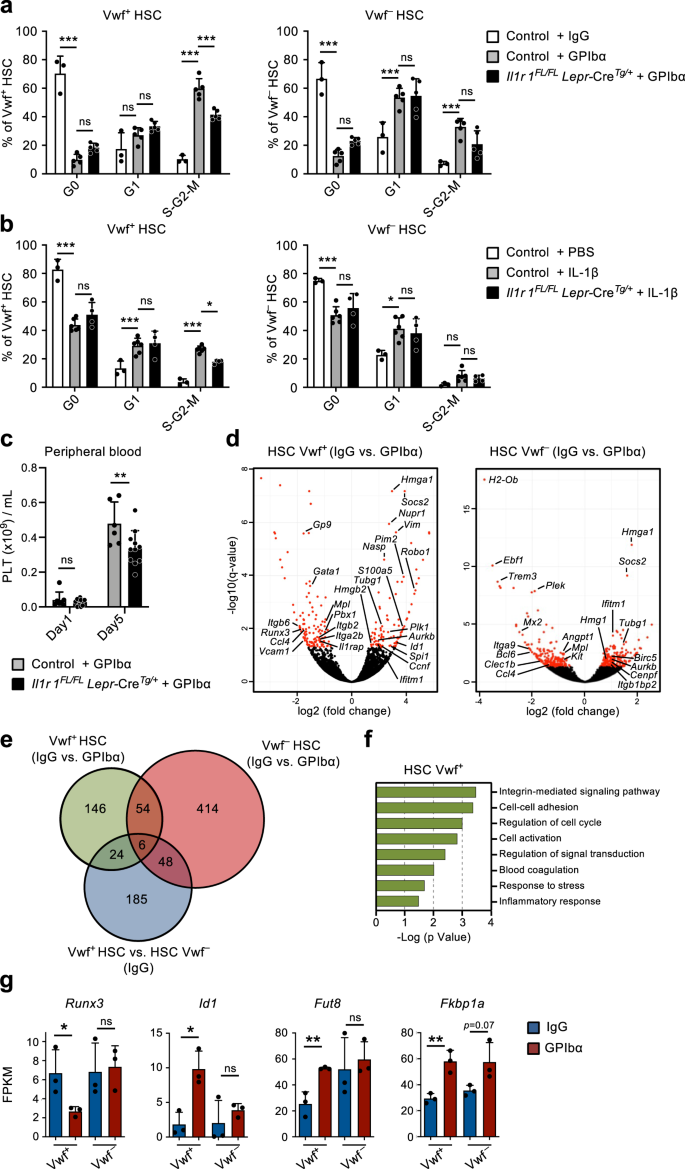
In overeenstemming met eerdere studies9, toediening van een enkele dosis anti-GPIba-antilichaam tegen Vwf-GFP-muizen, om de trombocytopenie na te bootsen die wordt waargenomen bij patiënten met immuuntrombocytopenie purpura (ITP), verarmen snel en efficiënt bloedplaatjes in de loop van 1 dag zonder andere bloedcellijnen significant te beïnvloeden (Fig. 1a). Dit ging gepaard met een snelle (binnen 1 dag) celcyclusactivatie van Lin-Scha1+cKit+ (LSK) Flt3-CD48-CD150+ HSC's. Rekrutering in de actieve celcyclus werd bij voorkeur waargenomen binnen de celcyclus Vwf-GFP+ (Vwf+) HSC-compartiment (afb. 1b-d), dat verrijkt is met bloedplaatjes-vooringenomen HSC's, maar voornamelijk reconstituerende HSC's uit meerdere lijnen bevat9,18. Terwijl ruim 60% van Vwf+ LSKFlt3-CD48-CD150+ HSC's kwamen in slechts een klein deel van de S-G2-M-fase van de celcyclus terecht Vwf-GFP- (Vwf-) HSC's kwamen S-G2-M binnen. Toch zijn de meeste Vwf- HSC's gingen van een rustige (G0) naar een meer geactiveerde G1-fase (Fig. 1c, d).
(Gerelateerd aan aanvullende figuren. 1 en 2). a Kinetische analyse van perifere bloedcelparameters na toediening van anti-GPIbα-antilichaam. Muizen op dag 0 werden behandeld met IgG-isotype-controle-antilichaam. Gegevens vertegenwoordigen gemiddelde ± SEM van 10 (dag 0), 13 (dag 1), 10 (dag 2), 9 (dag 3), 8 (dag 5) en 7 (dag 10) muizen uit 14 onafhankelijke experimenten. PLT-bloedplaatjes, WBC-witte bloedcellen, RBC-rode bloedcellen. b Representatieve FACS-profielen en poortstrategie van Vwf-GFP+ (Vwf+) en Vwf-GFP- (Vwf-) LSKFlt3-CD150+CD48- HSC's op de aangegeven tijdstippen na uitputting van bloedplaatjes. Getallen in poorten/kwadranten geven de frequentie aan (gemiddelde van alle geanalyseerde muizen) van de gated celpopulatie onder het totale aantal levende cellen (bovenste panelen) of onder HSC's (onderste panelen). c, d Celcyclusanalyse van Vwf+ en Vwf- LSKFlt3-CD150+CD48- HSC's op de aangegeven tijdstippen na de uitputting van bloedplaatjes. c Representatieve FACS-profielen van de celcyclus van Vwf+ (links) en Vwf- (rechts) HSC's in G0 (DAPI-Ki67-) G1 (DAPI-Ki67+) of S-G2-M (DAPI+Ki67+) fasen van de celcyclus. Getallen in poorten vertegenwoordigen frequenties (gemiddelde van alle geanalyseerde muizen) van totale HSC's. d Gemiddelde ± SD celcyclusfaseverdeling van Vwf+ (links) en Vwf- (rechts) HSC's. Gegevens van 5 (Dag 0), 5 (Dag 1), 3 (Dag 2), 5 (Dag 3), 5 (Dag 5) en 4 (Dag 10) muizen uit 6 onafhankelijke experimenten. ***p <0.001; **p < 0.01 voor de S-G2-M-celcyclusfractie; # # #p <0.001 voor de G1-celcyclusfractie (beide met behulp van 2-weg ANOVA met de meervoudige vergelijkingen van Tukey); e Absolute aantallen Vwf+ en Vwf- HSC's (per 2 poten, zie methoden). Gemiddelde ± SEM-gegevens van 8 (Dag 0), 8 (Dag 1), 7 (Dag 2), 5 (Dag 3), 6 (Dag 5) en 5 (Dag 10) muizen uit 9 onafhankelijke experimenten. ***p < 0.001 voor Vwf+ HSC (2-weg ANOVA met de meerdere vergelijkingen van Tukey); #p < 0.05 en ###p < 0.001 voor de vergelijking van Vwf+ versus Vwf- HSC's (2-weg ANOVA met de meerdere vergelijkingen van Sidak). Tijdstip van verschijning van de eerste Mk (f) en frequentie van kolonies met alleen Mk-cellen (g) in gekweekte enkelvoudige Vwf-of Vwf+ HSC's geïsoleerd uit muizen 16 uur na IgG- of GPIbα-behandeling. Gegevens van respectievelijk 138, 364, 147 en 451 uit een enkele cel afkomstige kolonies, geanalyseerd uit respectievelijk 5 biologische replicaten in 4 onafhankelijke experimenten. f De middelste lijn vertegenwoordigt de mediaan, de kadergrenzen vertegenwoordigen de 25-75 percentielen, de snorharen markeren de 5-95 percentielen. Cellen buiten de 5-95 percentielen worden gemarkeerd als uitschieters. P waarden berekend met de Kruskal-Wallis-test met de meervoudige vergelijkingen van Dunn. g P waarde berekend met de tweezijdige Fisher's exact-test. ***p <0.001; **p < 0.01; *p < 0.05; ns, niet-significant (p > 0.05). h Biotineproliferatieanalyse van Vwf-GFP+ HSC's 2 dagen na IgG- of GPIbα-behandeling. Representatieve plot (links) en gemiddelde ± SD MFI (genormaliseerd voor MFI van geen controle op biotine-labeling; rechts) van 6 muizen per groep in 3 onafhankelijke experimenten. **p <0.01; berekend met een tweezijdige t-test. Langdurige reconstitutie (16 weken) van bloedplaatjes-, myeloïde en lymfoïde cellijnen in het bloed (i) en van het BM HSC-compartiment (j) door biotine hoog en biotine laag Vwf-GFP+ HSC-fracties 2 dagen na uitputting van bloedplaatjes. 50 cellen getransplanteerd per muis. Gegevens vertegenwoordigen gemiddelde ± SEM van 4 donoren in 2 onafhankelijke experimenten. Elke stip vertegenwoordigt het gemiddelde van twee ontvangende muizen die per donor zijn getransplanteerd. ns, niet-significant (p > 0.05); berekend met tweezijdige t-toetsen. Zie ook aanvullende figuren. 1 en 2.
Vervolgens probeerden we de mechanistische basis voor de HSC-activering die werd waargenomen na de uitputting van bloedplaatjes verder te onderzoeken. Het anti-GPIbα-antilichaam bindt aan GPIbα (CD42b), de receptor voor trombine en VWF19, wat leidt tot activatie van bloedplaatjes, desialylatie en daaropvolgende klaring op een Fc-receptor-onafhankelijke manier20. GPIbα komt specifiek tot expressie in de megakaryocytische (Mk)-bloedplaatjeslijn, inclusief op MkP's, maar belangrijk voor onze onderzoeken en zoals eerder gerapporteerd door anderen21is GPIbα-expressie vrijwel niet detecteerbaar op HSC's (aanvullende figuur XNUMX). 1a). Na de aanvankelijke uitputting van bloedplaatjes herstelde het aantal bloedplaatjes zich langzaam, waarbij het normale aantal bloedplaatjes tussen dag 5 en 10 na de uitputting werd hersteld (Fig. 1a). Deze uitputting van bloedplaatjes leidde met name tot een viervoudige toename van het aantal Vwf+ LSKFlt3-CD48-CD150+ HSC's met 2 dagen, terwijl Vwf- HSC's namen toe met langzamere kinetiek na een initiële reductie (Fig. 1e). Vervolgens heeft de Vwf+/Vwf- De HSC-ratio en de absolute aantallen keerden geleidelijk terug naar normaal, gelijktijdig met de normalisatie van het aantal bloedplaatjes (Fig. 1a, e). De stijging van Vwf+ HSC's gingen ook gepaard met een selectieve toename van het aantal LSK Flt3-CD48+CD150+ subset van MPP's (Fig. 1b en aanvullende afb. 1b) blijkt Mk-vooringenomen te zijn22. Verder MkP's23 waren enkele dagen na de verhoging van Vwf ook aanzienlijk gestegen+ HSC's, terwijl erytroïde (Pre-CFU-E) en myeloïde (GMP) voorlopercellen niet significant werden beïnvloed (aanvullende figuur XNUMX). 1c, d). Opmerkelijk is dat, ondanks hun robuuste GPIbα-expressie en in overeenstemming met het Fc-onafhankelijke mechanisme waardoor het antilichaam leidt tot uitputting van bloedplaatjes20waren MkP's aanvankelijk enigszins (hoewel niet significant) verminderd, terwijl Mk's niet waren uitgeput in BM door toediening van antilichamen (aanvullende figuur XNUMX). 1d-g). Na de snelle initiële activering keerden HSC's snel terug naar rust, waarbij al 5 dagen na de uitputting van de bloedplaatjes een genormaliseerde faseverdeling van de celcyclus werd waargenomen (Fig. 1c, d). Een alternatief monoklonaal antilichaam (NIT E)20 verarmde bloedplaatjes en geactiveerde Vwf+ en Vwf- HSC-celcyclus op een vergelijkbare manier als het anti-GPIbα-antilichaam (aanvullende figuur XNUMX). 2a, b). Behandeling met GPIbα-antilichamen ging gepaard met een milde en voorbijgaande splenomegalie met verhoogde aantallen Vwf+ maar niet vwf- HSC's in de milt (aanvullende figuur XNUMX). 2c, d).
De rekrutering van rustende LSKFlt3-CD48-CD150+ BM-cellen die prolifereren na acute activering en uitputting van bloedplaatjes impliceren het bestaan van een feedbackmechanisme waarmee rustende HSC's worden gerekruteerd om de Mk- en bloedplaatjeshomeostase te herstellen. Om te onderzoeken of HSC's van muizen met een tekort aan bloedplaatjes efficiënter zijn in het genereren van Mks, hebben we een in vitro differentiatietest voor Mk / GM met één cel gebruikt. Clonogeniciteit van enkele Vwf+ of Vwf- LSKFlt3-CD48-CD150+ HSC's geïsoleerd uit muizen in homeostase (IgG) of na uitputting van bloedplaatjes (GPIbα) waren vergelijkbaar (~ 80%; aanvullende figuur XNUMX). 2e). Echter, enkele Vwf+ HSC's geïsoleerd uit muizen met verarmde bloedplaatjes differentieerden sneller in Mks dan in Vwf- HSC's van muizen met verarmde bloedplaatjes of Vwf+ HSC's geïsoleerd uit muizen in homeostase (Fig. 1f) en genereerde ook een groter aantal kolonies die uitsluitend uit Mks bestonden (Fig. 1g en aanvullende afb. 2f, gr). Van stamachtige Mk-gecommitteerde voorlopercellen die fenotypisch op HSC's lijken, is eerder aangetoond dat ze prolifereren als reactie op door poly (I: C) geïnduceerde trombocytopenie24. Om daarom definitiefer vast te stellen dat LSKFlt3-CD48-CD150+ BM-cellen die zijn geïnduceerd om te prolifereren als reactie op door anti-GPIbα geïnduceerde uitputting van bloedplaatjes omvatten echte herbevolkende HSC's op de lange termijn, we gebruikten doxycycline-induceerbare (tet-ON) H2B-mCherry-muizen6,25. In dit systeem resulteert een behandeling met doxycycline in de opname van met mCherry gelabelde histonen in nucleosomen, die zich gelijkmatig verdelen tussen dochtercellen wanneer cellen prolifereren. In overeenstemming met de celcyclusanalyse (Fig. 1c, d), resulteerde anti-GPIbα-geïnduceerde uitputting van bloedplaatjes in een verhoogde proliferatie van HSC's, zoals blijkt uit de verhoogde verdunning van de mCherry-labeling na 3 dagen (aanvullende figuur XNUMX). 2h). Belangrijk is dat FACS mCherry heeft gesorteerdlo (proliferatief) LSKFlt3-CD48-CD150+ cellen gesorteerd van muizen met verarmde bloedplaatjes hadden in vivo lange termijn (LT; 16 weken) reconstitutiepotentieel van meerdere lijnen (aanvullende figuur XNUMX). 2i), wat aantoont dat door anti-GPIbα geïnduceerde uitputting van bloedplaatjes krachtige LT-HSC's rekruteert voor proliferatie. Om Vwf directer te vergelijken+ HSC's die geactiveerd worden of die in een niet-prolifererende toestand blijven na uitputting van bloedplaatjes, gebruikten we een niet-invasieve labelingsmethode gebaseerd op de injectie van het N-hydroxilsulfosuccinimide-biotinederivaat (biotine), dat op efficiënte wijze de membraaneiwitten van alle BM-cellen labelt26. Wanneer cellen zich delen, worden gelabelde membraaneiwitten gelijkmatig verdeeld over dochtercellen, waardoor de analyse van de geschiedenis van de celdeling in vivo mogelijk wordt. Op dezelfde manier als bij het H2B-mCherry-model resulteerde de uitputting van bloedplaatjes in een verminderde biotine-labeling van Vwf+ HSC's (afb. 1h) en ook van Vwf- HSC's (aanvullende figuur XNUMX). 2j). De verschillen waargenomen in de celcyclus- en proliferatieanalyses van Vwf- HSC's zouden mogelijk de eerder beschreven hiërarchische relatie tussen Vwf kunnen weerspiegelen+ en Vwf- HSC's9. Dus de proliferatie van Vwf+ HSC's kunnen differentiëren tot Vwf- HCS, die de geschiedenis van de verdunning van biotinelabels overneemt. Belangrijk is dat FACS Vwf+Biotinelo (proliferatief) LSKFlt3-CD48-CD150+ cellen gesorteerd van muizen met verarmde bloedplaatjes (aanvullende figuur XNUMX). 2k, l) hadden in vivo lange termijn (LT; 16 weken) multilineage reconstitutiepotentieel (Fig. 1i), wat aantoont dat door anti-GPIbα geïnduceerde uitputting van bloedplaatjes krachtige LT-HSC's rekruteert voor proliferatie. Hoewel het de bloedplaatjes krachtig aanvulde, werd er bij de Vwf geen significante bloedplaatjesafwijking waargenomen+ HSC's prolifereren als reactie op de uitputting van bloedplaatjes, in vergelijking met niet-proliferatieve (biotineHi) Vwf+ HSC's (afb. 1i). Hoe dan ook, beide biotinefracties van Vwf+ HSC's vertoonden een vergelijkbare LT-HSC-reconstitutie (Fig. 1j) en waren over het algemeen even efficiënt in het genereren van de Vwf+ en Vwf- HSC-compartimenten (aanvullende afb. 2m). Dit komt overeen met het feit dat functioneel gedefinieerde LT-HSC’s worden gerekruteerd voor proliferatie en met het feit dat de relatieve proporties van Vwf+ en Vwf- HSC's keren grotendeels terug naar normaal zodra de homeostase is hersteld (Fig. 1b, e).
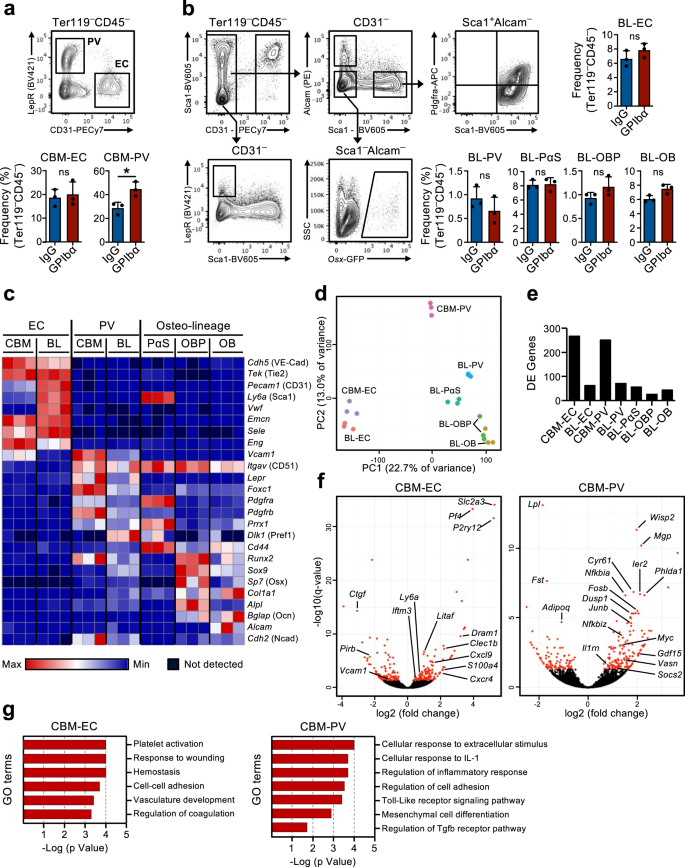
Transcriptionele herprogrammering van de HSC-niche als reactie op acute uitputting van bloedplaatjes
Het bestaan van een feedbackmechanisme waarmee rustende HSC's worden gerekruteerd voor proliferatie als reactie op de uitputting van bloedplaatjes impliceert dat HSC's in het BM in staat moeten zijn de vraag naar bloedplaatjesproductie te voelen. Onze hypothese was dat stromale nichecellen in het beenmerg bij dit proces betrokken zouden kunnen zijn. In feite zijn eerder veranderingen in de BM-niche na uitputting van bloedplaatjes gesuggereerd16,17 maar de betrokkenheid van specifieke nichecellen bij het reguleren van de HSC-functie in deze context is niet direct aangetoond. Daarom hebben we een globale RNA-sequencing-analyse van eerder gekarakteriseerde BM-nichecelpopulaties en HSC's gebruikt om mogelijke moleculaire interacties tussen deze cellen te onderzoeken, die betrokken zijn bij de HSC-reactie op de uitputting van bloedplaatjes. Hiervoor werden uit twee beschreven niet-hematopoietische cellen geïsoleerd27,28,29 verschillende anatomische gebieden in BM: de centrale BM (CBM) cellen en de botvoering (BL) cellen (aanvullende figuur XNUMX). 3a). Binnen de CD45-Ter119- niet-hematopoëtische cellen in zowel BL- als CBM-fracties, verschillende nichecelpopulaties worden gedefinieerd als CD31Hi endotheelcellen (EC) en CD31-Lepr+ perivasculaire cellen (PV). In de BL-fractie hebben we CD31 verder gedefinieerd-Alcam-Pdgfrα+Scha1+ (PαS) mesenchymale voorlopercellen, evenals CD31-Alcam-Scha1-osx-GFP+ osteoblastvoorlopercellen (OBP) en CD31-Alcam+Scha1- osteoblasten (OB) (fig. 2a, b). Flowcytometrische analyse van deze cellen geïsoleerd uit muizen in homeostase en 1 dag na uitputting van bloedplaatjes bracht geen grote veranderingen in de cellulaire samenstelling aan het licht, naast een kleine maar significante toename in CBM-PV-cellen (Fig. 2a, b). RNA-sequencing-analyse toonde een duidelijke clustering van de verschillende endotheliale, mesenchymale en HSC-populaties (aanvullende figuur XNUMX). 3b). De expressie van bekende markers die de verschillende nichecelpopulaties definiëren (Fig. 2c en aanvullende gegevens 1) en van verschillende hematopoietische regulatoren geclusterd op basis van genexpressiepatroon (aanvullende figuur XNUMX). 3c en aanvullende gegevens 1), bevestigde verder hun verschillende celidentiteiten. Bovendien toonde hoofdcomponentenanalyse (PCA) van de nichecelpopulaties de scheiding aan van de endotheliale en mesenchymale afstammingscellen langs de hoofdcomponent (PC) 1-as en een verdere scheiding van mesenchymale populaties langs de PC2-as op basis van het stadium van differentiatie (Fig. 2d). Differentiële genexpressieanalyse, waarbij nichecellen werden vergeleken die waren geïsoleerd uit muizen in homeostase en 1 dag na uitputting van bloedplaatjes, toonde een hoog aantal differentieel tot expressie gebrachte (DE) genen in CBM-EC (266 genen) en CBM-PV (249 genen) cellen (Fig. . 2e, f en aanvullende gegevens 2, 3). Daarentegen werd een veel lager aantal DE-genen gedetecteerd in andere nichepopulaties, waaronder de overeenkomstige bot-geassocieerde BL-EC en BL-PV) (Fig. 2e, fAanvullende Fig. 3d, e en aanvullende gegevens 2-4), wat duidt op een preferentiële CBM-nichebetrokkenheid bij de respons op trombocytopenie. Genontologie (GO)-analyse uitgevoerd op de DE-genen van CBM-EC benadrukte biologische processen die verband houden met bloedplaatjesactivatie/-coagulatie (Pf4, Clec1b, P2ry12), reactie op stress (Iftm3, Litaf, S100a4) en celadhesie (Vcam1, Ctgf) (Fig. 2g en aanvullende gegevens 5). GO-analyse van CBM-PV DE-genen onthulde biologische processen die geassocieerd zijn met ontstekingen en in het bijzonder met de cellulaire respons op het pro-inflammatoire Interleukine-1 (IL-1) (Fig. 2g en aanvullende gegevens 5). Andere biologische processen die in CBM-PV-cellen naar voren komen, zijn Toll-like receptor (TLR)-4-signalering, waarvoor signaalroutes stroomafwaarts van de receptor gedeeltelijk worden gedeeld met IL-1-signalering, en ook mesenchymale differentiatie en TGFβ-signalering.Vasn, Fst, Wisp2, Cyr61) (Fig. 2f, gr).
(Gerelateerd aan aanvullende afb. 3). FACS-analyse en poortstrategieën voor het sorteren van endotheel- en stromacellen in het centrale beenmerg (CBM; a) en botvoering (BL; b) celcompartimenten van muizen 1 dag na depletie van bloedplaatjes (behandeling met GPIbα-antilichaam). Controlemuizen ontvingen isotype (IgG) controleantilichaam. Staafdiagrammen vertegenwoordigen de gemiddelde ± SD-frequenties (%) van elke celpopulatie onder de totale niet-hematopoietische CD45-Ter119- cellen. Gegevens zijn van 3 muizen per groep in 3 (a) en 2 (b) onafhankelijke experimenten. *p < 0.05; ns niet-significant (p > 0.05); beoordeeld door middel van een tweezijdige t-test. c-g RNA-sequencing-analyse van de endotheel-/stromale celcompartimenten van muizen 1 dag na de uitputting van bloedplaatjes. c Expressie (FPKM) van genen die de verschillende nichecelpopulaties karakteriseren. d Hoofdcomponentenanalyse van genormaliseerde genexpressie van de verschillende onderzochte celpopulaties. e Aantal differentieel tot expressie gebrachte (DE) genen tussen met IgG en GPIbα behandelde muizen (aangepast p waarde (q)<0.05), in elke onderzochte nichecelpopulatie. f Vulkaanpercelen en g termen van genontologie (GO) analyse van genen die differentieel tot expressie worden gebracht in CBM-endotheelcellen (EC) en Lepr+ perivasculaire (PV) cellen. In fgeven rode stippen significant DE-genen aan (q < 0.05. Voor alle panels vertegenwoordigen de gegevens de gemiddelde ± SD FPKM van 3 biologische replicaties van 2 onafhankelijke experimenten. OB-osteoblasten, OBP-osteoblast-voorlopers, PαS Pdfgrα+Scha1+ mesenchymale voorlopers. Zie ook aanvullende afbeelding. 3.
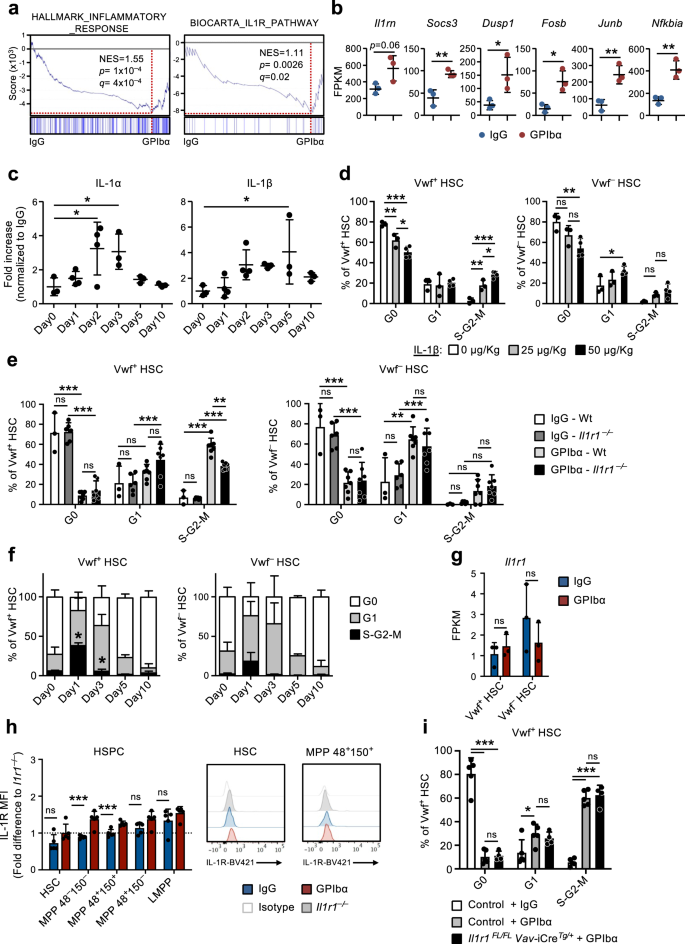
IL-1-signalering in niet-hematopoëtische cellen is van cruciaal belang voor de HSC-reactie op de uitputting van bloedplaatjes
Genenreeksverrijkingsanalyse (GSEA) bevestigde de verrijking van genen gekoppeld aan ontstekingsreactie en IL-1-receptorsignalering waargenomen in CBM-PV-cellen geïsoleerd uit met GPIbα behandelde muizen (Fig. 3a). Deze genen inbegrepen Il1rn (IL-1-doelgen en IL-1-signaleringsroute-antagonist), Soc3 en Dusp1 (regulatoren van de IL-1-signaleringsroute) en FosB, Junb en Nfkbia (componenten van routes die stroomafwaarts van de IL-1-signaleringscascade worden geactiveerd) (Fig. 3b). Om de rol van steriele ontstekingen in dit proces verder te onderzoeken, analyseerden we de niveaus van verschillende pro-inflammatoire cytokines in de extracellulaire BM-vloeistof van met GPIbα behandelde muizen. Deze analyse onthulde significant verhoogde niveaus van zowel IL-1α als IL-1β na depletie van bloedplaatjes (Fig. 3c), waarbij de kinetiek parallel loopt aan de expansie en daaropvolgende normalisatie van Vwf+ HSC (afb. 1e). Een soortgelijke aanvankelijke stijging werd ook waargenomen voor TNFa, hoewel deze ook na het tijdstip waarop Vwf+ De HSC-celcyclusstatus was genormaliseerd (aanvullende figuur XNUMX). 4a). Andere inflammatoire cytokines waren grotendeels onveranderd (IL-6 en IL-12) of namen af in latere stadia (INFγ) na de uitputting van bloedplaatjes (aanvullende figuur XNUMX). 4a). Er is aangetoond dat IL-1 in steady-state voornamelijk wordt geproduceerd door circulerende T-cellen (IL-1α) en granulocyten (IL-1β).30. In onze datasets analyseren we beide op IL-1-expressie Il1a en Il1b waren meestal niet detecteerbaar in de verschillende nichecelpopulaties en ook in HSC's (aanvullende figuur XNUMX). 4b), terwijl primaire Mks (aanvullende figuur. 4c, d) vertoonde een hoge expressie, in het bijzonder van Il1a (Aanvullende afb. 4b).
(Gerelateerd aan aanvullende afb. 5). a Genensetverrijkingsanalyse (GSEA) van globale genexpressiegegevens van CBM-PV-cellen voor de aangegeven genensets. NES, genormaliseerde verrijkingsscore (of geschaalde score). b Expressie van aan de IL-1-signaalroute aangesloten genen in CBM-PV-cellen 1 dag na de uitputting van bloedplaatjes. Gegevens vertegenwoordigen gemiddelde ± SD FPKM van 3 biologische replicaties van 2 onafhankelijke experimenten. **p < 0.01; *p < 0.05 (tweezijdige t-test). c Gemiddelde ± SD-niveaus van IL-1α en IL-1β in extracellulaire beenmergvloeistof geïsoleerd uit muizen op de aangegeven tijdstippen na depletie van bloedplaatjes (behandeling met GPIbα-antilichaam). Controlemuizen (dag 0) ontvingen isotype (IgG) controleantilichaam. Gegevens zijn afkomstig van 3 (Dag 0), 4 (Dag 1), 4 (Dag 2), 3 (Dag 3), 3 (Dag 5) en 3 (Dag 10) muizen uit 4 onafhankelijke experimenten. *p < 0.05 (1-weg ANOVA met de meervoudige vergelijkingen van Dunnett). d Celcyclusanalyse van Vwf+ (links) en Vwf- (rechts) HSC's van muizen 1 dag na intraveneuze toediening van de aangegeven hoeveelheden IL-1β. Gegevens zijn gemiddelde ± SD van 3 muizen die 0 of 25 μg/kg ontvingen, en 4 muizen die 50 μg/kg IL-1β ontvingen, in 2 onafhankelijke experimenten. Celcyclusanalyse van Vwf+ (links) en Vwf- (rechts) HSC's van Wt en Il1r1- / - muizen 1 dag (e) of voor HSC's vanaf Il1r1- / - muizen op de aangegeven tijdstippen (f) na uitputting van bloedplaatjes. e Gemiddelde ± SD-gegevens van 3 (IgG-Wt), 6 (IgG-Il1r1- / -) 7 (GPIbα -Wt) en 7 (GPIbα –Il1r1- / -) muizen uit 5 onafhankelijke experimenten. f Gemiddelde ± SD-frequenties van 6 (Dag 0), 7 (Dag 1), 3 (Dag 3), 3 (Dag 5) en 3 (Dag 10) muizen in 4 onafhankelijke experimenten. *p < 0.05 (in vergelijking met dezelfde analyse van Wt Vwf+ en Vwf- HSC's in Fig. 1d). g, h Il1r1/IL-1R-expressieanalyse (h) op RNA-niveau door RNA-sequencing (FPKM) in Vwf+ en Vwf- HSC's en (i) op eiwitniveau door flowcytometrie in HSPC-subsets, geïsoleerd uit muizen in homeostase of 1 dag na uitputting van bloedplaatjes. h Gemiddelde ± SD FPKM-gegevens van 3 biologische replicaties per aandoening. i Gemiddelde ± SD-gegevens van gemiddelde fluorescentie-intensiteit (MFI) genormaliseerd naar de MFI van de equivalente celpopulatie in Il1r1- / - muizen geanalyseerd binnen hetzelfde experiment. Gegevens zijn afkomstig van 5 muizen per conditie, in 2 onafhankelijke experimenten. i Celcyclusanalyse van Vwf-tdTomaat+ HSC's van muizen met voorwaardelijke verwijdering van Il1r1 in alle hematopoietische cellen (Il1r1FL/FL Vav-CreTg/+) 1 dag na depletie van bloedplaatjes. Controles omvatten Vwf-tdTomaat+ HSC's van Il1r1FL/+ Vav-CreTg/+, Il1r1+ / + Vav-CreTg/+ en vav-Cre+ / + muizen (die genotypen vertegenwoordigen zonder functieverlies van IL-1R). Gegevens vertegenwoordigen gemiddelde ± SD-frequenties van 5 (controle-IgG), 5 (controle-GPIbα) en 4 (Il1r1FL/FL Vav-CreTg/+-GPIbα) muizen uit 3 onafhankelijke experimenten. ***p <0.001; **p < 0.01; *p < 0.05; ns niet-significant (p > 0.05); met behulp van een tweezijdige t-test (b, g, h) of 2-weg ANOVA met de meerdere vergelijkingen van Tukey (d-f, i). Zie ook aanvullende afbeelding. 4.
Toediening van recombinant IL-1 aan muizen resulteerde in de celcyclusactivering van Vwf+ en Vwf- HSC's (afb. 3d), bij Vwf+ HSC's worden in hogere mate gerekruteerd in de S-G2-M-fase van de celcyclus (aanvullende figuur XNUMX). 4e), verenigbaar met IL-1 die de HSC-activering bemiddelt als reactie op door anti-GPIba geïnduceerde trombocytopenie. Om deze hypothese specifieker te onderzoeken, hebben we de uitputting van bloedplaatjes geïnduceerd bij IL-1R-deficiënte muizen (Il1r1-/-), die een normaal HSC-compartiment hebben30 en normale aantallen bloedplaatjes. Belangrijk is dat Il1r1-/- muizen vertoonden een significante vermindering van de frequentie van actief fietsen (S-G2-M) Vwf+ HSC's na bloedplaatjesdepletie (Fig. 3e, f), in vergelijking met met GPIba behandelde wildtype (Wt) muizen. Het feit dat Il1r1 deficiëntie heeft de celcyclusactivatie van HSC's als reactie op GPIbα-behandeling niet volledig tenietgedaan, wat erop wijst dat andere (IL-1-onafhankelijke) mechanismen hierbij betrokken zijn. In overeenstemming hiermee hebben we eerder verhoogde niveaus van THPO in serum aangetoond 1 dag na de uitputting van de bloedplaatjes9. Om andere signalen te identificeren die mogelijk synergiseren met IL-1 bij de activering van HSC's na de uitputting van bloedplaatjes, analyseerden we de expressie van bekende HSC-regulatoren, waaronder Tgfb1 en Pf4, eerder betrokken bij de rust van HSC31,32und Fgf1, voorheen geassocieerd met HSC-proliferatie32. Analyse van de RNA-sequentie van verschillende nichecelpopulaties onthulde een > 20-voudige opwaartse regulatie van Pf4 in CBM-EC (aanvullende figuur XNUMX). 4f), terwijl er geen verandering is in de uitdrukking van Tgfb1 en Fgf1 werd waargenomen. We onderzochten verder de eiwitniveaus van deze regulatoren in de extracellulaire BM-vloeistof na de uitputting van bloedplaatjes. In overeenstemming met de genexpressieanalyse waren de TGFβ1- en FGF1-niveaus niet veranderd, maar was PF4 significant verhoogd 1 dag na GPIbα-gemedieerde uitputting van bloedplaatjes (aanvullende figuur XNUMX). 4g). Gegeven de eerder beschreven rol van PF4 bij het induceren van HSC-rust31,33Het is onwaarschijnlijk dat de waargenomen verhoogde niveaus van PF4 in extracellulaire vloeistof van BM de activering van HSC-proliferatie na uitputting van bloedplaatjes verklaren.
RNA-sequencing onthulde zeer lage niveaus (≈1 FPKM) van Il1r1 transcripties in HSC's (Fig. 3g). Flowcytometrische analyse toonde niet-detecteerbare niveaus van IL-1R-eiwit op HSC's en lage niveaus op verschillende MPP-subsets (Fig. 3h en aanvullende afb. 5a). Naast het ontbreken van detecteerbare IL-1R-expressie bleek geen van de met IL-1-signalering geassocieerde genen die zijn opgereguleerd in CBM-PV te zijn opgereguleerd in Vwf.+ of Vwf- HSC na GPIbα-behandeling (aanvullend Fig. 5b). Hoewel we geen detecteerbare IL-1R-expressie hebben waargenomen in fenotypisch gedefinieerde HSC's, is eerder gesuggereerd dat IL-1 HSC's activeert30. Om te onderzoeken of IL-1 direct de activering van HSC’s na anti-GPIbα-geïnduceerde trombocytopenie kan mediëren, hebben we daarom depletie van bloedplaatjes geïnduceerd in Il1r1FL/FL vav-iCreTg/+ muizen die gericht zijn op het verwijderen van Il1r1 voor alle hematopoietische cellen, inclusief HSC's. Druppel digitale PCR-analyse van Vwf+ en Vwf- HSC's bevestigden een verwijderingsefficiëntie van >99% van de Il1r1 floxed allelen door Vav-iCre in beide Vwf+ en Vwf- HSC-subsets (aanvullende figuur XNUMX). 5c). In tegenstelling tot wat we bij de kiembaan hebben waargenomen Il1r1-/- muizen (afb. 3e, f), Il1r1FL/FL vav-iCreTg/+ muizen vertoonden een even efficiënte anti-GPIba-geïnduceerde celcyclusactivatie van Vwf+ HSC zoals bij Wt-muizen (Fig. 3i). Samen tonen deze resultaten aan dat directe IL-1R-signalering via HSC's of andere hematopoëtische cellen niet betrokken is bij de afzonderlijke celcyclusactivering van HSC's als reactie op de uitputting van bloedplaatjes, en impliceert eerder een rol voor niet-hematopoëtische IL-1-signalering in dit proces.
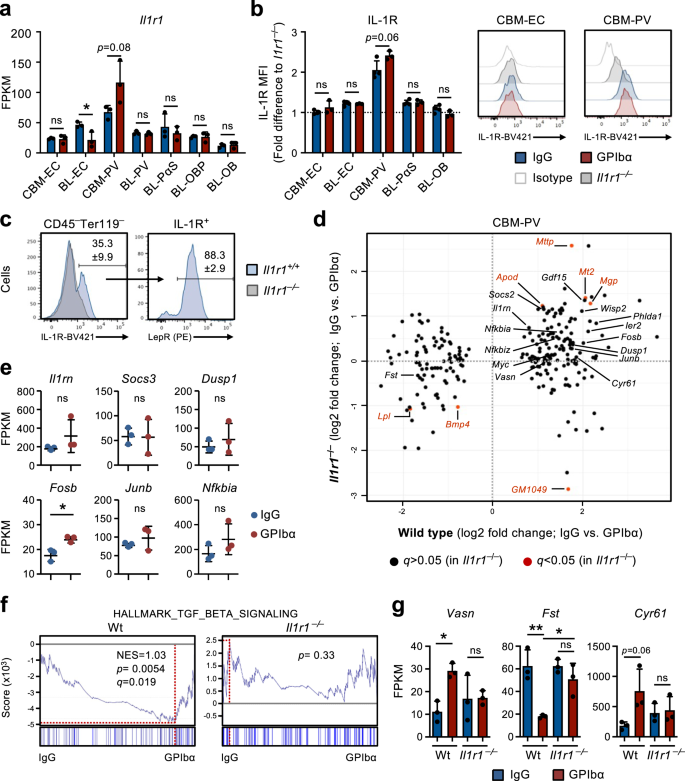
Bloedplaatjesdepletie resulteert in activering van IL-1-signalering in perivasculaire cellen
Onze studies in Il1r1FL/FLvav-iCreTg/+muizen en RNA-sequencing-analyse van BM-nichecellen suggereerden dat IL-1-signalering in nichecellen, in plaats van HSC's of andere hematopoietische cellen, een rol zou kunnen spelen bij de feedbackactivatie van HSC's na uitputting van bloedplaatjes. Van de nichecellen vertoonden CBM-PV-cellen de hoogste transcriptionele niveaus van Il1r1 uitdrukking (afb. 4a) en vertoonden ook duidelijke IL-1R-eiwitexpressie, terwijl alle andere stromale / endotheelcelpopulaties vrijwel negatief waren voor detecteerbare IL-1R-celoppervlakte-expressie (Fig. 4b). In feite zou bijna alle IL-1R-expressie in CBM kunnen worden toegeschreven aan Lepr+ PV-cellen (afb. 4c), die hogere niveaus van kritische HSC-regulatoren tot uitdrukking brachten, zoals Cxcl12 en Kitl, in vergelijking met endosteale IL-1R–/Lo BL-PV-cellen (aanvullende figuur XNUMX). 3c). Belangrijk is dat de vergelijking van DE-genen in CBM-PV-cellen van Wt en Il1r1-/- muizen in homeostase en na GPIbα-behandeling onthulden dat de meerderheid van de DE-genen geïdentificeerd in Wt-muizen na uitputting van bloedplaatjes (Fig. 2f en 3b) werden niet differentieel tot expressie gebracht in CBM-PV-cellen uit bloedplaatjesarme cellen Il1r1-/- muizen (afb. 4d), inclusief de genen die direct geassocieerd zijn met de activering van de IL-1-signaleringsroute (Fig. 4e). Naast IL-1-signaleringsgerelateerde genen vonden we bewijs voor IL-1R-afhankelijke DE van routes die betrokken zijn bij extrinsieke regulatie van HSC-proliferatie, waaronder de TGFβ-signaleringsroute (Fig. 2g en 4d, f, g)34. Dit omvatte de opregulering van Vasn (Vasorin), een directe remmer van TGFβ-signalering35 eerder betrokken bij HSC-activering36. Andere IL-1R-afhankelijke DE-genen inbegrepen eerst (Folistatine), een directe remmer van BMP/Activine-signalering37 en eerder is aangetoond dat het de Mk-differentiatie van hematopoietische voorlopercellen remt38en genen geassocieerd met celadhesie en integrinebinding/regulatie (Fig. 2f, gr en 4d-g).
a RNA-sequencing-analyse van Il1r1 genexpressie (FPKM) in verschillende nichecellen geïsoleerd uit muizen in homeostase (behandeld met IgG) of 1 dag na uitputting van bloedplaatjes (behandeld met GPIbα). Gemiddelde ± SD FPKM-gegevens van 3 biologische replicaties van 2 onafhankelijke experimenten. b, c Flowcytometrische analyse van IL-1R-expressie in verschillende endotheliale / stromale celpopulaties geïsoleerd uit muizen in homeostase of 1 dag na uitputting van bloedplaatjes. Gemiddelde ± SD-gegevens van gemiddelde fluorescentie-intensiteit (MFI) genormaliseerd naar de MFI van de equivalente celpopulatie in Il1r1- / - muizen geanalyseerd binnen hetzelfde experiment (b). c Frequentie van Lepr+ PV-cellen in totaal IL-1R+ CBM niet-hematopoëtische cellen geïsoleerd uit muizen in homeostase. Gegevens van 4 (IgG) en 3 (GPIbα) muizen in 2 onafhankelijke experimenten. d RNA-sequencing-analyse van CBM-PV-cellen geïsoleerd uit Il1r1+ / + en Il1r1- / - muizen in homeostase en na uitputting van bloedplaatjes, voor de expressie van CBM-PV-GPIbα-behandelingsgevoelige genen. Gegevens van 3 biologische replicaties per aandoening. e Expressie van aan de IL-1-signaalroute gelieerde genen in CBM-PV-cellen geïsoleerd uit Il1r1- / - muizen 1 dag na depletie van bloedplaatjes. Gemiddelde ± SD FPKM-gegevens van 3 biologische replicaties per aandoening. GSEA van globale genexpressiegegevens voor de aangegeven genenset (f) en expressie (FPKM; gemiddelde ± SD) van de aangegeven genen (g), in CBM-PV-cellen van wildtype en Il1r1- / - muizen in homeostase en na uitputting van bloedplaatjes. Gegevens van 3 muizen per aandoening. NES, genormaliseerde verrijkingsscore (of geschaalde score). *p <0.05; **p < 0.01; ns, niet-significant (p > 0.05); met behulp van een tweezijdige t-test (a, b, e) en 2-weg ANOVA met Tukey'a meerdere vergelijkingen (g).
IL-1-signalering in perivasculaire cellen is van cruciaal belang voor optimale activering van Vwf+ HSC
Om de rol van IL-1-signalering in CBM-PV-cellen bij de activering van Vwf directer te onderzoeken+ Als reactie op trombocytopenie induceerden we HSC’s depletie van bloedplaatjes bij muizen met voorwaardelijke verwijdering van Il1r1 specifiek in Lepr+ PV-cellen (aanvullende afb. 5d). Il1r1FL/FLLepr-CreTg/+ muizen vertoonden een significante vermindering van actief cyclisch (S-G2-M) Vwf+ HSC's, in vergelijking met met anti-GPIbα behandelde controlemuizen (Fig. 5a). De vermindering van de celcyclusactivatie was vergelijkbaar met die waargenomen bij kiemlijnverwijdering Il1r1-/- muizen (afb. 3e, f), ter ondersteuning van die Lepr+ CBM-PV-cellen zijn de belangrijkste cellen die betrokken zijn bij IL-1R-afhankelijke activering van Vwf+ HSC's als reactie op door anti-GPIbα geïnduceerde trombocytopenie. Deze bevindingen worden bevestigd door toediening van recombinant IL-1 aan Il1r1FL/FLLepr-CreTg/+ muizen resulteerden in verminderde rekrutering van Vwf+ HSC's in actieve S-G2-M (Fig. 5b). Bovendien is specifieke verwijdering van Il1r1 in Lepr+ PV-cellen resulteerden in een kleine maar significante vertraging in het herstel van bloedplaatjes na uitputting van bloedplaatjes (Fig. 5c).
(Gerelateerd aan aanvullende afb. 6). a-c Analyse van muizen met voorwaardelijke verwijdering van Il1r1 in Lepr+ perivasculaire cellen (Il1r1FL/FL Lepr-CreTg/+) muizen na uitputting van bloedplaatjes. Controles omvatten Il1r1FL/+ Lepr-CreTg/+, Il1r1+ / + Lepr-CreTg/+, Il1r1FL/FL Lepr-CreTg/+ (alleen IgG) en Lepr-Cre+ / + muizen. a Celcyclusanalyse van Vwf+ en VWF- HSC's 1 dag na uitputting van bloedplaatjes. Gegevens vertegenwoordigen gemiddelde ± SD-frequenties van 3 (controle-IgG), 5 (controle-GPIbα) en 5 (Il1r1FL/FL Lepr-CreTg/+-GPIbα) muizen uit 3 onafhankelijke experimenten. b Celcyclusanalyse van Vwf+ en VWF- HSC's van muizen 1 dag na intraveneuze toediening van 50 µg/kg IL-1β. Gegevens zijn gemiddelde ± SD van 3 (controle-IgG), 6 (controle-GPIbα) en 4 (Il1r1FL/FL Lepr-CreTg/+-GPIbα) muizen uit 3 onafhankelijke experimenten. c Perifere bloedanalyse van het herstel van bloedplaatjes op de aangegeven tijdstippen na depletie van bloedplaatjes. Gemiddelde ± SD-bloedplaatjesaantallen van 6 (controle) en 11 (Il1r1FL/FL Lepr-CreTg/+) muizen in 3 onafhankelijke experimenten. d-g Differentiële genexpressieanalyse in Vwf+ en Vwf- HSC's geïsoleerd uit wildtype muizen 1 dag na depletie van bloedplaatjes (GPIbα-behandeling). d Vulkaanplots van genen die differentieel tot expressie komen in Vwf+ en Vwf- HSC's. Rode stippen geven genen aan met significante expressieverschillen (aangepast p waarde (q)<0.05). e Venn-diagram dat het aantal differentieel tot expressie gebrachte genen in Vwf toont+ en Vwf- HSC's posten depletie van bloedplaatjes en tussen deze HSC-subsets in homeostase (IgG). f GO noemt analyse van biologische processen/routes die in Vwf zijn opgereguleerd+ HSC's na uitputting van bloedplaatjes. g Expressie (FPKM) van genen geassocieerd met activine/BMP-signalering in Vwf+ en Vwf- HSC's van Wt-muizen in homeostase en 1 dag na uitputting van bloedplaatjes. Alle gegevens (d-g) vertegenwoordigen gemiddelde ± SD FPKM-gegevens van 3 biologische replicaten per genotype en aandoening. *p <0.05; **p <0.01; ***p < 0.001; ns niet-significant (p > 0.05); met behulp van 2-weg ANOVA met de meerdere vergelijkingen van Tukey (a, b), 2-weg ANOVA met de meerdere vergelijkingen van Sidak (c) en dubbelzijdige t-test (g). Zie ook aanvullende afbeelding. 5.
Om meer inzicht te krijgen in hoe Vwf+ HSC's worden gerekruteerd voor proliferatie als reactie op door anti-GPIbα geïnduceerde uitputting van bloedplaatjes. We hebben RNA-sequencing van Vwf uitgevoerd+ en Vwf- HSC's. RNA-sequencing van Vwf+ HSC's identificeerden 230 differentieel tot expressie gebrachte genen na uitputting van bloedplaatjes, waarvan 170 uitsluitend differentieel tot expressie werden gebracht in Vwf+ en niet vwf- HSC's, en 24 van deze reeds onderscheidende Vwf+ en Vwf- HSC's in homeostase, inclusief met bloedplaatjes/Mk-lijn geassocieerde genen (Fig. 5d, eAanvullende Fig. 5e, f en aanvullende gegevens 6, 7). Vergelijking van Vwf+ en Vwf- HSC's van muizen met verarmde bloedplaatjes onthulden verrijking van celcyclusactiveringsgenen in Vwf+ HSC's, die op moleculair niveau de preferentiële activering van Vwf bevestigen+ HSC's als reactie op de uitputting van bloedplaatjes (aanvullende figuur XNUMX). 5g en aanvullende gegevens 8). Genen die differentieel tot expressie komen in Vwf+ HSC's na activering en uitputting van bloedplaatjes worden voornamelijk geassocieerd met integrinesignalering en celadhesie, waarvan bekend is dat ze worden gereguleerd door TGFβ-signalering39, maar ook de celcyclus, bloedstolling en reactie op stress/ontsteking (Fig. 5d-f). Hoewel we de betrokkenheid van andere signaalroutes bij de regulatie van deze genen niet kunnen uitsluiten, in lijn met de neerwaartse regulatie van eerst in CBM-PV-cellen (Fig. 4g), de kandidaat-activine/BMP-doelgenen Runx3 en ID140 werden respectievelijk naar beneden en naar boven gereguleerd in Vwf+ maar niet vwf- HSC's posten depletie van bloedplaatjes (Fig. 5g). Merk op dat het gen voor het α1,6-fucosyltransferase (fut8) dat op differentiële wijze de activiteit van de TGFβ- en Activine-receptoren reguleert41 en is ook een regulator van integrinesignalering42 werd specifiek in Vwf opgereguleerd+ HSC's posten depletie van bloedplaatjes. Bovendien, als reactie op door anti-GPIbα geïnduceerde bloedplaatjesdepletie, Vwf+ HSC's maar niet Vwf-HSC's zijn opgewaardeerd Fkbp1a, een intracellulaire regulator van Smad-signalering die de intensiteit en duur van de signalen stroomafwaarts van de TGFβ-, Activine- en BMP-receptoren moduleert43,44 (Fig. 5g). Samen met de neerwaartse regulering van eerst in CBM-PV-cellen (Fig. 4g), suggereren deze gegevens dat een verschuiving van rustversterkende TGFβ-signalering naar activerende Activine/BMP-signalering kan leiden tot veranderingen in integrineactiviteit, celadhesie en celcyclusstatus van HSC's als reactie op acute bloedplaatjesactivatie en -uitputting.
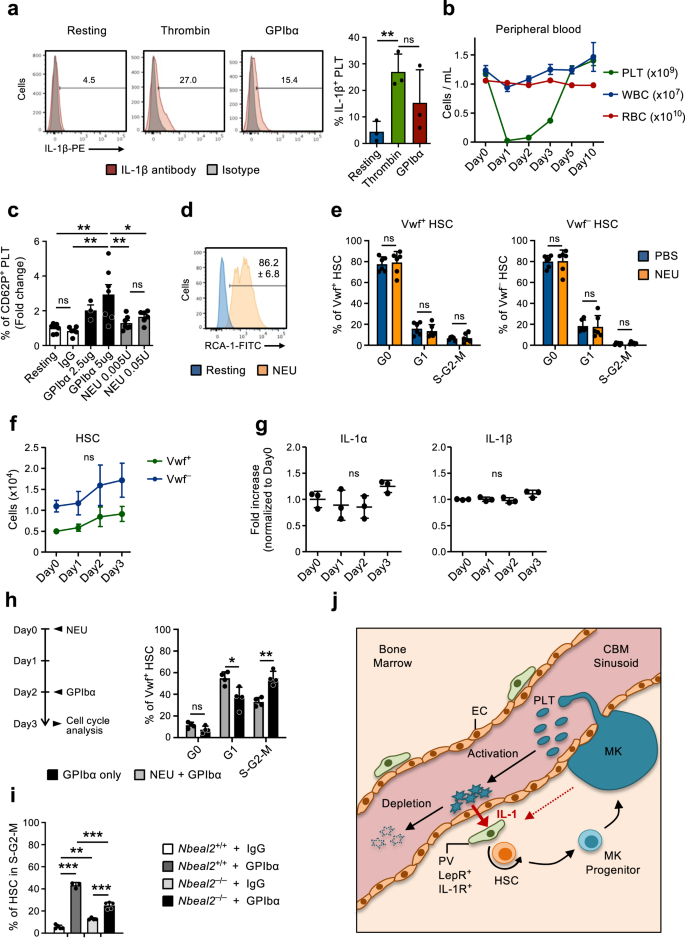
Bloedplaatjesactivatie is essentieel voor de HSC-reactie op bloedplaatjesuitputting
De genexpressieanalyse van CBM-EC's onthulde verschillende genen die opwaarts gereguleerd zijn bij uitputting van bloedplaatjes en die geassocieerd zijn met bloedplaatjesactivatie en coagulatie (Fig. 2f, gr). Dit komt overeen met het mechanisme waarmee bloedplaatjes vaak worden geconsumeerd45, hier nagebootst door GPIbα-gemedieerde uitputting van bloedplaatjes, die functioneert door Fc-onafhankelijke activering van bloedplaatjes te induceren, wat leidt tot translocatie van bloedplaatjessialidase neuraminidase-1 (NEU) naar het membraan, desialylatie en daaropvolgende klaring in de lever20. Bovendien worden bloedplaatjes erkend als belangrijke ontstekingsmediatoren46,47 en de expressie van IL-1-eiwit snel opreguleren na activering (Fig. 6a), zoals eerder door anderen is aangetoond48,49,50. Dit ondersteunt een rol voor de activering van bloedplaatjes en de daaropvolgende consumptie bij het mediëren van de hierin waargenomen IL-1-afhankelijke activering van Vwf+ HSC's als reactie op trombocytopenie. Om deze mogelijkheid verder te onderzoeken, behandelden we muizen met NEU51, wat vergelijkbaar is met de GPIbα-behandeling (Fig. 1a) leidt tot een efficiënte uitputting van bloedplaatjes (Fig. 6b) maar omzeilt de activering van bloedplaatjes20. Terwijl GPIbα-behandeling in vitro op efficiënte wijze bloedplaatjes activeerde, zoals gemeten door kleuring met P-Selectine (CD62P) aan het oppervlak, resulteerde in vitro NEU-behandeling slechts in een zeer milde activatie van bloedplaatjes, en alleen bij hoge concentraties (Fig. 6c). In vitro NEU-activiteit werd echter bevestigd door Ricinus communis agglutinine I (RCA-1) labeling (Fig. 6d), dat specifiek bindt aan gedesialyleerde eiwitten20. Ondanks het in vivo uitputten van bloedplaatjes met dezelfde efficiëntie, resulteerde NEU-behandeling, in tegenstelling tot anti-GPIbα-behandeling, niet in activatie van de HSC-celcyclus (Fig. 6e) en het aantal Vwf-patiënten is er ook niet significant door toegenomen+ of Vwf- HSC's (afb. 6f), LSK Flt3-CD48+CD150+ MPP's, pre-MegE en MkP's in BM (aanvullende figuur XNUMX). 6a, b). Merk op dat bij met NEU behandelde muizen de niveaus van IL-1α en IL-1β in BM grotendeels onveranderd bleven (Fig. 6g). Deze resultaten suggereren dat in plaats van louter het verlies van bloedplaatjes, door anti-GPIba-activatie geïnduceerde uitputting van bloedplaatjes betrokken is bij de waargenomen IL-1-afhankelijke activering van HSC's. Eerdere studies impliceerden een rol voor Mks en hun uitgescheiden factoren bij de regulatie van HSC-rust/proliferatie31,32,33,52. Omdat Mks ook GPIbα tot expressie brengen, hebben we, om meer specifiek een rol van bloedplaatjes in de waargenomen HSC-activering als reactie op anti-GPIbα-antilichaambehandeling aan te tonen, onafhankelijk van Mks, het anti-GPIbα-antilichaam toegediend aan muizen waarbij de bloedplaatjes efficiënt waren uitgeput met NEU. -behandeling (afb. 6b), wat het aantal Mks niet verandert33. Deze opeenvolgende NEU-GPIbα-behandeling resulteerde in verminderde celcyclusactivatie van Vwf+ HSC's, vergeleken met alleen GPIbα-behandeling (Fig. 6h), wat de betrokkenheid van bloedplaatjes bij dit proces bevestigt. Het feit dat enige HSC-activering werd waargenomen bij muizen met NEU-verarmde bloedplaatjes, vergeleken met controlemuizen met normale aantallen bloedplaatjes (Fig. 1d en 3e), ondersteunt ook een rol van Mks in de waargenomen HSC-activering als reactie op behandeling met anti-GPIbα-antilichamen.
(Gerelateerd aan aanvullende afb. 4). a Expressie van IL-1β in bloedplaatjes die rusten of na in vitro activering (3 uur) met trombine of GPIbα-antilichaam. (Links), representatieve FACS-profielen. Getallen in grafieken zijn gemiddelde frequenties van 3 onafhankelijke experimenten. (Rechts) Frequentie van IL-1β+ bloedplaatjes; gemiddelde ± SD van 3 biologische replicaties per aandoening in 3 onafhankelijke experimenten. Elke biologische replicaat bestaat uit bloedplaatjes verzameld uit 2-3 muizen. b Kinetische analyse van perifere bloedcellijnen na in vivo toediening van Neuraminidase (NEU). Gegevens vertegenwoordigen gemiddelde ± SEM van 10 (dag 0), 7 (dag 1), 8 (dag 2), 9 (dag 3), 6 (dag 5) en 3 (dag 10) muizen uit 6 onafhankelijke experimenten. PLT-bloedplaatjes, WBC-witte bloedcellen, RBC-rode bloedcellen. c Expressie van oppervlakte-P-selectine (CD62P) op bloedplaatjes gemeten met flowcytometrie na in vitro incubatie met GPIbα-antilichaam of NEU, bij de aangegeven concentraties. Gegevens vertegenwoordigen gemiddelde ± SD-voudige veranderingen van% CD62P+ cellen in elke toestand in relatie tot onbehandelde (rustende) bloedplaatjes, van 7 (rustende), 6 (IgG), 3 (GPIbα-2,5ug), 7 (GPIbα-5ug), 7 (NEU 0.005U) en 6 (NEU 0.05U) muizen in 3 onafhankelijke experimenten. d In vitro neuraminidase (NEU)-activiteit in rustende bloedplaatjes of na 30 minuten behandeling met NEU, geanalyseerd door RCA-1-binding. Representatief profiel van 1 op de 3 biologische replicaties. Getallen geven gemiddelde ± SD% RCA-1+ bloedplaatjes aan. e Gemiddelde ± SD celcyclusfaseverdeling van Vwf+ (links) en Vwf- (rechts) HSC's 1 dag na uitputting van bloedplaatjes met NEU. Gegevens van 6 muizen per conditie, in 3 onafhankelijke experimenten. f FACS-gebaseerde beoordeling van het HSC-compartiment in beenmerg van muizen op de aangegeven tijdstippen na uitputting van bloedplaatjes met NEU. Gegevens vertegenwoordigen absolute aantallen Vwf-GFP+ (Vwf+) Of Vwf-GFP- (Vwf-) HSC's (gemiddeld ±SEM) op de aangegeven tijdstippen na uitputting van bloedplaatjes. Gegevens zijn afkomstig van 5 (Dag 0), 4 (Dag 1), 5 (Dag 2) en 6 (Dag 3) muizen in 4 onafhankelijke experimenten. Er zijn geen significante veranderingen waargenomen in de aantallen Vwf+ of Vwf- HSC's op elk moment. g Gemiddelde ± SD-niveaus (voudige toename ten opzichte van dag 0) van de aangegeven cytokinen in extracellulair beenmergvocht geïsoleerd uit muizen op de aangegeven tijdstippen na depletie van bloedplaatjes met Neuraminidase. Gegevens van 3 muizen per tijdstip in 2 onafhankelijke experimenten. h Muizen werden op dag 0 behandeld met NEU, gevolgd door toediening van GPIbα-antilichaam op dag 2 en op dag 3 (links) geanalyseerd op celcyclusfaseverdeling in Vwf+ HSC's (rechts). Controlemuizen werden alleen behandeld met GPIba-antilichaam en 1 dag later geanalyseerd. Gegevens vertegenwoordigen gemiddelde ± SD-frequenties van 4 muizen per groep in 2 onafhankelijke experimenten. i HSC's in S-G2-M in Nbeal2- / - muizen 1 dag na depletie van bloedplaatjes (GPIbα). Gegevens vertegenwoordigen gemiddelde ± SD-celfrequenties van 5 (Wt-IgG), 3 (Wt-GPIbα), 4 (Nbeal2- / --IgG) en 5 (Nbeal2- / --GPIbα) muizen per conditie uit 3 onafhankelijke experimenten. j Schema dat het voorgestelde feedbackmechanisme weergeeft. Terwijl ze worden geconsumeerd, scheiden geactiveerde bloedplaatjes IL-1 af, dat IL-1R tot expressie brengende PV-cellen activeert om HSC-proliferatie en differentiatie naar de bloedplaatjeslijn te induceren. Zoals aangegeven kunnen Mks ook bijdragen aan de beschreven rekrutering van HSC's voor proliferatie als reactie op behandeling met het anti-GPIbα-antilichaam, resulterend in activeringsafhankelijke uitputting van bloedplaatjes. Voor alle gegevens ***p <0.001; **p < 0.01; *p < 0.05 (alleen aangegeven voor significante verschillen) met behulp van 1-weg ANOVA met de meervoudige vergelijkingen van Tukey (a, c, f, i), 2-weg ANOVA met de meerdere vergelijkingen van Sidak (e, h) of de meerdere vergelijkingen van Dunnett (g); ns niet significant. Zie ook aanvullende afbeelding. 6.
Bloedplaatjes slaan meerdere ontstekingsmodulatoren op in bloedplaatjeskorrels, die vrijkomen bij activatie van bloedplaatjes53,54. Om verder te onderzoeken of de afgifte van de inhoud van bloedplaatjeskorrels vereist is voor GPIbα-gemedieerde HSC-activering, induceerden we bloedplaatjesdepletie (GPIbα-behandeling) bij muizen met een tekort aan Nbeal2 (Nbeal2-/-), die geen α-korrels van bloedplaatjes hebben55. Nbeal2-/- muizen hebben over het algemeen een normale hematopoëse ondanks een kleine afname van het aantal bloedplaatjes en een lichte toename van HSC's (aanvullende figuur XNUMX). 6c-e). Eén dag na anti-GPIbα-behandeling Nbeal2-/- muizen hadden een significant verminderde frequentie van actief cyclische HSC's in vergelijking met Wt-muizen, ondanks het feit dat een hogere frequentie van HSC's zich vóór de behandeling in de cyclus bevonden (Fig. 6i). Samen suggereerden deze bevindingen dat IL-1 en andere regulatoren die worden uitgescheiden bij activering van bloedplaatjes een rol kunnen spelen bij het reguleren van de activering van HSC's als reactie op trombocytopenie.
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://www.nature.com/articles/s41467-023-41691-y