Het AI-gestuurde medicijnontdekkingsplatform van Lantern Pharma, RADR®, maakt waardecreatie mogelijk in meerdere dimensies van het ontwikkelingsproces van oncologische geneesmiddelen: van de uitbreiding van therapeutische indicaties en de identificatie van geneesmiddelcombinaties voor gebruik in precisie-oncologie, evenals het creëren van patiëntresponshandtekeningen of biomarkerprofielen die kunnen worden gebruikt om het succes van een klinische proef te vergroten.
Het proces van het creëren van nieuwe kankerbehandelingen is beladen met tal van wegversperringen, die de werkzaamheid ervan aanzienlijk beïnvloeden en de uitrol van succesvolle therapieën vertragen. De ontnuchterende realiteit is dat volgens schattingen van maar liefst 97% van de potentiële oncologische geneesmiddelen nooit op de markt worden gebracht. Wong, Siah en Lo, 2019. Dit faalpercentage is grotendeels te wijten aan het ingewikkelde samenspel van genetische doelen, onverwachte stijgingen in de resistentie van patiënten tegen geneesmiddelen en de voorspellende beperkingen van onze huidige preklinische modellen. Wat de zaken nog ingewikkelder maakt, is dat succesvolle medicijnen patiënten vaak slechts marginale overlevingsvoordelen opleveren.
Het ontwerp van klinische proeven is ook problematisch, waarbij geneesmiddelen vaak klakkeloos worden getest op verschillende soorten kanker, zonder rekening te houden met de specifieke genetische implicaties van het geneesmiddel. Volgens een studie uit 2021 'Verbetert het gebruik van biomarkers in de oncologie het risico op mislukken van klinische proeven? Een grootschalige analyse', hebben klinische onderzoeken die zijn opgezet zonder integratie van relevante en informatieve biomarkers 12 keer meer kans om te mislukken.
De grote behoefte aan vooruitgang bij de ontdekking van oncologische geneesmiddelen
Het faalpercentage op gokniveau van de huidige programma's voor het ontdekken van oncologische geneesmiddelen in klinische onderzoeken kan worden toegeschreven aan meerdere complexe factoren. Een prominente uitdaging is het verkeerd begrijpen van de werkzaamheid van een medicijn, vaak als gevolg van onverwachte off-target effecten, die het ware werkingsmechanisme (MOA) van het medicijn verdoezelen. Deze verwarring kan bijvoorbeeld resulteren in een verkeerde karakterisering van doelspecifieke remmers, een complicatie geïllustreerd door de maternale embryonale leucine zipper kinase (MELK) remmer OST167. Ondanks dat MELK werd geïdentificeerd als cruciaal bij meerdere soorten kanker, bleek het niet essentieel te zijn voor de fitheid van kankercellen, wat waarschijnlijk heeft bijgedragen aan het misverstand. Verdere verwarring ontstaat door de verkeerde identificatie van biomarkers, wat de bepaling van het ware doelwit van een medicijn belemmert. Studies zoals Lin et al. (2019) hebben ook aangetoond dat bepaalde eiwitten, waaronder MELK, HDAC6, MAPK14, PAK4, PBK en PIM1, waarvan aanvankelijk werd gedacht dat ze essentieel waren voor kanker, in feite niet essentieel zijn voor de overleving van kankercellen, waardoor een nieuwe laag van complexiteit wordt toegevoegd aan de ontdekking en goedkeuring van geneesmiddelen proces.
Een willekeurige benadering van oncologische klinische onderzoeken kan de effectiviteit van de onderzoeken verminderen en potentiële kansen missen. Het medicijn sorafenib is een levendig voorbeeld van de verrassingen bij de ontwikkeling van geneesmiddelen tegen kanker. Aanvankelijk werd verwacht dat het zou werken door het BRAF-gen te remmen, maar tests bij melanoom, waar BRAF-mutaties veel voorkomen, leverden geen overlevingsvoordeel op. In plaats daarvan vertoonde het medicijn de potentie om VEGF te blokkeren, een molecuul dat de groei van bloedvaten reguleert. Dit leidde tot de goedkeuring door de FDA voor de behandeling van nier-, lever- en schildklierkanker.
De complexiteit en diversiteit van het genetische landschap van kanker, samen met de uitdaging van resistentie tegen geneesmiddelen, hebben een substantiële invloed op de voortgang van succesvolle kankertherapieën. Neem toch een ander voorbeeld, het ooit veelbelovende medicijn Avastin. Aanvankelijk goedgekeurd voor uitgezaaide borstkanker in 2008, werd het later in 2011 door de FDA ingetrokken vanwege een gebrek aan bewijs voor het verlengen van de overleving van de patiënt en het verminderen van tumorgroei.
Deze uitdagingen benadrukken de dringende behoefte aan een meer verfijnde strategie bij de ontwikkeling van geneesmiddelen tegen kanker en het ontwerp van klinische proeven - een strategie die in staat is om op intelligente wijze genetische diversiteit aan te pakken, te anticiperen op resistentie tegen geneesmiddelen en de therapeutische toewijzing te optimaliseren. Deze geavanceerde strategie vormt de kern van de missie van Lantern Pharma, die gebruik maakt van de kracht van kunstmatige intelligentie (AI) via hun RADR®-platform om aan deze behoeften tegemoet te komen.
Precisie-oncologie mogelijk maken met het RADR® AI-platform
Sinds de oprichting in 2014, een in Dallas gevestigde biotech in de klinische fase Lantaarn Pharma heeft zich ingezet voor het verbeteren van de zorgstandaard voor kankerpatiënten door de ruimte voor therapeutische indicaties uit te breiden, mogelijkheden voor combinatietherapie te identificeren en betere klinische onderzoeken te ontwerpen met op precisie gebaseerde strategieën voor patiëntenselectie.
In het licht van de veelzijdige uitdagingen van de ontwikkeling van kankerbehandeling, loopt Lantern Pharma voorop met een baanbrekende tool: RADR®, een AI-gestuurd platform dat machine learning gebruikt voor het identificeren van actiemechanismen (MoA), die de preklinische ontwikkeling van oncologische middelen, het identificeren van nieuwe therapeutische indicaties, en het onderscheiden en voorspellen van reacties van patiënten op specifieke geneesmiddelen. Ontworpen om genomische en transcriptomische gegevens uit zowel klinische als preklinische studies grondig te analyseren, is RADR® een oplossing die de complexiteit van genetische heterogeniteit bij kanker en patiënten belicht.
De genetische diversiteit van kanker bemoeilijkt vaak de identificatie van patiëntengroepen die waarschijnlijk positief zullen reageren op een bepaald medicijn in klinische onderzoeken, wat leidt tot eindpunten die statistische significantie missen en het aantonen van klinisch voordeel voor wettelijke goedkeuring belemmeren. RADR® is ontworpen om deze uitdaging frontaal aan te gaan, met als doel de meest geschikte patiëntengroepen voor specifieke therapieën te vinden.
Door gebruik te maken van transcriptomische, genomische en medicijngevoeligheidsgegevens uit meerdere bronnen, analyseert RADR® meer dan 25 miljard klinische gegevenspunten, meer dan 154 interacties tussen geneesmiddelen en tumoren en meer dan 130,000 patiëntendossiers in 17 databases. Het platform omarmt datasets van openbare bronnen, commerciële klinische studies en Lantern's ex vivo 3D-tumormodellen om verbanden te leggen tussen genetische biomarkers en medicijnactiviteit. Dit end-to-end-proces transformeert multi-omics-gegevens in een optimaal model dat medicijnresponsen voorspelt, kandidaat-biomarkers genereert en helpt bij patiëntstratificatie voor het opzetten van klinische onderzoeken.

Afbeelding tegoed: Lantaarn Pharma. Het AI-gestuurde medicijnontdekkingsplatform RADR® van het bedrijf.
Het RADR®-platform gaat met name niet alleen over het verfijnen van de patiëntenselectie; het gaat ook om risicobeperking en succesoptimalisatie bij de ontwikkeling van geneesmiddelen. Door patiënten te scheiden in waarschijnlijke responders en non-responders voor verschillende oncologische therapieën, vergroot RADR® het potentieel om klinische onderzoeken minder risico te laten lopen en de kans op goedkeuring door de FDA te vergroten. Deze strategische patiëntenverrijking stroomlijnt niet alleen klinische onderzoeken, waardoor mogelijk de onderzoekskosten worden verlaagd en de levering van cruciale nieuwe therapieën wordt bespoedigd, maar maakt ook de weg vrij voor het personaliseren van kankerbehandelingen en mogelijk het verbeteren van de patiëntresultaten.
Bovendien is de operationele workflow van RADR® flexibel aangepast voor een reeks kandidaat-geneesmiddelen: geneesmiddelen in een vroeg stadium om indicaties, combinaties of gerichte effectieve doses te helpen definiëren; klinische kandidaat-geneesmiddelen in een vergevorderd stadium of op de plank liggen om te helpen bij het identificeren van de meest waarschijnlijke om gunstig te reageren; en momenteel op de markt gebrachte of generieke geneesmiddelen voor een nieuwe of andere kankerindicatie bij een bepaalde patiëntenpopulatie.
Een beproefd AI-platform voor precisie-oncologie
Sprekend in termen van daadwerkelijke resultaten, Lantern Pharmain net aangekondigd FDA-goedkeuring van een aanvraag voor een nieuw geneesmiddel voor onderzoek (IND) voor LP-184, een nieuw, synthetisch dodelijk, klein molecuul dat volledig intern is ontwikkeld - met behulp van inzichten van het AI-platform van Lantern, RADR®. De eerste klinische fase 1A-studie van LP-184 bij mensen zal naar verwachting deze zomer van start gaan voor meerdere geavanceerde solide tumoren en kankers van de hersenen en het centrale zenuwstelsel (CZS).
Eerder in maart 2023 heeft Lantern Pharma met succes de eerste patiënt in fase 2 gedoseerd multi-center Harmonic™ klinische studie, een belangrijke mijlpaal in de ontwikkeling van oncologische geneesmiddelen. Door gebruik te maken van zijn eigen RADR® AI- en machine learning-platform, transformeert het bedrijf therapeutische strategieën voor achtergestelde patiëntenpopulaties, zoals nooit-rokers met gevorderde niet-kleincellige longkanker. Met name in een eerdere fase 3-studie vertoonden patiënten die de LP-300 van het bedrijf met chemotherapie kregen hogere overlevingspercentages, wat de potentiële werkzaamheid van de aanpak van Lantern aantoont. Met naar schatting 24,000 tot 30,000 nooit-rokers die in de VS alleen al in 2021 de diagnose NSCLC hebben gekregen, is de noodzaak en potentiële impact van dergelijke behandelingen aanzienlijk.
Eerder dit jaar kwam Lantern ook behaalde met succes de Orphan Drug Designation (ODD) van de FDA voor LP-284, zijn nieuwe kandidaat-geneesmiddel voor de behandeling van mantelcellymfoom (MCL). Deze door AI ondersteunde vooruitgang in de ontdekking en ontwikkeling van oncologische geneesmiddelen werd in minder dan twee jaar gerealiseerd, wat aantoont dat het platform in staat is om het tempo en de doeltreffendheid van het op de markt brengen van nieuwe behandelingen te transformeren. LP-284 is de vierde ODD in de pijplijn van Lantern Pharma. Eerdere kandidaten die deze mijlpaal bereikten, waren alvleesklierkanker, glioblastoom en atypische teratoïde rhabdoïde tumoren (ATRT) voor pediatrisch gebruik (zie onderstaande illustratie van de pijplijn). De ODD-status, die aanzienlijke voordelen biedt, zoals zeven jaar marktexclusiviteit en versnelde ontwikkelingsprogramma's, verstevigt het klinische ontwikkelingspad en de commerciële vooruitzichten voor de kandidaat-geneesmiddelen LP-284, LP-184 en STAR-001 van Lantern Pharma.
In maart richtte Lantern Pharma een dochteronderneming op, Starlight Therapeutics, die zich toelegt op het ontwikkelen van therapieën voor het centrale zenuwstelsel (CZS) en hersenkanker, geholpen door het transformatieve RADR® AI-platform. Het AI-aangedreven platform vergemakkelijkte de versnelde ontwikkeling van STAR-001, Starlight's toonaangevende kandidaat-geneesmiddel, dat werkzaamheid heeft aangetoond in verschillende CZS- en hersenkankermodellen. Klinische onderzoeken voor nieuwe indicaties voor CZS-kanker bij volwassenen en kinderen, geïdentificeerd en geprioriteerd met inzichten van het RADR® AI-platform, zijn gepland voor eind 2023 en begin 2024.
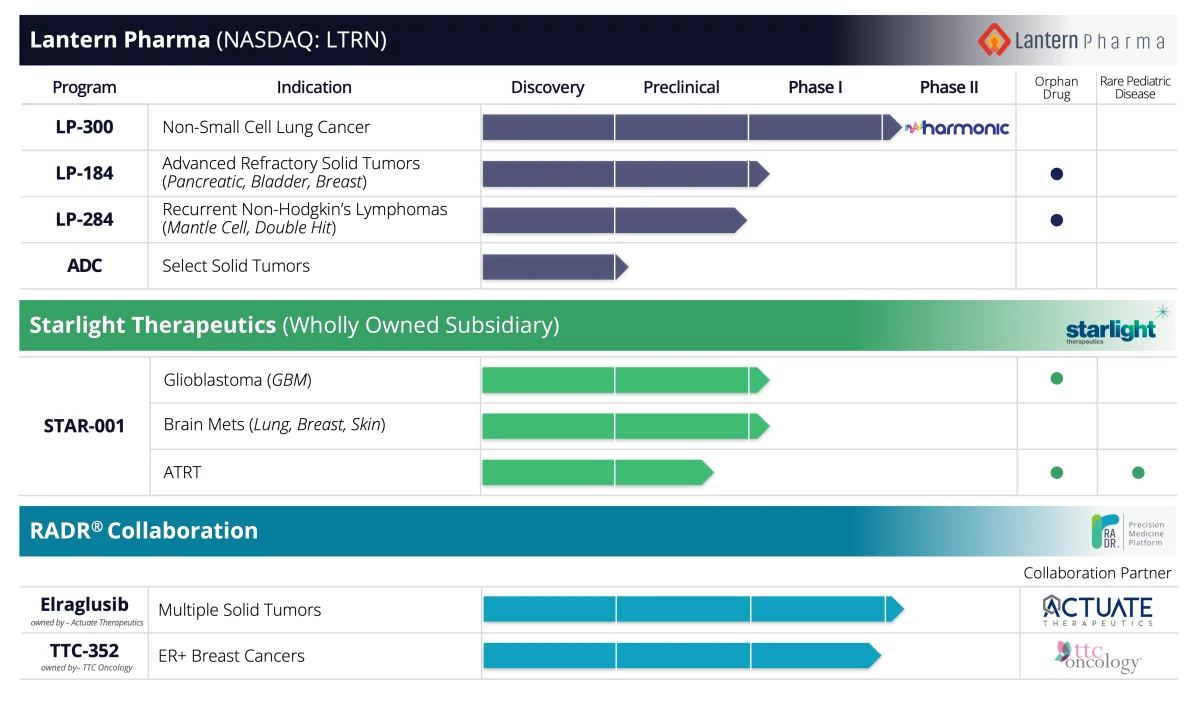
Afbeelding tegoed: Lantaarn Pharma. De oncologiepijplijn van het bedrijf, mogelijk gemaakt door het AI-gestuurde platform voor het ontdekken van geneesmiddelen RADR®.
De portefeuille van Lantern Pharma omvat vier kandidaat-geneesmiddelen, waaronder twee fase 2-programma's, een antilichaam-geneesmiddelconjugaatprogramma (ADC) voor 12 kankerindicaties en een groeiend aantal partnerprogramma's. Door effectief gebruik te maken van zijn AI-gestuurde RADR®-platform, biedt het bedrijf een veelbelovende kans voor belanghebbenden in de sector die hun therapeutische pijplijn willen verbeteren.
De ontdekking van geneesmiddelen in de oncologie bevorderen door middel van partnerschappen
Lantern Pharma biedt een nieuwe oplossing voor het vaak uitdagende landschap van de ontwikkeling van oncologische geneesmiddelen. Hun eigen RADR®-platform maakt gebruik van een geavanceerde mix van genomica en kunstmatige intelligentie (AI) om geneesmiddelen in de klinische fase die eerder zijn stopgezet, een nieuwe bestemming te geven en nieuw leven in te blazen. Door biomarkers voor de respons van de patiënt te identificeren en te valideren, verbetert Lantern Pharma effectief de potentiële waarde van deze behandelingen, wat een lucratieve kans biedt voor partners die hun oncologiepijplijnen willen optimaliseren en mogelijk mislukte kandidaat-geneesmiddelen nieuw leven willen inblazen.
In plaats van medicijnen van de grond af aan te ontwikkelen, hanteert Lantern Pharma een strategische benadering door zich te concentreren op klinische geneesmiddelen in een laat stadium die bij bepaalde patiëntengroepen hun werkzaamheid hebben aangetoond, maar anderszins zijn stopgezet. Met behulp van geavanceerde genomica, data-analyse en AI 'redden' ze deze waardevolle medicijnen en heroriënteren ze zich op de specifieke patiëntengroepen die zijn geïdentificeerd door middel van moleculaire profilering. Dit proces maakt gestratificeerde en efficiënte behandeling van patiënten mogelijk binnen gerichte klinische onderzoeken, waaronder de lopende samenwerkingsprogramma's van Lantern Pharma met Actuate Therapeutics (Elraglusib, in fase 2) en TTC Oncology (TTC-352, in fase 1).
Het RADR® AI-platform van Lantern Pharma slaagde er bijvoorbeeld in om de respons van Elraglusib op gemetastaseerd melanoom, resistent tegen checkpoint-remmers, te voorspellen met een nauwkeurigheid van 88% - voor een groep van 26 patiënten.
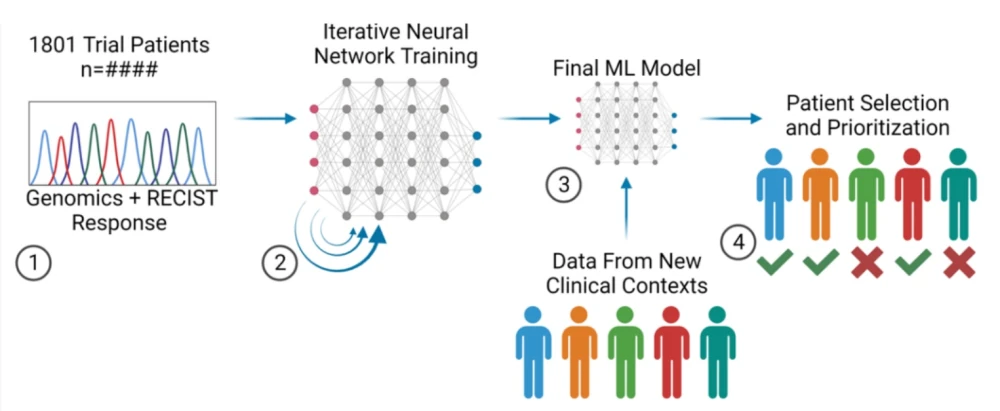
Ontwikkeling van een machine learning-model om de respons van patiënten op Elraglusib te voorspellen met genomics-input.
Afbeelding tegoed: van ASCO 2023 affiche #3079.
Na de succesvolle herbestemming van een medicijn en de identificatie van een diagnostische biomarker voor medicijnrespons, opent Lantern Pharma mogelijkheden voor licenties of partnerschappen. Hun unieke strategie bevordert de ontwikkeling van precisietherapieën en speelt tegelijkertijd in op belangrijke onvervulde behoeften in de oncologiemarkt, waardoor Lantern Pharma wordt gepositioneerd als een ideale partner voor organisaties die hun ontwikkelingsstrategie voor oncologie willen optimaliseren.
In de sector van de ontwikkeling van oncologische geneesmiddelen onderscheidt Lantern Pharma zich met zijn AI-gestuurde platform, RADR®, dat helpt bij het onthullen van nieuwe werkingsmechanismen (MoA's) voor oncologische middelen, waardoor gegevensgestuurde preklinische kandidaat-ontwikkeling mogelijk wordt, nieuwe therapeutische indicaties worden geïdentificeerd en nieuwe biomarkers worden afgeleid. voor precisie-oncologie en het voorspellen van de reacties van patiënten op kankertherapieën, verfijnt RADR® klinische onderzoeken en kan het mogelijk de kansen vergroten op weg naar goedkeuring door de FDA. Maar daar houdt hun innovatie niet op. Ze redden ook opgeborgen kandidaat-geneesmiddelen en bieden hen een tweede leven.
Men kan de belofte die het unieke model van Lantern Pharma inhoudt voor de bredere wetenschappelijke gemeenschap niet over het hoofd zien. Het bedrijf heeft een geschiedenis van succesvolle partnerschappen met toonaangevende organisaties, waaronder Actuate Therapeutics, TTC Oncology, John Hopkins, Fox Chase, UT Health San Antonio, Danish Cancer Society Research Center, Mayo Clinic en anderen. Zo gebruikte Lantern Pharma in een recente samenwerking met het National Cancer Institute (VS) zijn kunstmatige-intelligentieplatform, RADR®, om te helpen bij de ontdekking van een DNA-beschadigend middel voor de uiterst zeldzame vorm van kanker die bekend staat als atypische teratoïde rhabdoïde tumoren ( ATRT), een vooruitgang besproken in een nieuw gepubliceerd artikel.
De reis van het bedrijf wijst naar een toekomst waarin kankertherapie gepersonaliseerd en op precisie gericht wordt. Voor degenen die betrokken zijn bij de strijd tegen kanker, zou het overwegen van samenwerkingen met AI in pioniers op het gebied van geneesmiddelenontdekking zoals Lantern Pharma mogelijk de weg kunnen banen naar transformerende oplossingen in de oncologie.
Onderwerpen: Biotech-bedrijven
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- EVM Financiën. Uniforme interface voor gedecentraliseerde financiën. Toegang hier.
- Quantum Media Groep. IR/PR versterkt. Toegang hier.
- PlatoAiStream. Web3 gegevensintelligentie. Kennis versterkt. Toegang hier.
- Bron: https://www.biopharmatrend.com/post/690-unveiling-lantern-pharmas-success-story-in-ai-powered-precision-oncology/



