
Regulatory Affairs (RA) is een beroep in de life science-industrie waarbij wordt gecontroleerd of een bedrijf officiële regels of wetten volgt met betrekking tot de veiligheid en werkzaamheid van producten. Professionals op het gebied van regelgeving houden toezicht op de ontwikkeling, het testen, de productie en de marketing van producten op gebieden als farmaceutische producten, medische apparatuur, cosmetica, pesticiden en aanvullende medicijnen. Ze werken ook samen met regelgevende instanties en personeel aan specifieke kwesties die van invloed zijn op hun bedrijf en adviseren hun bedrijven over de regelgevingsaspecten en het klimaat dat van invloed zou zijn op voorgestelde activiteiten.
In deze blogpost wordt gedetailleerd ingegaan op regelgevingszaken, wat professionals op het gebied van regelgevingszaken doen en hoe PSC Biotech kan u helpen uw regelgevingsdoelstellingen te bereiken.
RA is een gespecialiseerd vakgebied binnen de life sciences-industrie dat zich bezighoudt met de goedkeurings- en complianceprocessen van toezichthouders voor nieuwe en bestaande producten zoals farmaceutische producten, medische apparatuur, biologische producten en andere gezondheidszorgproducten. Deze producten zijn in de eerste plaats ontworpen om therapeutische waarde te hebben en patiënten of andere consumenten te helpen behandelen. RA komt in beeld wanneer deze producten Dan moet je voldoen aan de strenge wettelijke eisen van overheidsinstanties zoals de FDA (Food and Drug Administration) in de Verenigde Staten of de EMA (Europees Geneesmiddelenbureau) in Europa.
De belangrijkste aspecten van de betekenis ervan zijn onder meer:
- Productgoedkeuring: Het verkrijgen van goedkeuringen voor nieuwe medicijnen, medische hulpmiddelen en therapieën uit de betreffende regioal regelgevende overheidsinstanties. Dit proces omvat uitgebreide documentatie die het ontwerp, onderzoek en ontwikkeling, niet-klinische en klinische onderzoeken, onderzoeken en rapporten, en interacties met regelgevende instanties om dit aan te tonen de veiligheid en werkzaamheid van het product.
- Kwaliteitsverzekering: Producten moeten worden vervaardigd, geëtiketteerd en getest in overeenstemming met de regelgeving om een consistente kwaliteit en veiligheid te behouden.
- Nakoming: Bedrijven moeten omgaan met complexe en evoluerende regelgeving, waardoor voortdurende naleving van veranderende eisen wordt gewaarborgd.
- Risicomanagement: Alle risico's die verband houden met regelgevingskwesties moeten efficiënt worden beheerd en beoordeeld, waardoor bedrijven worden begeleid bij het minimaliseren van potentiële juridische en financiële risico's.
- Markt toegang: Regelgevende goedkeuringen zijn vaak een voorwaarde voor markttoegang. Goedkeuringen worden verleend door overheidsinstanties via indieningen/dossiers van geneesmiddelen, dwz, documenten die alle gegevens over kwaliteit, veiligheid en werkzaamheid weergeven.
- Patienten veiligheid: Het is van het grootste belang om ervoor te zorgen dat producten veilig en effectief zijnING het welzijn van patiënten.
Kortom, RA is van cruciaal belang voor de life sciences-industrie om innovatieve en veilige gezondheidszorgproducten op de markt te brengen en er tegelijkertijd voor te zorgen dat ze voldoen aan strenge wettelijke normen. Het niet naleven van de regelgeving kan leiden tot terugroepingen van producten, juridische gevolgen en bijwerkingen voor patiënten, en schade aan de reputatie van een bedrijf.
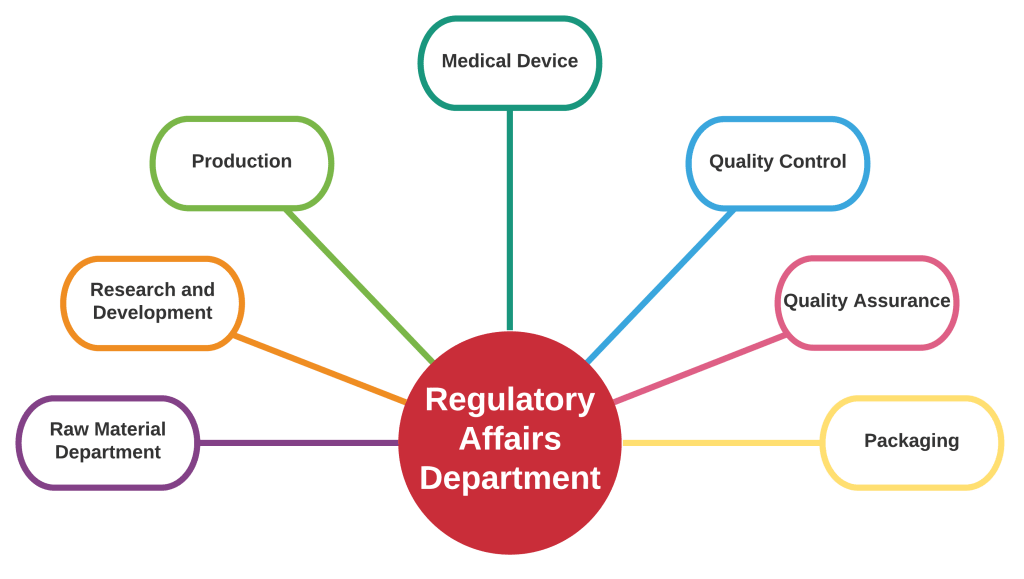
Rol van Regulatory Affairs en hoe deze verbonden is met alle afdelingen. Bron: Farma adviseur
Wat doen professionals op het gebied van Regulatory Affairs?
RA-professionals spelen een cruciale rol in de life sciences-industrie door het beheer van de complexe regelgevingsprocessen die de ontwikkeling, goedkeuring en marketing van farmaceutische producten, medische hulpmiddelen, biologische geneesmiddelen en andere gezondheidszorgproducten regelen. Hun verantwoordelijkheden omvatten een breed scala aan taken, waaronder:
- Regelgevende indieningen: RA-professionals bereiden aanvragen, dossiers en documenten voor en dienen deze in bij regelgevende instanties die goedkeuring vragen voor nieuwe producten of wijzigingen in bestaande producten. Hierbij worden gegevens verzameld over veiligheid, werkzaamheid en kwaliteit.
- Nakoming: RA-professionals zorgen ervoor dat hun organisaties zich houden aan alle relevante regelgeving, normen en richtlijnen. Zij monitoren veranderingen in de regelgeving en adviseren over noodzakelijke aanpassingen om naleving te garanderen.
- Klinische proeven: Zij kunnen toezicht houden op de planning en uitvoering van klinische onderzoeken en ervoor zorgen dat deze voldoen aan de wettelijke vereisten en ethische normen. Ze werken samen met klinische en onderzoeksteams om onderzoeken te ontwerpen die aanvaardbare gegevens ter goedkeuring genereren.
- Etikettering en verpakking: RA-professionals leveren input over de etikettering en verpakking van producten om ervoor te zorgen dat deze de productinformatie accuraat weergeeft en voldoet aan de wettelijke vereisten.
- Kwaliteitsverzekering: Regelgevende professionals werken samen met kwaliteitsborgingsteams om robuuste kwaliteitsmanagementsystemen (QMS) op te zetten en te onderhouden. Dit omvat het beheer van documentatie, audits en correctieve en preventieve acties (CAPA's).
- Regelgevingsstrategie: Ze ontwikkelen en implementeren regelgevingsstrategieën om producten efficiënt en effectief op de markt te brengen. Dit omvat het overwegen van mondiale regelgevingsvereisten en markttoegangsstrategieën.
- Communicatie met regelgevende instanties: Zij vertegenwoordigen hun organisaties in de communicatie met regelgevende instanties, het beantwoorden van vragen, het verstrekken van aanvullende gegevens en het deelnemen aan regelgevende vergaderingen en onderhandelingen.
- Toezicht na het in de handel brengen: Nadat een product is goedgekeurd en op de markt is, monitoren ze de prestaties ervan, inclusief de rapportage van bijwerkingen, om voortdurende veiligheid en werkzaamheid te garanderen.
- Mondiale regelgevingszaken: Ze navigeren door verschillende regelgevingssystemen en vereisten op internationale markten en zorgen ervoor dat producten wereldwijd op de markt kunnen worden gebracht.
- Risicomanagement: Zij beoordelen en beheren de risico's die verband houden met de naleving van de regelgeving, en houden de organisatie op de hoogte van mogelijke uitdagingen en kansen op het gebied van de regelgeving.
- Training en onderwijs: RA-professionals geven vaak training aan interne teams om ervoor te zorgen dat werknemers de wettelijke processen en vereisten begrijpen en volgen.
- Ethische en juridische overwegingen: Ze handhaven ethische en wettelijke normen in alle interacties met regelgevende instanties, beroepsbeoefenaren in de gezondheidszorg en het publiek.
RA-professionals zorgen ervoor dat gezondheidszorgproducten voldoen aan de wettelijke normen, veilig en effectief zijn en op de markt kunnen worden gebracht in overeenstemming met alle toepasselijke wet- en regelgeving. Hun werk is essentieel voor het succes en de integriteit van de life sciences-industrie.
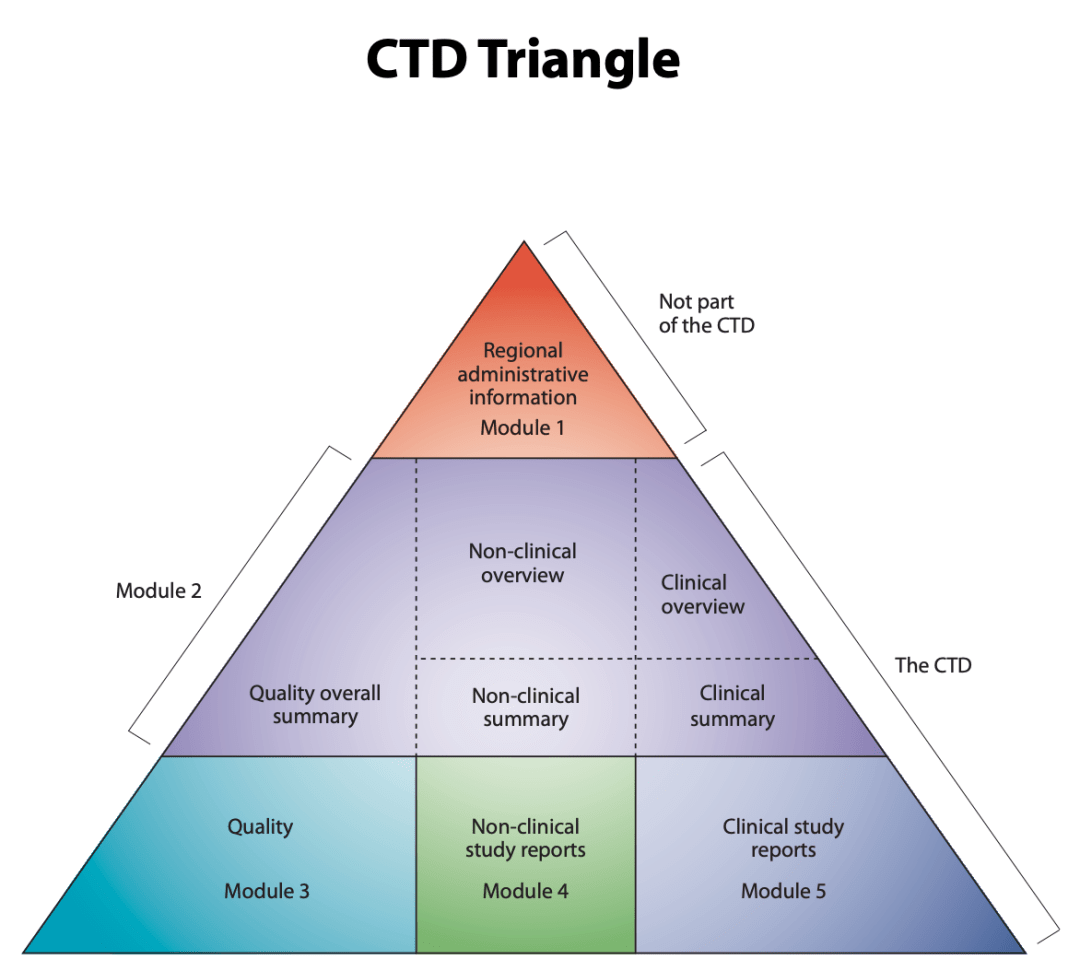
De CTD-driehoek. Het Gemeenschappelijk Technisch Document is onderverdeeld in vijf modules. Module 1 is regiospecifiek en de modules 2, 3, 4 en 5 zijn bedoeld om gemeenschappelijk te zijn voor alle regio's. Bron: ICH-website
Hoe kan PSC Biotech u helpen bij het bereiken van uw regelgevingsdoelstellingen?
Het RA-team van PSC beschikt over uitgebreide kennis en ervaring met het indienen van mondiale regelgevingsdocumenten. Wij ondersteunen alle gereguleerde productinzendingen voor farmaceutische producten, medische hulpmiddelen, biologische producten, fvoedsel, dranken, cosmetische producten en tissueproducten.
We kunnen pre- en post-market-activiteiten ondersteunen voor wereldwijde inzendingen op het gebied van de levenswetenschappen. We hebben aan verschillende regelgevingsprojecten gewerkt met betrekking tot de registratie van nieuwe producten op internationale markten, de ontwikkeling en analyse van regelgevingsstrategieën, indieningsdocumenten en richtlijnen voor regelgeving voor elk producttype.
Onze specialiteiten zijn onder meer:
Regelgevingsstrategie
- Schat de wettelijke risico's voor uw product in.
- Controleer de etiketteringsvereisten op basis van het product en de specifieke markten.
- Beoordeel preklinische, productproces- en productiegegevens.
- Niet-klinische en klinische onderzoeksdocumentatie beoordelen (fase 0, fase I, fase II, fase III, fase IV klinische onderzoeken)
- Inzendingsplanning en goedkeuringsstatistieken.
Projectdocumentatie en -documentatie beoordelen en onderhouden:
- Auteur of review productkwaliteitsgerelateerde documentatie, chemie, productie en controles (CMC) gerelateerde documentatie en herstelprojecten
- Beoordeel licentieaanvragen en dossiersjablonen
- Beoordeel of evalueer documentatie vóór en na goedkeuring, formulieren voor klinische onderzoeken, documentatie na goedkeuring, BA/BE-studies en gemeenschappelijk technisch document, ook bekend als CTD-modules.
- Antwoord op Avragen van instanties, verzoeken om ORphan-geneesmiddelen en versnelde aanduidingen, protocolondersteuning
Genereer en beheer inzendingsbestanden en beoordeel inzendingsbestanden van auteurs
- Schrijf CTD-modules en eCTD-modules, beoordeel of beheer inzendingen en dossiers zoals NDA, BLA, ANDA, DMF, BMF, EUA, of andere inzendingen van nieuwe producten.
- Inzendingen voor medische hulpmiddelen schrijven, beoordelen of beheren, zoals 510(k), PMA, IDE, MDR, & etikettering en merknaamgeving voor apparaten uit alle klassen (I, II, III)
- Ontwikkel of beoordeel aanvragen voor licentieverlening, preklinische, klinische proefstudies en andere tests.
- Beheer vestigingsregistratie, kwaliteitssysteemregulering en lijsten met medische hulpmiddelen.
- Begeleiden van veranderende regelgeving zoals 21 CFR, ISO, EU-GMP, ICH-richtlijnen of andere marktregelgeving die van invloed kan zijn op uw product of processen.
- Beheer al uw wereldwijde documenten en managementsystemen om de efficiëntie van al uw inzendingen te garanderen.
Risico-batenanalyse en risicobeoordelingen voor naleving van de regelgeving:
- Voer de juiste kloof- en risicoanalyse uit om bedrijven te helpen bij het analyseren van risicobeperkende maatregelen.
- Ontwikkel risicobeoordelings- en managementprogramma's voor uw product als onderdeel van pre- en post-goedkeuring indieningsprocedures.
- Voer proefaudits uit om de kwaliteit en naleving van de regelgeving te beoordelen.
Ontwikkel interne trainingsprogramma's en bied regelgevende ondersteuning aan bestaande teams.
PSC Biotech heeft dat ook de expertise om andere processen te ondersteunen die dat wel kunnen invloed rregulerende handelingen, zoals Computersysteemvalidatie (CSV), Computersysteemverzekering (CSA), Technisch schrijven, Audits, Inbedrijfstelling, Kwalificatie en Validatie (CQV), en projectmanagement activiteiten.
Zie ook
PSC-softwareoplossingen
Adviseurs inhuren
PSC Biotech Services biedt snelle, budgetvriendelijke expertise van hoog niveau.
Volg ons
Deel, betrek, blijf actueel
Kwaliteitsborging (QA) is een proces dat een bedrijf helpt ervoor te zorgen dat zijn producten of diensten voldoen aan de kwaliteitsnormen die door het bedrijf zijn gesteld of aan de wettelijke vereisten. QA is betrokken bij alle stadia van de ontwikkeling van een product, vanaf de levering van grondstoffen tot...
De BIO International Convention is het belangrijkste evenement voor de mondiale biotechnologie-industrie, waar u kunt netwerken met duizenden collega's, leiders en partners en de nieuwste innovaties en kansen in de life science-sector kunt ontdekken. Dit jaar is de…
Metrologie is van cruciaal belang voor elk biowetenschappelijk productieproces in een zeer technische en gereguleerde industrie. Bij PSC Biotech bieden we een scala aan metrologiediensten om onze klanten te helpen de nalevingsvereisten voor apparatuur en systemen te handhaven en ervoor te zorgen dat hun…
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://biotech.com/2023/09/25/your-compass-for-navigating-biopharma-regulations/






