Traumatisch hersenletsel (TBI), veroorzaakt door een plotselinge schok of impact op het hoofd, vereist een zo snel mogelijke diagnose. Om onomkeerbare schade te voorkomen, moeten levenskritische behandelbeslissingen binnen het ‘gouden uur’ na het trauma worden genomen. Het diagnosticeren van TBI op het zorgpunt is echter moeilijk, omdat men zich bij aankomst in een ziekenhuis moet verlaten op observaties door ambulancepersoneel, gevolgd door radiologisch onderzoek zoals MRI- of CT-scans.
Om tijdiger ingrijpen mogelijk te maken, hebben onderzoekers van de Universiteit van Birmingham ontwikkelen een draagbaar diagnostisch apparaat dat TBI detecteert door een veilige laser in het oog te laten schijnen. Het apparaat, beschreven in Wetenschap Advances, is bedoeld voor gebruik zodra zich een blessure voordoet – of het nu langs de weg, op het slagveld of op het sportveld is – om patiënten te beoordelen op traumatisch hersenletsel, de ernst van het trauma te bepalen en de behandeling dienovereenkomstig aan te sturen.
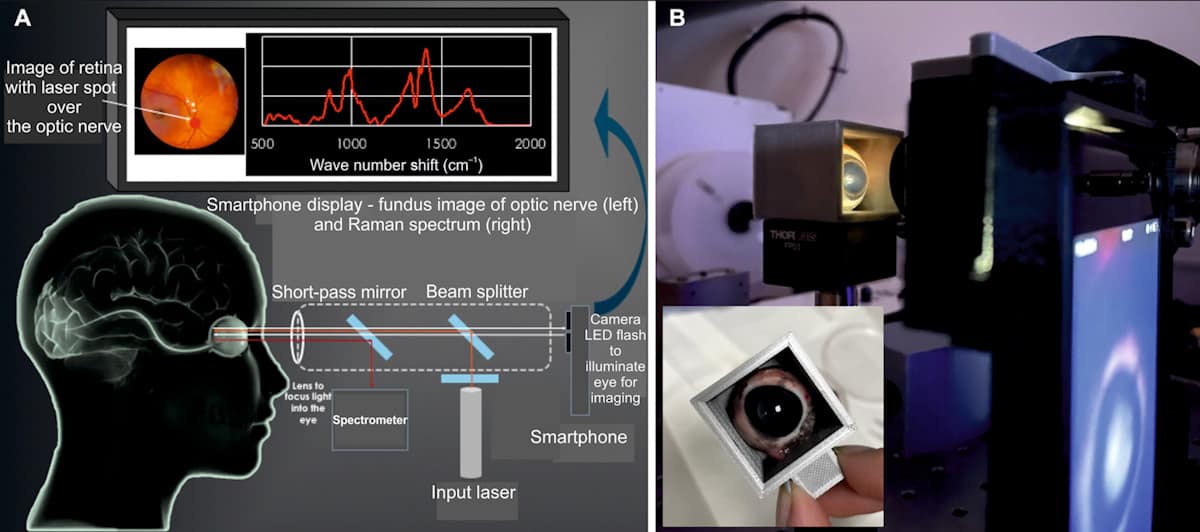
Het oogveilige apparaat (EyeD) is gebaseerd op Raman-spectroscopie – een optische techniek die gebruik maakt van inelastische verstrooiing van laserlicht om de moleculaire samenstelling te onderzoeken. Het werkt door een klasse 635-laser van 1 nm op het hoornvlies te laten schijnen. De gecollimeerde straal wordt vervolgens door de eigen optiek van het oog op het netvlies gefocusseerd. Om de laser op het betreffende gebied te richten, voert het EyeD-systeem tegelijkertijd fundusbeeldvorming en spectroscopische analyse uit met behulp van een smartphonecamera om de achterkant van het oog te visualiseren.
Raman-spectra verzameld uit het netvlies en de oogzenuw worden geanalyseerd op de aanwezigheid van TBI-specifieke biochemische veranderingen, met behulp van het kunstmatige neurale netwerkalgoritme SKiNET als beslissingsondersteunend hulpmiddel. Omdat het netvlies en de oogzenuw zo nauw verbonden zijn met de hersenen, zullen veranderingen in biomarkers na letsel biochemische veranderingen in de micro-omgeving van de hersenen weerspiegelen.
“Ons apparaat zal een vroege diagnose van TBI mogelijk maken door acute noodveranderingen in realtime in levend neuroretinaal/oogzenuwweefsel direct te beoordelen. Het stelt ons in staat weefsel van het centrale zenuwstelsel direct en niet-invasief te ondervragen”, legt teamleider uit Pola Goldberg Oppenheimer. “Het analyseren van de neuroretina als een projectie van het centrale zenuwstelsel biedt inzicht in de biochemie van de hersenen.”
Spectroscopische onderzoeken
Om de prestaties van hun beeldvormingsapparaat te testen, construeerden Oppenheimer en collega's een weefselfantoom dat de fysieke afmetingen en optische kenmerken van het oog nabootst, terwijl het een realistische Raman-signatuur van het netvlies oplevert. Het fantoom omvat een lens, een gaatje met een diameter van 4 mm dat de onverwijde pupil voorstelt en een monsterhouder voor netvliesweefsel.
Het team toonde aan dat het EyeD-apparaat de laserstraal effectief op de gewenste positie op het netvlies kon focussen. Spectra gemeten vanuit het weefselfantoom hebben de belangrijkste Raman-banden in het gebied met hoge golfgetallen opgelost, wat kan worden gebruikt om een aantal weefseltypen te onderscheiden.
De onderzoekers gebruikten vervolgens het prototype-apparaat om retinale monsters van varkensogen te analyseren, die qua grootte, structuur, ontwikkeling en samenstelling vergelijkbaar zijn met menselijke ogen. Ze verzamelden 510 metingen van 39 TBI-retinale monsters en 12 controlemonsters, waarbij spectra van dichtbij de optische schijf werden vastgelegd. Over het geheel genomen vertoonden de Raman-spectra verschillende karakteristieke banden in de periode 1200–1700 cm-1 vingerafdrukgebied, plus een verbetering van banden met hoog golfgetal in de 2800-3200 cm-1 regio.

Het gebruik van SKiNET om zelfoptimaliserende kaarten (SOM's) te maken die clustering van de Raman-spectra van het netvlies laten zien, onthulde een duidelijke scheiding tussen netvliezen met TBI en controlemonsters. Dit komt doordat de Raman-spectra biochemische variaties in het oog na traumatisch hersenletsel weerspiegelen. TBI verhoogt bijvoorbeeld het lipiden- en eiwitgehalte in het oog, waardoor de pieken die daaruit voortkomen duidelijker worden in de Raman-spectra.
De meest significante spectrale veranderingen als reactie op TBI waren te wijten aan de bijdragen van de hersenlipiden cardiolipine en cytochroom C, die zich manifesteerden als een toename in de verhouding van de 2930 tot de 2850 cmXNUMX.-1 piek in de Raman-spectra. De onderzoekers gebruikten geselecteerde kenmerken van de 2850/2930 piekverhouding en intensiteiten van zes karakteristieke pieken uit de TBI-spectra om de SKiNET-classificatie te vormen, wat een spectroscopische streepjescode opleverde voor TBI-detectie.
Om het vermogen van het EyeD-systeem te beoordelen om TBI te differentiëren via veranderingen in het netvlies, berekenden ze het gebied onder de curve (AUC) voor elke piek en de piekverhouding van 2930/2850, en zetten ze de echt-positieve cijfers uit tegen de vals-negatieve percentages. Het gebruik van SKiNET-optimalisatie met 10-voudige kruisvalidatie op de trainingsgegevens resulteerde in een classificatienauwkeurigheid van 90.7 ± 0.9%. Dit resultaat geeft aan dat veranderingen in de piekverhouding van 2930/2850 na TBI een waardevolle indicator zouden kunnen zijn om TBI te onderscheiden van gezonde controles.
“Het gebruik van gelijktijdige Raman-spectroscopie en fundusbeeldvorming, verpakt als een goedkoop handapparaat, biedt de eerste tastbare weg naar niet-invasieve point-of-care-diagnostiek van TBI”, vertelt Oppenheimer. Natuurkunde wereld.

Bij hersenschudding zijn de ogen de vensters naar de hersenen
De volgende stap zal zijn het optimaliseren van het prototype voor klinische validatie. Om de klinische vertaling te vergemakkelijken, zijn de onderzoekers van plan de stand-alone spectrometer te vervangen door een compacte spectrometer op het apparaat en uitlezing op een smartphone, waardoor fundusfotografie en Raman-spectroscopie via één smartphonescherm mogelijk worden.
“We ontwikkelen momenteel een gebruiksvriendelijk apparaat, geïntegreerd met ons kunstmatige neurale netwerkalgoritme voor geautomatiseerde interpretatie van outputs zonder dat specialistische ondersteuning nodig is, waardoor spectrale gegevens snel worden geclassificeerd”, zegt Oppenheimer. “[We zijn ook] de bruikbaarheid van apparaten klinisch aan het evalueren bij gezonde vrijwilligers en bij patiënten om het potentieel ervan voor realtime diagnose aan te tonen. Nadat we de verdraagbaarheid en bruikbaarheid van het apparaat hebben vastgesteld, gaan we over tot een first-in-human evaluatie en een kleinschalige klinische proef.”
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://physicsworld.com/a/handheld-device-uses-eye-safe-retinal-spectroscopy-to-diagnose-brain-injury/



